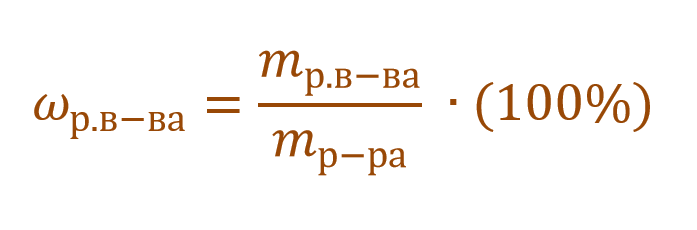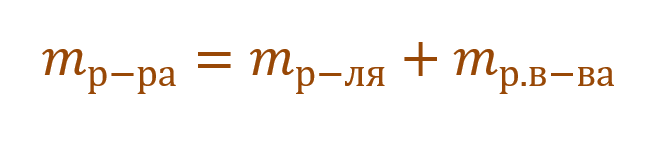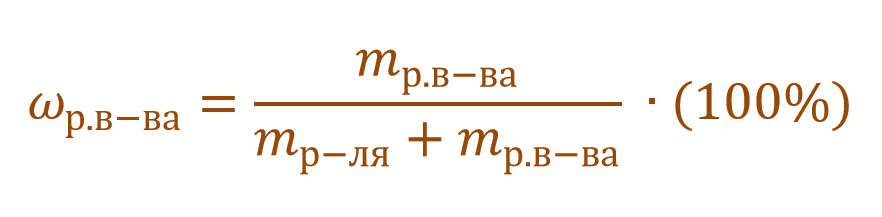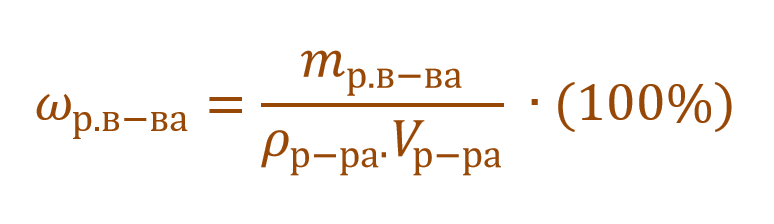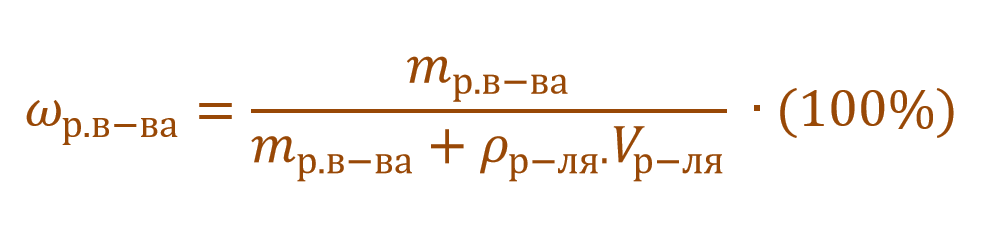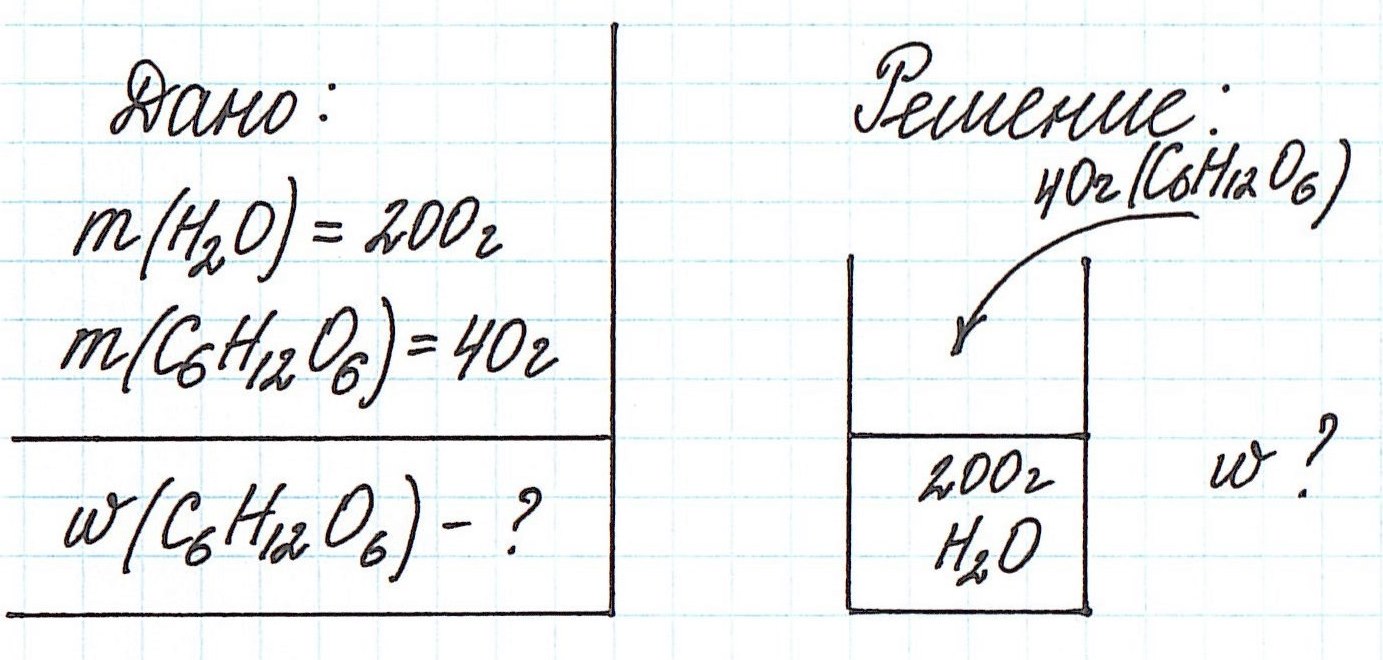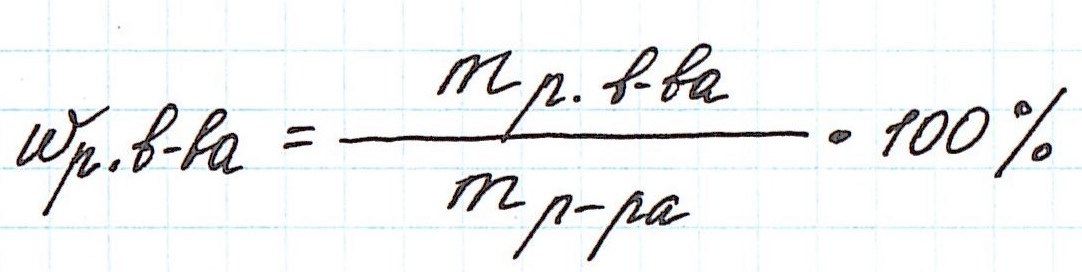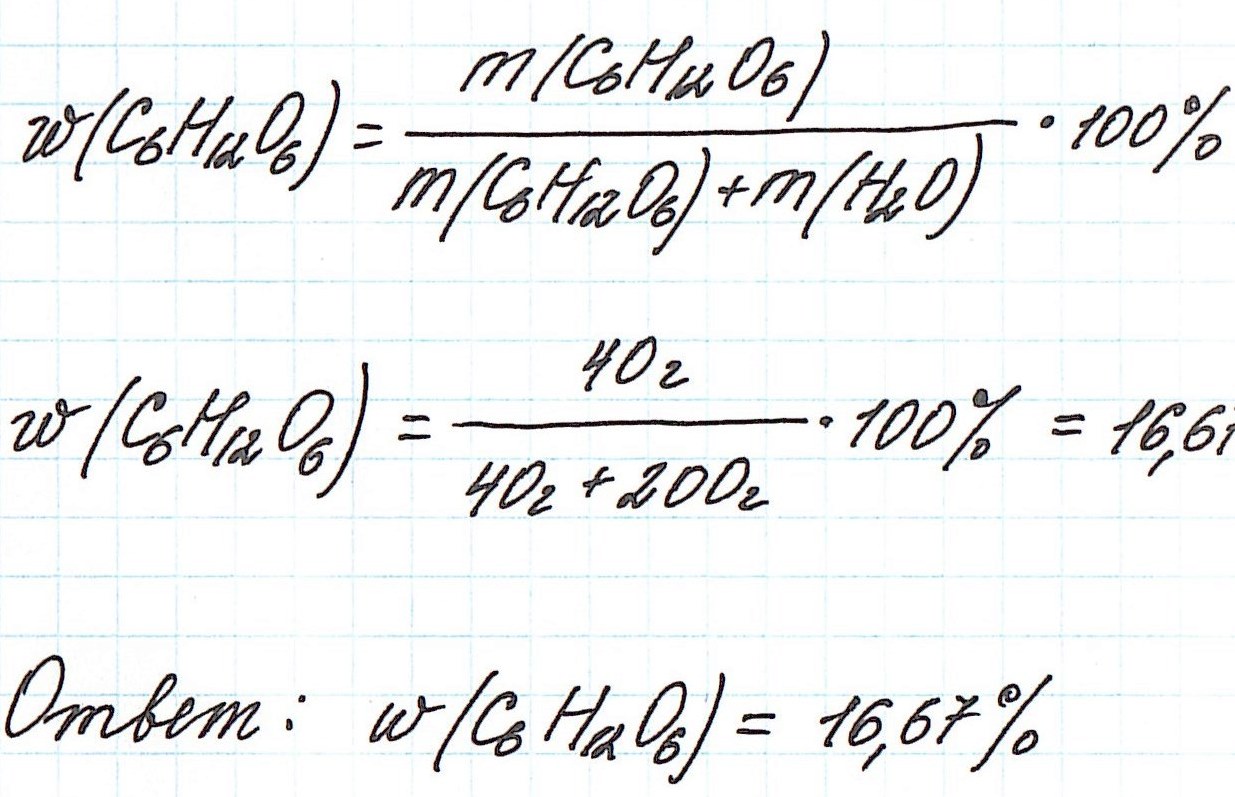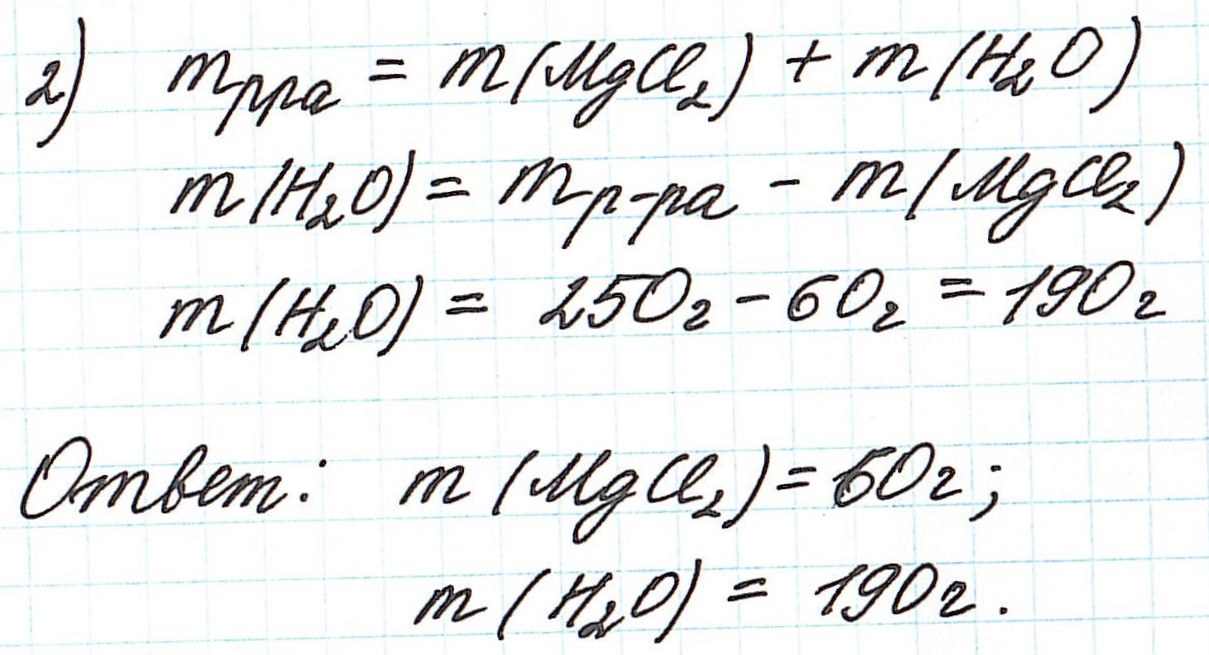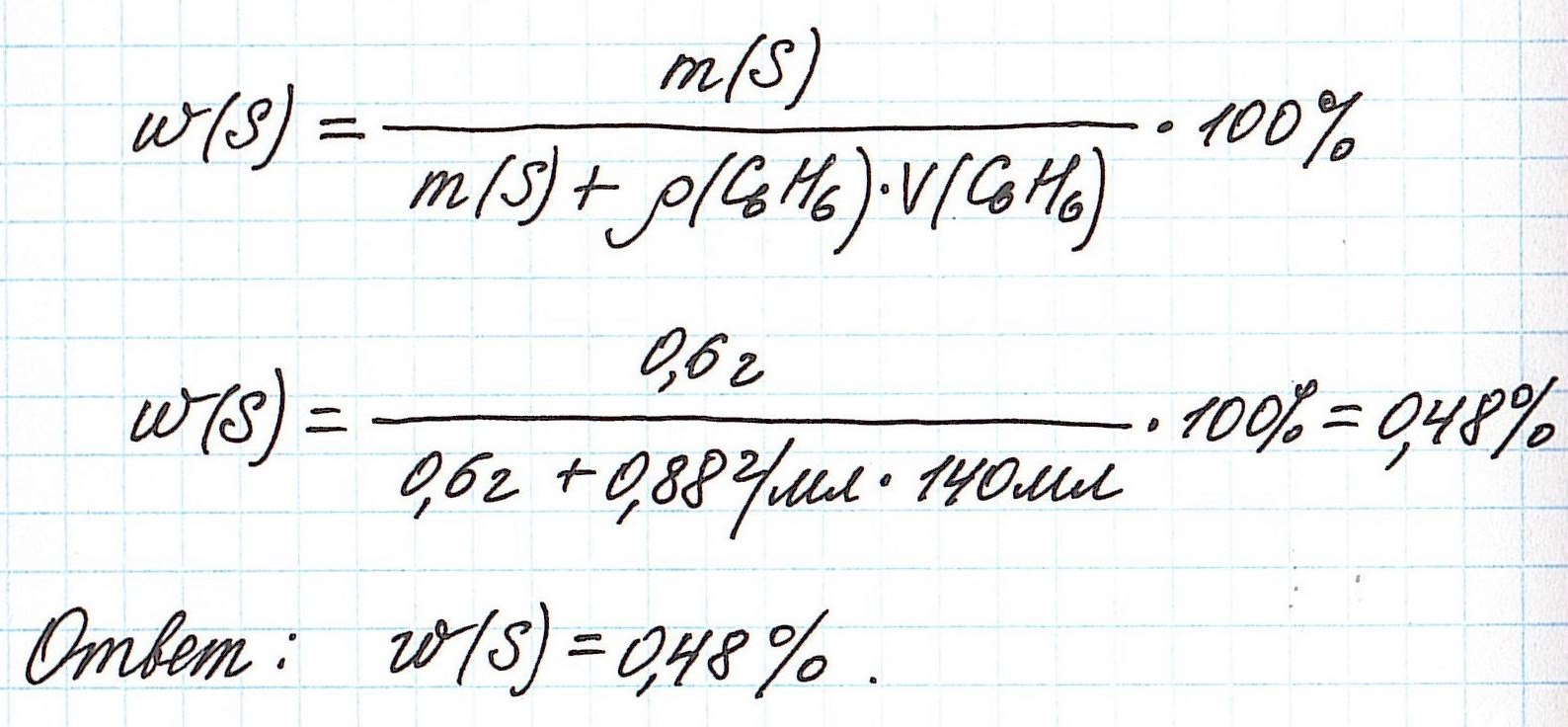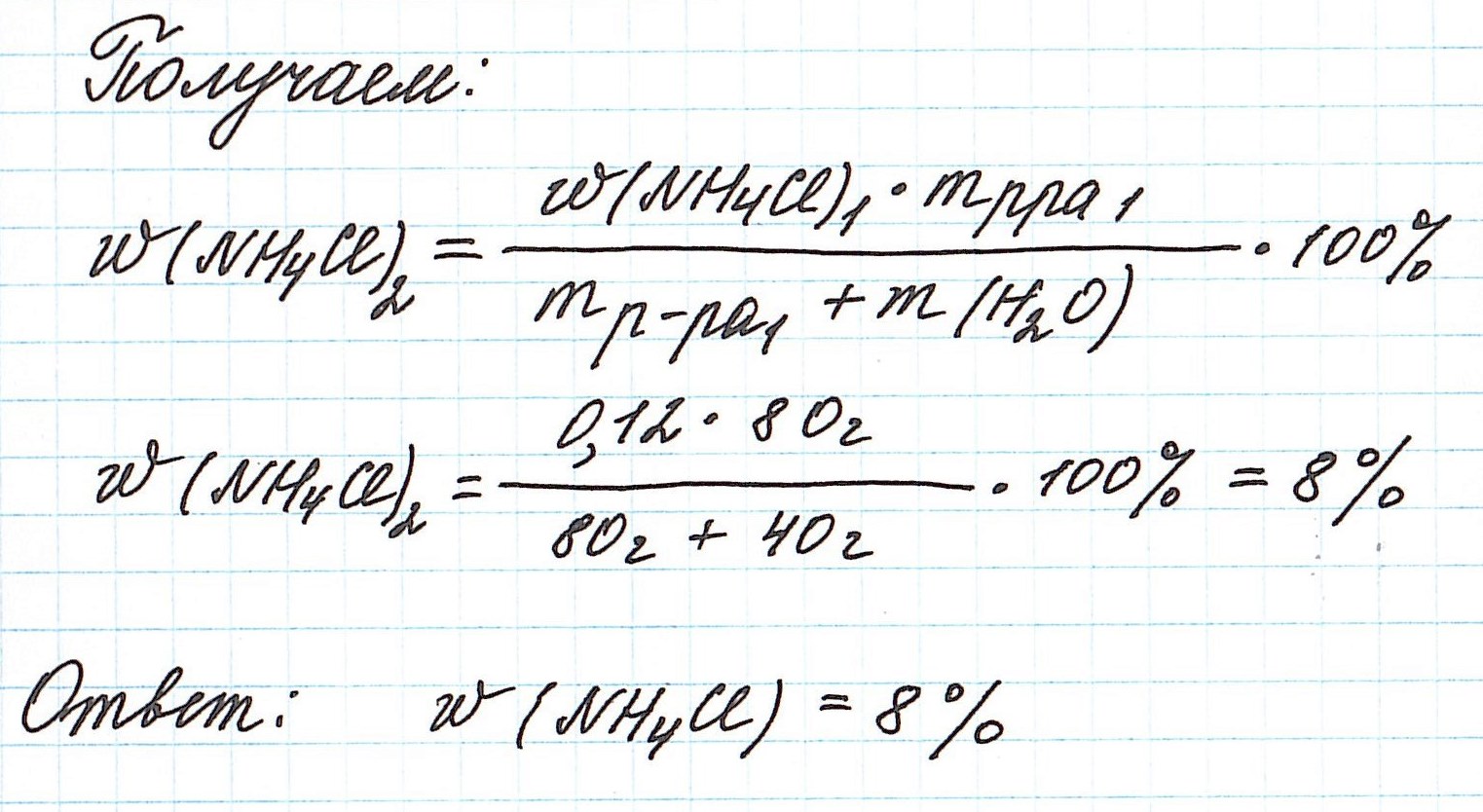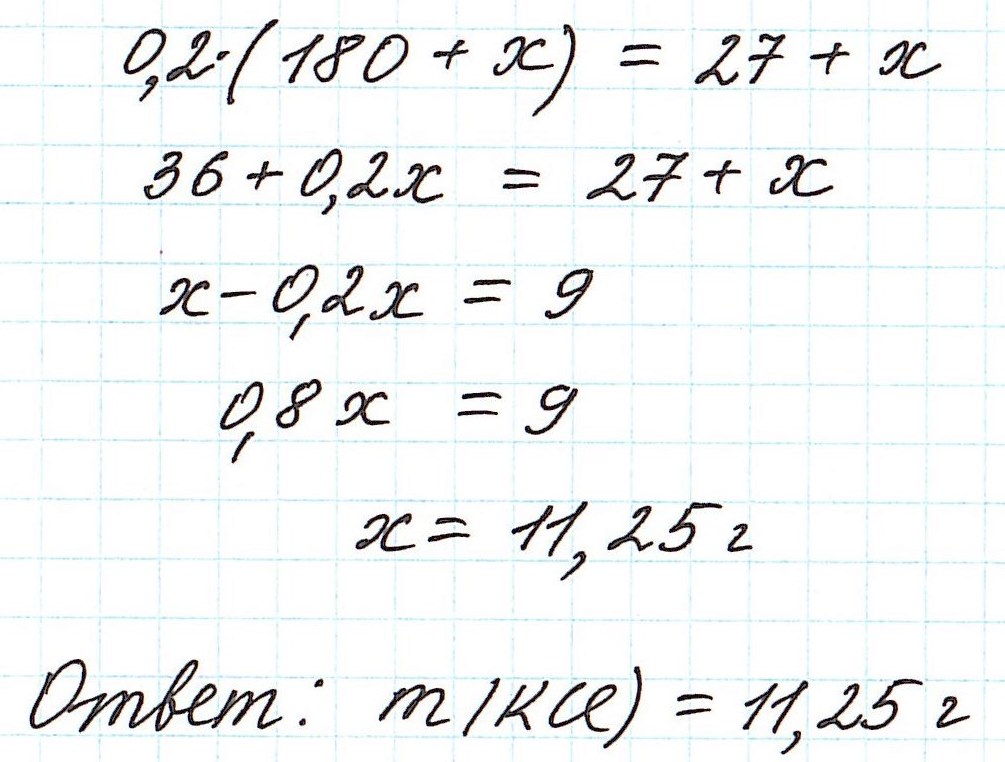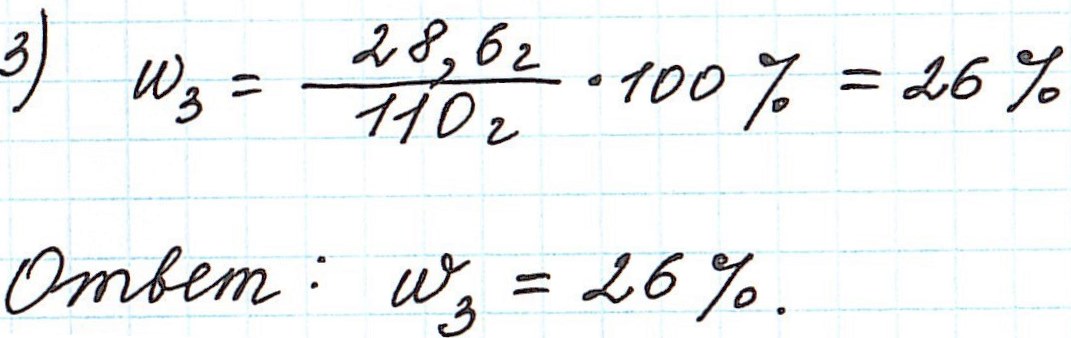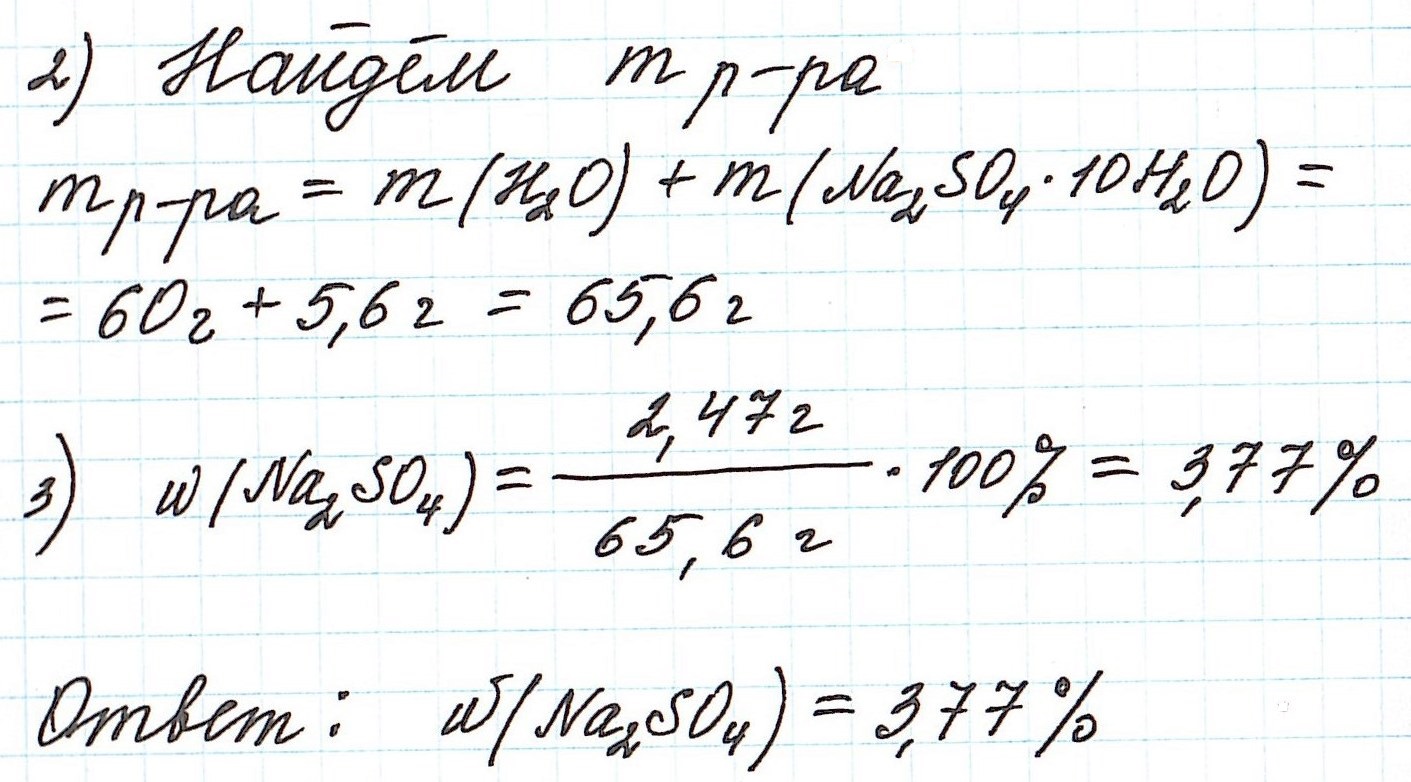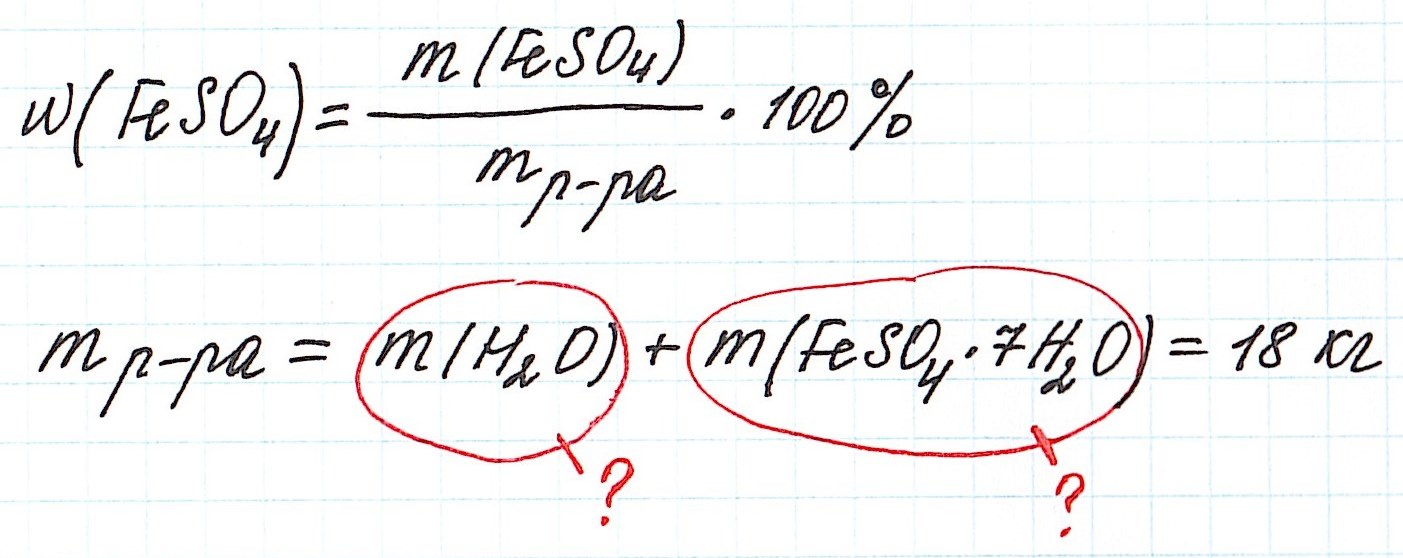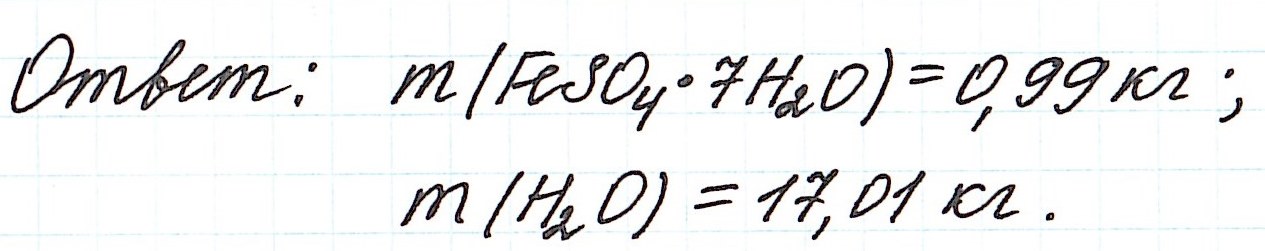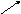Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
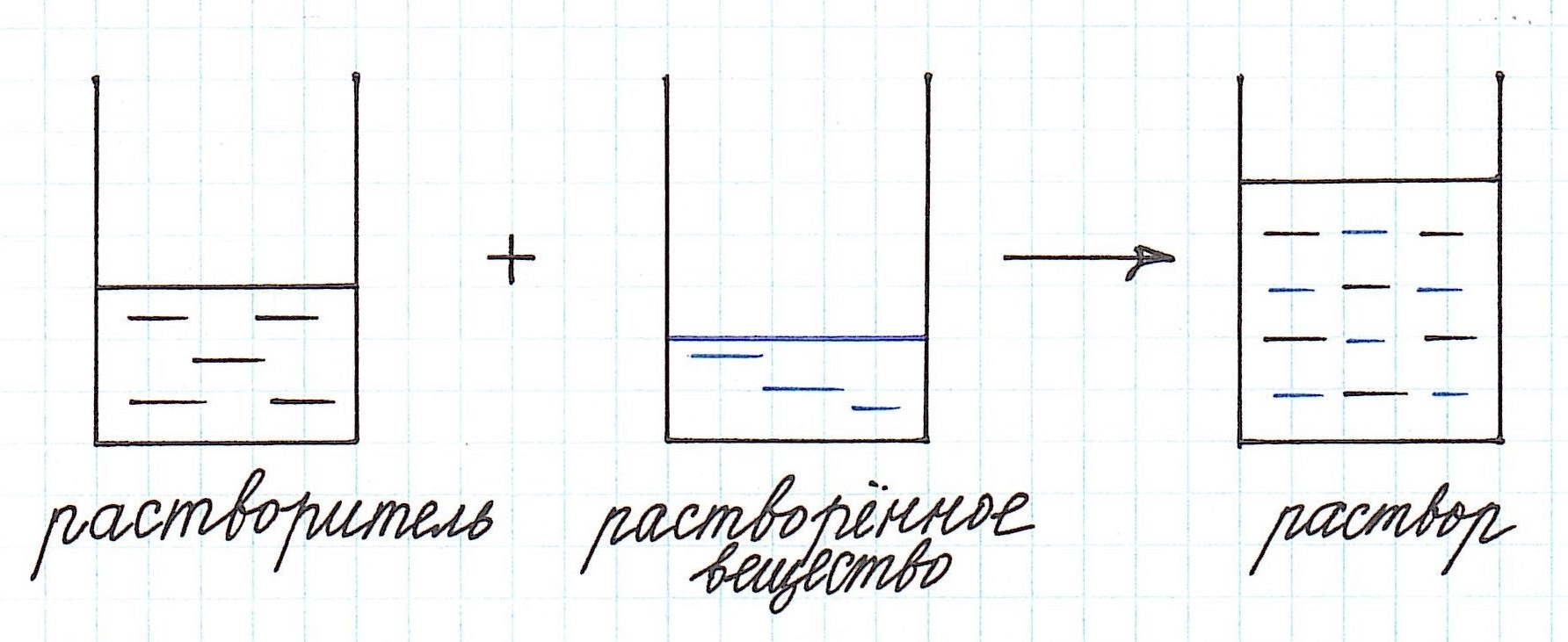
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
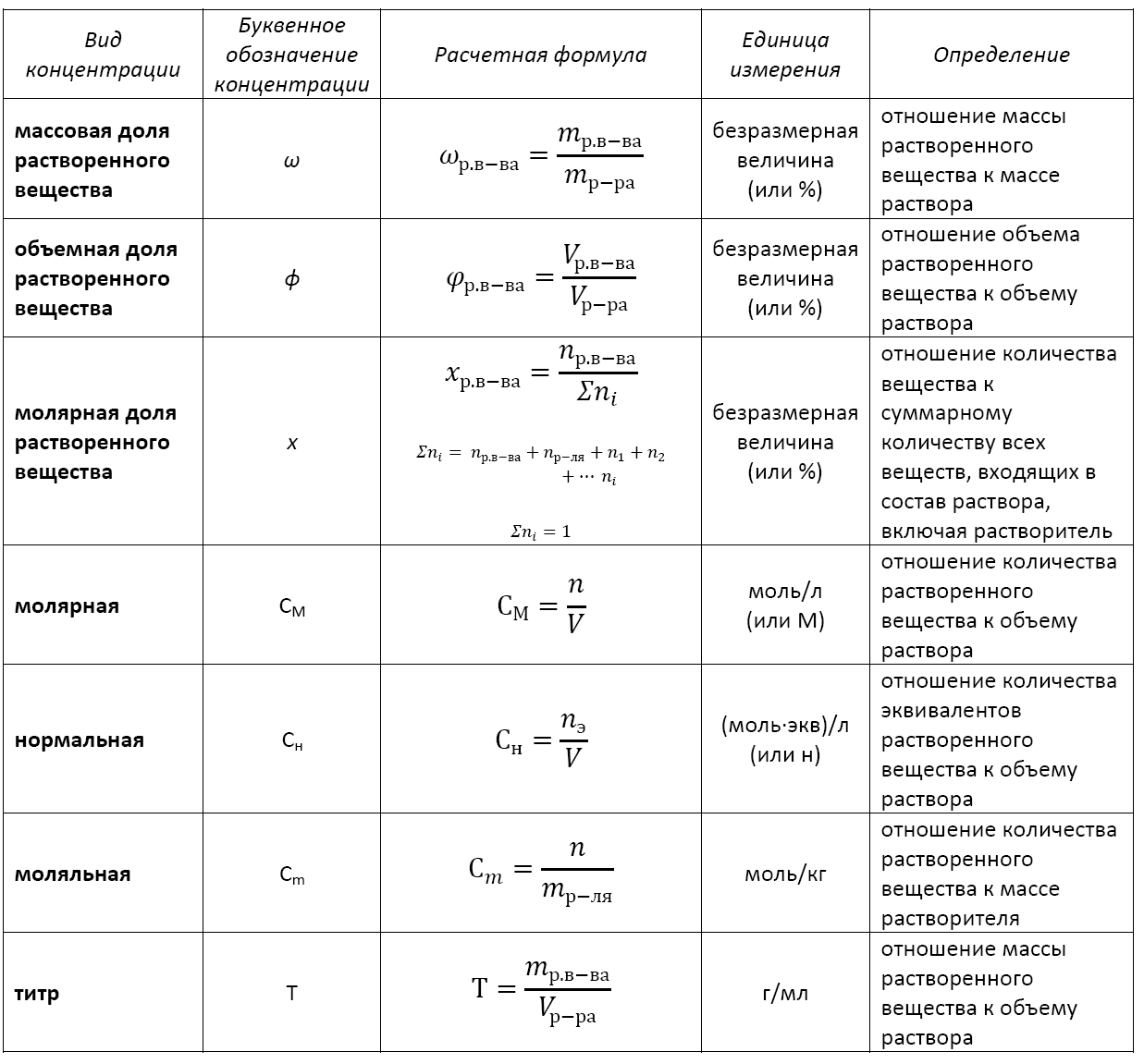
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
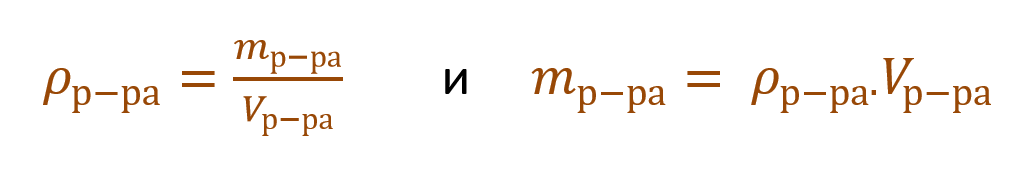
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
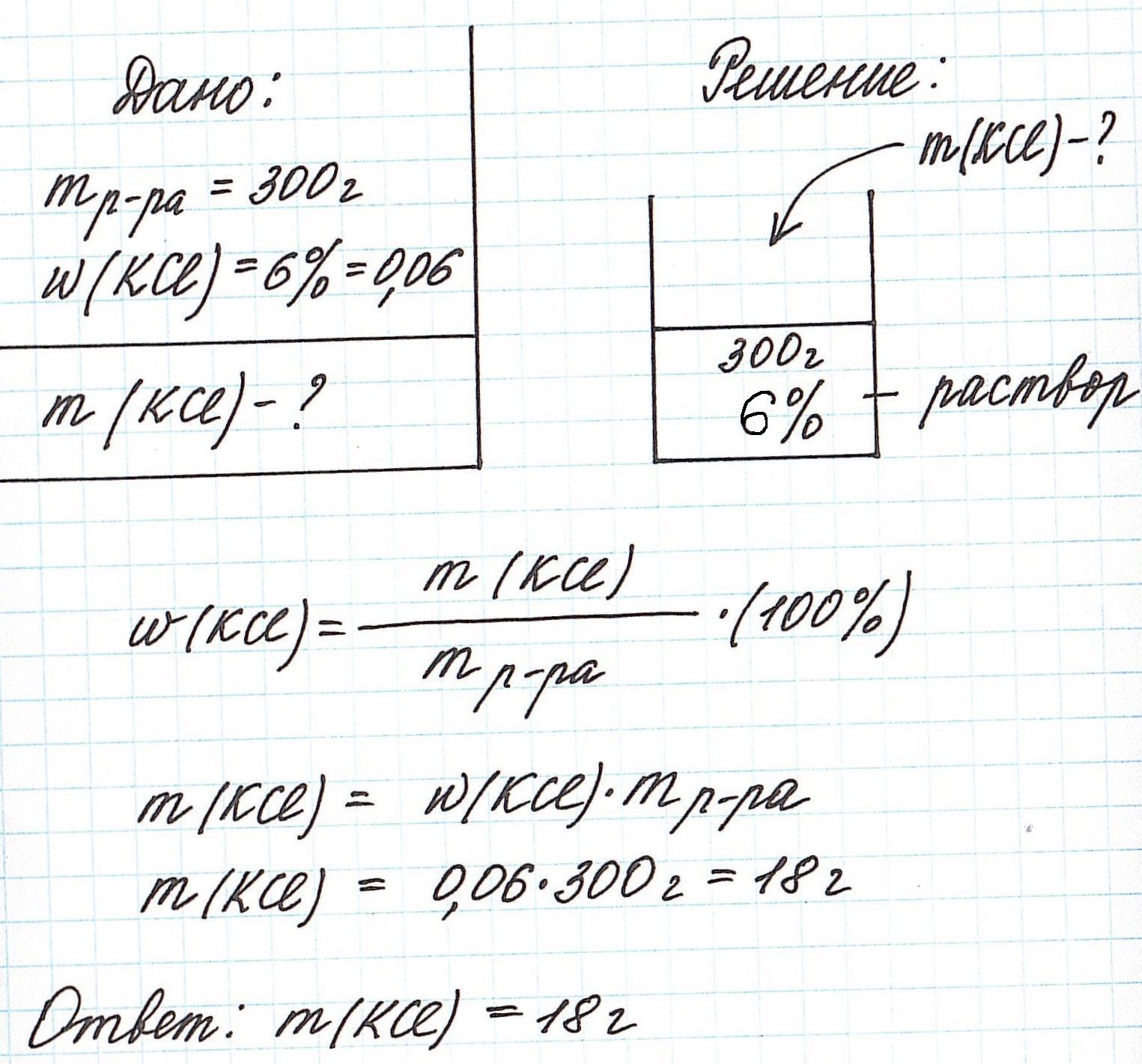
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
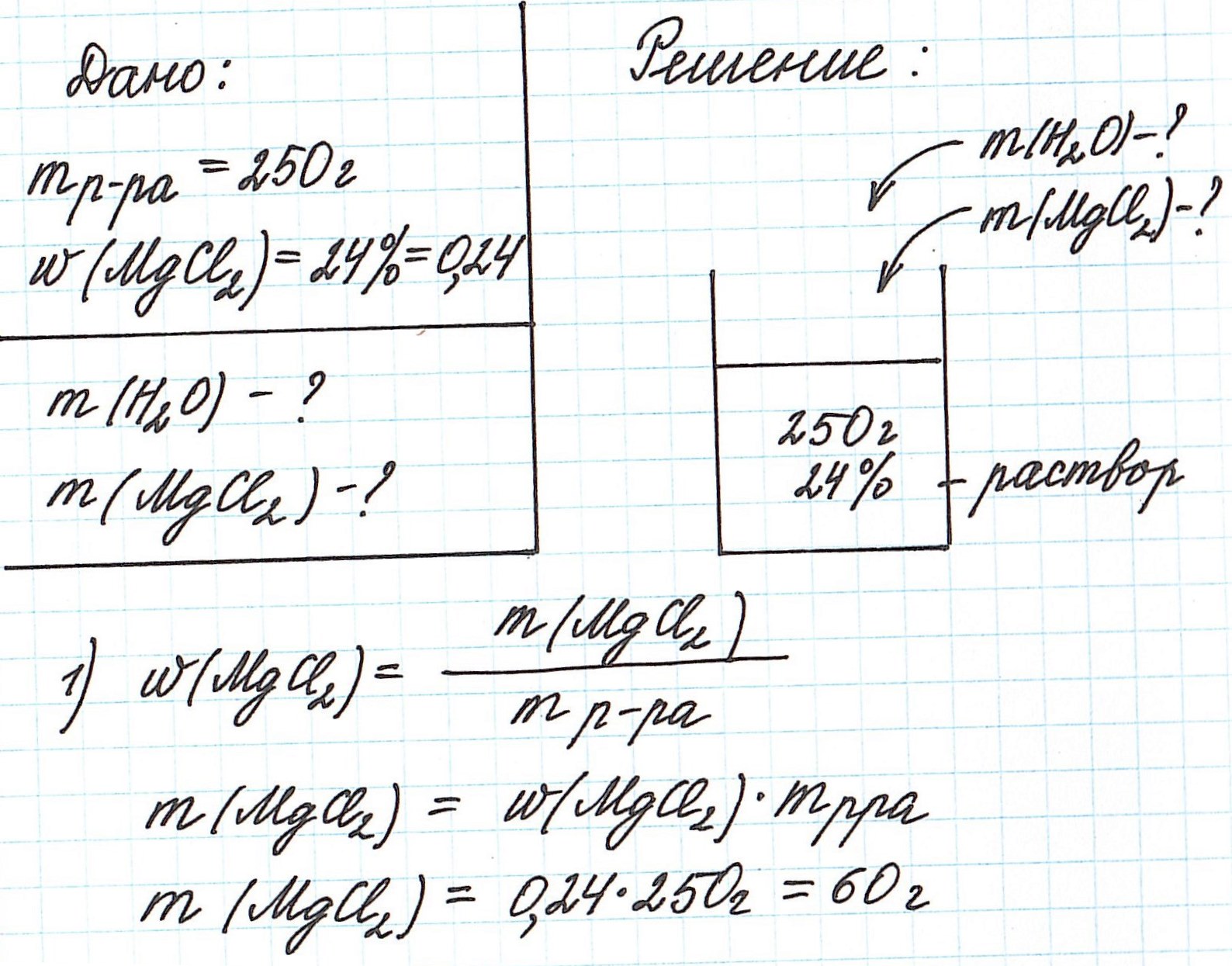
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
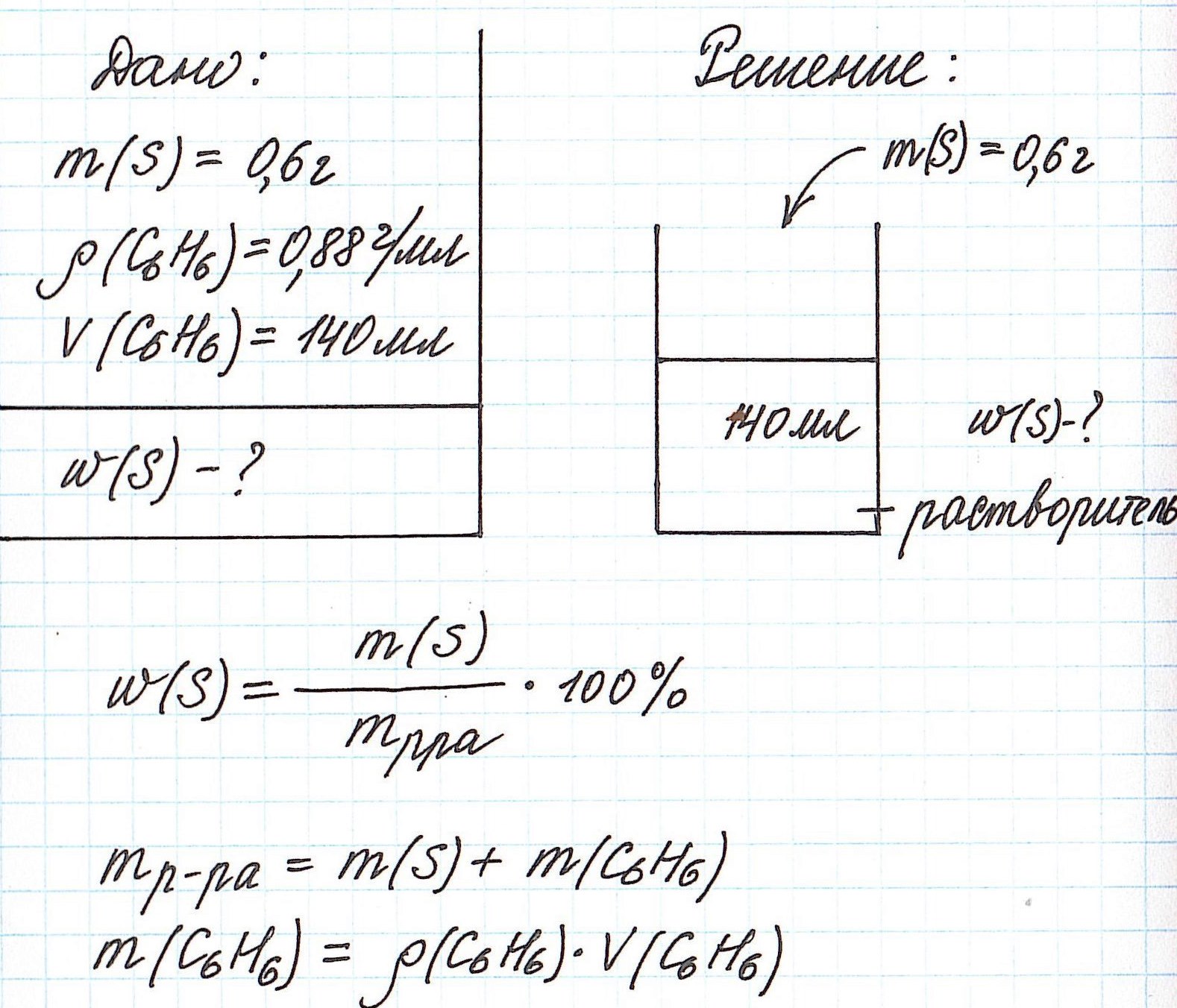
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
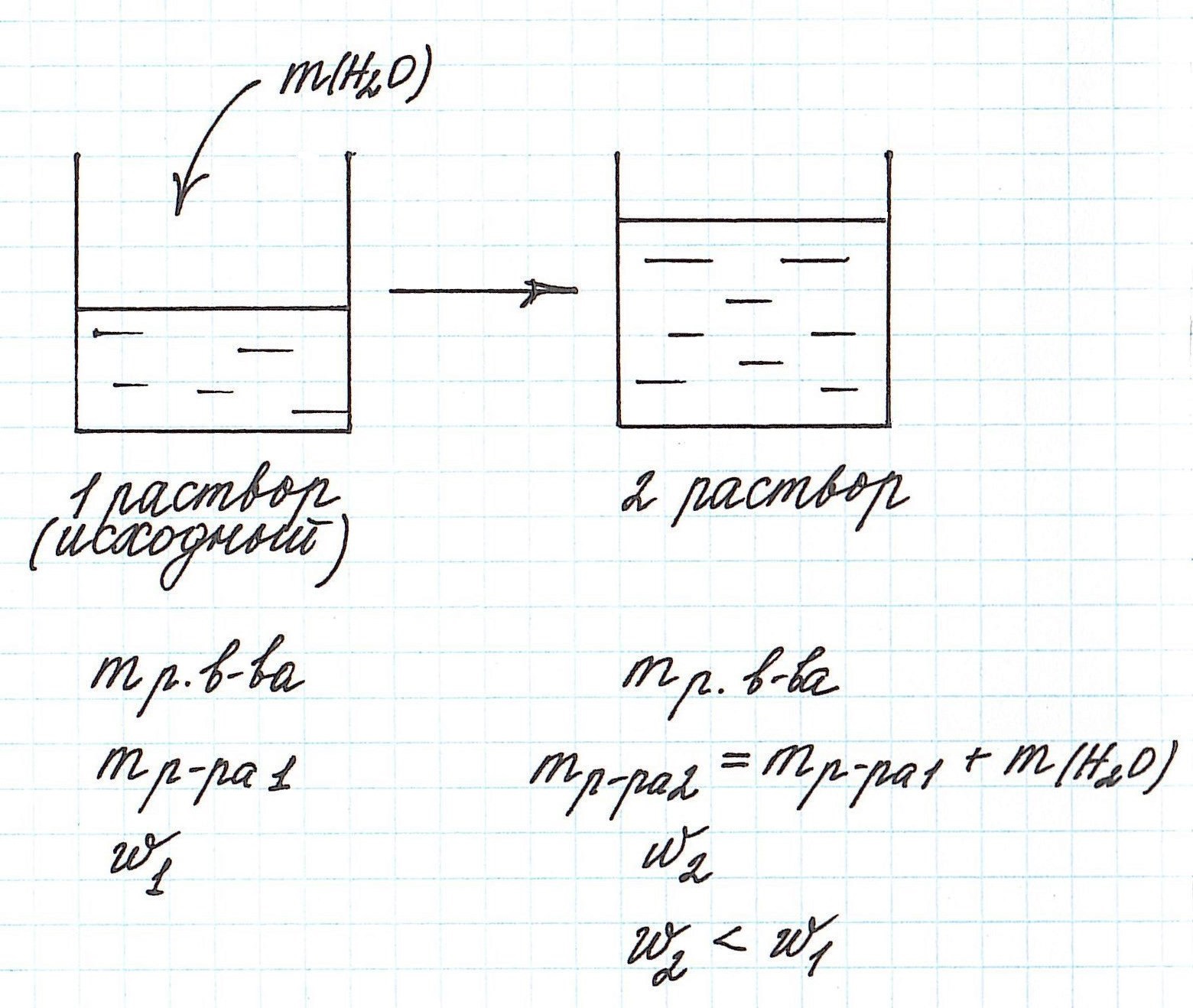
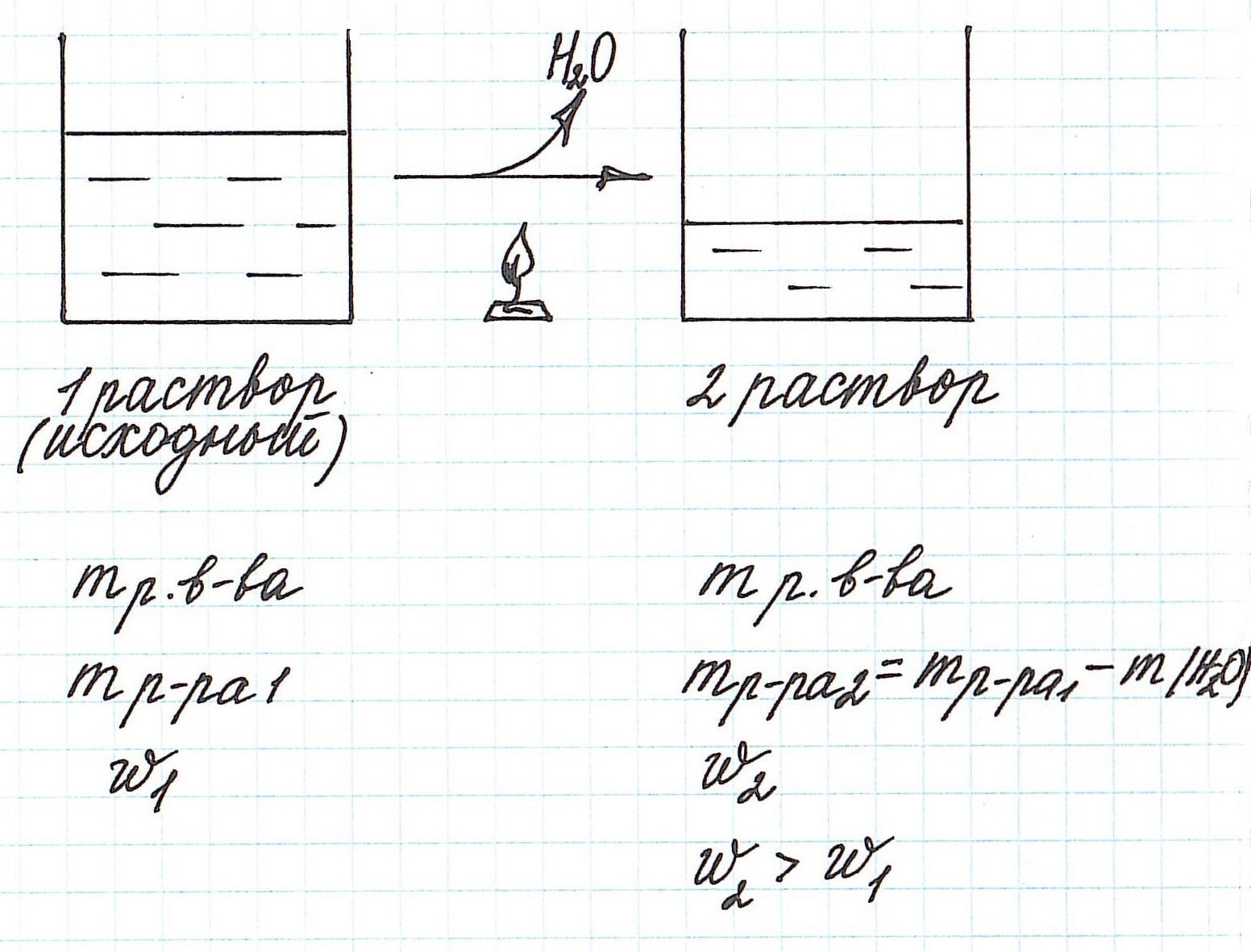
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
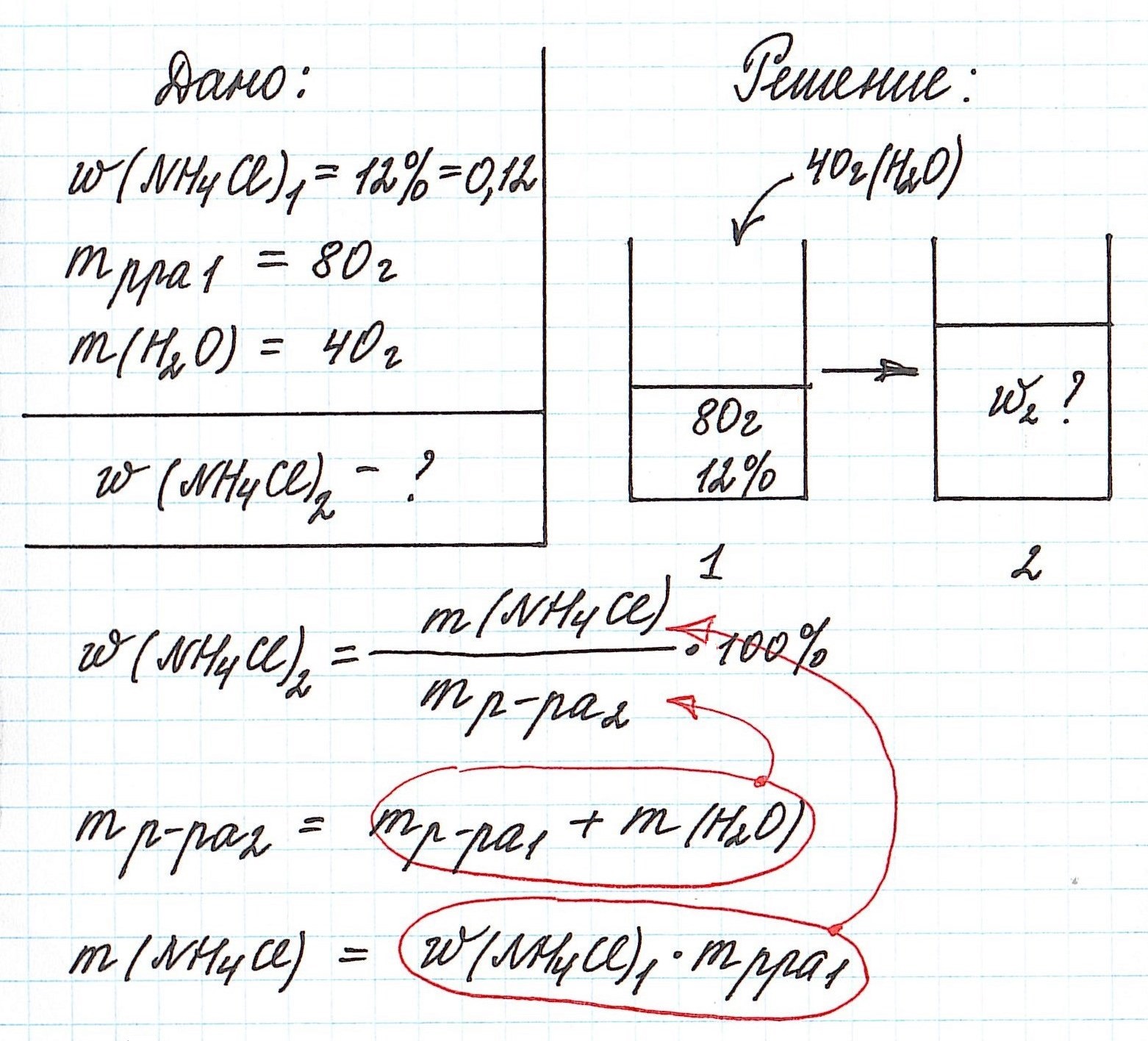
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
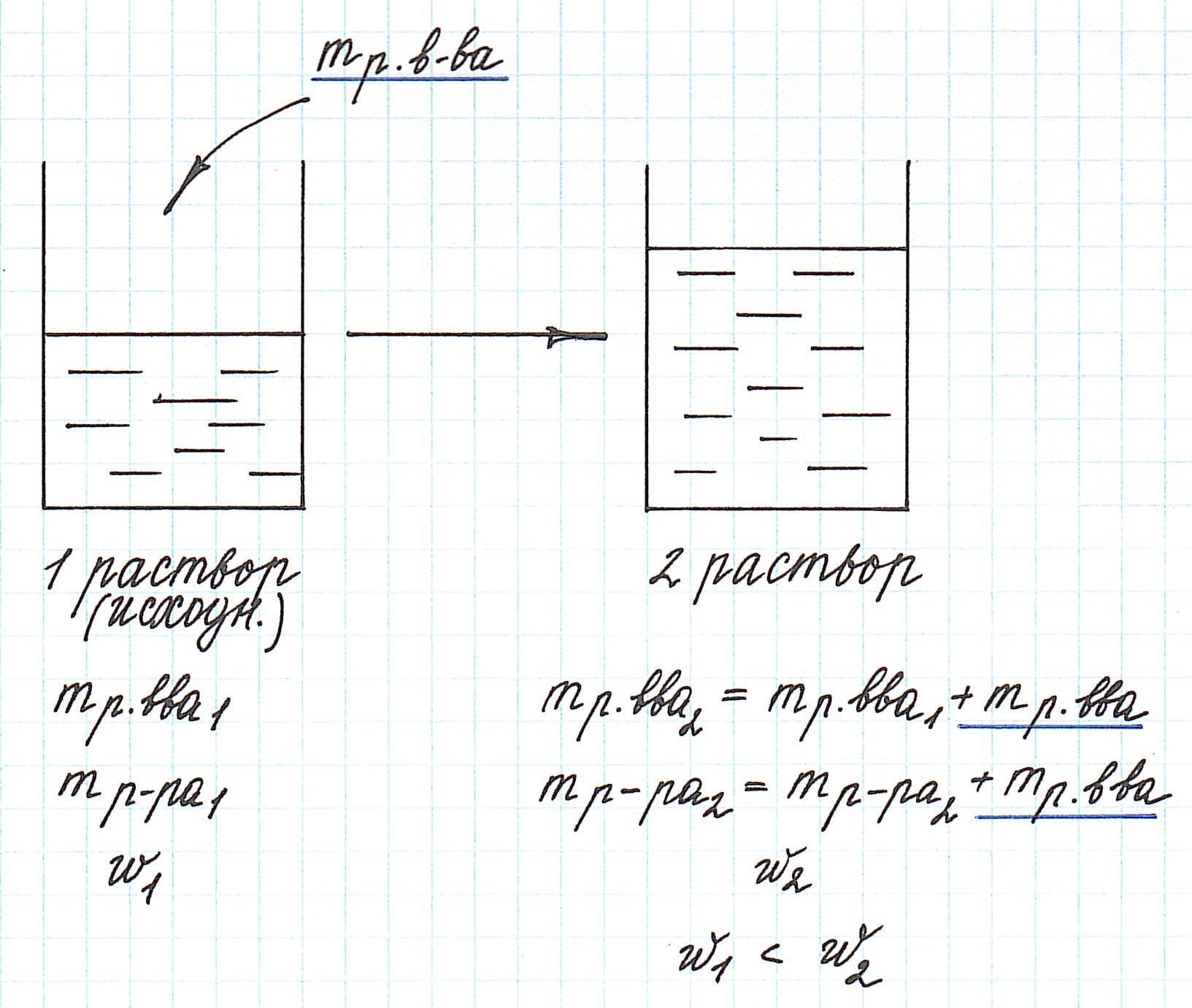
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
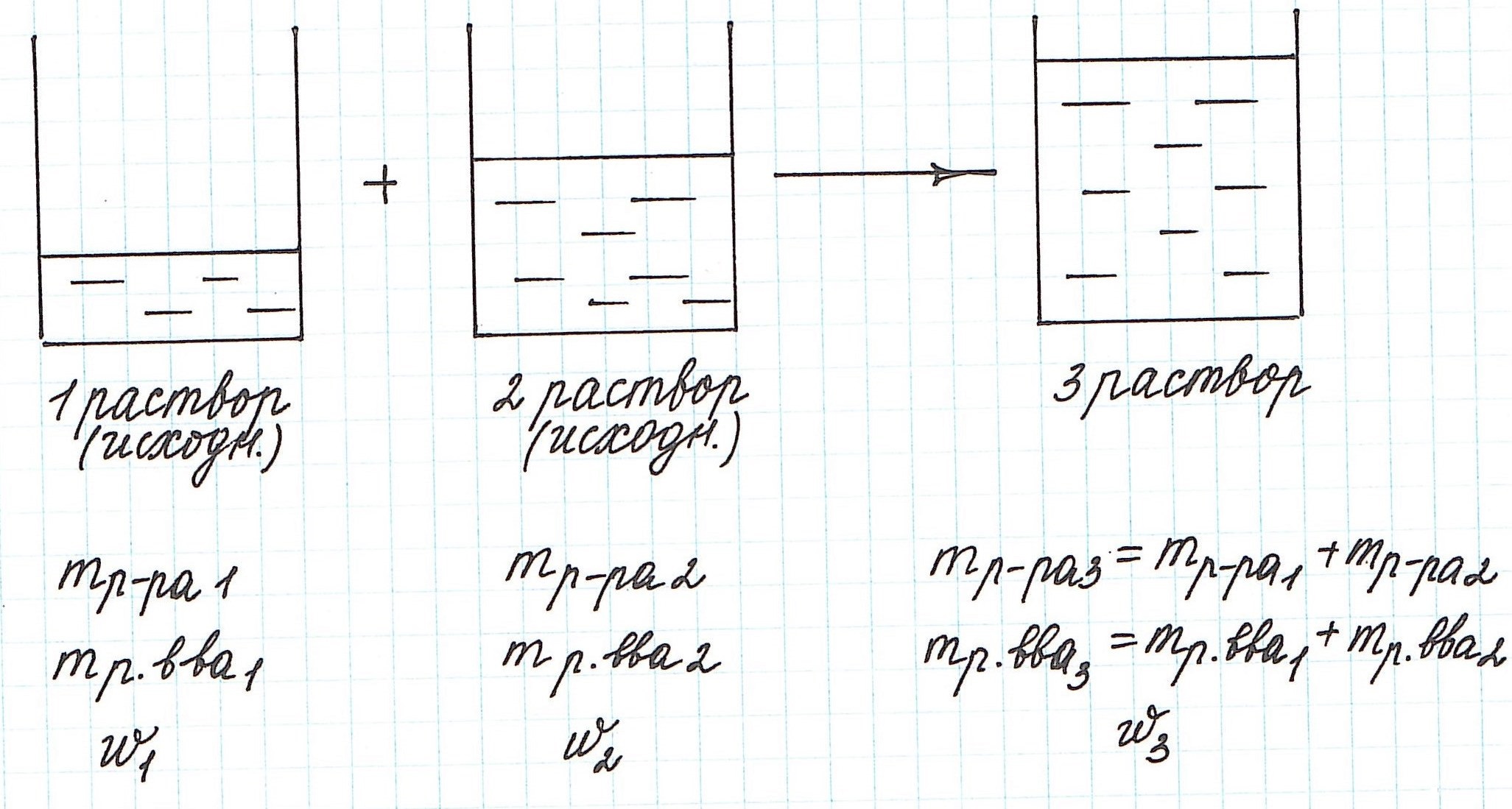
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
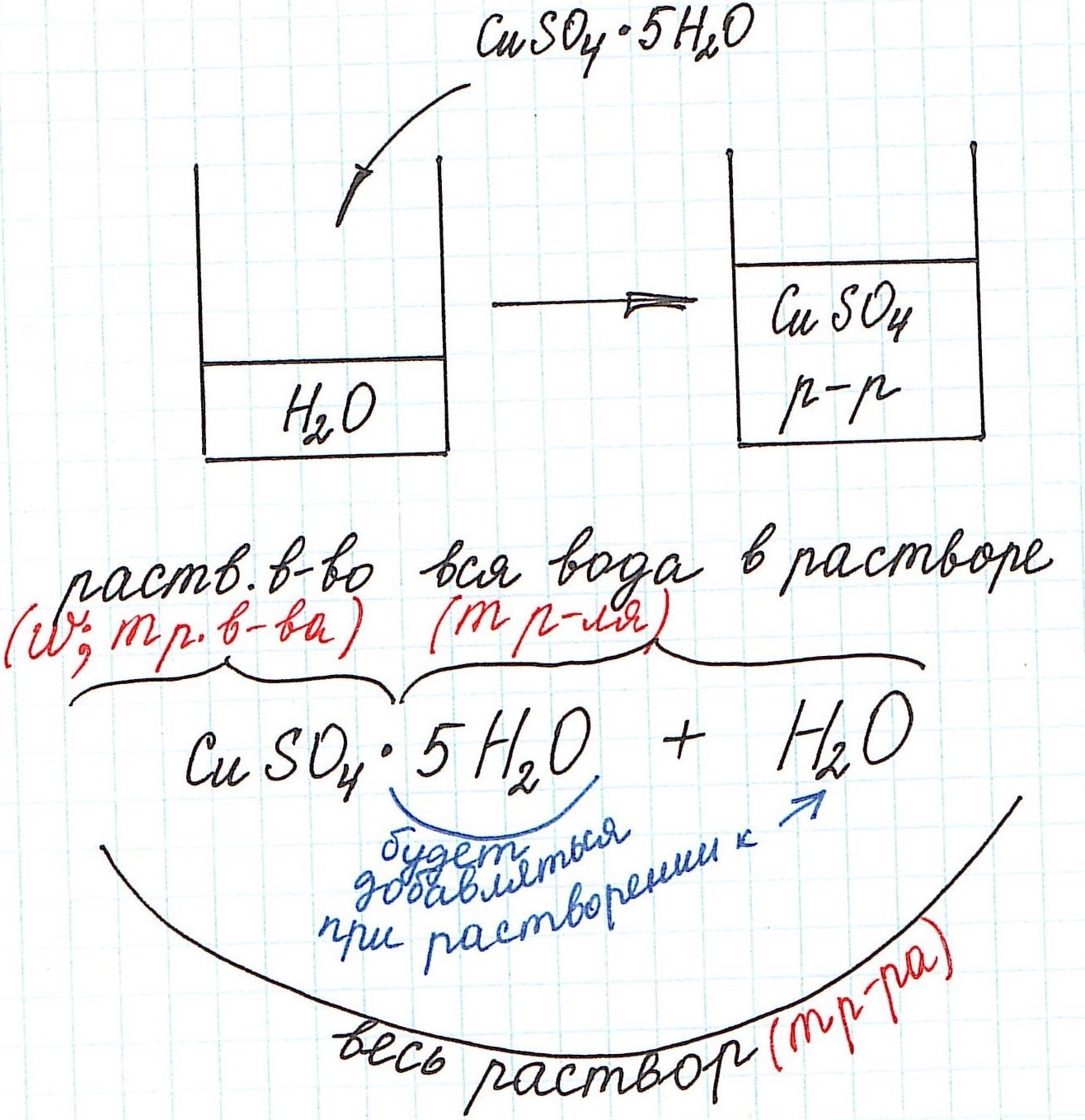
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
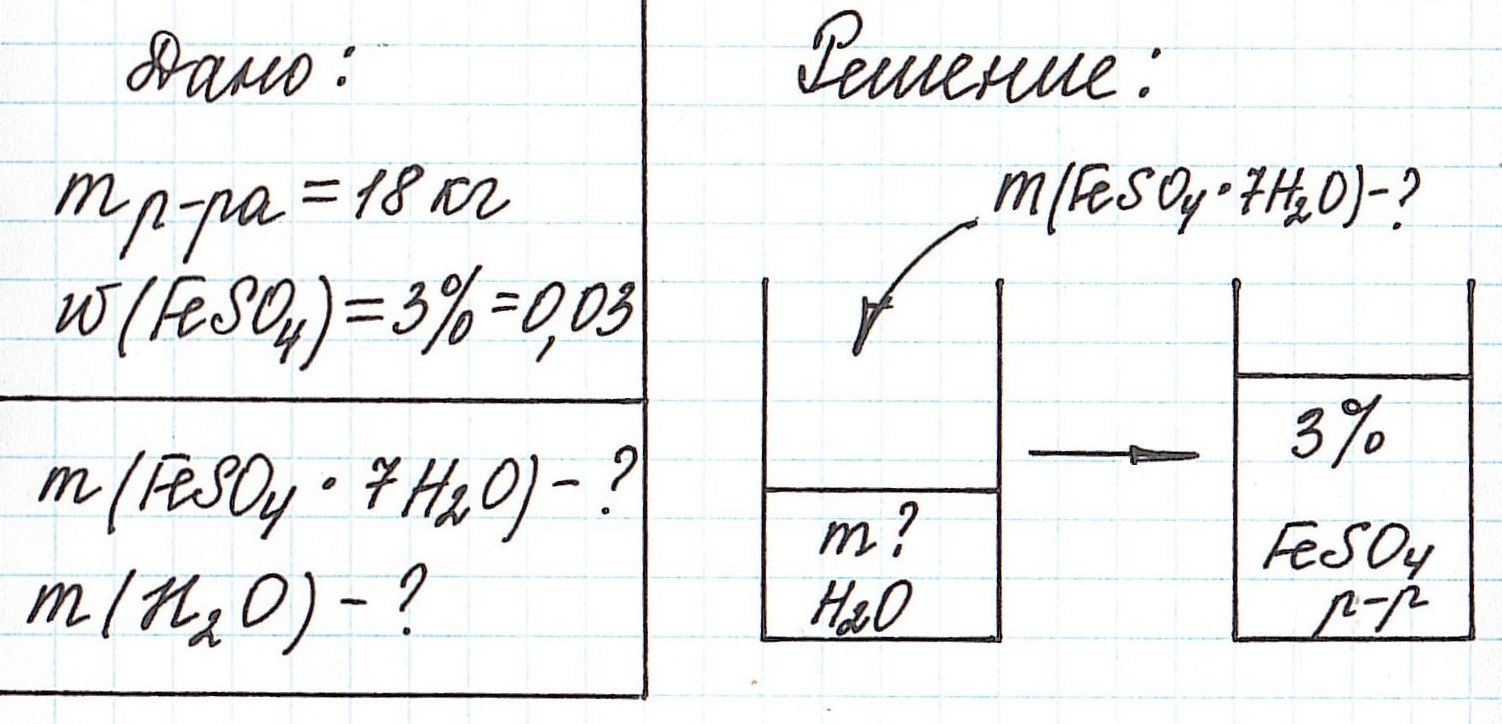
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
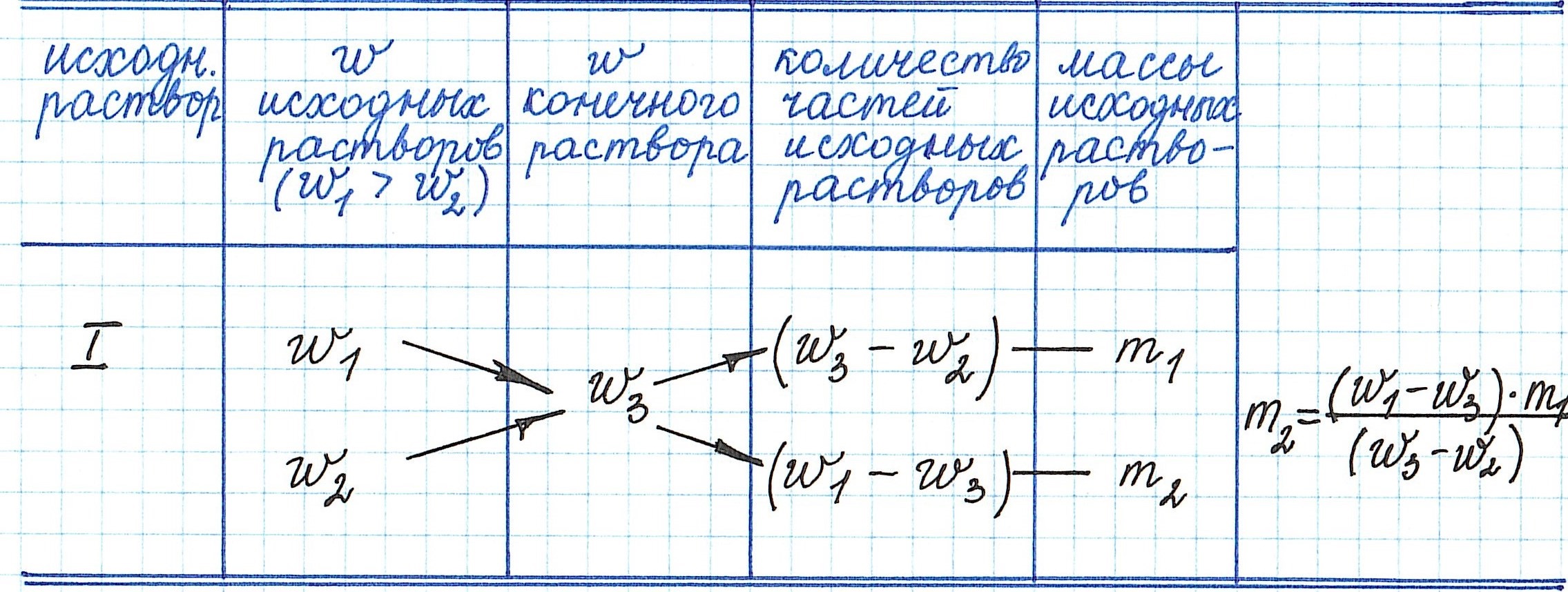
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
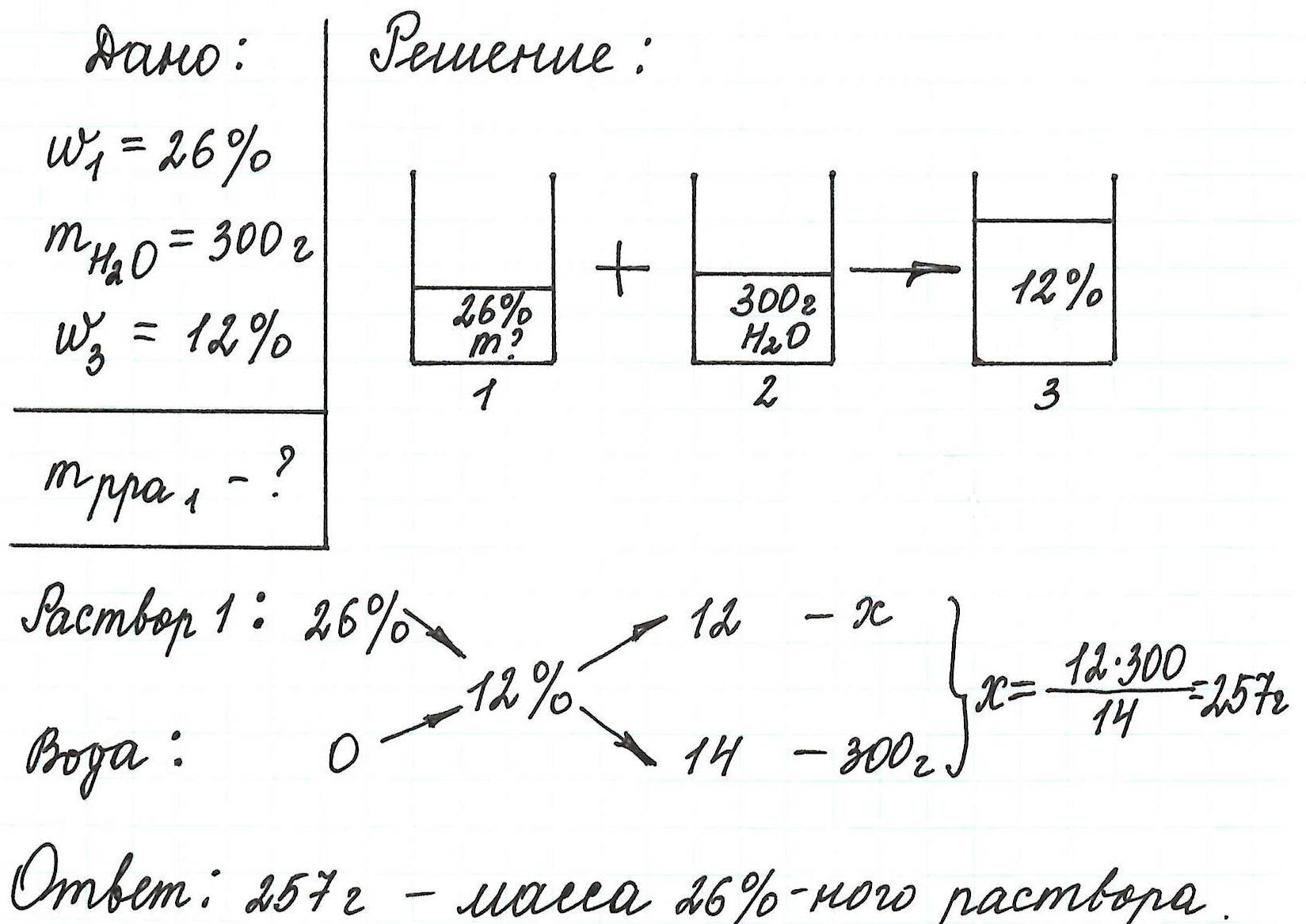
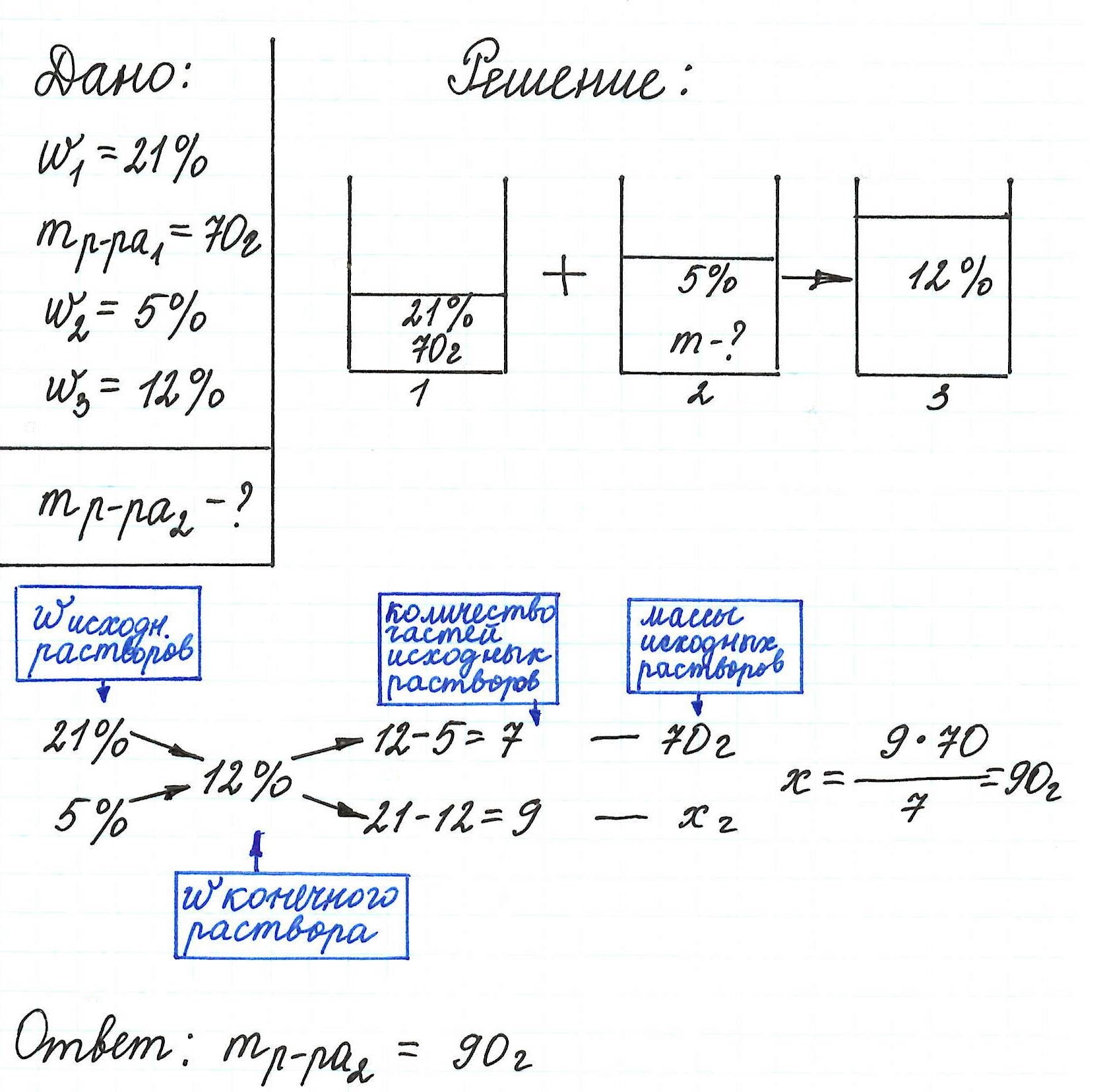
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Способы выражения концентрации растворов.
Молярная концентрация См– отношение количества вещества в молях
(n) к объему раствора в
литрах:
Если вещество обозначить через Xто:
Нормальная концентрация или молярная
концентрация эквивалента Сн
– отношение количества эквивалентов
вещества к объему раствора
Молярная и нормальная концентрации
связаны между собой: См
= Сн∙f
или Сн = См
/f
Титр (Т) – часто используется на
практике. Титр раствора –это масса
вещества в граммах в 1 мл раствора (г/мл).
Если Т(HNO3) = 0,006354
г/мл, то это значит, что в 1 мл раствора
содержится 0,006354 г азотной кислоты.
Титр раствора по определяемому
веществу– это масса вещества в г,
взаимодействующая с 1 мл титранта.
Например, ТHCl/NaOHсоставляет 0,003954 г/мл, это означает, что
1 мл раствораHCl(титранта)
реагирует с 0,003954 гNaOH(определяемого вещества).
Массовая доля вещества (ω)––
отношение массы растворенного вещества
(mв-ва) к массе
раствора(mр-ра).
Массовая доля – величина безразмерная,
ее представляют либо в долях, либо в
процентах. Например, для 5%-го раствора
хлорида кальция, широко применяемого
в медицине, ω%(CaCl2)
=5% или в долях ω=0,05. И это означает, что
в 100 г раствора содержится 5 г хлорида
кальция.
ω
где ρ – плотность раствора.
Моляльная концентрация Cm– отношение количества молей растворенного
вещества к 1000 г растворителя, т.е. число
молей растворенного в-ва в 1000 г
растворителя.
Формулы для перерасчета концентраций.
(плотность (ρ) раствора дана в г/мл)
|
ω,% |
См, |
Сн, |
Т, г/мл |
|
|
ω,% |
|
|
|
|
|
См, |
|
|
|
|
|
Сн, |
|
|
|
|
|
Т, г/мл |
|
|
|
|
Приготовление рабочих растворов
Растворы
титр, которых известен, называются
титрованными. Титрованный раствор можно
приготовить, если точную навеску
растворить в мерной колбе. Например,
навеску 0,2750 г Nа2SО4поместим в колбу на 200 мл и доведем объем
дистиллированной водой до метки, то
титр приготовленного раствора точно,
конечно, известен:
Т= 0,2750/200 =0,0013750 г/мл
Вещества,
из которых готовят растворы с известным
титром, называются исходными (стандартными
веществами). Исходные вещества должны
удовлетворять следующим требованиям:
а) они
должны быть химически чистыми (примеси
не более 0,05-0,1 %);
б) состав
должен строго соответствовать химической
формуле;
в)
устойчивы при хранении в растворе и в
твердом состоянии;
г)
величина эквивалента должна быть
наибольшей.
Раствор,
приготовленный таким образом, называется
стандартными раствором с приготовленным
титром. Способ приготовления титрованных
растворов зависит от свойств вещества
и агрегатного состояния
1. Из
веществ кристаллических х.ч. готовят
по точной навеске.
Например:
приготовить 250 мл 0,1н раствораNa2CO3,
М(Na2CO3)
= 106 г/моль. Эквивалентная масса Э(Na2CO3)
= 53 г/моль,
Необходимо:
а)
рассчитать навеску, необходимую для
приготовления раствора:
m
= CH∙
M(1/z Na2CO3)∙V(л)
= 0,1∙53∙0,25 = 1,325 (г)
б)
отвесить навеску на аналитических
весах,
в)
навеску количественно перенести в
мерную колбу на 250 мл, растворить в
небольшом количестве дистиллированной
воды и долить ею до метки, тщательно
перемешивая.
2.
Приготовление из фиксанала.Готовят
раствор, сразу разбивая фиксанал в
мерную колбу нужного объема, и вымывают
из фиксанала все кристаллы дистиллированной
водой и доводят раствор до метки.
3. Из
кристаллических веществ, загрязненных,
гигроскопичных, летучих и т.д.
Необходимо
для приготовления;
а)
рассчитать навеску,
б)
отвесить ее на технических весах,
перенести в любую склянку на 250 мл,
растворить в дистиллированной воде и
долить до метки,
в)
установить точную концентрацию
приготовленного раствора по исходному
веществу (титрованному раствору).
Растворы, титр которых находят не по
точной навеске, а путем титрования
титрованным раствором, называют растворы
с установленным титром.
Примеры:
1.
Приготовить400мл 0,05 н раствора буры
из кристаллической.
Решение:
Определить
массу навески буры, она равна:
m=
Э(Nа2В4О7∙10Н2О)∙Сн∙V(л)=190,71∙0,05∙0,4=3,81
г.
Отвешиваем
на аналитических весах навеску, переносим
в мерную колбу, тщательно растворяем и
доводим до метки 400 мл.
2.Приготовить
100 мл0,15 н раствора из 3н раствора её.
Вопросы
к задаче: а) в каких объемах реагируют
растворы с одинаковой концентрацией?
б) какая зависимость между объемами
реагирующих веществ и нормальными
концентрациями?
Данную
задачу можно решить по формуле: Сн1∙V1= Сн2∙V2;
Сн1
и Сн2 — концентрации растворов
моль/л;V1иV2
– объемы исходного и конечного
раствора в мл,
V1= Сн2∙V2/ Сн1= 0,15 100 / 3 = 5 мл
Значит,
для приготовления 100 мл 0,15 н раствора
нужно взять 5 мл 3н раствора и довести
до метки 100 мл дистиллированной водой.
3.Приготовить
100г 14% раствора,хлорида натрия из 22%-
го и 10%-го растворов этой соли.
Весовое
соотношение исходных растворов находим
по правилу смешения (правило креста):
1
8 весовых частей
1
2
4 весовые части
Из
большего числа вычитаем меньшее: 22-14= 8
в.ч. 10%-го
14-10 = 4
в.ч. 22%-го
Получим
12 г 14% -го раствора
Дальше
рассуждаем:
на 12 г
14%-го раствора нужно 8 г 10%-ного
на 100 г
Х

на 12 г
14%-го раствора нужно 4 г 22%-ного
н
100 г Х
Х = 33,3 г
Измеряем ареометром плотность исходных
растворов. Разделив массы растворов на
плотность, получим объемы исходных
растворов, необходимых для приготовления
нужного раствора. Отмериваем их и
переливаем в склянку для использования
в работе.
Определить
титр раствора хлорида натрия, если
известно, что на титрование его 10 мл
расходовалось 9,2 мл 0,1 н раствора нитрата
серебра. Титр можно определить:
по
закону эквивалентов: (Cн∙V)NaCl= (Cн∙V)AgNO3
Cн
(NaCl) = (9,2∙0,1)/10 = 0,092 моль/л,
Т = (58,5∙0,092)/1000 = 0,005382 г/мл
58,5 –
это эквивалентная масса хлорида натрия.
ФИКСИРОВАНИЕ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
Установление состояния эквивалентности
является очень важным моментом в
проведении анализа. Несоответствие
момента прекращения титрования (точки
эквивалентности) приводит к возникновению
индикаторных ошибок титрования, к
неправильным ответам, что чревато
последствиями. В принципе, индикаторная
ошибка неизбежна при любом определении,
но при правильном определении точки
конца реакции столь мала, что ею можно
пренебречь. Точку эквивалентности можно
определить химическими методами
(применение индикаторов) и физико-химическими
методами (потенциометрическими,
кондуктометрическими, фотоколометрическими).
В
некоторых случаях изменения в системе
титрования столь заметны, что не требуется
каких то заметных особых приемов для
обнаружения конца реакции. Проблема
выбора способа фиксирования точки
эквивалентности всегда решается
применительно к конкретной практике
(методике исследования). Чаще всего
используют индикаторы. Полученные
результаты должны быть достоверны, т.е.
должны быть подвергнуты статистической
обработке. Методику статобработки см.
в данном методическом руководстве.
Метод нейтрализации
и его применение в медико-санитарной
практике
Медико биологическое значение.
Метод кислотно-основного титрования
позволяет определять количественно в
исследуемых объектах кислые и основные
продукты.
Так, в санитарно-гигиенической практике
этим методом определяют кислотность и
щелочность многих пищевых продуктов,
питьевых и сточных вод.
В клинической практике кислотно-основное
титрование используют для определения
кислотности желудочного сока, буферной
емкости крови, спинно-мозговой жидкости,
мочи и других биологических жидкостей.
Этот метод широко используется в
фармацевтической химии при анализе
лекарственных веществ, установления
доброкачественных продуктов питания
(например,молока).
Большое значение имеет рассматриваемый
метод и при санитарно гигиенической
оценке объектов окружающей среды.
Промышленные стоки могут содержать или
кислые, или щелочные продукты. Закисление
или защелачивание природных водоемов
и почвы приводит порой к необратимым
последствиям, в связи с чем контроль
кислотно-основного баланса весьма
важен.
МЕТОД НЕЙТРАЛИЗАЦИИ
Краткое описание метода нейтрализации
сводится к следующим моментам:
а)
Реакция
В основе метода лежит реакция взаимодействия
H++ OH— →
H2O.
б)
Определяемые
вещества:
кислоты:
сильные и слабые
основания:
сильные и слабые: соли, подвергающиеся
гидролизу.
в)
Титранты:
Сильные
кислоты (соляная, серная) с концентрацией
от 0,01 до 1,0 моль/л используются для
определения концентрации оснований и
солей, гидролизующихся по аниону.
Сильные
основания: (NaOH, KOH) с концентрацией от
0,01 до 1,0 моль/л
используются
для определения концентрации кислот и
солей, гидролизующихся по катиону.
Чаще всего
титранты для метода нейтрализации
готовят из фиксаналов. Иногда растворы
сильных кислот готовят разбавлением
концентрированного раствора кислоты,
а растворы сильных оснований, растворением
навески твердой щелочи. Последние
способы приготовления растворов, требуют
экспериментального уточнения концентрации
приготовленного титранта с использованием
установочных (исходных) веществ.
Для
титрантов кислот, в качестве установочных
веществ, используют соду Na2CO3
или буру Na2B4O7•10H2O.
Для
титрантов щелочей — щавелевую кислоту
(H2C2O4•2H2O).
г)
Индикаторы
Реакция
между кислотами и основаниями не
сопровождается, как правило, какими-либо
внешними эффектами, поэтому для
фиксирования точки эквивалентности
приходится использовать специальные
вещества-индикаторы. Кислотно-основные
индикаторы это, слабые кислоты или
основания, степень ионизации которых
определяется концентрацией [H+]
ионов в растворе.
H+Ind
↔
H++Ind—
Чем больше
концентрация H+
ионов, тем меньше будет степень ионизации
индикатора. Молекулярная HInd и ионная
HInd формы индикатора имеют разные окраски.
Таким образом, концентрация ионов H+
влияет
на соотношение концентраций HInd и Ind что,
в свою очередь, определяет характер или
яркость окраски.
Для
характеристики кислотности растворов
в химии широко пользуются водородным
показателем, pH — отрицательный десятичный
логарифм молярной концентрации [H+].
В кислых
растворах pH<7, в щелочных pH>7, в
нейтральных
Все
индикаторы изменяют свою окраску не
скачкообразно, а плавно, т.е. в определенном
интервале значений pH, называемом
интервалом перехода.
Поскольку
индикаторы как кислоты или основания
отличаются друг от друга по силе, они
имеют разные интервалы перехода (см.
табл.1).
Таблица
1
|
N п/п |
Анализ вещество |
pH в точке эквивалент-ности |
Скачок титрования |
Используемые индикаторы |
Интервал перехода окраски индикатора |
|
1. |
Сильная Сильное или наоборот |
7.0 |
3-11 |
Метилоранж Метилрот Фенолфталеин |
3.1-4.4 4.2-6.3 8.3-10.0 |
|
2. |
Слабая Сильное основание |
8-10 |
6-11 |
Фенолфталеин |
8.3-10.0 |
|
3. |
Слабое Сильная кислота |
4-6 |
3-7 |
Метилоранж Метилрот |
3.1-4.4 4.2-6.3 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO4 2% и плотностью 1029 кг/м3. Определить молярность, нормальность, моляльность и титр этого раствора раствора.
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) =
56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв·
М(FeSO4) = 1/2·152
= 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029
= 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) =
0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е.
воды в растворе равна:
mH2O = 2,06-0,0412
= 2,02 кг
b
(FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста