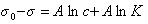Уравнение Гиббса
дает возможность вычислить зависимость
поверхностного натяжения от концентрации
раствора,
если известна изотерма адсорбции.
Для малых концентраций
адсорбата адсорбция должна подчиняться
закону Генри.
Поверхностное
натяжение раствора можно вычислить по
уравнению:
=
о
– КГ
RT·c,
о
– поверхностное натяжение чистого
растворителя;
– поверхностное
натяжение раствора с концентрацией с;
R
– газовая
постоянная;
Т
– температура,
К;
КГ
– константа адсорбционного равновесия
(константа Генри), зависящая от природы
веществ и температуры.
Уравнение называется
1-м уравнением
Шишковского.
В области зависимости
адсорбции от концентрации растворенного
вещества, отвечающей уравнению адсорбции
Ленгмюра,
можно записать:
d
= Гm·RTdln(1
+ bc)
или в интегральной
форме
=
о
– Гm·RT
ln(1
+ bc)
=
о
– h
ln(1
+ bc),
где Гm
– предельная
поверхностная концентрация адсорбата;
h
= Гm·RT
– константа, зависящая от температуры
и природы веществ;
h
и b
– постоянные,
причем константа h
постоянна для всего гомологического
ряда, тогда как константа b
возрастает в 3–3,5 раза при переходе к
каждому последующему гомологу.
Уравнение называется
2-м уравнением
Шишковского.
Этим уравнением
пользуются для расчета поверхностного
натяжения в растворах и расплавах, если
известна изотерма адсорбции.
Если bc
1, то уравнение Шишковского можно привести
к линейному виду:
о
–
=
h
ln
b
+ h
ln
c.
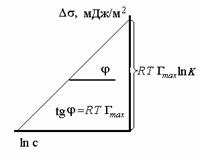
Линейный график
в координатах о–
от lnc
(рис. 3.4) позволяет определить константы
уравнения Шишковского h
и b
, а затем
рассчитать предельную адсорбцию Гm
и размеры молекулы ПАВ.

ОА =
h
lnb.

Рис. 3.4. Графическое представление
уравнения Шишковского вкоординатах
линейной формы
Предельная
величина адсорбции
определяется по формуле:
Гm
= h/RТ,
где h
– константа
уравнения Шишковского, определяется
графически;
R
– газовая
постоянная;
Т
– температура
опыта.
Площадь поперечного
сечения ПАВ
можно вычислить по формуле:
q
=1/(Гm·NA),
где NА
– число Авогадро.
Осевая длина
молекулы ПАВ (толщина
адсорбционного слоя)
l
= Гm
·M/,
где
– плотность
ПАВ, М
– его молярная масса.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1.5. Поверхностное натяжение растворов и адсорбция
Свободная поверхностная энергия самопроизвольно может только уменьшаться, что проявляется в уменьшении либо поверхности раздела фаз, либо межфазного (поверхностного) натяжения. Поверхностное натяжение может уменьшаться в результате самопроизвольного перераспределения компонентов системы между объемами фаз a и b и поверхностью их раздела. В поверхности раздела фаз будут преимущественно концентрироваться те компоненты, которые способны уменьшать избыточную свободную поверхностную энергию. Это явление получило название «адсорбция». Количественно мерой адсорбции служит избыток вещества в поверхностном слое определенной толщины по сравнению с его количеством в таком же слое в объеме фазы. Этот избыток обычно относят к единице площади поверхности (или к единице массы адсорбента). Такая адсорбция называется гиббсовской и обозначается буквой Гi. Поверхностный избыток является алгебраической величиной. Если он положителен, то вблизи поверхности данный компонент присутствует в избытке, если отрицателен, то концентрация компонента на поверхности фазы ниже, чем в ее объеме .
Рассмотрим распределение в системе i -го компонента, предполагая, что это вещество способно понижать поверхностное натяжение. В соответствии с уравнением (1.1.6) число молей n вещества i-го компонента в системе определяется как 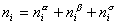
Количество вещества в обеих фазах составляет
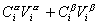
где С a , С b — концентрация вещества в фазах a, b.
Количество вещества на поверхности раздела фаз 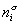
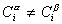
Учитывая уравнение (1.1.81) ,
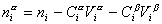
Разделив выражение (1.1.82) на площадь поверхности раздела фаз А, можем определить гиббсовскую адсорбцию:
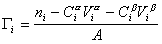
Фундаментальным уравнением физической химии поверхностей является взаимосвязь между адсорбцией и межфазным натяжением, которую можно определить экспериментально при одновременном изменении многих факторов. Остановимся на системах, в которых адсорбция протекает при постоянной температуре. Связь между адсорбцией и межфазным натяжением при постоянной температуре T называется изотермой адсорбции, фундаментальное уравнение которой известно как уравнение Гиббса. Рассмотрим его вывод.
При небольшом обратимом изменении энергии системы dU с учетом формулы (1.1.4) можем написать
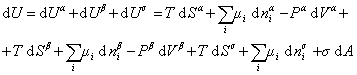
где U – полная внутренняя энергия системы; U a , U b , U s – внутренняя энергия фаз aиb и поверхности их раздела; P a , P b — давление в фазах aиb; m — химический потенциалi-того компонента; S a , S b , S s – энтропия фаз a иb и их поверхности раздела; s — поверхностное натяжение.
Поскольку из курса химической термодинамики известно, что
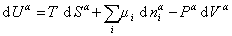
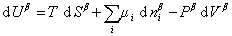
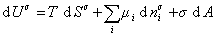
Если энергию, энтропию и количество компонентов увеличивать от нуля до некоторого определенного значения при постоянстве температуры T, площади поверхности раздела фаз A и количестве вещества на этой поверхности 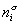
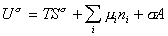
дифференцирование которого приводит к выражению
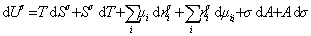
Сравнивая его с уравнением (1.1.88), получаем
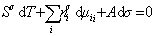
В расчете на единицу поверхности
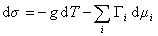
где 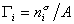
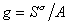
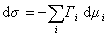
Для двухкомпонентной системы
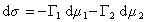
где индекс 1 относится к растворителю, а индекс 2 – к растворенному веществу.
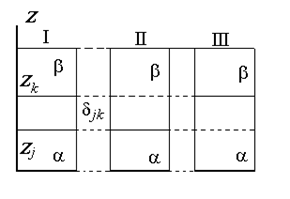
Разделяющая поверхность Гиббса может быть проведена так, чтобы обратилась в нуль адсорбция любого наперед заданного компонента, но только одного, как это показано на рис. 1.15.
Расстояние между двумя плоскостями (разделяющими поверхностями), одна из которых соответствует условию Гj = 0, а другая — Гk = 0, обозначим dkj:
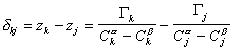
где Гk, Гj– избытки 
Поскольку значения Г1 в уравнении (1.1.93) определены относительно произвольно выбранного положения разделяющей плоскости, то ее можно расположить так, чтобы избыток растворителя в поверхностном слое был равен нулю ( Г1 = 0).
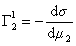
где верхний индекс 1 означает, что для выбранной поверхности раздела Г1=0.
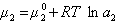
получаем после дифференцирования уравнения (1.1.96)
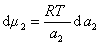
где 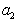
Поэтому, подставляя уравнение (1.1.97) в уравнение (1.1.95), получаем
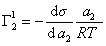
Из уравнения (1.1.98) следует, что если 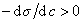
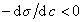
Поскольку 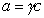
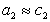
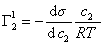
Уравнение (1.1.99) представляет собой наиболее употребляемую форму изотермы адсорбции Гиббса, причем так как рассматривается адсорбция именно растворенного вещества, индексы при адсорбции и концентрации опускают, т.е.
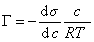
Исследования показывают, что существуют такие вещества, растворение которых приводит к резкому снижению поверхностного натяжения раствора. Эти вещества называют поверхностно-активными. В соответствии с уравнением Гиббса адсорбция их всегда положительна, т.е. концентрация в поверхностном слое выше объемной концентрации. По предложению Ребиндера мера поверхностной активности обозначается первой буквой фамилии Гиббса. Обычно используют значения поверхностной активности в бесконечно разбавленных растворах
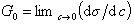
К классу поверхностно-активных веществ (ПАВ) относятся жирные кислоты и их соли (мыла), сульфокислоты, их соли, спирты, алкилсульфоэфиры и др. Если 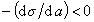
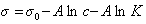
Обозначим постоянной В постоянные при изотермических условиях величины 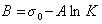
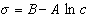
Следовательно, при относительно высокой концентрации растворов ПАВ их поверхностное натяжение должно уменьшаться экспоненциально с увеличением концентрации.
Уравнение (1.1.107) может быть получено непосредственно из уравнения изотермы адсорбции Гиббса:
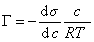
При достаточно высокой концентрации растворенного вещества адсорбция достигает предела , т.е. Г = Гmax , поэтому
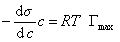
где при постоянной температуре правая часть представляет собой постоянную величину и может быть обозначена RT Гmax = A. Следовательно,
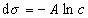
откуда после интегрирования получаем
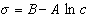
Таким образом, уравнение Шишковского может быть выведено из уравнения Гиббса, так как уравнения (1.1.107) и (1.1.109) идентичны. Точность уравнения Шишковского связана с тем, что в нем уже заложено условие насыщения адсорбционного слоя.
Если уравнение Шишковского в форме
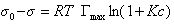
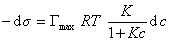
и подставить в уравнение Гиббса величину
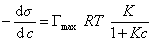
то уравнение изотермы адсорбции примет вид
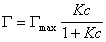
В такой форме уравнение изотермы адсорбции носит название изотермы Ленгмюра. Американский ученый И. Ленгмюр в 1917 г. развил представление о мономолекулярной адсорбции и на основании молекулярно- кинетической теории получил уравнение (1.1.113) .
Уравнение Шишковского позволяет определить предел адсорбции (при Kc>>1), так как в таком случае это уравнение принимает вид
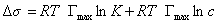
Построив график 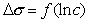
Понимание адсорбционных процессов имеет чрезвычайно важное значение, так как они лежат в основе многих процессов, протекающих на границе раздела фаз, например крашения, отмывания загрязнений, отделки текстильных материалов и т.д., т.е. в основе всех коллоидно -химических процессов на границе жидкость–газ.
Методы определения поверхностного натяжения жидкостей
ОПРЕДЕЛЕНИЕ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ РАСТВОРОВ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ СТАЛАГМОМЕТРИЧЕСКИМ МЕТОДОМ
ЦЕЛЬ: Научиться определять поверхностное натяжение жидкостей сталагмометрическим методом. Построение изотерм поверхностного натяжения для растворов различных спиртов. Определение зависимости поверхностного натяжения растворов ПАВ одного гомологического ряда от концентрации; вычисление констант уравнения Шишковского; проверка правила Траубе-Дюкло.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Физико-химические особенности поведения дисперсных систем в жидких средах определяются процессами, протекающими на поверхности раздела между составляющими систему фазами, и свойствами граничных слоев, поскольку величина поверхности раздела фаз в таких системах относительно велика.
Молекулы на границах раздела фаз не полностью окружены другими молекулами того же вида по сравнению с соответствующими молекулами в объеме фазы, поэтому поверхность раздела фаз в межфазном поверхностном слое всегда является источником силового поля. Результат этого явления – нескомпенсированность межмолекулярных сил и наличие внутреннего или молекулярного давления. Для увеличения площади поверхности необходимо вывести молекулы из объемной фазы в поверхностный слой, совершив работу против межмолекулярных сил. Если процесс обратим и проходит в изотермических условиях, то затраченная работа равна увеличению свободной поверхностной энергии на границе раздела фаз по сравнению с энергией в объеме.
Приращение свободной поверхностной энергии при увеличении поверхности на 1 см 2 представляет собой удельную свободную энергию и обозначается символом σ. Величину σ называют также поверхностным натяжением и рассматривают как силу, стягивающую поверхность.
Зависимость поверхностного натяжения от концентрации ПАВ.
Зависимость поверхностного натяжения ПАВ от концентрации водных растворов хорошо описывается уравнением Шишковского, которое было получено им эмпирическим путем при исследовании растворов гомологов предельных жирных кислот на границе с собственным паром:
где А и В — эмпирические постоянные, причем величина В постоянна для всего гомологического ряда, а величина А возрастает в 3 — 3,5 раза при переходе к каждому последующему гомологу.
Определить физический смысл постоянных уравнений Шишковского можно путем анализа уравнения Гиббса:
и уравнения Ленгмюра:
где Г∞— предельная адсорбция; а = kдес/kадс —отношение констант скоростей адсорбции и десорбции.
Запишем уравнение Гиббса в виде:
и подставим величину Г из уравнения Ленгмюра:
=>
Интегрируя в пределах от 0 до С, получим
Сравнив полученное уравнение с уравнением Шишковского, получаем:
B = RTГ∞ и .
Методы определения поверхностного натяжения жидкостей
Существующие методы определения поверхностного натяжения разделяются на три основные группы:
I. Статические методы:
1) метод капиллярного поднятия;
2) метод вращающейся капли;
3) метод Вильгельми или метод уравновешивания пластинки.
II. Полустатические методы:
1) метод максимального давления образования пузырька или капли;
2) метод отрыва кольца – метод Дю-Нуи;
3) сталагмометрический метод (метод взвешивания и счета капель).
III. Динамические методы:
1) метод колеблющихся струй;
2) метод нулевой ползучести;
3) метод расщепления.
В основе большинства статических и полустатических методов измерения поверхностного натяжения лежит метод капиллярности с основополагающим уравнением Лапласа. Наиболее теоретически разработанные методы связаны с измерением разности давлений по обе стороны поверхности раздела фаз, т.е. капиллярного давления.
Поскольку кривизну поверхности измерить трудно, то ее оценивают на основании других параметров, например, связывая ее с радиусом капилляра, формирующего мениск.
Статические методы основаны на изучении устойчивого равновесного состояния, к которому самопроизвольно приходит изучаемая система, что позволяет получать истинно равновесные значения поверхностного натяжения.
Метод капиллярного поднятия основан на формуле Жюрена:
При этом применяются тонкие капилляры, что обеспечивает сфериность мениска. Этот метод может давать точность измерения поверхностного натяжения до десятых и сотых долей .
Метод вращающейся капли позволяет измерять очень низкие значения межфазного натяжения на границах двух жидкостей. В этом методе трубка, заполненная жидкостью, приводится во вращение вокруг своей оси.
Рис. Равновесная форма вращающейся капли.
В трубку вводится капля другой жидкости с меньшей плотностью ρ2. За счёт действия центробежных сил эта менее плотная жидкость стремится расположиться ближе к оси вращения и вытягивается в тонкий столбик. Измеряя размеры столбика и скорость вращения ω, при известной разности плотностей жидкостей (ρ1 – ρ2) можно определить натяжение σ межфазной поверхности.
Метод Вильгельми или метод уравновешивания пластинки. Закреплённую на коромысле весов тонкую пластину шириной d погружают в жидкость. Пластина хорошо смачивается этой жидкостью. На поверхности пластина с обеих сторон образуются мениски. Их форма и максимальная высота поднятия определяется уравнением Лапласа.

Рис. Условие равновесия при изменении поверхностного натяжения по методу Вильгельми.
Суммарный вес поднятой жидкости на единицу длины периметра пластины не зависит от формы мениска и при нулевом краевом угле смачивания равен поверхностному натяжению σ.
,
где F — сила, которую надо приложить для уравновешивания пластины;
d – ширина пластины.
Метод Вильгельма один из наиболее точных методов определения поверхностного натяжения, не требующий введения каких-либо поправок.
Если платиновая или стеклянная пластина установлена так, что её нижняя поверхность будет располагаться строго на уровне поверхности, то
,
где F — сила, необходимая дл преодоления сил, втягивающих пластину внутрь жидкости, т.е. для уравновешивания пластины при её возвращении в начальное положение;
l и b – ширина и толщина пластины.
Полустатические методыопределения поверхностного натяжения основаны на достижении системой некоторого равновесного состояния, но это равновесие неустойчиво
Метод максимального давления образования пузырька или капли под действием приложенного извне избыточного давления Δp через калиброванный капилляр в объём жидкости продавливается пузырёк газа или капля другой жидкости. По мере роста пузырька радиус кривизны его поверхности r уменьшается и достигает минимального значения, равного радиусу капилляра r0, когда поверхность пузырька приобретает форму полусферы.
При r = r0 капиллярное давление достигает своего максимального значения .
Рис. Изменение радиуса кривизны поверхности пузырька при изменении поверхностного натяжения по методу наибольшего давления.
Если избыточное давления Δp меньше максимального давления , то система механически устойчива.
Если , капиллярное давление не может уравновесить приложенного давления Δp и пузырёк теряет свою устойчивость, разрастается и отрывается от поверхности, что соответствует максимальному значению перепада давления, отвечающего условию , отсюда
Метод отрыва кольца – метод Дю-Нуи основан на измерении усилия F, необходимого для отрыва от поверхгости жидкости тонкого кольца радиуса rк хорошо смачиваемого жидкостью (θ = 0º).
В первом приближении можно считать, что значение поверхностного натяжения обратно пропорционально длине периметра кольца 2π rк, т.е.
,
где 2π rк – длина периметра кольца,
rк – радиус кольца, измеренный от его центра до осевой линии проволоки.
Метод Дю-Нуи достаточно точен и часто используется для определения поверхностного натяжения жидкостей.
Его редко применяют для определения межфазного натяжения на границе ж – ж, поскольку в этом случае трудно реализовать условие θ = 0º.
Рис. Изменение поверхностного натяжения по методу отрыва кольца.
Сталагмометрический метод (метод взвешивания и счета капель) широко применяется для определения межфазного натяжения ж – ж. Основан на определении веса капли, отрывающейся под действием силы тяжести от плоской поверхности торцевого среза капилляра. Расчет проводят по формуле
,
где f (r/a) – некоторая функция, определяемая из таблиц Гаркинса и Брауна; а – капиллярная постоянная.
В грубом приближении можно считать, что в момент отрыва капли её вес Р уравновешивается силами поверхностного натяжения:
,
где — 2π r0 – длина окружности капилляра,
Если жидкости хорошо смачивают материал капилляра, то, пренебрегая различием между углами смачивания, можно проводить относительное измерение поверхностного натяжения, используя стандартную жидкость. В этом случае обычно принимают, что масса капли Р в момент отрыва пропорциональна поверхностному натяжению на границе раздела жидкость – пар, т.е.
где k – постоянная данного прибора.
Поверхностное натяжение σ можно вычислить, зная массу капли жидкости m в момент отрыва ее от капилляра, по уравнению:
σ= ,
где g – ускорение свободного падения, r – радиус капилляра.
Если ,где ρ – плотность жидкости, n – число капель в объёме жидкости V, вытекающей из капилляра, тогда поверхностное натяжение равно:
При калибровке сталагмометра стандартной жидкостью , поэтому
.
Динамические методы определения поверхностного натяжения имеют более специальное назначение, они применяются для изучения неравновесных состояний поверхностных слоёв жидкостей и скорости установления равновесной структуры их поверхности.
Метод колеблющихся струй позволяет изучать свойства поверхности жидкости через очень малые промежутки времени после их образования.
Метод нулевой ползучести для пластичных твёрдых тел вблизи точки плавления (в основном для металлов).
Метод расщепления по плоскости спайности для хрупких твёрдых тел, особенно монокристаллов с хорошо выраженной спайностью.
Для правильного выбора метода исследования растворов мицеллообразущих полуколлоидных, высокомолекулярных и типичных коллоидных поверхностно-активных веществ (высшие гомологи мыл, красители, белковые вещества) решающее значение имеет учет явлений, определяющих кинетику достижения равновесных (наименьших) значений поверхностного натяжения. Эта кинетика вызывается малой скоростью процесса формирования адсорбционных слоев, связанной с медленной диффузией сложных молекул из объема к поверхности, ориентацией их в поверхностном слое (двумерная миграция), явлениями коллоидного старения. Явления старения связаны с появлением в адсорбционном слое и прилегающих к нему слоях жидкости сплошной сетчатой (гелеобразной) структуры с явно выраженными упругопластичными вязкими свойствами.
Если эти свойства достаточно сильно развиты, то пленка становится упругой (твердой) и любые измерения поверхностного натяжения, требующие достаточной подвижности поверхности раздела, становятся неосуществимыми.
Поэтому, чтобы получить в таких растворах истинные равновесные значения поверхностного натяжения, лучше пользоваться статическими методами. Однако и некоторые полустатические методы (как, например, метод наибольшего давления пузырька или капли) вполне пригодны для этой цели, обладая при этом преимуществом простоты и удобства измерений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Оборудование и реактивы.Химические стаканы вместимостью 50 мл; сталагмометры; пипетки вместимостью 5 мл резиновая груша; исследуемые жидкости (спирты: изопропиловый, изобутиловый, изоамиловый) и стандартная жидкость (дистиллированная вода).
Поверхностное натяжение растворов определяют сталагмометрическим методом, который заключается в отсчете капель при медленном вытекании исследуемой жидкости из капилляра. В данной работе используется относительный вариант метода, когда одна из жидкостей (дистиллированная вода), поверхностное натяжение которой при данной температуре точно известно, выбирается в качестве стандартной. Сталагмометр представляет собой стеклянную трубку с расширением посередине и капилляром в нижней части; расширенная часть ограничена двумя метками.
1. Отмеряют в химический стаканчик 2,5 мл дистиллированной воды. Поместив капилляр в стаканчик с дистиллированной водой, при помощи резиновой груши затягивают раствор в прибор (уровень жидкости должен быть чуть выше верхней метки) и дают жидкости по каплям вытекать из сталагмометра в стаканчик. Когда уровень жидкости достигнет верхней метки, начинают отсчет капель; отсчет продолжают до достижения уровнем нижней метки. Эксперимент повторяют 3 раза. Для расчета поверхностного натяжения используют среднее значение n.
2. Повторяют эксперимент для каждой исследуемой жидкости.
3. Готовят растворы заданных спиртов с разной концентрацией методом разбавления.
Расчет поверхностного натяжения исследуемой жидкости производят по формуле:
,
где σo, ρo, no — поверхностное натяжение, плотность, число капель для дистиллированной воды; σ, ρ, n — соответствующие величины для исследуемого раствора.
Стандартной жидкостью в нашем случае является вода, зависимость поверхностного натяжения которой от температуры (°С) имеет следующий вид:
В данной работе используются разбавленные растворы, поэтому можно принять, что ρ = ρo и вести расчет по формуле:
Результаты эксперимента для каждого из спиртов заносят в таблицу 1. По полученным данным строят изотермы поверхностного натяжения исследуемых растворов, начиная от σ = σo (рис. 1)
Рис. 1. Изотерма поверхностного натяжения.
По углу α (см. рис. 1) наклона касательной, проведенной к изотерме поверхностного натяжения в точке С = 0, σ = σo, определяют поверхностную активность Gi каждого из спиртов (Gi = — tg α) которая в данном случае будет численно равна отношению длины отрезка а к длине отрезка b (рис. 1). Длины отрезков берутся в единицах шкалы соответствующей оси координат. Сравнивая полученные значения Gi, делают вывод о влиянии длины углеводородного радикала на поверхностную активность спиртов и применимости правила Траубе-Дюкло к гомологическому ряду одноатомных спиртов.
| спирт | С, моль/л | n, шт. | σ, Н/м | Gi |
Для вычисления констант уравнения Шишковского строят график в координатах σо – σ = f(lnC). Полученные экспериментальные данные используют для нахождения констант А и В в уравнении Шишковского:
σ = σ0 — B ln (AC + 1)
При АС >> 1 уравнение принимает вид:
σ0 — σ = B ln A + B ln С
Величины А и В находят из графика зависимости σ — σ0= f(C) (рис. 2).
Рис. 2. Графическое определение постоянных А и В в уравнении Шишковского.
Угловой коэффициент наклона прямолинейного участка построенной кривой равен В = tg α. Для определения константы А экстраполируют полученную прямую до оси абсцисс.
1. Определить сталагмометрическим методом поверхностное натяжение серий растворов спиртов различной концентрации. Выполнить расчёт поверхностного натяжения спиртов двумя способами: через количество петель и через массу капли.
ρ (изопропил. сп.) = 0,7851 г/см 3 (20°С)
ρ (изобутил. сп.) = 0,8027 г/см 3 (20°С)
ρ (изоамил. сп.) = 0,814 г/см 3 (20°С)
2. Построить изотерму поверхностного натяжения для каждого из спиртов.
3. Определить поверхностную активность каждого из спиртов. Сделать вывод о влиянии длины углеводородного радикала на поверхностную активность спиртов и о применимости правила Траубе-Дюкло к гомологическому ряду одноатомных спиртов.
4. Определить графическим способом константы уравнения Шишковского.
http://allrefrs.ru/2-41473.html
From Wikipedia, the free encyclopedia
The Szyszkowski Equation[1] has been used by Meissner and Michaels[2] to describe the decrease in surface tension of aqueous solutions of carboxylic acids, alcohols and esters at varying mole fractions. It describes the exponential decrease of the surface tension at low concentrations reasonably but should be used only at concentrations below 1 mole%.[3]
Equation[edit]
with:
- σm is surface tension of the mixture
- σw is surface tension of pure water
- a is component specific constant (see table below)
- x is mole fraction of the solvated component
The equation can be rearranged to be explicit in a:
This allows the direct calculation of that component specific parameter a from experimental data.
The equation can also be written as:
with:
- γ is surface tension of the mixture
- γ0 is surface tension of pure water
- R is ideal gas constant 8.31 J/(mol*K)
- T is temperature in K
- ω is cross-sectional area of the surfactant molecules at the surface
The surface tension of pure water is dependent on temperature. At room temperature (298 K), it is equal to 71.97 mN/m [4]
Parameters[edit]
Meissner and Michaels published the following a constants:
| Compound | a.104 | Compound | a.104 |
|---|---|---|---|
| Propionic acid | 26 | n-Propyl alcohol | 26 |
| Isopropyl alcohol | 26 | Methyl acetate | 26 |
| n-Propyl amine | 19 | Methyl ethyl ketone | 19 |
| n-Butyric acid | 7 | Isobutyric acid | 7 |
| n-Butyl alcohol | 7 | Isobutyl alcohol | 7 |
| Propyl formate | 8.5 | Ethyl acetate | 8.5 |
| Methyl propionate | 8.5 | Diethyl ketone | 8.5 |
| Ethyl propionate | 3.1 | Propyl acetate | 3.1 |
| n-Valeric acid | 1.7 | Isovaleric acid | 1.7 |
| n-Amyl alcohol | 1.7 | Isoamyl alcohol | 1.7 |
| Propyl propionate | 1.0 | n-Caproic acid | 0.75 |
| n-Heptanoic acid | 0.17 | n-Octanoic acid | 0.034 |
| n-Decanoic acid | 0.0025 |
Example[edit]
The following table and diagram show experimentally determined surface tensions in the mixture of water and propionic acid.
|

|
This example shows a good agreement between the published value a=2.6*10−3 and the calculated value a=2.59*10−3 at the smallest given mole fraction of 0.00861 but at higher concentrations of propionic acid the value of an increases considerably, showing deviations from the predicted value.
See also[edit]
- Bohdan Szyszkowski
References[edit]
- ^ B. von Szyszkowski, Z. physik. Chemie, 64, 385 (1908)
- ^ H.P. Meissner, A.S. Michaels, Surface Tension s of Pure Liquids and Liquid Mixtures», Ind. Eng. Chem., 41(12), 2782, (1949)
- ^ Bruce E. Poling, John M. Prausnitz, John P. O’Connell, The Properties of Gases and Liquids, 5th Edition
- ^ NIST Chemistry WebBook http://webbook.nist.gov/chemistry/
- ^ Suarez F., Romero C.M., J.Chem.Eng.Data, 56(5), 1778-1786, 2011
УРАВНЕНИЕ ШИШКОВСКОГО. ПЕРЕХОД ОТ УРАВНЕНИЯ ГИББСА К УРАВНЕНИЮ ЛЕНГМЮРА [c.124]
Обработка экспериментальной зависимости сг = /(с) с целью построения изотермы адсорбции [графика зависимости T = f )] наиболее проста в тех случаях, когда известна зависимость а = [ с) в аналитическом виде. В настоящее время, к сожалению, нет достаточно общей формулы, связывающей поверхностное натяжение с концентрацией раствора. Среди наиболее простых зависимостей отметим эмпирическое уравнение Шишковского [c.15]
Решение. Зависимость поверхностного натяжения от концентрации ПАВ выражается уравнением Шишковского (П. 10) [c.66]
После интегрирования получим уравнение Шишковского-. [c.157]
Для характеристики поверхностного натяжения растворов в зависимости от активности (или концентрации) растворенного вещества были предложены эмпирические уравнения, например уравнение Шишковского [c.332]
Используя уравнение Гиббса и одно из уравнений, образующих стороны треугольника, можно получить два других уравнения. Так, совместное решение уравнений Гиббса и Ленгмюра приводит к уравнению Шишковского [3], а пользуясь уравнением Шишковского, можно перейти от уравнения Гиббса к уравнению Ленгмюра [4]. Уравнение Фрумкина, в соответствии со схемой, можно получить из уравнений Шишковского и Ленгмюра. Действительно, преобразуем уравнение Шишковского так [c.16]
Зависимость иоверхностного натяжения в растворах ПАВ от их концентрации в соответствии с уравнением Шишковского показана на рис. П1. 19. Из рис. И1. 19 видно, что при малых концентрациях ПАВ в растворе поверхностное натяжение снн кается резко, но с [c.157]
Уравнение Шишковского применимо к низшим гомологам (до Ст — Сц) алифатических карбоновых кислот, спиртов и других предельных соединений. Если определены константы Л и В, по уравнению можно рассчитать поверхностное натяжение раствора ПАВ по заданной концентрации с. [c.309]
Совместное решение адсорбционного уравнения Гиббса (1.21) с уравнением Ленгмюра (П.2) для ПАВ дает уравнение Шишковского, связывающее изменение поверхностного натяжения раствора с концентрацией растворенного ПАВ в объеме [c.39]
Ленгмюровские представления об адсорбции позволяют объяснить и известное правило Дюкло—Траубе (1878 г.), которое, так же как и уравнение Шишковского, было установлено экспериментально для растворов низших жирных кислот. Согласно этому правилу, отношение концентраций двух соседних гомологов, которым соответствуют одинаковые А, постоянно и приблизительно равно 3,2. К такому же выводу можно прийти, исходя из уравнения Шишковского. Для п-го и (п + 1)-го гомологов из (4.42) имеем [c.111]
Рассчитывают величину максимальной поверхностной активности при адсорбции из водной и углеводородной фаз по формуле (G)i=a, bi, где 2ц и Ь, — константы уравнения Шишковского для каждой из фаз (индекс 1 символизирует природу фазы). Для определения констант а и Ь в обоих случаях используют описанный выше прием (см. с. 18—19) — спрямление изотерм поверхностного натяжения в координатах приближенной формы уравнения Шишковского. [c.119]
Определение констант уравнения Шишковского может быть выполнено двумя способами. [c.18]
Состояние идеального двухмерного газа адсорбционная пленка имеет прп соблюдении закона распределения Генри. Прн высокой концентрации ПАВ в растворе для описания распределения вещества между объемом и межфазным слоем необходимо пользо ваться уравнением Ленгмюра, а изменение поверхностного натяжения следует уравнению Шишковского (III. 117). Чтобы получить соответствующее уравнение состояния адсорбционной пленки, запишем уравнение Шишковского в следующем виде [c.159]
Отношение (VI. 37) отражает правило Дюкло — Траубе. Оно является постоянной величиной и для водных растворов при 20°С составляет 3,2. При температурах, отличных от 20 °С, постоянная имеет другие значения. Поверхностная активность пропорциональна также константе, входящей в уравнение Ленгмюра (или уравнение Шишковского), так как Кг = КАоо (III. 17) и Лоо— емкость монослоя — постоянна для данного гомологического ряда. Для органических сред правило Дюкло — Траубе обращается поверхностная активность снижается с увеличением длины углеводородного радикала ПАВ. [c.291]
Рассчитайте константы уравнения Шишковского, если поверхностное давление н-валериаиовой кислоты при 292 К в зависимости от площади поверхности, приходящейся на 1 моль этого вещества, составляет [c.73]
Принимая во внимание, что Оо — а = я, из уравнения Шишковского (II. 10) [c.67]
Если измерить понижение поверхностного натяжения Асг растворов одинаковой концентрации двух соседних членов ряда, то о можно рассчитать из уравнения Шишковского, полагая, что Ь в уравнении (14) имеет одинаковое значение для всех членов гомологического ряда. Зная а для нескольких членов ряда, можно проверить выполнимость правила Траубе, [c.45]
В этом уравнении константа Ь остается постоянной для всех членов ряда, в то время как константа а закономерно изменяется от члена к члену в гомологическом ряду. Случаи, при которых выполняется уравнение Шишковского, малочисленны, но они типичны и сравнительно просты. По этой причине оно с давних пор привлекало внимание исследователей и было всесторонне изучено теоретически. Для его термодинамического вывода необходимы два исходных уравнения. Одним из них может служить адсорбционная изотерма Гиббса, которая для достаточно разбавленных растворов имеет вид [см. уравнение (4.18а)] [c.109]
Проверяют применимость уравнения Шишковского к экспериментальным зависимостям о=/(с) (см, с. 33). Для систем, к которым применимо это уравнение, [c.34]
Это уравнение совпадает с уравнением Шишковского, если положить [c.110]
Интегрируя, получим известное уравнение Шишковского [c.30]
Величину О можно рассчитать, пользуясь константами уравнения Шишковского. Продифференцируем по концентрации уравнение Шишковского [c.18]
Сопоставляя это уравнение с уравнением Шишковского [c.356]
Таким образом, мы пришли к уравнению Ленгмюра. При этом существенно, что константа 1/Л, входящая в уравнение Шишковского и служащая мерой капиллярной активности вещества, оказалась равной постоянной» k в уравнении Ленгмюра. Следовательно, уравнение Шишковского является тем переходным мостом, который соединяет уравнение Гиббса, выведенное исходя из чисто термодинамических представлений, и уравнение Ленгмюра, выведенное на основе молекулярно-кинетических положений. [c.125]
Уравнение Шишковского хорошо применимо для вычисления, поверхностного натяжения жирных кислот с не слишком большим числом атомов углерода в молекуле (до Се). [c.124]
Зависимость поверхностного натяжения раствора (Т от концентрации для водных растворов ПАВ подчиняется эмпирическому уравнению Шишковского [c.205]
Как было показано Ленгмюром в 1917 г., пользуясь уравнением Шишковского в дифференцированном виде, можно перейти от уравнения Гиббса к уравнению Ленгмюра. В самом деле, уравнение Шишковского можно записать так [c.124]
Подставим уравнение Шишковского в дифференцированном виде в уравнение Гиббса [c.125]
Наконец, пользуясь уравнением (V, 15), можно установить смысл эмпирической постоянной В в уравнении Шишковского. При достаточно большой кон-.центрации, когда Л < с, величиной Л можно пренебречь и уравнение (V, 15) принимает вид [c.125]
Учитывая, что при с- 0 п — Ьс)- аЬс, получаем из уравнения Шишковского [c.59]
Обозначив Г =й/7 Т из уравнений Шишковского (111.13) и Гиббса (111.11), получим [c.59]
Нетрудно убедиться, что прн Л х О о — о , а при Л 1 = 1 сг = 01. Уравнение (XV.33) является обобщением уравнения Шишковского и описывает всю область концентраций бинарного совершенного раствора. Оно было выведено А. А. Жуховицким (в 1944 г.) А. Эвансом и Э. Гуггенгеймом (в 1945 г.). [c.317]
Совместное решение уравнений (1.17) и (1.19) позволяет установить физический смысл констант А я В уравнения Шишковского (1.18). Константа B=V
RT характеризует предельно возможную адсорбцию вещества на поверхности, а константа А — адсорбционную способность зещества при малых концентрациях раствора. [c.15]
Уравнение Шишковского выполняется н при адсорбции поверхностно-активных веществ на границе вода — жидкие углеводороды. Оно было экспериментально подтверждено при адсорбции стероидов на границе вода — вазелиновое масло (Р. Ру и Ж- Баре). [c.58]
Связь между константами, входящими в уравнение Шишковского, и строением молекул поверхностно-активных веществ можно установить, если обратиться к закономерности, установленной Дюкло и Траубе. Дюкло обнаружил, что способность поверхностно-активных веществ снижать поверхностное натяжение воды в гомологическом ряду усиливается с ростом числа углеродных атомов. Траубе дополнил наблюдения Дюкло. Найденная этими исследователями зависимость между поверхностной активностью и числом углеродных атомов получила название правила Дюкло — Траубе при увеличении числа углеродных атомов в гомологическом ряду в арифметической прогрессии поверхностная активность возрастает в геометрической прогрессии, причем увеличению углеводородной части молекулы на одну группу СНз соответствует возрастание поверхностной активности примерно в 3—3,5 раза (в среднем в 3,2 раза). [c.59]
Соотношение (VI. 32) может быть использовано для оценки условий стабилизации дисперсных систем при обеспечении их определенным термодинамическим фактором устойчивости. Например, для определения величины адсорбции ПАВ на поверхности tia THu или его концентрации в дисперсионной среде, которые необходимы для устойчивости системы, достаточно объединить соотношение (VI. 32) с уравнением Шишковского (III. 117). Подобную оценку условий стабилизации можно провести и для минимального электрического потенциала, если сравнить соотношение i(VI.32) с уравнением электрокапиллярной кривой (11.77). [c.286]
Изотерма поверхностного натяжения, характеризующая зависимость этой величины от концентрации коллоидного ПАВ в растворе, состоит из почти прямолинейного участка падения поверхностного натяжения, криволинейного участка, описываемого уравнением Шишковского, и почти горизонтального участка в области концентраций выше ККМ. На этом последнем участке поверхиост- ное натяжение почти перестает изменяться, так как вновь вводп- [c.400]
Наоборот, если поверхность уменьшается, то локальное натяженпе понижается по сравнению с равновесным, так как требуется определенное время для десорбцпи и диффузии ПАВ. Это различие между динамическим и статическим натяжениями известно как эффект Марангони. Была предпринята попытка количественного обоснования этого эффекта на основе уравнения Шишковского (1908). Эта проблема трудна из-за сложностей конвективного переноса, потенциальных энергетических барьеров адсорбции и стерических ограничений к проникновению молекул в адсорбционный слой, уже частично занятый молекулами ПАВ. Качественно ясно, что этот эффект является наибольшим в системах с очень разбавленными растворами высоко поверхпосгно-активных соединений, включающих высоко-мо.текулярные поверхностно-активные вещества. [c.86]
В случае низших гомологов жирных кислот и спиртов, для которых применимо уравнение Шишковского, при /г >10 см вторым слагаемым в подкоренном выражении можно пренебречь, и тогда максимум Е должен находиться при концентрациях, близких к В. С другой стороны, данные Барча (табл. 10) свидетельствуют о том, что нестабильные пены обладают максимальной устойчивостью при концентрациях поверхностно-активного компонента порядка В. Поэтому в данном случае эластичность, вероятно, будет стабилизирующим фактором. [c.234]
Пользуясь уравнением Шишковского в дифференцированном виде, можно также найти связь между поверхностной активностью —rf r/rf и удельной капиллярной постоянной 1/Л. В самом деле, при концентрациях поверхностно-активного вещества с 4 Л уравнение (V, 15) принимает вид / [c.125]
Физическая и коллоидная химия (1988) — [
c.290
]
Учение о коллоидах Издание 3 (1948) — [
c.126
,
c.133
,
c.135
,
c.145
]
Физическая и коллоидная химия (1964) — [
c.277
]
Физическая и коллоидная химия Учебное пособие для вузов (1976) — [
c.179
]
Физическая и коллоидная химия (1960) — [
c.219
]