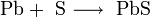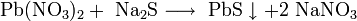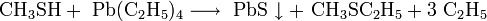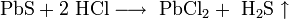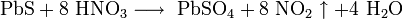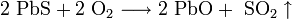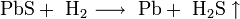| Сульфид свинца II | |
|---|---|
| Систематическое наименование |
Сульфид свинца II |
| Хим. формула | PbS |
| Рац. формула | PbS |
| Состояние | твёрдый |
| Молярная масса | 239,28 г/моль |
| Плотность | 7.5 г/см³ |
| Температура | |
| • плавления | 1114 °C |
| • кипения | 1281 °C |
| Рег. номер CAS | 1314-87-0 |
| PubChem | 14819 |
| Рег. номер EINECS | 215-246-6 |
| SMILES |
S=[Pb] |
| InChI |
1S/Pb.S XCAUINMIESBTBL-UHFFFAOYSA-N |
| ChemSpider | 14135 |
| Токсичность | среднетоксичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид свинца (галенит, свинцовый блеск) — неорганическое химическое соединение свинца и серы, представляющее собой кристаллическое соединение с окраской от сине-серого до серебристо-серой.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Кристаллическая решетка
- 4 Химические свойства
- 5 Применение
- 6 Интересные факты
- 7 Распространение
Получение
Взаимодействием расплавов или паров свинца с серой:
- Pb + S ⟶ PbS
Осаждением из водного раствора Pb2+ сероводородом или какими-либо другими сульфидами:
- Pb(NO3)2 + Na2S ⟶ PbS ↓ + 2 NaNO3
Сульфид свинца можно также получить из свинец-органических веществ, при взаимодействии с органическими соединениями серы (меркаптанов, тиофенов и др.):
- CH3SH + Pb(C2H5)4 ⟶ PbS ↓ + CH3SC2H5 + 3 C2H6
Физические свойства
- Температура плавления 1114 °C.
- Температура кипения 1281 °C.
- Твёрдость от 2 до 3, в зависимости от получения или природного местонахождения.
- Плотность 7,5 г/см³
- Давление паров при 800 °C − 0,2 мм рт. ст., а при 900 °C − 2 мм рт. ст.
- Уравнение температурной зависимости давления пара в условиях конгруэнтного испарения: lgPPbS, атм = −11597/T + 6,61.
Минерал сульфида свинца — галенит
Кристаллическая решетка
Для кристаллов PbS при стандартных условиях характерна кубическая сингония (типа NaCl, z = 4, пространственная группа Fm3m), но при повышении давления 2,4—4,2 МПа устойчивой становится ромбическая сингония (типа SnS, пространственная группа Pcmn).
Химические свойства
- В парах происходит частичное разложение сульфида свинца на следующие соединения: Pb2S2, Pb, S2, PbS2.
- Не растворим в воде, щелочах и разбавленных кислотах (кроме азотной), соляная и серная (средней концентрации) кислоты вытесняют сероводород из соли, а концентрированные кислоты-окислители окисляют сульфид свинца до сульфата свинца:
-
- PbS + 2 HCl ⟶ PbCl2 + H2S ↑
- PbS + 8 HNO3 ⟶ PbSO4 + 8 NO2 ↑ + 4 H2O
- При прокаливании в потоке кислорода или воздуха происходит окисление атома серы с образованием оксида свинца II:
-
- 2 PbS + 3 O2 ⟶ 2 PbO + 2 SO2 ↑
- Восстановить сульфид свинца до металлического свинца можно нагреванием в токе водорода:
-
- PbS + H2 ⟶ Pb + H2S ↑
- Легко окисляется озоном:
-
- PbS + 4 O3 ⟶ PbSO4 + 4 O2 ↑
Минерал сульфида свинца — галенит
Применение
- Применяют в керамической промышленности;
- Используют для получения защитных плёнок, полупроводниковых, новых современных наноматериалов;
- Сульфид свинца — хороший материал полупроводниковой техники, фотоприемников и детекторов ИК-диапазона.
Интересные факты
Свинцовые белила, использовавшиеся ранее при изготовлении картин, со временем приобретают серый оттенок. Это происходит из-за того, что свинцовые белила реагируют с постоянно присутствующим в воздухе в следовых количествах сероводородом, при этом образуется темный сульфид свинца II:
-
- 2 PbCO3 ⋅ Pb(OH)2 + 3 H2S → 3 PbS + 2 CO2 + 4 H2O
Восстановить такие картины можно обработкой пероксидом водорода, который переводит тёмный сульфид свинца II в белый сульфат:
-
- PbS + 4 H2O2 → PbSO4 + 4 H2O
Соединение PbS2 на самом деле является не сульфидом свинца IV, а персульфидом свинца II, в молекуле которого присутствует ион S22−, аналогичный пероксид-иону. Сульфид свинца IV не существует в природе и не может быть получен, так как ион Pb4+ является сильным окислителем, а ион S2− — восстановителем, и при попытке образования PbS2 происходит следующая окислительно-восстановительная реакция:
-
- 2 PbO2 + 2 Na2S → PbO + 2 Na2O + 2 SO2
Распространение
Руды с максимальным содержанием сульфида свинца найдены и добываются на территории Германии, Чехии, Великобритании, Канады и Австрии.
В рудах сульфиду свинца часто сопутствуют соединения серебра, обычно сульфид серебра Ag2S.
Сульфид свинца обнаружен также на некоторых планетах Солнечной системы (по данным РФФИ).
Запишите формулы следующих солей:
а) карбоната калия, сульфида свинца (II), нитрата железа (III);
б) хлорида свинца (IV), фосфата магния, нитрата алюминия.
reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. §22. Вопросы и задания. Номер №2
Решение а
Получай решения и ответы с помощью нашего бота
карбонат калия −
K
2
C
O
3
;
сульфид свинца (II) − PbS;
нитрат железа (III) −
F
e
(
N
O
3
)
3
;
Решение б
хлорид свинец (IV) −
P
b
C
l
4
;
фосфат магния −
M
g
3
(
P
O
4
)
2
;
нитрат алюминия −
A
l
(
N
O
3
)
3
.
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| Other names
Plumbous sulfide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.861 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
PbS |
| Molar mass | 239.30 g/mol |
| Appearance | Black |
| Density | 7.60 g/cm3[1] |
| Melting point | 1,113[1] °C (2,035 °F; 1,386 K) |
| Boiling point | 1,281 °C (2,338 °F; 1,554 K) |
|
Solubility in water |
2.6×10−11 kg/kg (calculated, at pH=7)[2] 8.6×10−7 kg/kg[3] |
|
Magnetic susceptibility (χ) |
−83.6·10−6 cm3/mol[4] |
|
Refractive index (nD) |
3.91[5] |
| Structure[7] | |
|
Crystal structure |
Halite (cubic), cF8 |
|
Space group |
Fm3m, No. 225 |
|
Lattice constant |
a = 5.936 Å |
|
Formula units (Z) |
4 |
|
Coordination geometry |
Octahedral (Pb2+) Octahedral (S2−) |
|
Dipole moment |
3.59 D[6] |
| Thermochemistry[8] | |
|
Heat capacity (C) |
49.5 J/mol⋅K |
|
Std molar |
91.2 J/mol |
|
Std enthalpy of |
-100.4 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-98.7 kJ/mol |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H332, H360, H373, H410 |
|
Precautionary statements |
P201, P202, P260, P261, P264, P270, P271, P273, P281, P301+P312, P304+P312, P304+P340, P308+P313, P312, P314, P330, P391, P405, P501 |
| NFPA 704 (fire diamond) |
2 0 0 |
| Flash point | Non-flammable |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
Lead(II) oxide Lead selenide Lead telluride |
|
Other cations |
Carbon monosulfide Silicon monosulfide Germanium(II) sulfide Tin(II) sulfide |
|
Related compounds |
Thallium sulfide Lead(IV) sulfide Bismuth sulfide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lead(II) sulfide (also spelled sulphide) is an inorganic compound with the formula PbS. Galena is the principal ore and the most important compound of lead. It is a semiconducting material with niche uses.
[edit]
Addition of hydrogen sulfide or sulfide salts to a solution containing a lead salt, such as PbCl2, gives a black precipitate of lead sulfide.
- Pb2+ + H2S → PbS↓ + 2 H+
This reaction is used in qualitative inorganic analysis. The presence of hydrogen sulfide or sulfide ions may be tested using «lead acetate paper.»
Like the related materials PbSe and PbTe, PbS is a semiconductor.[9] In fact, lead sulfide was one of the earliest materials to be used as a semiconductor.[10] Lead sulfide crystallizes in the sodium chloride motif, unlike many other IV-VI semiconductors.
Since PbS is the main ore of lead, much effort has focused on its conversion. A major process involves smelting of PbS followed by reduction of the resulting oxide. Idealized equations for these two steps are:[11]
- 2 PbS + 3 O2 → 2 PbO + 2 SO2
- PbO + C → Pb + CO
The sulfur dioxide is converted to sulfuric acid.
Nanoparticles[edit]
Lead sulfide-containing nanoparticle and quantum dots have been well studied.[12] Traditionally, such materials are produced by combining lead salts with a variety of sulfide sources.[13][14] In 2009, PbS nanoparticles have been examined for use in solar cells.[15]
Applications[edit]
World War II German PbS infrared detector
PbS was one of the first materials used for electrical diodes that could detect electromagnetic radiation, including infrared light.[16] As an infrared sensor, PbS directly detects light, as opposed to thermal detectors, which respond to a change in detector element temperature caused by the radiation. A PbS element can be used to measure radiation in either of two ways: by measuring the tiny photocurrent the photons cause when they hit the PbS material, or by measuring the change in the material’s electrical resistance that the photons cause. Measuring the resistance change is the more commonly used method. At room temperature, PbS is sensitive to radiation at wavelengths between approximately 1 and 2.5 μm. This range corresponds to the shorter wavelengths in the infra-red portion of the spectrum, the so-called short-wavelength infrared (SWIR). Only very hot objects emit radiation in these wavelengths.
Cooling the PbS elements, for example using liquid nitrogen or a Peltier element system, shifts its sensitivity range to between approximately 2 and 4 μm. Objects that emit radiation in these wavelengths still have to be quite hot—several hundred degrees Celsius—but not as hot as those detectable by uncooled sensors. (Other compounds used for this purpose include indium antimonide (InSb) and mercury-cadmium telluride (HgCdTe), which have somewhat better properties for detecting the longer IR wavelengths.) The high dielectric constant of PbS leads to relatively slow detectors (compared to silicon, germanium, InSb, or HgCdTe).
Planetary science[edit]
Elevations above 2.6 km (1.63 mi) on the planet Venus are coated with a shiny substance. Though the composition of this coat is not entirely certain, one theory is that Venus «snows» crystallized lead sulfide much as Earth snows frozen water. If this is the case, it would be the first time the substance was identified on a foreign planet. Other less likely candidates for Venus’ «snow» are bismuth sulfide and tellurium.[17]
Safety[edit]
Lead(II) sulfide is so insoluble that it is almost nontoxic, but pyrolysis of the material, as in smelting, gives dangerous fumes.[18] Lead sulfide is insoluble and a stable compound in the pH of blood and so is probably one of the less toxic forms of lead.[19] A large safety risk occurs in the synthesis of PbS using lead carboxylates, as they are particularly soluble and can cause negative physiological conditions.
References[edit]
- ^ a b Haynes, p. 4.69
- ^ Linke, W. (1965). Solubilities. Inorganic and Metal-Organic Compounds. Vol. 2. Washington, D.C.: American Chemical Society. p. 1318.
- ^ Ronald Eisler (2000). Handbook of Chemical Risk Assessment. CRC Press. ISBN 978-1-56670-506-6.
- ^ Haynes, p. 4.128
- ^ Haynes, p. 4.135
- ^ Haynes, p. 9.63
- ^ Haynes, p. 4.141
- ^ Haynes, p. 5.25
- ^ Vaughan, D. J.; Craig, J. R. (1978). Mineral Chemistry of Metal Sulfides. Cambridge: Cambridge University Press. ISBN 978-0-521-21489-6.;
- ^ Hogan, C. Michael (2011). «Sulfur». in Encyclopedia of Earth, eds. A. Jorgensen and C.J. Cleveland, National Council for Science and the environment, Washington DC. Archived 2012-10-28 at the Wayback Machine
- ^ Sutherland, Charles A.; Milner, Edward F.; Kerby, Robert C.; Teindl, Herbert; Melin, Albert; Bolt, Hermann M. (2005). «Lead». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_193.pub2. ISBN 978-3527306732.
- ^ «The Quantum Mechanics of Larger Semiconductor Clusters («Quantum Dots»)». Annual Review of Physical Chemistry. 41 (1): 477–496. 1990-01-01. Bibcode:1990ARPC…41..477B. doi:10.1146/annurev.pc.41.100190.002401.
- ^ Zhou, H. S.; Honma, I.; Komiyama, H.; Haus, Joseph W. (2002-05-01). «Coated semiconductor nanoparticles; the cadmium sulfide/lead sulfide system’s synthesis and properties». The Journal of Physical Chemistry. 97 (4): 895–901. doi:10.1021/j100106a015.
- ^ Wang, Wenzhong; Liu, Yingkai; Zhan, Yongjie; Zheng, Changlin; Wang, Guanghou (2001-09-15). «A novel and simple one-step solid-state reaction for the synthesis of PbS nanoparticles in the presence of a suitable surfactant». Materials Research Bulletin. 36 (11): 1977–1984. doi:10.1016/S0025-5408(01)00678-X.
- ^ Lee, HyoJoong; Leventis, Henry C.; Moon, Soo-Jin; Chen, Peter; Ito, Seigo; Haque, Saif A.; Torres, Tomas; Nüesch, Frank; Geiger, Thomas (2009-09-09). «PbS and CdS Quantum Dot-Sensitized Solid-State Solar Cells: «Old Concepts, New Results»«. Advanced Functional Materials. 19 (17): 2735–2742. doi:10.1002/adfm.200900081. ISSN 1616-3028. S2CID 98631978.
- ^ Putley, E H; Arthur, J B (1951). «Lead Sulphide – An Intrinsic Semiconductor». Proceedings of the Physical Society. Series B. 64 (7): 616–618. doi:10.1088/0370-1301/64/7/110.
- ^ «‘Heavy metal’ snow on Venus is lead sulfide». Washington University in St. Louis. Archived from the original on 2008-04-15. Retrieved 2009-07-07.
- ^ «Lead sulfide MSDS» (PDF). Archived from the original (PDF) on 2006-11-11. Retrieved 2009-11-20.
- ^ Bischoff, Fritz; Maxwell, L. C.; Evens, Richard D.; Nuzum, Franklin R. (1928). «Studies on the Toxicity of Various Lead Compounds Given Intravenously». Journal of Pharmacology and Experimental Therapeutics. 34 (1): 85–109.
Cited sources[edit]
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. ISBN 9781498754293.
External links[edit]
- Case Studies in Environmental Medicine (CSEM): Lead Toxicity
- ToxFAQs: Lead
- National Pollutant Inventory – Lead and Lead Compounds Fact Sheet
Сульфид свинца
- Сульфид свинца
-
Сульфид свинца
Сульфид свинца Общие Систематическое наименование Сульфид свинца (II) Химическая формула PbS Отн. молек. масса 239.28 а. е. м. Физические свойства Состояние (ст. усл.) твердый Плотность 7,5 г/см³ Термические свойства Температура плавления 1114 °C Температура кипения 1281 °C Классификация Рег. номер CAS 1314-87-0 Сульфид свинца (галенит, свинцовый блеск) — кристаллическое соединение с окраской от сине-серого до серебристо-серой.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Кристаллическая решетка
- 4 Химические свойства
- 5 Применение
- 6 Интересные факты
- 7 Распространиение
- 8 Смотри также
- 9 Ссылки
- 10 Литература
Получение
- Взаимодействие расплава или пара свинца с серой:
- Осаждением из водного раствора Рb2+ сероводородом или какими-либо другими сульфидами:
- Сульфид свинца можно также получить из свинец-органических веществ, при взаимодействии с органическими соединениями серы(меркаптанов, тиофенов и др.):
Физические свойства
- Температура плавления 1114°С.
- Температура кипения 1281°С.
- Твёрдость от 2 до 3, в зависимости от получения или природного местонахождения.
- Плотность 7,5 г/см³
- Давление паров при 800°С − 0,2 мм рт. ст., а при 900°С − 2 мм рт. ст.
- Уравнение температурной зависимости давления пара в условиях конгруэнтного испарения: lgPPbS, атм = −11597/T + 6,61.
Кристаллическая решетка
Для кристаллов PbS при стандартных условиях характерна кубическая сингония (типа NaCl, z = 4, пространственная группа Fm3m), но при повышении давления 2,4-4,2 МПа устойчивой становится ромбическая сингония (типа SnS, пространственная группа Pcmn).
Химические свойства
- В парах происходит частичное разложение сульфида свинца на следующие соединения: Рb2S2, Рb, S2, РbS2.
- Не растворим в воде, щелочах и разбавленных кислотах (кроме азотной), соляная и серная (средней концентрации) кислоты вытесняют сероводород из соли, а концентрированные кислоты-окислители окисляют сульфид свинца до сульфата свинца:
- При прокаливании в потоке кислорода или воздуха происходит окисление атома серы с образованием оксида свинца (II):
- Восстановить сульфид свинца до металлического свинца можно нагреванием в токе водорода:
- Легко окисляется озоном:
Применение
- Применяют в керамической промышленности;
- Используют для получения защитных пленок, полупроводниковых, новых современных наноматериалов;
- Сульфид свинца — хороший материал полупроводниковой техники, фотоприемников и детекторов ИК-диапазона.
Интересные факты
- Свинцовые белила, использовавшиеся ранее при изготовлении картин, со временем приобретают серый оттенок. Это происходит из-за того, что свинцовые белила реагируют с постоянно присутствующем в воздухе в следовых количествах сероводородом, при этом образуется темный сульфид свинца (II):
-
- 2PbCO3·Pb(OH)2 + 3H2S → 3PbS + 2CO2 + 4H2O.
-
- Соединение PbS2 на самом деле не является сульфидом свинца (IV), а является обыкновенным персульфидом свинца (II), в молекуле которого присутствует ион S22-, аналогичный пероксид-иону (Это доказано). А сульфид свинца (IV) — не существует в природе, и не может быть получен, так как ион Pb4+ является сильным окислителем, а ион S2- — восстановителем, и при попытке образования PbS2 происходит следующая окислительно-восстановительная реакция:
-
- 2PbO2 + 2Na2S → PbO + 2Na2O + 2SO2.
-
- Есть перспективы для использования сульфида свинца для передачи данных внутри микрочипов для ускорения передачи информации. Это возможно за счет того что что маленькие частицы (порядка нанометров) после электрического возбуждения способны излучать световую энергию в виде лазерного излучения, что способствует быстрой передачи данных. Это исследование даёт возможность кардинально повысить тактовую частоту компьютерных микропроцессоров.
Распространиение
Руды, с максимальным содержанием сульфида свинца расположенны на территории Германии, Чехии, Великобритании, Канады и Австрии.
В рудах ему часто сопутствуют соединения серебра, обычно это Ag2S.
Сульфид свинца обнаружен также на некоторых планетах Солнечной системы (по данным РФФИ).
Смотри также
- Свинец
- Сульфиды
Ссылки
- Краткое описание свойсив галенита
- Методы управления осаждением пленок сульфида свинца (II)
- фотосвойства пленок и кристаллов халькогенидов свинца (II)
Литература
- Ахметов Н.С. Общая и неорганическая химия М:Высшая школа, 2001г.
- Некрасов Б.В. Основы общей химии, М:Высшая Школа, в 2 томах, 1973г.
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Сульфид свинца» в других словарях:
-
Сульфид свинца(II) — Общие … Википедия
-
Сульфид свинца(IV) — Общие Систематическое наименование Сульфид свинца (II) Традиционные названия Сернистый свинец Химическая формула PbS2 Физические свойства … Википедия
-
сульфид свинца(II) — сернистый свинец(II) … Cловарь химических синонимов I
-
свинца сульфид — PbS, чёрно серые кристаллы. В воде нерастворим. В природе минерал галенит. Полупроводник; применяют для фоторезисторов. * * * СВИНЦА СУЛЬФИД СВИНЦА СУЛЬФИД (сернистый свинец), PbS, черно серые кристаллы. В воде нерастворим. В природе минерал… … Энциклопедический словарь
-
СУЛЬФИД — СУЛЬФИД, химическое соединение, получаемое из СУЛЬФИДА ВОДОРОДА, H2S, в котором другой химический элемент или их группа замещает водород. Примером неорганического сульфида служит сульфид свинца, PbS, встречающийся в виде полезного ископаемого… … Научно-технический энциклопедический словарь
-
Сульфид титана(II) — Общие Систематическое наименование Сульфид титана(II) Традиционные названия Сернистый титан Химическая формула TiS Физические свойства Состояние ( … Википедия
-
Сульфид титана(III) — Общие Систематическое наименование Сульфид титана(III) Традиционные названия Сернистый титан Химическая формула Ti2S3 Физические свойства … Википедия
-
Сульфид титана(IV) — Общие Систематическое наименование Сульфид титана(IV) Традиционные названия Сернистый титан; дисильфид титана Химическая формула TiS2 Физические свойства … Википедия
-
Сульфид молибдена(III) — Общие Систематическое наименование Сульфид молибдена(III) Традиционные названия Сернистый молибден Химическая формула Mo2S3 Физические свойства … Википедия
-
Сульфид молибдена(VI) — Общие Систематическое наименование Сульфид молибдена(VI) Традиционные названия Сернистый молибден Химическая формула MoS3 Физические свойства Состояние ( … Википедия
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.