Почти на каждой коробке с БАДами производители пишут: «Сделано по стандартам GMP». Возьмем БАД «Сорбипол» — заменитель лекарства «Полисорб» — и прочтем на упаковке круглую плашку: GMP.
Но подождите, БАД — это не лекарство. Какое же отношение добавка имеет к GMP? Если даже предположим, что «Сорбипол» произведен по надлежащей практике, то как мы это проверим?
Стандарты GMP первоначально разрабатывали именно для производства лекарств, а производители добавок соблюдать их не обязаны. Однако компания, которая выпускает БАДы, имеет право добровольно пройти аудит и получить сертификат GMP.
Хотя это дорого и сложно, в конце концов вложения обычно окупаются, ведь покупатели больше доверяют добавкам, которые создавали под таким же строгим контролем, что и лекарства. Проверить подлинность сертификата GMP просто — достаточно заглянуть на сайт Минпромторга.
Как лечиться эффективно и недорого
Лучшие материалы о том, как проверять назначение, выбирать качественное лекарство из дюжины аналогов и возвращать деньги за лечение, — в вашей почте дважды в месяц по четвергам. Бесплатно
Что такое стандарты GMP и зачем они нужны
GMP — это аббревиатура, которая расшифровывается как Good Manufacturing Practice, или «надлежащая производственная практика». Фактически это набор правил, в соответствии с которыми фармкомпании обязаны производить лекарственные препараты.
Стандарты GMP охватывают все аспекты производства — от требований к сырью и чистоте помещений до обучения сотрудников и упаковки товара. Все это позволяет делать высококачественные лекарства, в которых будет ровно столько действующего вещества, сколько заявлено на упаковке, и не будет вредных примесей и загрязнителей.
Какие стандарты GMP существуют в мире. Впервые стандарт GMP ввели в США — это произошло в 1963 году. Эксперимент оказался таким удачным, что в 1968 году сотрудники ВОЗ взяли американские правила производства лекарств за основу собственных фармацевтических стандартов. В 1969 году ВОЗ рекомендовала стандарт GMP всем государствам мира.
Сегодня в большинстве стран производство лекарств контролируется на государственном уровне. Там действуют национальные правила надлежащей производственной практики, которых обязаны придерживаться все фармкомпании.
При этом существуют стандарты GMP, регулирующие производство лекарств на уровне межгосударственных союзов. Например, собственные правила производства лекарств есть в Евросоюзе, Ассоциации государств Юго-Восточной Азии и Евразийском экономическом союзе ЕАЭС, в который входит и Россия.
Если какая-то фармкомпания планирует продавать свои препараты на территории межгосударственного союза, ей нужно подтвердить, что она работает в соответствии с его требованиями.
Какие стандарты GMP есть в России. Национальные российские стандарты GMP описаны в ГОСТ Р 52249-2009. Это адаптированный для России перевод Руководства по GMP Евросоюза версии 2011—2012 года.
Но с 2022 года все российские фармкомпании должны работать по стандартам GMP ЕАЭС. Правила GMP Евразийского экономического союза очень похожи на национальный российский стандарт, поэтому перестраивать работу компаниям не придется.
Как фармкомпании подтверждают, что они работают по GMP
Все российские фармкомпании обязаны получить сертификат GMP — документ, который подтверждает, что они работают в соответствии с правилами надлежащей производственной практики. В России сертификацию контролирует Министерство промышленности и торговли, или Минпромторг.
Чтобы получить сертификат, представители фармкомпании подают в Минпромторг заявление и документы, в которых описано устройство завода и то, какие препараты на нем производят.
Затем специалисты Минпромторга направляют документы в Государственный институт лекарственных средств и надлежащих практик — ФГБУ «ГИЛС и НП». Сотрудники этого института назначают дату проверки и создают комиссию для инспекции.
В назначенный срок инспекторы приезжают на производство, проверяют документы, осматривают завод и отбирают образцы лекарств, которые затем передают на анализ.
Если инспекторы не обнаружат проблем с документами и недочетов на производстве, а лабораторные исследования покажут, что состав лекарства не отличается от заявленного в инструкции, фармкомпания получит сертификат GMP. Но если инспекция обнаружит проблемы, компания может сертификат и не получить.
И в том и в другом случае информация об этом попадет в базу данных Минпромторга. Там находятся сведения обо всех выданных и отозванных сертификатах, а также о тех, действие которых было приостановлено или прекращено.
Как на упаковке добавки может появиться упоминание стандарта GMP
Согласно российскому закону «О качестве и безопасности пищевых продуктов» биологически активные добавки, или БАДы, относятся к продуктам питания — наряду с минеральной водой, алкогольными напитками и жевательной резинкой. Это значит, что производители продуктов питания и добавок не обязаны сертифицировать производство по стандартам GMP.
Если компания производит исключительно добавки, она обязана получить только свидетельство о государственной регистрации. Этот документ подтверждает, что продукт безопасен с гигиенической и санитарной точки зрения.
Чтобы его получить, производитель должен обратиться в Федеральное управление Роспотребнадзора. Его сотрудники проверят образцы добавки и составят экспертное заключение о возможности ее применения. Если все в порядке, добавка получит свидетельство, которое попадет в Реестр свидетельств о государственной регистрации Роспотребнадзора.
Однако некоторые фармкомпании, которые уже прошли сертификацию GMP, производят на своих заводах не только лекарства, но и добавки. В этом случае они имеют право написать на упаковке добавки, что она сделана по стандартам GMP.
Но право работать по стандартам GMP и пройти добровольную сертификацию производства есть даже у тех компаний, которые делают только добавки. Им придется проделать большую работу: провести предварительный аудит, разработать программу внедрения стандарта и внутреннюю документацию предприятия, изменить практику и обучить персонал работать по новым правилам. После этого они могут подать заявление на сертификацию в Минпромторг и пройти эту процедуру на тех же условиях, что и фармкомпании. Если все получится, сведения об этом сертификате тоже попадут в базу данных Минпромторга.
Как проверить, что добавку действительно произвели в соответствии со стандартом GMP
У всех компаний, которые работают по стандарту GMP, должен быть соответствующий сертификат. Как правило, фармкомпании размещают скриншоты этих документов на своих сайтах. Например, компания «Фармакор-продакшн», которая производит БАД «Сорбипол», разместила сертификат GMP в разделе «О компании».
Проверить подлинность сертификата можно на сайте Минпромторга. Для этого нужно зайти на страницу «Перечни и реестры» и найти там раздел «Сведения из базы данных о сертификатах GMP».
Откроется окно, в котором будет закреплена эксель-таблица. Скачайте таблицу, зайдите на вкладку «Выдача сертификата» и найдите в ней номер интересующего вас сертификата. Если в колонке «Статус выданного сертификата» стоит пометка «Действующий», все в порядке.
Сертификат GMP компании «Фармакор-продакшн» действующий, поэтому добавку «Сорбипол» действительно произвели по надлежащей практике.
Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
- К каким производствам применима эта процедура?
- Стандарт GMP в международной практике
- Правила GMP в России
- Процедура получения сертификата в России
- Стоимость получения сертификата
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
- лекарственные препараты;
- медицинские изделия различного назначения, включая те из них, которые применяются в диагностических целях;
- продукты питания и ингредиенты для их производства;
- биологически активные добавки.
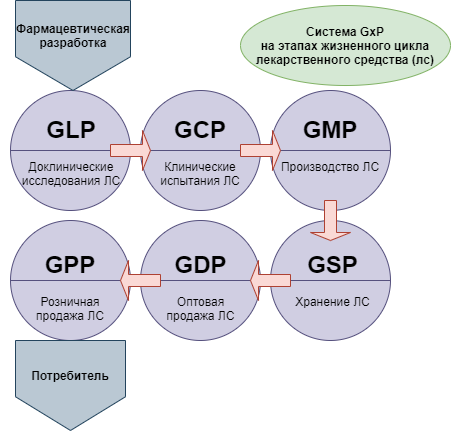
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
- GLP — Good Laboratory Practice (надлежащая лабораторная практика);
- GCP — Good Clinical Practice (надлежащая клиническая практика);
- GDP — Good Distributon Practice (надлежащая дистрибьюторская практика);
- GACP — Good Agricultural and Collection Practice (надлежащая практика культивирования и сбора лекарственных растений).
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
- национальный стандарт РФ ГОСТ Р 52249-2009, устанавливающий правила изготовления и контроля качества лекарственных препаратов;
- постановление Правительства от 5 июня 2008 года N 438 с рядом изменений, внесенных за последние годы, которое утверждает полномочия Министерства промышленности и торговли в этой области;
- постановление Правительства от 3 декабря 2015 года N 1314, устанавливающее порядок оценки соответствия производителей требованиям стандарта надлежащей практики;
- приказ Минпромторга от 14 июня 2013 года N 916, утверждающий правила применения надлежащей производственной практики в соответствии с актуальным стандартом;
- приказ Минпромторга от 26 мая 2016 года N 1714, определяющий административный регламент предоставления государственной услуги по выдаче документации, подтверждающей соответствие изготовителя установленным нормам надлежащей производственной практики;
- приказ Минпромторга России от 17.12.2015 N 4119, утверждающий правила ведения реестра сведений о том, какие лекарства имеют сертификат качества GMP в России.
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
- Решение Совета ЕЭК от 3 ноября 2016 года N 77, утверждающее правила надлежащей производственной практики в границах ЕАЭС;
- Приказ Минпромторга от 4 сентября 2020 года N 2945, которым введен административный регламент предоставления госуслуги по выдаче документации, подтверждающей соответствие производств установленным правилам.
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
- стабильное качество продукции, не зависящее от внешних факторов;
- повышение доверия потребителей, включая крупных оптовых покупателей, которые всегда отслеживают, какие производители имеют сертификат соответствия GMP на их продукцию;
- возможность вывода продукции на международные рынки, где ее может купить гораздо больше потребителей;
- возможность привлечения инвесторов для реализации проектов по расширению производства;
- получение преимуществ при участии в конкурсном отборе поставщиков, в том числе для государственных закупок.
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
- оценка производства на соответствие критериям безопасности, включая проведение его проверки в отношении вероятности попадания в продукт посторонних примесей и веществ;
- оценка производства на соблюдение технических требований к выпуску продукции, включая выполнение условий относительно влажности, температуры и других параметров в производственных помещениях;
- оценка качества, безопасности и действенности лекарственных средств, производимых на конкретном предприятии;
- оценка соответствия параметров производства и характеристик лекарственного средства нормативной документации, принятой в рамках процедуры GMP.
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
- копию документа, подтверждающего наличие у заявителя полномочий по взаимодействию с контролирующей организацией;
- копия основного досье используемого производственного объекта;
- информация о фактах несоответствия препарата действующим требованиям к качеству и безопасности и о фактах отзыва медикамента из оборота за период не менее 2 лет;
- полный список лекарств, который изготавливаются на данном производственном объекте;
- копия лицензии на производство лекарств;
- письмо о согласии на проведение инспекции производства.
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
|
Этап сертификационной процедуры |
Максимальная допустимая продолжительность |
|
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции |
10 рабочих дней |
|
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку |
3 рабочих дня |
|
Инспектирование и анализ лекарственного средства |
160 рабочих дней |
|
Принятие решения о выдаче заключения по результатам инспекционного отчета |
10 рабочих дней |
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
|
Для того, что бы проверить срок действие или наличия сертификата GMP, выданного Российской Федерацией (РФ), необходимо зайти на сайт минпромторга в реестр выданных сертификатов по адресу:
Реестр выданных сертификатов GMP:
Реестр сертификатов GMP
Кроме того в реестре можно посмотреть список производственных площадок, которым было отказано в выдаче российского сертификата GMP.
Подробнее о процедуре получения российского сертификата GMP (соответствие правилам надлежащей производственной практики) смотри в статье Российская GMP инспекция.
 |
|
| Общие сведения | |
|---|---|
| Тип |
Специальная информационная система |
| Оператор |
Россельхознадзор (Федеральная служба по ветеринарному и фитосанитарному надзору) |
| Разработчик |
ФГБУ «ВНИИЗЖ» (Федеральный центр охраны здоровья животных, г. Владимир) |
| Начало использования |
04 июня 2015 года |
| Состояние |
Промышленная эксплуатация |
| Последняя версия |
Гален 3.0.5 (11.05.2023) |
| Технологии | |
| Язык программирования |
Java 8 (Oracle) |
| Программная платформа |
Java Platform, Enterprise Edition (Oracle) |
| СУБД |
MySQL (Oracle) |
| Интерфейс |
Веб-интерфейс |
| Языки интерфейса |
Русский |
| Сопровождение и поддержка | |
| Сайт |
https://galen.vetrf.ru |
| Электронная почта |
galen@fsvps.ru |
| Справочные материалы |
Перечень справочной информации по компонента Гален |
Предназначение операции
Стандарт GMP (Good Manufacturing Practic, Надлежащая производственная практика) — система норм, правил и указаний в отношении производства лекарственных средств, медицинских устройств, изделий диагностического назначения, продуктов питания, пищевых добавок и активных ингредиентов.
Минпромторг России осуществляет выдачу заключений о соответствии производителя лекарственных средств указанным требованиям в соответствии с утвержденными Правилами организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям (утверждены постановлением Правительства Российской Федерации от 03 декабря 2015 г. № 1314).
Операция предназначена для управления государственным реестром заключений о соответствии (GMP) в компоненте«Гален»: поиска и редактирования сведений о выданных заключениях, а также для ввода сведений по заключению о соответствии (GMP).
Предусловия и подготовительные действия
Для выполнения операции необходимо соблюдение следующих условий:
- Пользователь должен иметь доступ с ролью ответственного сотрудника к компоненту «Гален» для Центрального аппарата Россельхознадзора.
Для реализации функции средствами компонента необходимо выполнить следующие действия:
- Выполните вход в компонент «Гален».
- Откройте раздел «Заключения GMP».
- Перейдите в подраздел «Государственный реестр заключений о соответствии (GMP)».
Основные действия
В компоненте «Гален» при работе с государственным реестром заключений о соответствии (GMP) возможно выполнение следующих действий:
- Поиск заключений о соответствии (GMP).
- Работа с заключением о соответствии (GMP).
- Ввод сведений по заключению о соответствии (GMP).
Поиск заключений о соответствии (GMP)
Для осуществления действий по поиску заключений о соответствии (GMP) необходимо выполнить следующие шаги:
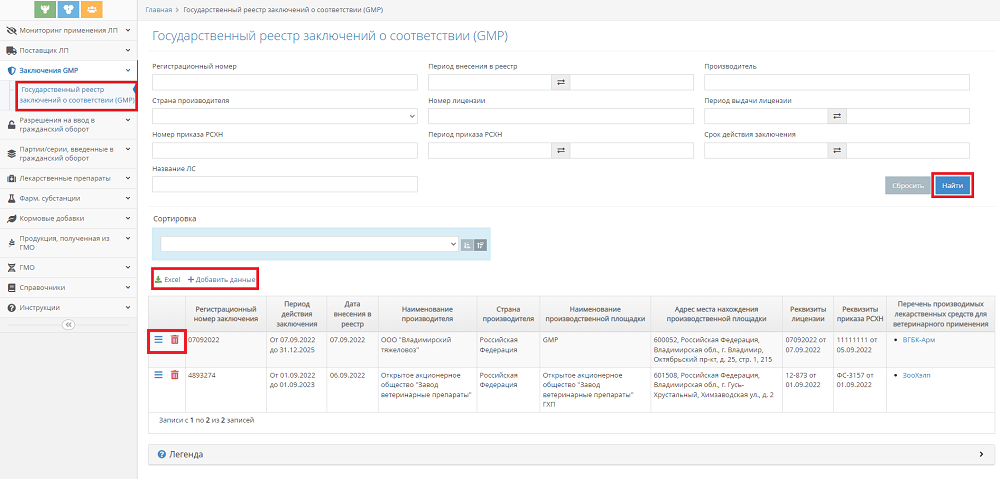
- Для поиска данных укажите значения фильтров поиска (рис. 1):
Рис. 1. Список заключений о соответствии (GMP) в компоненте «Гален» (07.09.2022 Версия: 2.5.4)
- регистрационный номер;
- период внесения в реестр;
- производитель;
- страна производителя;
- номер лицензии;
- период выдачи лицензии;
- номер приказа РСХН;
- период приказа РСХН;
- срок действия заключения;
- название ЛС.
- Нажмите на кнопку «Найти». В результате в списке будут отображены записи, соответствующие заданным критериям поиска.
Для сброса значений фильтров поиска, а также результатов фильтрации, нажмите на кнопку «Сбросить».
Дополнительные действия
- Для выгрузки сформировавшегося списка в формате Excel нажмите на кнопку Excel (пиктограмма «зеленая стрелка вниз»), размещенную над блоком заключений (рис. 1). В результате выполненного действия сформируется и будет загружен на ваше устройство файл Excel.
- Для просмотра легенды со списком элементов страницы «Государственный реестр заключений о соответствии (GMP)», нажмите на пиктограмму «знак вопроса» в блоке «Легенда» (рис. 2).
Рис. 2. Легенда со списком элементов экранной формы «Государственный реестр заключений о соответствии (GMP)» в компоненте «Гален» (07.09.2022 Версия: 2.5.4)
Вернуться к основным действиям ↑
Работа с заключением о соответствии (GMP)
На странице просмотра списка заключений о соответствии (GMP) (рис. 1) возможно выполнить следующие шаги:
- Для просмотра информации о заключениях о соответствии (GMP) необходимо обратить внимание на таблицу на странице просмотра государственного реестра заключений о соответствии (GMP) (рис. 1).
- 2.1. Для редактирования заключения нажмите на кнопку «Ввод сведений по заключению о соответствии (GMP)» (пиктограмму «три полоски») (рис. 3). В результате откроется страница ввода сведений по заключению о соответствии (GMP) (рис. 3).
Рис. 3. Редактирование заключения о соответствии (GMP) в компоненте «Гален» (07.09.2022 Версия: 2.5.4)
- 2.2. На открывшейся странице ввода сведений измените необходимые данные и нажмите на кнопку «Сохранить». В результате заключение будет отредактировано.
- 2.1. Для редактирования заключения нажмите на кнопку «Ввод сведений по заключению о соответствии (GMP)» (пиктограмму «три полоски») (рис. 3). В результате откроется страница ввода сведений по заключению о соответствии (GMP) (рис. 3).
- Для удаления заключения о соответствии (GMP) нажмите на кнопку «Удалить» (пиктограмма «корзина») на странице просмотра государственного реестра заключений о соответствии (GMP) (рис. 1).
Ввод сведений по заключению о соответствии (GMP)
Для осуществления действий по вводу сведений по заключению о соответствии (GMP) необходимо выполнить следующие шаги:
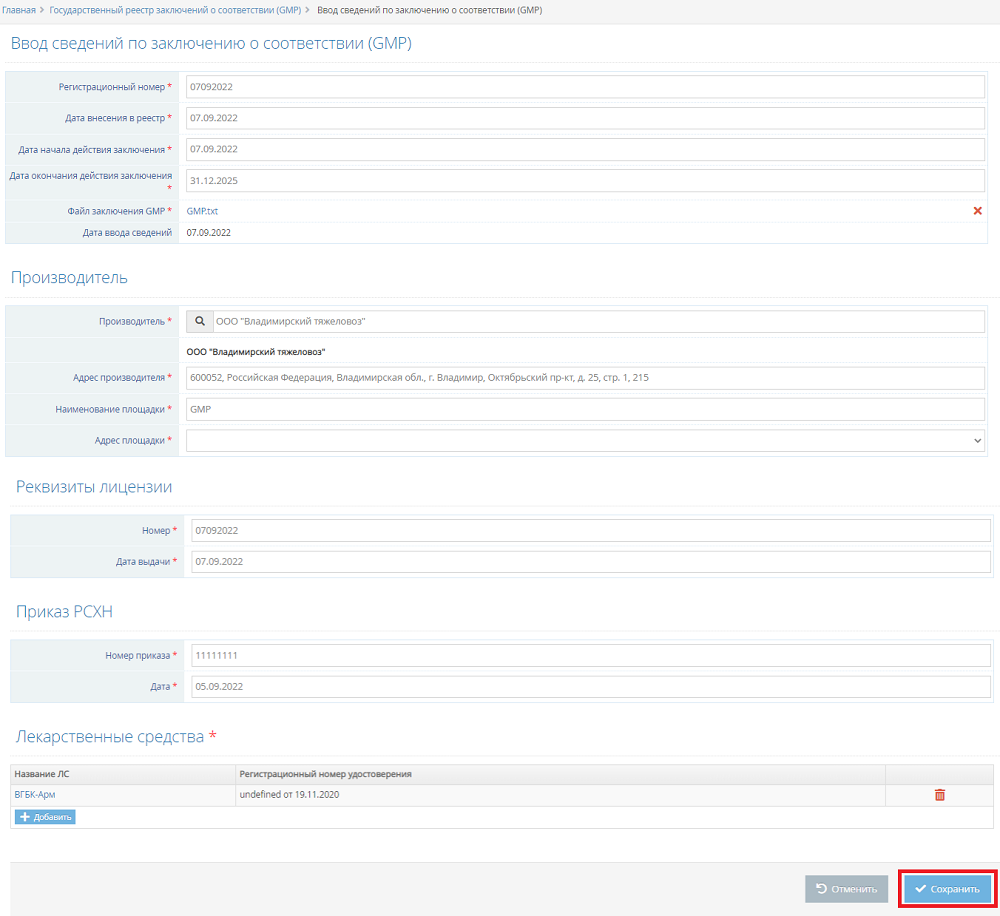
- Нажмите на кнопку «Добавить данные» на странице просмотра государственного реестра заключений о соответствии (GMP) (рис. 1). В результате откроется страница «Ввод сведений по заключению о соответствии (GMP)».
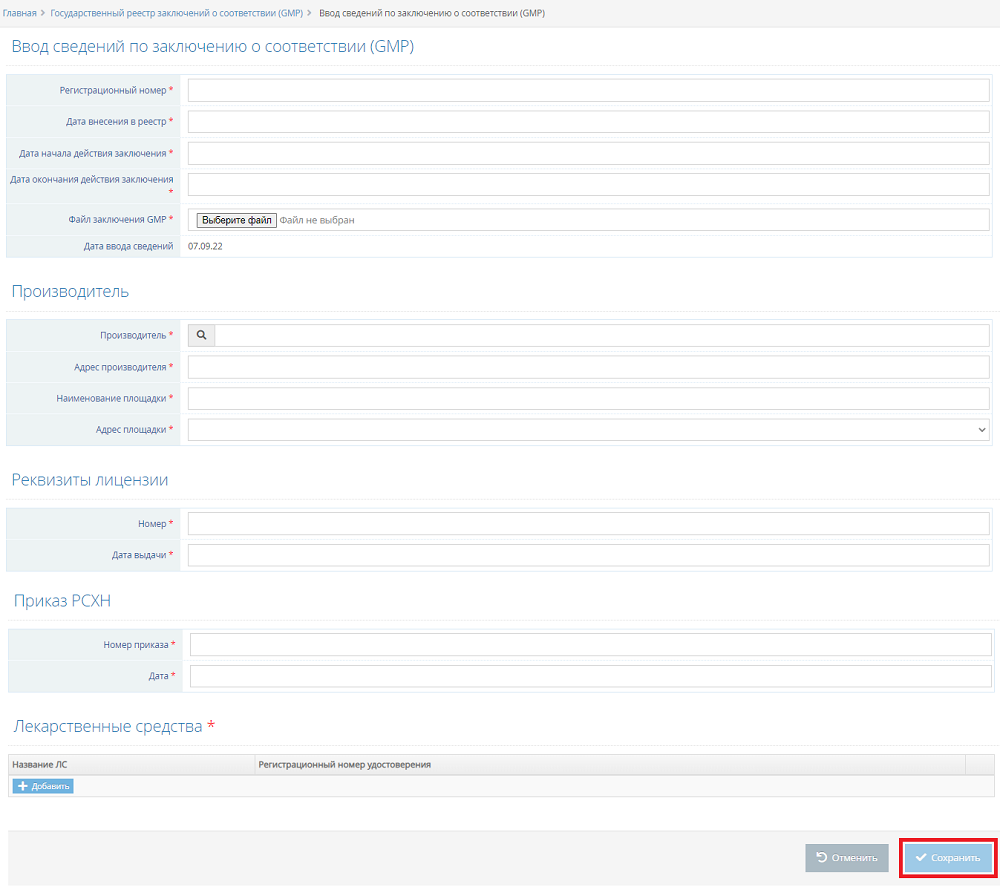
- В открывшейся странице ввода сведений укажите значения полей (* – помечены обязательные к заполнению поля) (рис. 4):
Рис. 4. Экранная форма «Ввод сведений по заключению о соответствии (GMP)» (07.09.2022 Версия: 2.5.4)
- * регистрационный номер;
- * дата внесения в реестр;
- * дата начала действия заключения;
- * дата окончания действия заключения;
- * файл заключения GMP;
- * производитель (указать можно только из справочника);
- * адрес производителя (заполняется автоматически после выбора производителя);
- * наименование площадки;
- * адрес площадки (указать можно только из выпадающего списка);
- * номер лицензии;
- * дата выдачи лицензии;
- * номер приказа РСХН;
- * дата приказа РСХН.
- Для добавления лекарственного средства в карточку сведений по заключению о соответствии (GMP) нажмите на кнопку «Добавить» в блоке «Лекарственные средства». В результате откроется модальное окно «Лекарственное средство».
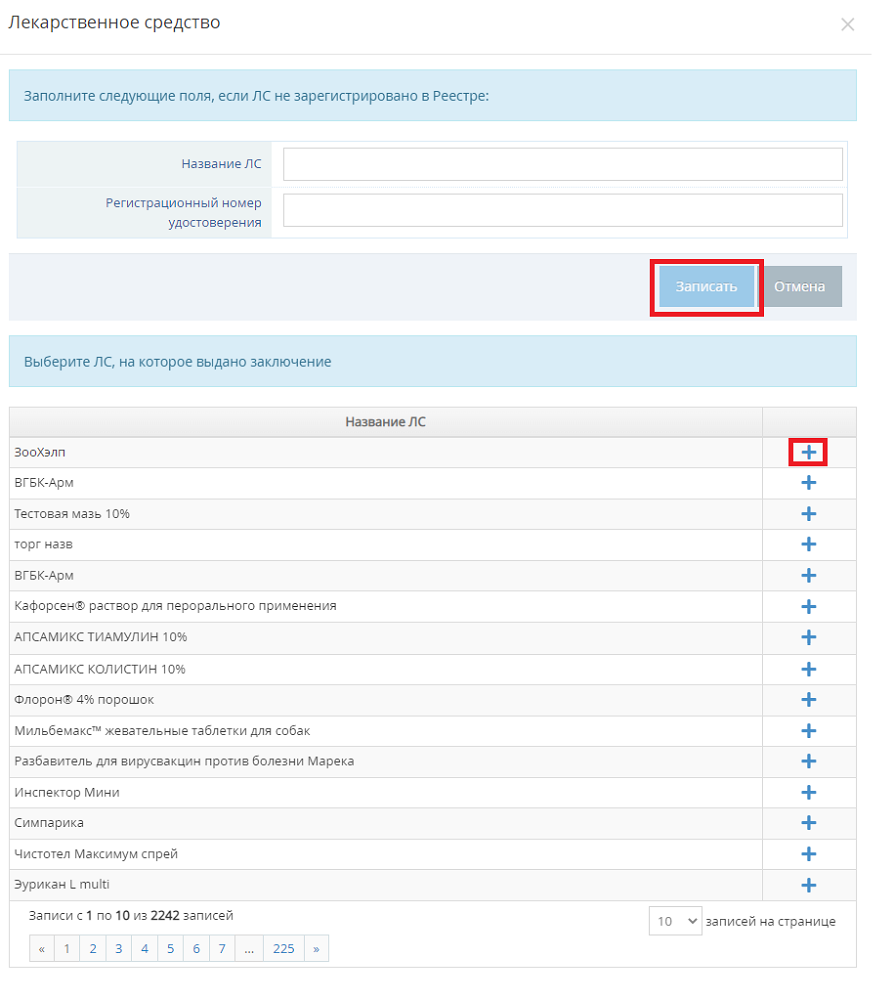
- В открывшемся модальном окне (рис. 5):
Рис. 5. Добавление ЛП в заключение о соответствии (GMP) в компоненте «Гален» (07.09.2022 Версия: 2.5.4)
- 4.1. Если лекарственное средство внесено в Реестр ЛП, то найдите его наименование в разделе «Выберите ЛС, на которое выдано заключение» и нажмите на расположенную напротив него кнопку «Выбрать» (пиктограмма «плюс») (в разделе отображаются все препараты Реестра ЛП без ограничения).
- 4.2. Если лекарственное средство не внесено в Реестр, то укажите значения следующих полей:
- название ЛС;
- регистрационный номер удостоверения.
- 4.2.1. Нажмите на кнопку «Записать».
- Чтобы удалить лекарственное средство из подраздела «Лекарственные средства», нажмите на кнопку «Удалить» (пиктограмма «корзина»).
- После заполнения всех полей нажмите на кнопку «Сохранить». В результате заключение о соответствии (GMP) будет внесено в государственный реестр.
Вернуться к основным действиям ↑
Заключительные действия
В результате выполненных действий будут выполнены поиск, просмотр, ввод, редактирование и удаление сведений по заключению о соответствии (GMP), а также сформирована выгрузка сведений в формате Excel.
Вернуться к началу ↑
Исключительные ситуации
По техническим вопросам, связанным с работой компонента «Гален», обращаться по электронной почте на адрес galen@fsvps.ru.
Ресурсы
Временные затраты на поиск/просмотр/ввод/удаление/скачивание выгрузки составляют не более 1 минуты
Ссылки
- https://galen.vetrf.ru — Веб-интерфейс компонента «Гален».
Вернуться к началу ↑