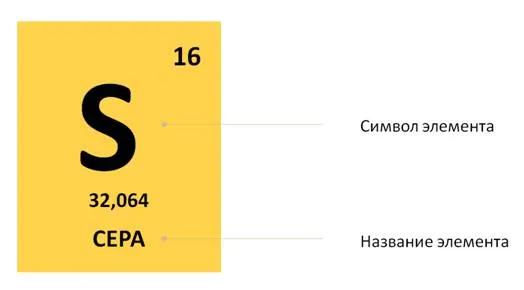
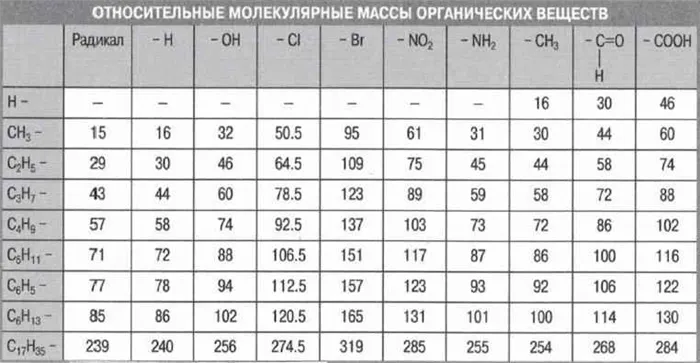
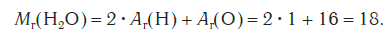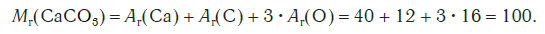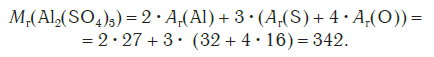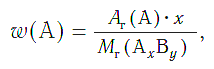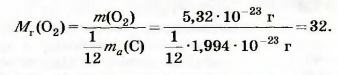В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Самое сложное — выяснить, сколько атомов каждого атома находится в соединении. Имеется три атома кальция, два атома фосфора и восемь атомов кислорода. Как вы к этому пришли? Если часть соединения приведена в скобках, умножьте подстрочный индекс сразу после символа элемента на подстрочный индекс, закрывающий скобки.
Урок 7. Относительная молекулярная и относительная формульная массы
В уроке 7 «Относительная молекулярная масса и относительная типовая масса» из книги «Химия для чайников» мы узнаем, как рассчитать относительную молекулярную массу и относительную типовую массу веществ, а также узнаем, что такое массовая доля и приведем формулу для ее расчета. Помните, что на прошлом уроке «Валентность» мы дали определение валентности и научились ее определять; мы рассмотрели элементы с постоянной и переменной валентностью и научились составлять химические формулы в зависимости от валентности.
Каждый химический элемент характеризуется определенным значением относительного атомного веса. Состав вещества выражается молекулярной или простой формулой его структурной единицы. Такая структурная единица состоит из определенного количества атомов химического элемента. Поэтому масса структурной единицы может быть выражена в единицах атомной массы.
Относительная молекулярная масса
Вещества с молекулярной структурой характеризуются их относительной молекулярной массой, которая обозначается буквой М.r.
Относительная молекулярная масса — это физическая величина, которая соответствует отношению массы молекулы вещества к 1/12 массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные веса, как и относительные атомные веса, являются безразмерными величинами. Значение Mrпоказывает, как часто масса молекулы определенного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, что означает, что масса H2Молекула O имеет массу в 18 раз больше 1/12 массы атома углерода, т.е. в 18 раз больше атомной единицы массы. Следовательно, масса H2SO4в 98 раз больше, чем 1/12 массы атома углерода.
Относительная формульная масса
Вещества с немолекулярной структурой также характеризуются аналогичной величиной, которая называется относительной массой формулы. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, образующих структурную единицу этих веществ — формульную единицу, и также обозначается Mr. В этом случае, конечно, необходимо учитывать индексы в атомных символах.
Например, относительная формульная масса вещества CaCO3равна:
Относительная стандартная масса вещества Al2(SO4)3равна:
Относительная стандартная масса показывает, во сколько раз масса стандартной единицы данного вещества больше 1/12 массы атома углерода или атомной единицы массы u .
Понятие атомной единицы массы
В настоящее время принято считать, что масса в единице массы или единице атомного номера — это масса одного атома или единицы атомного номера.
Атомная масса показывает, какую массу имеет атом. Его можно найти в таблице Менделеева. Как правило, масса в этой таблице приводится в виде дробного числа, которое очень близко к целочисленному значению. Например, атомная масса водорода составляет 1,000797 а.е.м., гелия — 4,0026 а.е.м., а кислорода — 15,9994 а.е.м.. В практических приложениях обычно округляют эти значения до целых чисел. В практических задачах принято устанавливать атомную массу водорода на уровне 1 AU, гелия — 4 AU и кислорода — 16 AU. Исключением является хлор, масса которого округляется до 35,5 AU.
Важно понимать, что атомы одного и того же элемента могут иметь разную массу. Такие вещества с разной атомной массой называются изотопами. Изотопы одного и того же элемента имеют одинаковое количество протонов, но разное количество нейтронов. Однако все изотопы одного и того же элемента обладают одинаковыми химическими свойствами.
Матрица Менделеева дает средний вес всех изотопов с учетом их обилия в природе. Кислород, например, имеет три стабильных изотопа:
- кислород-16 (масса 15,9949 а. е. м, распространенность 99,759%)
- кислород-17 (масса 16,9991 а. е. м., распространенность 0,037%)
- кислород-18 (масса 17,9991 а. е. м., распространенность 0,204%)
Исходя из этого, атомный вес кислорода, приведенный в таблице Менделеева, рассчитывается следующим образом:
(15,9949-99,759 + 16,9991-0,037 + 17,9991-0,204)/100 = 15,9994 а.е.
Молекулярная масса
Если вы знаете атомные веса отдельных элементов, вы также можете определить молекулярные веса молекул. Для этого достаточно сложить атомные веса атомов, входящих в состав молекулы.
Возьмем, к примеру, молекулу метана, имеющую формулу CH4что означает, что он состоит из 1 атома углерода (с массой 12 уе) и 4 атомов водорода (с массой 1 уе каждый). Добавьте атомные массы:
12 + 1 + 1 + 1 + 1 + 1 + 1 = 12 + 4-1 = 16 уе.
Поэтому молекула метана имеет молекулярную массу 16 а.е.м.
Обратите внимание, что очень часто возникает путаница относительно молекул простых газов — водорода, кислорода, азота и т.д. Это происходит потому, что их молекулы состоят из двух атомов, поэтому их масса вдвое больше массы их атомов. Например, атомный вес элемента кислорода составляет 16 уе, но молекула кислорода с формулой O2который имеет формулу O, весит 16 — 2 = 32.
Молярная масса
Молекулярные веса веществ тесно связаны с понятием молекулярной массы. Молекулярная масса — это масса 1 моль вещества. Численно это то же самое, что и молекулярный вес, но измеряется он в других единицах — граммах на молекулу или г/моль.
Молекулярная масса может быть использована для определения того, легче или тяжелее газ, чем воздух. Мы просто должны сравнить молекулярную массу газа с молекулярной массой воздуха, которая составляет 28,98 г/моль. Поэтому кислород тяжелее воздуха, так как его молекулярная масса составляет 32 г/моль. С другой стороны, азот легче воздуха, поскольку его молекулярная масса составляет 28 г/моль. Здесь следует уточнить
п.3. Молярная масса
Молярная масса – это масса 1 моля вещества. Из определения 1 моля вещества и относительной молекулярной массы следует, что молярная масса равна $ mu=M_rcdot 10^frac>>$
Например: Молярная масса воды $ mu(mathrm)=M_r(mathrm)cdot 10^=18cdot 10^frac>>$
Алгоритм определения молярной массы вещества с помощью таблицы Менделеева Шаг 1. По таблице Менделеева найти относительные атомные массы (A_) для всех элементов, входящих в молекулу вещества. Шаг 2. Найти относительную молекулярную массу как сумму всех относительных атомных масс $ M_r=sum_i A_ $ Шаг 3. Записать молярную массу в виде $ mu=M_rcdot 10^frac>>$
Например: Найдем молярную массу этилового спирта begin A_r(mathrm)=12, A_r(mathrm)=1, A_r(mathrm)=16\ M_r(mathrm)= 2A_r(mathrm)+6A_r(mathrm) +A_r(mathrm)=2cdot 12+6cdot 1+16=46\ mu(mathrm)=46cdot 10^frac>>Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы содержится в этом кристалле? (Округлите ответ до двух значащих цифр).
п.4. Молярный объем
$ Количество вещества в кристалле серы: $<mu>u=frac=frac.<mu>$
$ Число молекул в кристалле серы: $ N=frac<mu text<газ>>=22,4frac>>$
N_A $ $ N=frac
п.5. Задачи
cdot 6,022cdot 10^\approx 3,8cdot 10^ $ Ответ : (3.8cdot 10^).
Относительная молекулярная масса одной молекулы $ M_r=8cdot A_r=8cdot 32=256 $ Молярная масса $ mu=256cdot 10^frac>>Проблема 2*. Генератор кислорода космического корабля произвел 1,6 кг кислорода (mathrm). Обычно космонавту требуется 600 литров кислорода в день. Предполагая, что газовые условия приблизительно нормальные, определите, сколько часов астронавт получал кислород.<mu>$ Объем полученного кислорода $<mu>u=frac=frac<1,6cdot 10^><256cdot 10^>$ Объем произведенного кислорода $ V=frac
=V_
Относительная молекулярная масса молекулы кислорода $ M_r=2cdot A_r=32 $ Молярная масса кислорода $ mu=32cdot 10^frac>>$ количество часов, в течение которых атом дышит begin t=frac=frac>{frac<mu>= 44,8\\text end Ответ: 44,8 часа.<mu><mu>>\6pt t=frac><32cdot 10^ text>cdot frac>>
Гипермаркет знаний>>Химия>>Химия 7 класс>> Относительная молекулярная и относительная формульная массы
Относительная молекулярная и относительная формульная массыМатериал параграфа поможет вам:
> выяснить, что такое относительная молекулярная масса и относительная формульная масса;
> правильно вычислять относительные молекулярные и формульные массы.
Относительная молекулярная масса.
Массы молекул, как и атомов, чрезвычайно малы. Поэтому в химии используют относительные массы молекул. Их еще называют относительными молекулярными массами.
Относительная молекулярная масса — это отношение массы Молекулы к 1/12 массы атома Карбона.
Относительную молекулярную массу сокращенно обозначают Mr. Эта величина, как и относительная атомная масса, не имеет размерности.
Математическая формула для ее вычисления, исходя из массы молекулы:
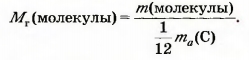
Найдем относительную молекулярную массу кислорода, использовав массы молекулы кислорода (5,32 • 10-23 г) и атома Карбона (1,994 • 10-23 г):
Значительно проще вычислять относительную молекулярную массу, используя относительные атомные массы.
Относительная масса молекулы равна сумме относительных масс атомов, которые входят в ее состав.
Найдем относительные молекулярные массы кислорода и воды, взяв из периодической системы Менделеева значения относительных атомных масс Оксигена и Гидрогена:
Mr(O2) = 2Аr(0) = 2 • 16 = 32;
Mr(H2O) = 2Ar(H) +Ar(O) = 2 • I + 16 = 18.
► Вычислите относительные молекулярные массы азота N2 и аммиака NH3.
Это интересно
Наименьшую массу имеют ионы Гидрогена H+ и H— .
Относительная формульная масса.
Для ионов, а также веществ с атомным и ионным строением (они не содержат молекул) вместо термина «относительная молекулярная масса» используют другой «относительная формульная масса». Эту физическую величину обозначают и рассчитывают так же, как и относительную молекулярную массу.
Относительная формульная масса иона. Масса простого иона почти не отличается от массы соответствующего атома, так как ион содержит наодин или несколько электронов больше или меньше, чем атом, а масса электрона в тысячи раз меньше массы атома. Совпадают также относительные формульные массы простых ионов и относительные атомные массы элементов:
Mr(K+) = Ar(K); Mr(O2- ) = Ar(O).
Относительные формульные массы сложных ионов можно рассчитать тем же способом, что и относительные молекулярные массы:
Mr(CO2-3 ) =Ar (C ) + ЗАr(0) = 12 + 3 • 16 = 60.
► Вычислите относительные формульные массы ионов NH+4 и NO—2.
Это интересно
Значение относительной формульной массы 100 имеют соединения с Формулами
CrO3, Mg3N2, CaCO3.
Относительная формульная масса ионного вещества. Вычисление относительной формульной массы поваренной соли осуществляют так:
Mr(NaCl) =A r(Na) +Ar(Cl) = 23 + 35,5 = 58,5.
В качестве другого примера возьмем алюминий сульфат Al2(SO4)3. Это соединение состоит из простых ионов Al3+ и сложных ионов SO4— .
Относительную формульную массу соединения можно вычислить двумя способами.
1 способ. Используем относительные атомные массы:
Mr[Al2(SO4)3] = 2Ar(Al) + 3Ar(S) + 3 • 4Аr(0) = 2 • 27 + 3 • 32 + 12 • 16 = 342.
2 способ. Используем относительные формульные массы ионов:
Mr(Al3+) =A r(Al) =27;
Mr(SO2-4) = Ar(S) + 4Аr(0) = 32 + 4 • 16 = 96;
Mr[Al2(S04)3] = 2Mr(Al3+) + 3Mr(S02-4 ) = 2 • 27 + 3 • 96 = 342.
Относительная формульная масса — это относительная масса формульной единицы вещества.
Понятие «относительная формульная масса» является универсальным. Оно может быть использовано для веществ любого строения, а также для ионов — простых и сложных.
Выводы
Относительная молекулярная масса — это отношение массы молекулы к — массы атома Карбона или сумма относительных масс атомов, которые входят в состав молекулы.
Для ионов, веществ атомного и ионного строения используют относительную формульную массу. Ее обозначают и вычисляют так же, как и относительную молекулярную массу.
?
84. Что такое относительная молекулярная масса? Как ее рассчитать: а) исходя из массы молекулы; б) по химической формуле молекулы?
85. У какого вещества наименьшая относительная молекулярная масса?
86. Вычислите (желательно устно) относительные молекулярные массы веществ, которые имеют такие формулы:
a) Cl2, O3, P4; б) CO, H2S, H3PO4.
87. Рассчитайте относительные формульные массы веществ с такими формулами:
a) CaH2, AIH3; б) Li2O, MgO; в) Cu(OH)2, (NH4 )2S.
88. Во сколько раз масса атома Оксигена больше или меньше массы:
а) молекулы водорода; б) молекулы метана CH4; в) иона Купрума Cu2+; г) иона S02-4? Попробуйте выполнить расчеты устно.
89. Относительная молекулярная масса соединения Хлора с Оксигеном равна 183. В его молекуле — 7 атомов Оксигена. Какова формула вещества?
90. Относительная формульная масса соединения элемента X с Флуором вдвое превышает относительную атомную массу Фосфора. Определите элемент X и напишите формулу соединения.
91. Масса молекулы воды равна 3 • 10-23 г, а атома Карбона — 2 • 10-23 г.
Вычислите по этим данным относительную молекулярную массу воды.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урокаконспект урока и опорный каркас
презентация урока
интерактивные технологии
акселеративные методы обучения Практика
тесты, тестирование онлайн
задачи и упражнения
домашние задания
практикумы и тренинги
вопросы для дискуссий в классе Иллюстрации
видео- и аудиоматериалы
фотографии, картинки
графики, таблицы, схемы
комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения
рефераты
шпаргалки
фишки для любознательных
статьи (МАН)
литература основная и дополнительная
словарь терминов Совершенствование учебников и уроков
исправление ошибок в учебнике
замена устаревших знаний новыми Только для учителей
календарные планы
учебные программы
методические рекомендации
обсуждения
Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний — Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов —
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других «взрослых» тем.
Разработка — Гипермаркет знаний 2008-
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: 
Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.