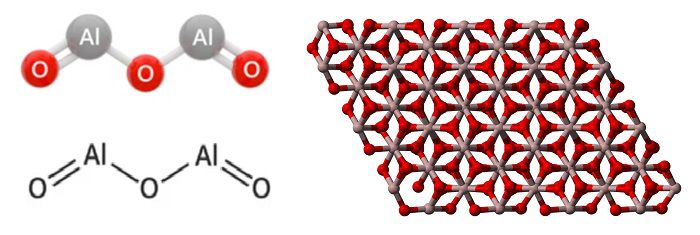
Оксид алюминия
Способы получения
Оксид алюминия можно получить различными методами:
1. Горением алюминия на воздухе:
4Al + 3O2 → 2Al2O3
2. Разложением гидроксида алюминия при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
3. Оксид алюминия можно получить разложением нитрата алюминия:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Химические свойства
Оксид алюминия — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например, оксид алюминия взаимодействует с оксидом натрия:
Na2O + Al2O3 → 2NaAlO2
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Например, оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
2NaOH + Al2O3 → 2NaAlO2 + H2O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например, оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al2O3 + 3SO3 → Al2(SO4)3
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например, оксид алюминия реагирует с серной кислотой:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
6. Оксид алюминия проявляет слабые окислительные свойства.
Например, оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Al2O3 + 3CaH2 → 3CaO + 2Al + 3H2
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
2Al2O3 → 4Al + 3O2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
| Оксид алюминия | |
|---|---|
 |
|
| Хим. формула | Al2O3 |
| Состояние | кристаллическое |
| Молярная масса | 101,96 г/моль |
| Плотность | 3,99 г/см³ |
| Т. плав. | 2044 °C |
| Т. кип. | 2980 °C |
| Энтальпия образования | −1675,7 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| ГОСТ | ГОСТ 8136-85 |
| Рег. номер CAS | 1344-28-1 |
| PubChem | 9989226 |
| Рег. номер EINECS | 215-691-6 |
| SMILES |
[O-2].[O-2].[O-2].[Al+3].[Al+3] |
| InChI |
1S/2Al.3O/q2*+3;3*-2 PNEYBMLMFCGWSK-UHFFFAOYSA-N |
| RTECS | BD1200000 |
| ChEBI | 30187 |
| ChemSpider | 8164808 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
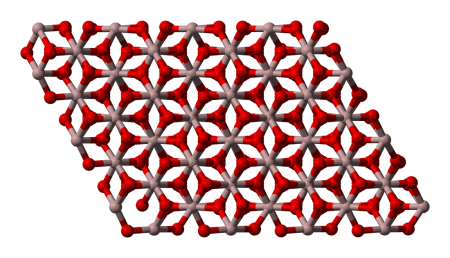
Оксид алюминия Al2O3 — бинарное соединение алюминия и кислорода. В природе распространён как основная составляющая часть глинозёма, нестехиометрической смеси оксидов алюминия, калия, натрия, магния и т. д. В модификации корунд имеет атомную кристаллическую решётку.
Содержание
- 1 Свойства
- 1.1 Плотность
- 1.2 Основные модификации оксида алюминия
- 2 Получение
- 3 Применение
Свойства
Бесцветные нерастворимые в воде кристаллы. Амфотерный оксид. Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей. Является диэлектриком, но некоторые исследователи считают его полупроводником n-типа. Диэлектрическая проницаемость 9,5—10. Электрическая прочность 10 кВ/мм.
Плотность
| Модификация | Плотность, г/см3 |
|---|---|
| α-Al2O3 | 3,99 |
| θ-Al2O3 | 3,61 |
| γ-Al2O3 | 3,68 |
| κ-Al2O3 | 3,77 |
Основные модификации оксида алюминия
В природе можно встретить только тригональную α-модификацию оксида алюминия в виде минерала корунда и его редких драгоценных разновидностей (рубин, сапфир и т. д.). Она является единственной термодинамически стабильной формой Al2O3. При термообработке гидроксидов алюминия около 400 °С получают кубическую γ-форму. При 1100—1200 °С с γ-модификацией происходит необратимое превращение в α-Al2O3, однако скорость этого процесса невелика, и для завершения фазового перехода необходимо либо наличие минерализаторов, либо повышение температуры обработки до 1400—1450 °С.
Известны также следующие кристаллические модификации оксида алюминия: кубическая η-фаза, моноклинная θ-фаза, гексагональная χ-фаза, орторомбическая κ-фаза. Спорным остаётся существование δ-фазы, которая может быть тетрагональной или орторомбической.
Вещество, иногда описываемое как β-Al2O3, на самом деле представляет собой не чистый оксид алюминия, а ряд алюминатов щелочных и щёлочноземельных металлов со следующими общими формулами: MeO·6Al2O3 и Me2O·11Al2O3, где MeO — это оксиды кальция, бария, стронция и т. д., а ME2O — оксиды натрия, калия, лития и других щелочных металлов. При 1600—1700 °С β-модификация разлагается на α-Al2O3 и оксид соответствующего металла, который выделяется в виде пара.
Получение
Получают из бокситов, нефелинов, каолина, алунитов алюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал.
- 3Cu2O + 2Al →1000∘C 6Cu + Al2O3
- 2Al(OH)3 →t Al2O3 + 3H2O
Плёнки оксида алюминия на поверхности алюминия получают электрохимическими или химическими методами. Так, например, получают диэлектрический слой в алюминиевых электролитических конденсаторах. В микроэлектронике также применяется эпитаксия оксида алюминия, которая многими учёными считается перспективной, например, в изоляции затворов полевых транзисторов.
Применение
Оксид алюминия (Al2O3), как минерал, называется корунд. Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из-за примесей корунд бывает окрашен в разные цвета: красный корунд (содержащий примеси хрома) называется рубином, синий, традиционно — сапфиром. Согласно принятым в ювелирном деле правилам, сапфиром называют кристаллический α-оксид алюминия любой окраски, кроме красной. В настоящее время кристаллы ювелирного корунда выращивают искусственно, но природные камни всё равно ценятся выше, хотя по виду не отличаются. Также корунд применяется как огнеупорный материал. Остальные кристаллические формы используются, как правило, в качестве катализаторов, адсорбентов, инертных наполнителей в физических исследованиях и химической промышленности.
Керамика на основе оксида алюминия обладает высокой твёрдостью, огнеупорностью и антифрикционными свойствами, а также является хорошим изолятором. Она используется в горелках газоразрядных ламп, подложек интегральных схем, в запорных элементах керамических трубопроводных кранов, в зубных протезах и т. д.
Так называемый β-оксид алюминия в действительности представляет собой смешанный оксид алюминия и натрия. Он и соединения с его структурой вызывают большой научный интерес в качестве металлопроводящего твёрдого электролита.
γ-Модификации оксида алюминия применяются в качестве носителя катализаторов, сырья для производства смешанных катализаторов, осушителя в различных процессах химических, нефтехимических производств (ГОСТ 8136-85).
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Aluminum oxide is a chemical substance made up of atoms of aluminum and oxygen. Aluminum loses three electrons in the chemical process, whereas oxygen gains two. It is frequently referred to as alumina. Alpha-Alumina, alumina, alundum, or alkoxide are other names for it. Aluminum oxide is a white, odorless amorphous material. Because of its multiple beneficial properties, the chemical contributes significantly to a wide range of life-extension and social welfare applications. It can also be found in bauxite.
Aluminum Oxide Formula
Aluminum oxide may be found in nature as corundum, rubies, sapphires, and emeralds. It’s an alkaline earth compound that interacts with both acids and bases. It appears white and exists as a solid.
It has no odor and is insoluble in water. This molecule is most commonly found in crystalline form, which is known as -aluminum oxide or corundum. Because of its hardness, it is usually utilized as an abrasive and in cutting tools.
The chemical formula for Aluminium oxide is Al2O3 which is an inorganic chemical reagent .
Structure of Aluminium oxide
Two Aluminium atoms bond with two oxygen atoms each to form the structure of aluminum oxide, which means it has three oxygen atoms.
Physical Properties of Aluminium Oxide
- Aluminum oxide is a whitish solid.
- It is insoluble in water and as well as in all other solvents.
- Although aluminum oxide is an electrical insulator, it exhibits thermal conductivity in ceramic material.
- Aluminum oxide has a relatively high melting point (2345K) and boiling point (3250K).
- Aluminum oxide has a density of 3.987g/cm3.
Chemical Properties of Aluminium Oxide
- Sodium aluminate and water are formed when aluminum oxide interacts with sodium hydroxide. This reaction occurs at temperatures ranging from 900 to 1100°C. This reaction, in which aluminum oxide serves as an acid, produces salt and water.
Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Metal oxides are typically basic in nature, although aluminum oxide is amphoteric. As a consequence, it functions as both an acid and a base. In this case, it does not act as an acid but acts as a base.
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
This is known as a neutralization reaction.
- Aluminum oxide includes oxide ions therefore it interacts with acids similarly to sodium or magnesium oxides. Aluminum chloride solution is formed when aluminum oxide reacts with hot dilute hydrochloric acid.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Uses of Aluminium Oxide
- Aluminum oxide is mostly utilized as an abrasive due to its hardness and strength. Aluminum oxide is used as a replacement for an industrial diamond in the manufacturing of sandpaper, cutting tools, and other products.
- It is most commonly utilized as a ceramic material.
- It is used as a plastic filler.
- It is often seen as an ingredient in sunscreen, lipstick, blush, and nail paint.
- It is used in the manufacturing of glass. and Aluminosilicate glass is a common glass that contains aluminum oxide. Aluminosilicate glass comprises 5–10% of Aluminium oxide.
- It is utilized as a catalyst in various industrial processes. For example, the Aluminium oxide is used as a catalyst in the Claus process, which converts hydrogen sulfide waste into elemental sulfur.
- Aluminum oxide can be used to eliminate water from gas streams.
- Aluminum oxide flakes are used in paints to add a reflecting or decorative look.
- Aluminum oxide is utilized as an electrical insulator in integrated circuits.
- Transparent aluminum oxide is used in sodium vapor lamps and compact fluorescent lights.
Sample Questions
Question 1: Is Aluminum Oxide Harmful to Humans?
Answer:
When compared to other chemicals, aluminium oxide is less hazardous. However, when concentrations increase, the toxicity increases.
Question 2: What is the purpose of aluminum oxide?
Answer:
Aluminium oxide is a high-quality ceramic oxide with several uses in the production of adsorbents and catalysts. It is also utilised in the aerospace industry and in the production of a variety of economically important chemicals.
Question 3: What Is aluminum oxide acidic or basic?
Answer:
Aluminium(III) oxide is an amphoteric metal oxide, which means that it has both acidic and basic properties. The acidic or basic character of Al2O3 is determined by the nature of the other reactant in the chemical process.
Question 4: Which liquids react with aluminum?
Answer:
Aluminium chloride and hydrogen gas are formed when aluminium combines with dilute hydrochloric acid. At room temperature, chlorine and liquid bromine react with aluminium.
Question 5: Why is it that aluminum cannot react with water?
Answer:
Aluminum metal rapidly forms a thin coating of aluminium oxide a few millimetres thick, which prevents it from reacting with water. When this layer corrodes, a reaction occurs, resulting in the release of extremely combustible hydrogen gas.
Question 6: Is aluminum oxide a gas?
Answer:
Al2O is commonly found as a gas since the solid state is not stable at room temperature and is only stable between 1050 and 1600°C. Aluminium(I) oxide is produced by boiling Al and Al2O3 in a vacuum in the presence of SiO2 and C, and afterwards condensing the products.
Last Updated :
28 Apr, 2022
Like Article
Save Article
Оксид алюминия – это распространённое вещество, относящееся к классу оксидов. Он используется во многих областях деятельности, распространён в промышленности, ювелирном деле, химии, стекловарении. Благодаря высокой химической активности и особой структуре алюминиевый оксид входит в состав смазочных смесей, бронежилетов. Применение алюминия оксида распространилось в область очищения газов, электроизоляции, хроматографии.
Содержание
- Что такое оксид алюминия, формула
- Виды оксидов алюминия
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение оксида алюминия
- Применение
- Применение алюминия оксида в химической промышленности
- Применение алюминия оксида в стеклоделии, керамике и других областях
- Где купить и сколько стоит
- Заключение
Что такое оксид алюминия, формула
Оксид алюминия – это бинарное соединение металла алюминия с кислородом. Химическая формула – Al2O3. В молекуле вещества между двумя атомами алюминия находится атом кислорода.
В природе оксид алюминия встречается чаще всего в форме глинозёма. Его месторождения распространены по всему миру. Чистое соединение можно встретить в природе как минерал корунд. Он образуется в глубинах земной коры из кристаллизующихся магнитных расплавов. Поэтому его находят в магматических породах. Иногда он бывает загрязнён примесями железа, хрома, титана. Это драгоценный материал. Его не огранённые, естественные кристаллы – таблитчатые или бочонкообразные, сросшиеся, либо разбросанные в виде отдельных вкраплений, зёрен, сплошных корочек. Корунд довольно твёрдый, твёрдость по шкале Мооса – 9. Встречаются как прозрачные, так и полу-непрозрачные экземпляры. Характеризуется стеклянным блеском, неровным изломом, плотность порядка 4,1 г/см3.
Регионы добычи расположены в Индии, на острове Шри-Ланка, в Канаде, Норвегии, России (Северная Карелия, Средний и Приполярный Урал).
Виды оксидов алюминия
Разновидности сапфиров
Оксид алюминия существует в разных модификациях. К альфа-модификации относятся природный минерал и все его подвиды, она термодинамически стабильна. При обработке соединений при высоком температурном режиме образуется гамма-модификация – это кубическая форма, появляющаяся при нагреве до 400 °С. Она при повышении жара до 1000 °С с добавлением минерализаторов спонтанно переходит в альфа-форму. Другие модификации:
- н-фаза кубическая;
- тета-фаза в форме призмы (моноклинная);
- к-фаза шестиугольная;
- х-фаза ромбическая.
Различия вещества по цвету и его интенсивности определяются содержанием окисей железа и хрома, следовыми количествами других красящих минералов. По окраске выделяют несколько разновидностей оксидов алюминия:
- Рубин отличается ярко-красной насыщенной цветовой гаммой с высокой степенью прозрачности.
- Сапфир окрашен в голубовато-синие тона, наиболее бледные и тёмные вариации ценятся меньше. Умеренная голубизна – самая дорогая. Выделяют зелёный сапфир, который называли восточным изумрудом, и «восточный аметист» – фиолетовый сапфир.
- Падпараджа – сапфировый камень нежно персикового, желтоватого или розоватого оттенка.
- Лейкосапфир бесцветен, отличается дешевизной и низкой востребованностью.
- Наждак – основа распространённой в быту «наждачки» – абразивный материал, которым издревле пользовались для шлифования.
- Синтетический корунд производится искусственным путём и имеет приятный розоватый окрас, его именуют «розой Франции».
- Натуральный оксид алюминия непрозрачен, высокотвёрдый, тугоплавкий.
Физические свойства, внешний вид
Оксид алюминия – это мелкокристаллический бесцветный порошок с плотностью 3,99 г/см3. Он не растворяется в воде и кислотах, но смешивается с горячими растворами щелочей. Вещество плохо проводит электрический ток и является диэлектриком. Учёные причисляют его к проводнику n-типа, имеющему определённые электроны проводимости, которые являются носителями заряда.
Оксид алюминия довольно термостабилен, его температура плавления – 2044 °С, закипает при 2980 °С. Он характеризуется хорошей теплопроводностью, устойчив к действию агрессивных факторов окружающей среды: повышенной влажности, коррозии, ветру и температурным перепадам.
Химические свойства, реакции
Структурная формула и кристаллическая решетка оксида алюминия
Оксид алюминия является амфотерным, т.е. он вступает во взаимодействие как с щелочами, так и кислотами. Оксид алюминия реагирует с простыми веществами, в том числе с углеродом. При этом происходит реакция диспропорционирования, выделяется карбид:
2Al2O3 + 9C → Al4C3 + CO↑
Оксид алюминия реагирует с кислотными оксидами, с трёхокисью серы:
Al2O3 + 3SO3 → Al2(SO4)3
За счёт двойственных свойств алюминия, оксид алюминия реагирует с основными оксидами, образуется метаалюминат кальция. Уравнение реакции:
Al2O3 + СaO → Ca(AlO2)2
Оксид алюминия реагирует с соляной кислотой. В ходе реакции выделяется вода и хлорид:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
В реакциях с концентрированными щелочами формируются более сложные продукты. Так, оксид алюминия реагирует с едким натром, образуя тетрагидроксоалюминат натрия:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
По схожему механизму идёт реакция с расплавом гашёной извести:
Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O
Оксид алюминия реагирует с солями при нагревании:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2↑
При пропускании электричества запускается реакция электролиза:
Al2O3 → 4Al + 3O2
Производство и получение оксида алюминия
В лабораторных условиях получение ведется различными путями. Распространен прямой синтез из металла, сгорающего в кислороде:
4Al + 3O2 → 2Al2O3
Нередко для добычи реактива используют термолиз гидроксидов алюминия:
2Al(OH)3 + Al2O3 + 3H2O
Для этого подходит разложение любых солей алюминия – карбонатов, сульфатов:
Al2(CO3)3 → Al2O3 + 3CO2
В промышленности добыча оксида алюминия производится из естественного сырья – бокситов, каолина, нефелинов:
3Cu2O + 2Al → 6Cu + Al2O3
Применение
Применение алюминия оксида во многих сферах деятельности обусловлено его уникальными химическими свойствами. Ежегодно производится более десяти тонн оксида алюминия, большинство которого уходит на нужны керамической промышленности и химии. Он служит сырьём для выделения металлического алюминия, проявляет каталитическую активность в реакциях десульфуризации, полимеризации. Вещество необходимо для создания абразивов, красок, тканей, стекла.
Применение алюминия оксида в химической промышленности
Оксид алюминия обладает выраженными способностями катализатора. Он ускоряет реакции, не расходуясь при этом сам, поэтому его внесение в систему очень выгодно, а иногда и просто необходимо для успешного синтеза. Чаще всего его применяют на нефтеперерабатывающих заводах.
Применение алюминия оксида обусловлено тем, что, соединяясь с отходящими из реакторов газами, он обезвреживает их. Они в большой концентрации содержат сероводород, который оксид алюминия связывает, преобразуя в серу. Оксид алюминия служит носителем других катализаторов, необходимых для создания полимеров.
Оксид алюминия входит в состав среды для хроматографа. Он может работать при различной кислотности среды: кислой (pH → 4,5), основной (pH → 9,5), нейтральной. Стружку оксида добавляют в жидкости для более спокойного кипения.
Применение алюминия оксида в стеклоделии, керамике и других областях
Повышенная твёрдость оксида алюминия способствует его использованию в качестве абразива. Его порошок наносят на поверхность наждачной бумаги. При этом шлифование из-за низкой удельной теплоёмкости остаётся безопасным. Его используют для полировки дисков, в качестве напыления на наконечник кия в бильярде.
Оксид алюминия вносят в красящие составы для придания им блеска. Напыление из вещества упрочняет керамические пластины бронежилетов, защищает от истирания и повышенного износа любые детали. Благодаря изоляционным свойствам алюминия оксида им покрывают конденсаторы, катушки зажигания автомобилей.
Оксид алюминия – компонент алюмосиликатного стекла, отличающегося ударопрочностью, устойчивостью к возникновению трещин и царапин. Он является ингредиентом наполнителей для пластмасс, в медицине – активный компонент противозачаточных препаратов, материал для эндопротезов тазобедренных суставов.
Где купить и сколько стоит
Оксид алюминия продаётся заводами-производителями оптом. Стоимость 1 кг составляет 150 рублей при минимальном заказе от 25 кг. При меньших объёмах – 1-5 кг, цена поднимает до 200-250 руб/кг.
Заключение
Оксид алюминия – это вещество, востребованное в промышленности. Оно незаменимо для производства стекла, керамических изделий, органическом и неорганическом синтезе. Огранённый минер имеет большую эстетическую ценность и с древних времён привлекает ювелиров.
Читайте также:
- Хлорид алюминия: свойства, применение
- Сульфат алюминия: свойства, применение
- Гидроксид алюминия: свойства, инструкция, применение
- Алюмосиликаты: свойства, виды, получение, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…