From Wikipedia, the free encyclopedia

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Copper(II) nitrate |
||
| Other names
Cupric nitrate |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.019.853 |
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
Cu(NO3)2 | |
| Molar mass | 187.5558 g/mol (anhydrous) 241.60 g/mol (trihydrate) 232.591 g/mol (hemipentahydrate) |
|
| Appearance | blue crystals hygroscopic |
|
| Density | 3.05 g/cm3 (anhydrous) 2.32 g/cm3 (trihydrate) 2.07 g/cm3 (hexahydrate) |
|
| Melting point | 114 °C (237 °F; 387 K) (anhydrous, decomposes) 114.5 °C (trihydrate) 26.4 °C (hexahydrate, decomposes) |
|
| Boiling point | 170 °C (338 °F; 443 K) (trihydrate, decomposes) | |
|
Solubility in water |
trihydrate:[3] 381 g/100 mL (40 °C) 666 g/100 mL (80 °C) hexahydrate:[3] 243.7 g/100 mL (80 °C) |
|
| Solubility | hydrates very soluble in ethanol, ammonia, water; insoluble in ethyl acetate | |
|
Magnetic susceptibility (χ) |
+1570.0·10−6 cm3/mol (~3H2O) | |
| Structure | ||
|
Crystal structure |
orthorhombic (anhydrous) rhombohedral (hydrates) |
|
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Irritant, Oxidizer | |
| NFPA 704 (fire diamond) |
1 0 3 OX |
|
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3 (as Cu)[4] | |
|
REL (Recommended) |
TWA 1 mg/m3 (as Cu)[4] | |
|
IDLH (Immediate danger) |
TWA 100 mg/m3 (as Cu)[4] | |
| Safety data sheet (SDS) | Cu(NO3)2·3H2O | |
| Related compounds | ||
|
Other anions |
Copper(II) sulfate Copper(II) chloride |
|
|
Other cations |
Silver nitrate Gold(III) nitrate |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
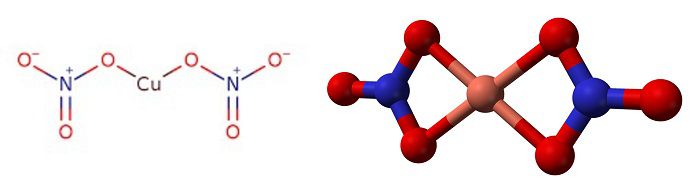
Copper(II) nitrate describes any member of the family of inorganic compounds with the formula Cu(NO3)2(H2O)x. The hydrates are blue solids. Anhydrous copper nitrate forms blue-green crystals and sublimes in a vacuum at 150-200 °C.[5][6] Common hydrates are the hemipentahydrate and trihydrate.
Synthesis and reactions[edit]
Hydrated copper(II) nitrate[edit]
Hydrated copper nitrate is prepared by treating copper metal or its oxide with nitric acid:[7]
- Cu + 4 HNO3 → Cu(NO3)2 + 2 H2O + 2 NO2
The same salts can be prepared treating copper metal with an aqueous solution of silver nitrate. That reaction illustrates the ability of copper metal to reduce silver ions.
In aqueous solution, the hydrates exist as the aqua complex [Cu(H2O)6]2+. Such complexes are highly labile owing to the d9 electronic configuration of copper(II).
Attempted dehydration of any of the hydrated copper(II) nitrates by heating affords the oxides, not Cu(NO3)2.[6] At 80 °C the hydrates convert to «basic copper nitrate», Cu2(NO3)(OH)3, which converts to CuO at 180 °C.[7] Exploiting this reactivity, copper nitrate can be used to generate nitric acid by heating it until decomposition and passing the fumes directly into water. This method is similar to the last step in the Ostwald process. The equations are as follows:
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
- 3 NO2 + H2O → 2 HNO3 + NO
Treatment of copper(II) nitrate solutions with triphenylphosphine, triphenylarsine, and triphenylstibine gives the corresponding copper(I) complexes [Cu(EPh3)3]NO3 (E = P, As, Sb; Ph = C6H5). The group V ligand is oxidized to the oxide.[8]
Anhydrous copper(II) nitrate[edit]
Anhydrous Cu(NO3)2 is one of the few anhydrous transition metal nitrates.[9] It cannot be prepared by reactions containing or producing water. Instead, anhydrous Cu(NO3)2 forms when copper metal is treated with dinitrogen tetroxide:[6]
- Cu + 2 N2O4 → Cu(NO3)2 + 2 NO
Structure[edit]
Anhydrous copper(II) nitrate[edit]
Structure of anhydrous copper(II) nitrate in the gas phase.[6]
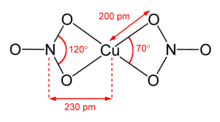
Two polymorphs of anhydrous copper(II) nitrate, α and β, are known.[6] Both polymorphs are three-dimensional coordination polymer networks with infinite chains of copper(II) centers and nitrate groups. The α form has only one Cu environment, with [4+1] coordination,[1] but the β form has two different copper centers, one with [4+1] and one that is square planar.[2]
The nitromethane solvate also features «[4+1] coordination», with four short Cu-O bonds of approximately 200 pm and one longer bond at 240 pm.[10]
Heating solid anhydrous copper(II) nitrate under a vacuum to 150-200 °C leads to sublimation and «cracking» to give a vapour of monomeric copper(II) nitrate molecules.[6][11] In the vapour phase, the molecule features two bidentate nitrate ligands.[12]
Hydrated copper(II) nitrate[edit]
Five hydrates have been reported: the monohydrate (Cu(NO3)2·2H2O),[2] the sesquihydrate (Cu(NO3)2·1.5H2O),[13] the hemipentahydrate (Cu(NO3)2·2.5H2O),[14] a trihydrate (Cu(NO3)2·3H2O),[15] and a hexahydrate ([Cu(OH2)6](NO3)2.[16] The hexahydrate is interesting because the Cu–O distances are all equal, not revealing the usual effect of Jahn-Teller distortion that is otherwise characteristic of octahedral Cu(II) complexes. This non-effect is attributed to the strong hydrogen bonding that limits the elasticity of the Cu-O bonds.
Applications[edit]
Copper(II) nitrate finds a variety of applications, the main one being its conversion to copper(II) oxide, which is used as catalyst for a variety of processes in organic chemistry. Its solutions are used in textiles and polishing agents for other metals. Copper nitrates are found in some pyrotechnics.[7] It is often used in school laboratories to demonstrate chemical voltaic cell reactions. It is a component in some ceramic glazes and metal patinas.
Organic synthesis[edit]
Copper nitrate, in combination with acetic anhydride, is an effective reagent for nitration of aromatic compounds, known as the Menke nitration.[17]
Hydrated copper nitrate adsorbed onto clay affords a reagent called «Claycop». The resulting blue-colored clay is used as a slurry, for example for the oxidation of thiols to disulfides. Claycop is also used to convert dithioacetals to carbonyls.[18] A related reagent based on montmorillonite has proven useful for the nitration of aromatic compounds.[19]
Electrowinning[edit]
Copper(II) nitrate may also be used for copper electrowinning on small scale with a ammonia (NH3) as a byproduct.[20]
Naturally occurring copper nitrates[edit]
No mineral of the ideal Cu(NO3) formula, or the hydrates, are known. Likasite, Cu3(NO3)(OH)5·2H2O and buttgenbachite, Cu19(NO3)2(OH)32Cl4·2H2O are related minerals.[21][22]
Natural basic copper nitrates include the rare minerals gerhardtite and rouaite, both being polymorphs of Cu2(NO3)(OH)3.[23][24][25] A much more complex, basic, hydrated and chloride-bearing natural salt is buttgenbachite.[22][25]
References[edit]
- ^ a b Wallwork, S. C.; Addison, W. E. (1965). «526. The crystal structures of anhydrous nitrates and their complexes. Part I. The α form of copper(II) nitrate». J. Chem. Soc. 1965: 2925–2933. doi:10.1039/JR9650002925.
- ^ a b c Troyanov, S. I.; Morozov, I. V.; Znamenkov, K. O.; Yu; Korenev, M. (1995). «Synthesis and X-Ray Structure of New Copper(II) Nitrates: Cu(NO3)2·H2O and β-modification of Cu(NO3)2«. Z. Anorg. Allg. Chem. 621 (7): 1261–1265. doi:10.1002/zaac.19956210727.
- ^ a b Perrys’ Chem Eng Handbook, 7th Ed
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ Pass and Sutcliffe (1968). Practical Inorganic Chemistry. London: Chapman and Hall.
- ^ a b c d e f Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 1190. ISBN 978-0-08-037941-8.
- ^ a b c H.Wayne Richardson «Copper Compounds» Ullmann’s Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_567.
- ^ Gysling, Henry J. (1979). «Coordination Complexes of Copper(I) Nitrate». Inorganic Syntheses. Inorganic Syntheses. Vol. 19. pp. 92–97. doi:10.1002/9780470132500.ch19. ISBN 9780470132500.
- ^ Addison, C. C.; Logan, N.; Wallwork, S. C.; Garner, C. D. (1971). «Structural Aspects of Co-ordinated Nitrate Groups». Quarterly Reviews, Chemical Society. 25 (2): 289. doi:10.1039/qr9712500289.
- ^ Duffin, B.; Wallwork, S. C. (1966). «The crystal structure of anhydrous nitrates and their complexes. II. The 1:1 copper(II) nitrate-nitromethane complex». Acta Crystallographica. 20 (2): 210–213. doi:10.1107/S0365110X66000434.
- ^ Addison, C. C.; Hathaway, B. J. (1958). «628. The vapour pressure of anhydrous copper nitrate, and its molecular weight in the vapour state». J. Chem. Soc.: 3099–3106. doi:10.1039/JR9580003099.
- ^ LaVilla, R. E.; Bauer, S. H. (1963). «The Structure of Gaseous Copper(II) Nitrate as Determined by Electron Diffraction». J. Am. Chem. Soc. 85 (22): 3597–3600. doi:10.1021/ja00905a015.
- ^ Dornberger-Schiff, K.; Leciejewicz, J. (1958). «Zur Struktur des Kupfernitrates Cu(NO3)2.1.5H2O». Acta Crystallogr. 11 (11): 825–826. doi:10.1107/S0365110X58002322.
- ^ Morosin, B. (1970). «The crystal structure of Cu(NO3)2.2.5H2O». Acta Crystallogr. B26 (9): 1203–1208. doi:10.1107/S0567740870003898.
- ^ J. Garaj, Sbornik Prac. Chem.-Technol. Fak. Svst., Cskosl. 1966, pp. 35–39.
- ^ Zibaseresht, R.; Hartshorn, R. M. (2006). «Hexaaquacopper(II) dinitrate: absence of Jahn-Teller distortion». Acta Crystallogr. E. 62: i19–i22. doi:10.1107/S1600536805041851.
- ^ Menke J.B. (1925). «Nitration with nitrates». Recueil des Travaux Chimiques des Pays-Bas. 44: 141. doi:10.1002/recl.19250440209.
- ^ Balogh, M. «Copper(II) Nitrate–K10 Bentonite Clay» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289X.
- ^ Collet, Christine (1990). «Clays Direct Aromatic Nitration». Angewandte Chemie International Edition in English. 29 (5): 535–536. doi:10.1002/anie.199005351.
- ^ Oishi, Tetsuo; Koyama, Kazuya; Konishi, Hirokazu; Tanaka, Mikiya; Lee, Jae-Chun (November 2007). «Influence of ammonium salt on electrowinning of copper from ammoniacal alkaline solutions». Electrochimica Acta. 53 (1): 127–132. doi:10.1016/j.electacta.2007.06.024.
- ^ «Likasite». www.mindat.org.
- ^ a b «Buttgenbachite». www.mindat.org.
- ^ «Gerhardtite». www.mindat.org.
- ^ «Rouaite». www.mindat.org.
- ^ a b International Mineralogical Association (21 March 2011). «List of Minerals». www.ima-mineralogy.org.
External links[edit]
- National Pollutant Inventory – Copper and compounds fact sheet
- ICSC Copper and compounds fact sheet
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
| Нитрат меди(II) | |
  |
|
| Систематическое название |
Нитрат меди(II) |
|---|---|
| Другие названия |
Медь азотнокислая |
| Химическая формула |
Cu(NO3)2 |
| Внешний вид |
Бесцветные кристаллы (безводный) |
| Свойства | |
| Молярная масса |
безводный: 187,55 г/моль; |
| Температура плавления |
безводный: 255 °C[1]; |
| Температура разложения |
безводный: 170 °C |
| Плотность |
безводный: 3,05 г/см³; |
| Растворимость в воде |
124,7 г/100 мл |
| Токсикологические данные | |
| LD50 |
тригидрат: 940 мг/кг |
| Структура | |
| Кристаллическая решётка |
безводный: ромбическая; |
| Термодинамические свойства | |
| Стандартная энтальпия образования |
безводный: −310 кДж/моль; |
| Стандартная молярная энтропия |
+192 Дж/(К·моль) |
| Стандартная энергия образования Гиббса |
−117 кДж/моль |
| Классификация | |
| Регистрационный номер CAS |
10031-43-3 |
| Регистрационный номер EC |
221-838-5 |
| Безопасность | |
| R-фразы |
R8, R22, R34 |
| S-фразы |
S17, S26, S36/37/39, S45, S60 |
| H-фразы |
H272, H314, H318, H302 |
| P-фразы |
P221, P210, P303+P361+P353, P305+P351+P338, P405, P501 |
|
Символы опасности |
|
|
Символы опасности СГС |
|
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
Нитра́т ме́ди(II) — неорганическое вещество с формулой 
Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Разложение
- 3.2 Гидролиз
- 3.3 Обменные реакции
- 3.4 Прочие реакции
- 4 Получение
- 5 Применение
- 6 Токсичность
- 7 Примечания
Нахождение в природе[править | править вики-текст]
Нитрат меди(II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Герхардтит[2] | Руаит[3] | |
|---|---|---|
| Состав | Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства[править | править вики-текст]
Безводный нитрат меди(II) при нормальных условиях — твердое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО[4].
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов[5]:
- Cu(NO3)2·6H2O: триклинная сингония, пространственная группа P1, а = 0,591 нм, b = 0,777 нм, с = 0,543 нм, α = 97,65°, β = 93,88°, γ = 72,53°, Z = 1.
- Cu(NO3)2·3H2O: ромбическая сингония, пространственная группа Pmn21, а = 1,12 нм, b = 0,505 нм, с = 0,528 нм, Z = 4.
- Cu(NO3)2·2,5H2O: моноклинная сингония, пространственная группа I2/a, а = 1,64539 нм, b = 0,49384 нм, с = 1,59632 нм, β = 93,764°, Z = 8.
- Cu(NO3)2·1,5H2O: моноклинная сингония, пространственная группа C2/c, а = 2,22 нм, b = 0,490 нм, с = 1,54 нм, β = 48°, Z = 8.
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C[6].
Химические свойства[править | править вики-текст]
Разложение[править | править вики-текст]
Нитрат меди(II) при нагревании разлагается с образованием оксида меди(II) и диоксида азота:
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
Гидролиз[править | править вики-текст]
Нитрат меди(II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Катион тетрааквамеди(II) подвергается обратимому гидролизу:
В упрощённом виде:
Обменные реакции[править | править вики-текст]
В водных растворах нитрат меди(II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)
с фосфатом натрия (выпадает синий осадок)
с жёлтой кровяной солью (выпадает красный осадок)
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
с азидами щелочных металлов (выпадает коричневый осадок азида меди(II))
Прочие реакции[править | править вики-текст]
Нитрат меди(II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди(I):
Нитрат меди(II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
Получение[править | править вики-текст]
Нитрат меди(II) может быть получен растворением в азотной кислоте металлической меди, оксида меди(II) или гидроксида меди(II):
Безводный нитрат меди(II) может быть получен при взаимодействии меди с тетраоксидом диазота (реакция ведётся при 80 °C в этилацетате):
Применение[править | править вики-текст]
Нитрат меди(II) используют для получения чистого оксида меди(II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей[5].
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»)[7].
Токсичность[править | править вики-текст]
Нитрат меди(II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — LC50 для рыб 0,29 мг/л в течение 96 ч.[8]
Примечания[править | править вики-текст]
- ↑ При быстром нагревании или избыточном давлении.
- ↑ Герхардтит на webmineral.com. Архивировано из первоисточника 2 мая 2012.
- ↑ Руаит на webmineral.com. Архивировано из первоисточника 2 мая 2012.
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 147. — 637 с. — ISBN 978-5-358-01303-2.
- ↑ 1 2 Нитрат меди на xumuk.ru. Архивировано из первоисточника 2 мая 2012.
- ↑ Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 104. — 685 с. — ISBN 5-7107-8085-5.
- ↑ Menke J. B. (1925). «Nitration with nitrates». Recueil des Travaux Chimiques des Payes-Bas 44: 141.
- ↑ Merck Safety Data Sheet — Copper(II) nitrate trihydrate (pdf)
| |
|---|
|
Азид меди(I) (Cu(N3)) • Азид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодаты меди(II) • Полииодиды меди(II) (CuIn) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Дисульфид меди(II) (CuS2) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Тиоцианат меди(I) (CuSCN) • Тиоцианат меди(II) (Cu(SCN)2) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) • |
| |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат бериллия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |
| Нитрат меди (II) | |
|---|---|
 |
|
| Систематическое название | Нитрат меди (II) |
| Другие названия | Медь азотнокислая |
| Химическая формула | Cu(NO3)2 |
| Внешний вид | Бесцветные кристаллы (безводный) Голубые кристаллы (кристаллогидраты) |
| Молярная масса | безводный: 187,57 г/моль; тригидрат: 241.63 г/моль; гексагидрат: 295,69 г/моль |
| Температура плавления | безводный: 255 °C; тригидрат: 114,5 °C; гексагидрат: 24,4 °C |
| Температура разложения | безводный: 170 °C |
| Плотность | безводный: 3,05 г/см³; тригидрат: 2,32 г/см³; гегсагидрат: 2,074 г/см³ |
| Растворимость в воде | 124,7 г/100 мл |
| LD50 | тригидрат: 940 мг/кг |
| Кристаллическая решётка | безводный: ромбическая; тригидрат: ромбическая; гексагидрат: триклинная; 1,5- и 2,5-гидраты: моноклинная |
| Стандартная энтальпия образования | безводный: −310 кДж/моль; тригидрат: −1217 кДж/моль |
| Стандартная молярная энтропия | +192 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −117 кДж/моль |
| ГОСТ | ГОСТ 4163-68 |
| Регистрационный номер CAS | 10031-43-3 |
| Регистрационный номер EC | 221-838-5 |
| Пиктограммы опасности |  |
| Пиктограммы опасности СГС |   |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
Нитрат меди (II) — неорганическое вещество с формулой Cu(NO3)2 , является солью двухвалентной меди и азотной кислоты. Безводный нитрат меди (II) представляет собой бесцветные гигроскопичные кристаллы. При поглощении влаги образует кристаллогидраты голубого цвета.
Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Разложение
- 3.2 Гидролиз
- 3.3 Обменные реакции
- 3.4 Прочие реакции
- 4 Получение
- 5 Применение
- 6 Токсичность
Нахождение в природе
Нитрат меди (II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Герхардтит | Руаит | |
|---|---|---|
| Состав | Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства
Безводный нитрат меди (II) при нормальных условиях — твёрдое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО.
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов:
- Cu(NO3)2·6H2O: триклинная сингония, пространственная группа P1, параметры ячейки a = 0,591 нм, b = 0,777 нм, c = 0,543 нм, α = 97,65°, β = 93,88°, γ = 72,53°, Z = 1.
- Cu(NO3)2·3H2O: ромбическая сингония, пространственная группа Pmn21, параметры ячейки a = 1,12 нм, b = 0,505 нм, c = 0,528 нм, Z = 4.
- Cu(NO3)2·2,5H2O: моноклинная сингония, пространственная группа I2/a, параметры ячейки a = 1,64539 нм, b = 0,49384 нм, c = 1,59632 нм, β = 93,764°, Z = 8.
- Cu(NO3)2·1,5H2O: моноклинная сингония, пространственная группа C2/c, параметры ячейки a = 2,22 нм, b = 0,490 нм, c = 1,54 нм, β = 48°, Z = 8.
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C.
Химические свойства
Разложение
Нитрат меди (II) при нагревании разлагается с образованием оксида меди (II) и диоксида азота:
- 2Cu(NO3)2 →>170∘C 2CuO + 4NO2 + O2
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
- 3NO2 + H2O ⟶ 2HNO3 + NO↑
Гидролиз
Нитрат меди (II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
- Cu(NO3)2 + 4H2O ⟶ [Cu(H2O)4]2+ + 2NO3−
Катион тетрааквамеди (II) подвергается обратимому гидролизу:
- [Cu(H2O)4]2+ + H2O ⇄ [Cu(H2O)3(OH)]+ + H3O+ , pKa = 7,34
В упрощённом виде:
- Cu2+ + H2O ⇄ CuOH+ + H+
Обменные реакции
В водных растворах нитрат меди (II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)
- Cu(NO3)2 + 2NaOH ⟶ Cu(OH)2 ↓ + 2NaNO3
с фосфатом натрия (выпадает синий осадок)
- 3Cu(NO3)2 + 2Na3PO4 + 3H2O ⟶ Cu3(PO4)2 ⋅ 3H2O↓ + 6NaNO3
с жёлтой кровяной солью (выпадает красный осадок)
- 2Cu(NO3)2 + K4[Fe(CN)6] ⟶ Cu2[Fe(CN)6]↓ + 4KNO3
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
- Cu(NO3)2 + 4NH3 ⋅ H2O ⟶ [Cu(NH3)4](NO3)2 + 4H2O
с азидами щелочных металлов (выпадает коричневый осадок азида меди (II))
- Cu(NO3)2 + 2MN3 →0−10∘C Cu(N3)2 ↓ + 2MNO3 (M = Li, Na)
Прочие реакции
Нитрат меди (II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди (I):
- 4Cu(NO3)2 + 18(NH2OH ⋅ H2O) ⟶ 4CuN3↓ + 9N2O↑ + 12NH3↑ + 27H2O
- 4Cu(NO3)2 + (N2H4 ⋅ H2O) + 4NaOH ⟶ 4CuN3↓ + N2↑ + 4NaN3 + 5H2O
Нитрат меди (II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
- Cu(NO3)2 + N2O4 ⟶ Cu(NO3)2 ⋅ N2O4↓
Получение
Нитрат меди (II) может быть получен растворением в азотной кислоте металлической меди, оксида меди (II) или гидроксида меди (II):
- Cu + 4HNO3 ⟶ Cu(NO3)2 + 2NO2↑ + 2H2O
- CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O
- Cu(OH)2 + 2HNO3 ⟶ Cu(NO3)2 + 2H2O
Безводный нитрат меди (II) может быть получен при взаимодействии меди с тетраоксидом диазота (реакция ведётся при 80 °C в этилацетате):
- Cu + 2N2O4 ⟶ Cu(NO3)2 + 2NO↑
Применение
Нитрат меди (II) используют для получения чистого оксида меди (II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей.
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»).
Токсичность
Нитрат меди (II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — LC50 для рыб 0,29 мг/л в течение 96 ч.
|
Соединения меди |
|---|
|
|
Нитраты |
|---|
|
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Нитрат меди – это неорганическое медьсодержащее соединение. Вещество нашло применение во многих сферах, прежде всего в органическом и неорганическом синтезе в качестве источника добычи меди и её оксидов, ценного катализатора. Раствор нитрата меди – протрава для усиления окраски тканей, используется в сельском хозяйстве, пиротехнике, строительстве.
Содержание
- Что такое нитрат меди, виды, формулы
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение нитрата меди, уравнение
- Применение
- Применение меди нитрата в сельском хозяйстве
- Применение меди нитрата в химии и других сферах
- Опасность нитратов меди, меры предосторожности
- Где купить и сколько стоит
- Заключение
Что такое нитрат меди, виды, формулы
Нитрат меди – это соль амфотерного металла меди и остатка азотной кислоты. Химическая формула:
Cu(NO3)2
За счёт специфического свойства меди (двойственная валентность), она способна в зависимости от условий удерживать возле себя либо 1 либо два атома других элементов. Соответственно, существует две разновидности нитрата меди:
- нитрат меди I – CuNO3;
- нитрат меди II – Cu(NO3).
Однако вариация с единичной валентностью меди является теоретической, т.е. вещество существует в теории, но не было получено на практике. Это связано с вероятной неустойчивостью такого объединения. Поэтому о его качествах рассуждают гипотетически.
В природе чистый нитрат меди не встречается, однако с примесями его находят в минералах. Герхардтит помимо нитрата меди также содержит гидроксилол. Минерал имеет тёмно-зелёную окраску, стеклянный блеск, низкую твёрдость по шкале Мооса, прозрачен. Довольно часто встречается в Италии, Чехии, Украине, Франции.
Нитрат меди в окружающей среде находят в руаитах, отличающихся изумрудным окрасом. Это хрупкое образование, прозрачное, имеет вид пластинчатых кристаллов, обнаруживается значительно реже. Известны месторождения в Африке, Германии.
Физические свойства, внешний вид
Нитрат меди представляет собой мелкие синие кристаллы без вкуса и запаха. Они эффективно растворяются в воде и поглощают влагу из воздуха, образуя кристаллогидраты. Раствор нитрата проявляет кислую среду за счёт обилия катионов H+. Стремительно образует раствор с водой, а также растворителями органической природы: этанол, метанол, летучие ароматические соединениям: фенол, толуол, бензол.
Температура плавления нитрата меди высока и составляет порядка 255 °С при плотности 3,05 г/см3. Термолиз протекает при 170 °С.
Если подвергать водный раствор нитрата кристаллизации, можно выделить гидраты ряда Cu(NO3)2 ∙ хH2O, где х = 6, 3, 2,5 и 1,5. В отличие от других подобных веществ, имеющих связь с водой, нитрат меди объединяется с математически нецелыми частями, формируя реагенты, описываемые формулами Cu(NO3)2 ∙ 2,5H2O и Cu(NO3)2 ∙ 1,5H2O. Свойства меди нитрата, напитавшегося водой, немного отличаются: растворы менее плотные и формируются значительно быстрее.
Химические свойства, реакции
Структурная формула и молекула нитрата меди
Нитрат меди — это высокореактивное вещество. Он вступает во взаимодействие с растворами и твёрдыми формами многих солей, гидроксидами, кислотами. Так, нитрат меди реагирует с едкой щелочью, в ходе реакции формируется гидроксид меди:
Cu(NO3)2 + NaOH → 2NaNO3 + Cu(OH)2↓
Раствор нитрата меди реагирует с фосфатами, в этой реакции выпадает нерастворимый осадок:
3Cu(NO3)2 + 2Na3PO4 → Cu3(PO4)2↓ + 6NaNO3
Нитрат меди реагирует с сероводородом, вступая в реакцию осаждения сульфида чёрного цвета:
Cu(NO3)2 + H2S → CuS↓ + 2HNO3
При прокаливании нитрата запускается реакция термического разложения:
Cu(NO3)2 → 2СuO + 4NO2↑ + О2↑
Если пропускать через раствор нитрата меди электрический ток, наблюдается реакция электролиза:
Cu(NO3)2 + H2O → 2Cu↓ + 4HNO3 + O2↑
В растворе нитрата меди протекает индикаторная реакция выхода аммиаката:
Cu(NO3)2 + 4NH3 → [Cu(NH3)4](NO3)2
Раствор при этом окрашивается в яркий сине-фиолетовый цвет, выдающий присутствие в нём меди.
Нитрат меди реагирует с йодидами, характерна окислительно-восстановительная реакция с выделением чистого йода и смеси нитрата с йодидом:
Cu(NO3)2 + 4NaI → 2CuI + I2 + 4NaNO3
Производство и получение нитрата меди, уравнение
Получение нитрата меди в лаборатории основано на растворении в кислотах металла меди. Типичный синтез показан в уравнении меди реакции:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Нитрат меди растворяется в полярных растворителях, что применяется для получения его из гидроксида:
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O
В промышленных масштабах получение вещества ведется посредством схожих реакций.
Нитрат меди I предположительно можно синтезировать восстановлением раствора нитрата медью Реакция описывается уравнением меди нитрата:
[Cu(NH3)4](NO3)2 + Cu → 2CuNO3 + 4NH3
Применение
Нитрат меди применяется во многих областях. Применение захватывает преимущественно отрасль химии, где нитрат меди выступает как катализатор и реактив для превращения других веществ с медью. В текстильной промышленности – это фиксатор и протрава для прокрашивания тканевых волокон, в пиротехнических изделиях нитрат меди придаёт пламени жёлтый цвет.
Применение меди нитрата в сельском хозяйстве
Применение нитрата меди подавляет развитие болезнетворных микроорганизмов, патогенных грибков за счёт сильной окислительной способности. Вещество разрушает мембраны грибов, нарушает целостность их гиф и предотвращает формирование мицелия. В садоводстве и комнатном цветоводстве нитрат меди в комплексе с другими препаратами защищает растения от плесени и загнивания.
Нитрат меди нацелен на борьбу с такими микозами, как:
- антракноз;
- фитофтороз;
- корневая гниль;
- мучнистая роса;
- ржавчина.
Применение меди нитрата в химии и других сферах
Нитрат меди востребован при получении оксидов меди. Он играет роль реактива, поставляющего основной металл. Кроме того, раствор нитрата – источник медьсодержащих агентов, обладающих выраженной каталитической активностью. При добавлении в смесь уксусного альдегида готовят реагент Менке, необходимых для реакции нитрования органики. Он адсорбируется на глине, а затем измельчается до суспензии, применяемый для окисления тиолов.
Нитрат меди важен для прокраски нитей. Он выступает протравой, позволяющей сохранить пигмент на волокнах надолго. Он не позволяет ему состирываться и выгорать на солнце, надолго фиксирует яркость и естественный цвет.
Опасность нитратов меди, меры предосторожности
Нитрат меди относится к 3 классу опасности (умеренно опасно). При попадании на открытые участки кожи вызывает сильное раздражение. Разъедает кожные покровы, оставляя глубоки ожоги. Вдыхание порошка опасно, поскольку нежная слизистая дыхательных путей повреждается. Провоцирует кашель, иногда повреждает бронхи. При применении нитрата меди необходимо соблюдать меры безопасности: носить защитные перчатки, респиратор и очки. После контакта тщательно мыть руки и споласкивать полость рта, при первых признаках отравления – срочно обратиться к врачу.
Где купить и сколько стоит
Нитрат меди продают заводы-производители. Оптовая цена раствора нитрата меди за 1 л составляет 500 рублей при минимальной закупке 40 литров. Он доступен к покупке в интернет-магазинах по стоимости 600 рублей за 100 г.
Заключение
Нитрат меди – это активная соль, которую из-за особых свойств применяют для синтеза медных реактивов, превращений органики, создания пиротехники. Она необходима для защиты растительности от грибковых заболеваний, окраски текстиля. Вещество опасно, работать с ним следует в специальной одежде.
Читайте также:
- Гидроксиды меди: виды, свойства, применение
- Сульфат меди Е519: свойства, применение, вред и польза
- Нитрат алюминия: свойства, реакции, применение
- Сульфид алюминия: свойства, реакции, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…












![mathsf{Cu(NO_3)_2 + 4 H_2O longrightarrow [Cu(H_2O)_4]^{2+} + 2 NO_3^-}](https://web.archive.org/web/20150402194817im_/https://upload.wikimedia.org/math/b/1/7/b17d2c8ac25770f6a1118d2eac5a980a.png)
![mathsf{[Cu(H_2O)_4]^{2+} + H_2O rightleftarrows [Cu(H_2O)_3(OH)]^+ + H_3O^+} , pK_a = 7,34](https://web.archive.org/web/20150402194817im_/https://upload.wikimedia.org/math/e/e/a/eead5a428babd744e9232a27f5050cea.png)



![mathsf{2 Cu(NO_3)_2 + K_4[Fe(CN)_6] longrightarrow Cu_2[Fe(CN)_6] downarrow + 4 KNO_3}](https://web.archive.org/web/20150402194817im_/https://upload.wikimedia.org/math/8/4/0/8408d28d195929764d7df9e667931f19.png)
_2 + 4 H_2O}](https://web.archive.org/web/20150402194817im_/https://upload.wikimedia.org/math/2/1/2/212c0a3b0b768c3637db974ea52959fc.png)