Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
В физических науках некоторые свойства смесей относятся к мольной доле или мольному проценту одного из компонентов смеси. Моль представляет количество вещества, но относится к числу атомов или молекул, а не к массе или объему. В частности, 1 моль представляет 6, 022 × 10 23 атомов или молекул вещества. Вы рассчитываете число молей, деля массу вещества на атомный или молекулярный вес вещества. Затем вы находите мольную долю, деля моли одного вещества в смеси на общее число молей всех веществ в смеси.
-
Определить массу
-
Рассчитать молекулярный вес
-
Разделите массу на молекулярный вес
-
Рассчитать процент молей
-
Мольные доли для всех веществ в смеси должны составлять до 100 процентов. В примере 10 г NaCl в сочетании с 100 г воды мольная доля NaCl и H2O составляла 2, 99 и 97, 01 = 100.
Разница между «молекулярной массой» или «формульной массой» представляет собой формальность, которая различает соединения с ковалентными и ионными связями. Однако на практике вы рассчитываете молекулярные и формульные веса одинаково.
Определите массу всех химических веществ в смеси. Если смесь уже приготовлена, эта информация должна быть предоставлена. Если вы готовите смесь самостоятельно, запишите массу в граммах каждого вещества. Например, рассмотрим раствор, приготовленный путем объединения 10 г хлорида натрия (NaCl) и 100 мл или 100 г воды (H2O). Если смесь готовится с использованием неметрических измерений, таких как унции, конвертируйте в единицы граммов с помощью онлайн-калькулятора.
Рассчитайте веса формул или молекулярные веса всех компонентов смеси, умножив число атомов каждого типа в формуле на соответствующий атомный вес. Проверьте периодическую таблицу элементов на атомный вес. Например, NaCl содержит один атом натрия и один атом хлорида с атомными весами 22, 99 и 35, 45 соответственно. Следовательно, вес формулы NaCl составляет (1 х 22, 99) + (1 х 35, 45) = 58, 44. H2O содержит один атом водорода и один атом кислорода с атомными весами 1, 01 и 16, 00 соответственно. Это дает воде молекулярный вес (2 х 1, 01) + (1 х 16, 00) = 18, 02.
Определите количество молей каждого вещества, разделив его массу в граммах на формулу или молекулярную массу. В этом случае 10 г NaCl представляет 10 ÷ 58, 44 = 0, 171 моль NaCl, а 100 г воды представляет 100 ÷ 18, 02 = 5, 55 моль H2O.
Рассчитайте мольный процент одного из компонентов, разделив его число молей на общее число молей всех веществ и умножив результат на 100. В случае 0, 171 моля NaCl и 5, 55 молей H2O, мольная доля NaCl становится 0, 171 ÷ (0, 171 + 5, 55) х 100 = 2, 99 процента. Мольная доля воды становится 5, 55 ÷ (5, 55 + 0, 171) = 97, 01 процента.
подсказки
From Wikipedia, the free encyclopedia
In chemistry, the mole fraction or molar fraction (xi or χi) is defined as unit of the amount of a constituent (expressed in moles), ni, divided by the total amount of all constituents in a mixture (also expressed in moles), ntot.[1] This expression is given below:
The sum of all the mole fractions is equal to 1:
The same concept expressed with a denominator of 100 is the mole percent, molar percentage or molar proportion (mol%).
The mole fraction is also called the amount fraction.[1] It is identical to the number fraction, which is defined as the number of molecules of a constituent Ni divided by the total number of all molecules Ntot. The mole fraction is sometimes denoted by the lowercase Greek letter χ (chi) instead of a Roman x.[2][3] For mixtures of gases, IUPAC recommends the letter y.[1]
The National Institute of Standards and Technology of the United States prefers the term amount-of-substance fraction over mole fraction because it does not contain the name of the unit mole.[4]
Whereas mole fraction is a ratio of moles to moles, molar concentration is a quotient of moles to volume.
The mole fraction is one way of expressing the composition of a mixture with a dimensionless quantity; mass fraction (percentage by weight, wt%) and volume fraction (percentage by volume, vol%) are others.
Properties[edit]
Mole fraction is used very frequently in the construction of phase diagrams. It has a number of advantages:
- it is not temperature dependent (as is molar concentration) and does not require knowledge of the densities of the phase(s) involved
- a mixture of known mole fraction can be prepared by weighing off the appropriate masses of the constituents
- the measure is symmetric: in the mole fractions x = 0.1 and x = 0.9, the roles of ‘solvent’ and ‘solute’ are reversed.
- In a mixture of ideal gases, the mole fraction can be expressed as the ratio of partial pressure to total pressure of the mixture
- In a ternary mixture one can express mole fractions of a component as functions of other components mole fraction and binary mole ratios:
Differential quotients can be formed at constant ratios like those above:
or
The ratios X, Y, and Z of mole fractions can be written for ternary and multicomponent systems:
These can be used for solving PDEs like:
or
This equality can be rearranged to have differential quotient of mole amounts or fractions on one side.
or
Mole amounts can be eliminated by forming ratios:
Thus the ratio of chemical potentials becomes:
Similarly the ratio for the multicomponents system becomes
[edit]
Mass fraction[edit]
The mass fraction wi can be calculated using the formula
where Mi is the molar mass of the component i and M̄ is the average molar mass of the mixture.
Molar mixing ratio[edit]
The mixing of two pure components can be expressed introducing the amount or molar mixing ratio of them 
The amount ratio equals the ratio of mole fractions of components:
due to division of both numerator and denominator by the sum of molar amounts of components. This property has consequences for representations of phase diagrams using, for instance, ternary plots.
Mixing binary mixtures with a common component to form ternary mixtures[edit]
Mixing binary mixtures with a common component gives a ternary mixture with certain mixing ratios between the three components. These mixing ratios from the ternary and the corresponding mole fractions of the ternary mixture x1(123), x2(123), x3(123) can be expressed as a function of several mixing ratios involved, the mixing ratios between the components of the binary mixtures and the mixing ratio of the binary mixtures to form the ternary one.
Mole percentage[edit]
Multiplying mole fraction by 100 gives the mole percentage, also referred as amount/amount percent [abbreviated as (n/n)% or mol %].
Mass concentration[edit]
The conversion to and from mass concentration ρi is given by:
where M̄ is the average molar mass of the mixture.
Molar concentration[edit]
The conversion to molar concentration ci is given by:
where M̄ is the average molar mass of the solution, c is the total molar concentration and ρ is the density of the solution.
Mass and molar mass[edit]
The mole fraction can be calculated from the masses mi and molar masses Mi of the components:
Spatial variation and gradient[edit]
In a spatially non-uniform mixture, the mole fraction gradient triggers the phenomenon of diffusion.
References[edit]
- ^ a b c IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «amount fraction». doi:10.1351/goldbook.A00296
- ^ Zumdahl, Steven S. (2008). Chemistry (8th ed.). Cengage Learning. p. 201. ISBN 978-0-547-12532-9.
- ^ Rickard, James N.; Spencer, George M.; Bodner, Lyman H. (2010). Chemistry: Structure and Dynamics (5th ed.). Hoboken, N.J.: Wiley. p. 357. ISBN 978-0-470-58711-9.
- ^ Thompson, A.; Taylor, B. N. (2 July 2009). «The NIST Guide for the use of the International System of Units». National Institute of Standards and Technology. Retrieved 5 July 2014.

Ответ:
Предупреждение! Длинный ответ Процент молей — это процентная доля молей определенного компонента от общего числа молей в смеси.
Объяснение:
МОЛЬНАЯ ДОЛЯ
Давайте начнем с определения мольной доли.
Мольная доля # Ци # (греческая буква chi) — это число молей данного компонента смеси, деленное на общее число молей в смеси.
#n_t = n_a + n_b + n_c +… #, где
# N_T # = общее количество родинок
# N_A # = моли компонента а
# N_B # = моли компонента b
# N_C # = моли компонента с
Мольная доля компонента А составляет
#chi_a = n_a / n_t #
Если система состоит только из двух компонентов, один компонент является растворителем, а другой — растворенным веществом.
Более распространенный компонент, растворитель, обычно называется компонентом 1, а растворенное вещество называется компонентом 2.
# chi_1 = n_1 / n_t #
# chi_2 = n_2 / n_t #, где
#n_t = n_1 + n_2 #
Сумма мольных долей для каждого компонента в растворе равна 1. Для раствора, содержащего два компонента, растворенное вещество и растворитель, # chi_1 + chi_2 = 1 #
МОЛЕВОЙ ПРОЦЕНТ
Моль процентов равно мольной доле для компонента, умноженной на 100%
моль% a = # Chi_a # × 100 %
Сумма молярных процентов для каждого компонента в растворе равна 100%.
Для раствора, содержащего два компонента, растворенное вещество и растворитель, мол.% растворенного вещества + мол.% растворителя = 100%
ПРИМЕР
Каковы мольная доля и мольный процент хлорида натрия и мольная доля и мольный процент воды в водном растворе, содержащем 25,0 г воды и 5,0 г хлорида натрия?
(а) Определите компоненты, составляющие решение.
# «NaCl» # это растворенное вещество и # «Н» _2 «О» # это растворитель.
(б) Рассчитайте родинки каждого компонента.
#n_ «NaCl» = 5,0 цвет (красный) (отмена (цвет (черный) («г NaCl»))) × «1 моль NaCl» / (58,44 цвет (красный) (отмена (цвет (черный) («г NaCl «)))) =» 0,086 моль NaCl «#
#n_ «H O» = 25,0 цвет (красный) (отмена (цвет (черный) («g H» _2 «O»))) × («1 моль H» _2 «O») / (18,02 цвет (красный) (отмена (цвет (черный) («g H» _2 «O»)))) = «1,38 моль H» _2 «O» #
(c) Рассчитайте мольную долю каждого компонента.
#n_t = n_1 + n_2 # = (1,38 + 0,086) моль = 1,46 моль
# chi_2 = n_2 / n_t = (0.086 цвет (красный) (отменить (цвет (черный) («mol»)))) / (1.46 цвет (красный) (отменить (цвет (черный) («mol»)))) = «0.058» #
# chi_1 = n_1 / n_t = (1,38 цвет (красный) (отмена (цвет (черный) («моль»)))) / (1,46 цвет (красный) (отмена (цвет (черный) («моль»)))) = «0,942» #
Примечание: мы могли бы также написать # chi_1 = 1 — chi_2 = 1 — 0,058 = 0,942 #
(d) Рассчитайте мольный процент каждого компонента.
Крот% 2 = # chi_2 × 100% = 0,058 × 100% = «5,8 мол.%» #
Крот% 1 = # chi_1 × 100% = 0,942 × 100% = «94,2 мол.%» #
Примечание: мы могли бы также написать моль% 1 = 100 — моль% 2 = (100 — 5,8)% = 94,2 моль%
Резюме
#chi_ «NaCl» = «0,058; моль% NaCl» = цвет (белый) (ll) «5,8 моль%» #
#chi_ «H O» = 0,942; цвет (белый) (l) «моль% H» _2 «O» цвет (белый) (l) = «94,2 моль%» #
Что значит хиазм? Какой пример? + Пример
Хиазм — это устройство, в котором два предложения написаны друг против друга, полностью изменяя их структуру. Где A — первая повторенная тема, а B встречается дважды. Примерами могут быть «Никогда не позволяйте дураку поцеловать вас или поцелую дурачить вас». Еще один вопрос Джона Кеннеди: «Не спрашивайте, что ваша страна может сделать для вас; спросите, что вы можете сделать для своей страны». Надеюсь это поможет 
Что такое берма и что она представляет? + Пример
Искусственная земляная плотина. Берма — это застроенная полоса земли, которая работает как плотина. Раньше было иное применение для берм, как в зубчатых стенах, но в настоящее время он используется в качестве плотины. Причина, по которой он используется вместо каменной или бетонной плотины, заключается в том, что вы можете сажать на берму, поэтому, по сути, она может быть хорошей частью сада или двора и все же служить цели плотины. Это своего рода крайний пример бермы, на котором нет посаженной растительности (пока).
Что такое дегидратационный синтез и гидролиз? включить пример для каждого, что повлияет на живой организм?
Дегидратационный синтез связывает два мономера путем удаления воды из двух соседних гидроксильных групп (-ОН); Гидролиз противоположен, вставляя воду в полимер, чтобы разбить его на мономеры. Когда ваше тело находится в очереди с инсулином, оно удаляет глюкозу из кровотока и сохраняет ее в виде молекулы гликогена (животного крахмала) — многие глюкозы связаны вместе в цепочку посредством синтеза дегидратации. Когда ваше тело находится в очереди из-за гормона глюкагона, гликоген расщепляется на его глюкозные мономеры посредством гидролиза и попадает в кровоток. Мне нравится этот пример, потому что он иллюстрирует гомеостатич
Важной
характеристикой раствора является его
состав или концентрация компонентов.
Для выражения концентраций растворов
применяются различные способы.
1.
Мольная доля (Хi)
или мольный процент (Хi,
%, мол.%).
Мольная доля –
отношения числа молей данного компонента
к общему числу молей.
2.
Массовая доля (Wi)
или массовый (весовой) процент (Wi,%,
масс.%, вес.%).
Массовая (весовая) доля – отношение
массы данного компонента в растворе к
массе раствора.
.
Массовый (весовой) процент:
а) массовая
(весовая) доля, выраженная в процентах;
б) количество
граммов растворенного вещества в 100 гр.
раствора.
10% по массе
раствор KCl: 10 г. KCl
в 100 гр. раствора или 10 г. KCl
в 90 г. растворителя.
3.
Молярная концентрация (молярность) (Сi)
– число молей растворенного вещества,
содержащееся в 1 литре раствора. [Сi]=
моль/л.
4.
Моляльность (m) – число
молей растворенного вещества в 1000 г.
растворителя. [m]=моль/1
кг. р-ля.
5.
Нормальность (Ni)
– количество грамм-эквивалент
растворенного вещества, содержащееся
в 1 литре раствора. [Ni]=г-экв/моль.
§3. Примеры решения задач.
Пример 1.
Раствор KCl
содержит 250 г KCl в 1000 г
воды. Плотность раствора 1,133 г/см3.
Вырвзить состав раствора:
а) в молях соли на
1 л. раствора (молярность);
б) в молях соли на
1000 г. воды (моляльность);
в) в весовых
процентах (вес.%);
г) в мольных долях
(Хi)
MKCl=39+35,5=
74,5 г/моль
моль
а) Масса раствора
mр-ра=250+1000=1250 г.
Объем раствора
см3
3,36 моль KCl
содержится в 1103,3 см3 раствора
С
содержится в 1000 см3 раствора
моль/л
б) 3,36 моль KCl
содержится, по условию задачи, в 1000 г
воды.
m=3,36
моль/1 кг воды.
в) mр-ра=1250
г.
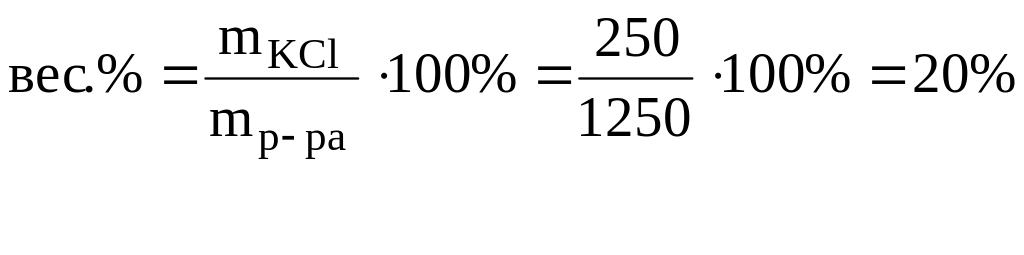
г) nKCl=3,36
моль
моль
Пример 2.
Выразите концентрацию
50% (по весу) водного раствора AgNO3
через молярность, нормальность,
моляльность, и мольную долю. Плотность
раствора при 18С
1,668 г/см3.
По определению
весового процента этот раствор содержит
50 г. AgNO3 в 100 г раствора,
или 50 г AgNO3 в 50 г
воды.
m
(AgNO3)=50 г.
m
(Н2О)=50 г.
m
раствора=100 г.
а) молярность –
число молей растворенного вещества в
1 литре раствора.
М (AgNO3)=
108+14+16.3=170 г/моль
моля
см3
0,29 моля AgNO3
содержится в 59,95 см3 раствора
С молей AgNO3
содержится в 1000 см3 раствора
моль/л
б) нормальность –
число грамм-эквивалент растворенного
вещества в 1 л. раствора.
Нормальность можно
рассчитать, зная молярность и валентность
металла (для солей), количество атомов
водорода, входящих в кислоту или
количество групп ОН (для оснований).
В данном случае
валентность серебра – единица, значит
для AgNO3, нормальность
будет равна молярности.
N=С=4,84
г-экв/л.
в) моляльность –
количество молей растворенного вещества
в 1 кг. растворителя.
0,29 моля AgNO3
содержится в 50 г воды
m
молей AgNO3 содержится
в 1000 г воды
моль/1 кг. воды
г) мольная доля –
отношение числа молей данного компонента
к сумме чисел молей всех компонентов
раствора.
Рассчитаем число
молей воды:
молей.
Пример 3.
Выразите концентрацию
водного раствора через весовой процент,
моляльность, мольную долю и нормальность.
Концентрация водного раствора AlCl3
равна 1,185 моль/л, а его плотность при
20С составляет 1,129
моль/л.
При решении задач
на пересчет концентраций выпишите
сначала три массы: массу раствора, массу
растворенного вещества и массу
растворителя.
М (AlCl3)=27+35,5.3=133,5
моль/л
В данной задаче в
качестве способа выражения концентраций
задана молярность, т.е. число молей
растворенного вещества в 1 л. раствора.
Отсюда
mраствора=Vраствора.раствора=1000.1,129=1129
г.
m
(AlCl3)=1,185.133,5=158,2
г.
m
(H2O)=1129-158,2=970,8
г.
а) весовой процент
б) моляльность
1,185 молей AlCl3
содержится в 970,8 г воды
m
молей AlCl3 содержится
в 1000 г воды
моль/1 кг. растворителя
в) мольная доля
молей
г) нормальность
Поскольку валентность
алюминия равна трем, то нормальность
будет равна 3 молярности, т.е.
N=3C=3.1,185=3,56
г-экв/л.
Пример 4.
Выразите концентрацию
водного раствора Cu(NO3)2
через весовые проценты, молярность,
мольную долю и нормальность, если
моляльность этого раствора равна 1,33
моль/1 кг. воды и плотность при 22С
составляет 1,189 г/см3.
M
(Cu(NO3)2)=64+2.(14+16.3)=188
г/моль
В данной задаче,
в качестве способа выражения концентраций
задана моляльность, т.е. число молей
растворенного вещества в 1 кг. растворителя,
значит
m(H2O)=1000
г.
г.
mраствора=
1000+250,04=1250,04 г.
а)

б) Молярность
см3
1,33 моля Cu(NO3)2
содержится в объеме 1051,3 см3
С молей Cu(NO3)2
содержится в объеме 1000 см3
моль/л
в) мольная доля
молей
г) нормальность
Поскольку валентность
меди равна двум, то нормальность будет
равна 2 молярности, т.е. N=2C=2.1,27=2,54
г-экв/л.
Пример 5.
Выразите концентрацию
водного раствора через весовой процент,
молярность, моляльность и нормальность,
если мольная доля HCl в
этом растворе равна 0,05, а плотность
раствора при 18С
составляет 1,05 г/см3.
а) весовой процент
Примем массу
раствора – 100 гр.
Массу HCl
обозначим через Y, тогда
масса воды будет равна 100-Y.
Запишем, известную
нам мольную долю, учтя все введенные
обозначения и то, что M(HCl)=1+35,5
=36,5 г/моль, а M(H2O)=18
г/моль.

0,05.(3650-18,5Y)=18Y
Y=9,64
Поскольку весовой
процент можно определить как количество
граммов растворенного вещества в 100 г.
раствора, то вес.% в этой задаче будет
равен 9,64%.
б) молярность
см3
моля
0,26 моля HCl
содержится в объеме 95,24 см3
С молей HCl
содержится в объеме 1000 см3
моль/л
в) моляльность
m(H2O)=100-9,64=90,36
г.
0,26 моля HCl
содержится в 90,36 г. воды
m
молей HCl содержится в 1000
г. воды
моль/1 кг.воды
г) нормальность
Поскольку соляная
кислота – одноосновная, т.е. содержит
один атом водорода, то нормальность
будет равна молярности. N=С=2,74
г-экв/л.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #



![{displaystyle {begin{aligned}x_{1}&={frac {1-x_{2}}{1+{frac {x_{3}}{x_{1}}}}}\[2pt]x_{3}&={frac {1-x_{2}}{1+{frac {x_{1}}{x_{3}}}}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e838685d60e290137de8c0667aee0c140ff2ba4c)


![{displaystyle {begin{aligned}X&={frac {x_{3}}{x_{1}+x_{3}}}\[2pt]Y&={frac {x_{3}}{x_{2}+x_{3}}}\[2pt]Z&={frac {x_{2}}{x_{1}+x_{2}}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e2933fbbf166772a7fc0427a243e43b4b6a7e8f5)








![{displaystyle {begin{aligned}x_{1}&={frac {1}{1+r_{n}}}\[2pt]x_{2}&={frac {r_{n}}{1+r_{n}}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b0910f08dbb3df422878f3a5bb41340050aacea)


![{displaystyle {begin{aligned}x_{i}&={frac {rho _{i}}{rho }}{frac {bar {M}}{M_{i}}}\[3pt]Leftrightarrow rho _{i}&=x_{i}rho {frac {M_{i}}{bar {M}}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/822cf1892820c32533fad4d27991f30ff9b57fb2)
![{displaystyle {begin{aligned}c_{i}&=x_{i}c\[3pt]&={frac {x_{i}rho }{bar {M}}}={frac {x_{i}rho }{sum _{j}x_{j}M_{j}}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e0b7eefd89c9164755e2df84abc56c0333dd2b6)



