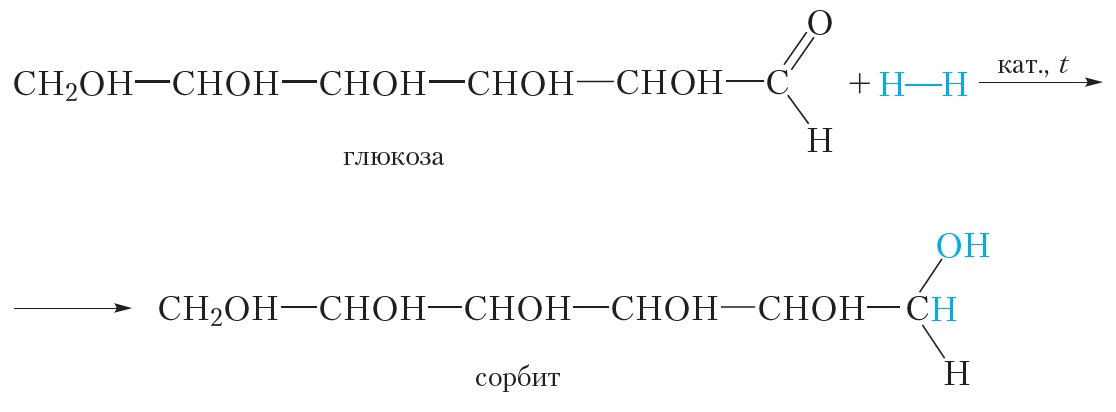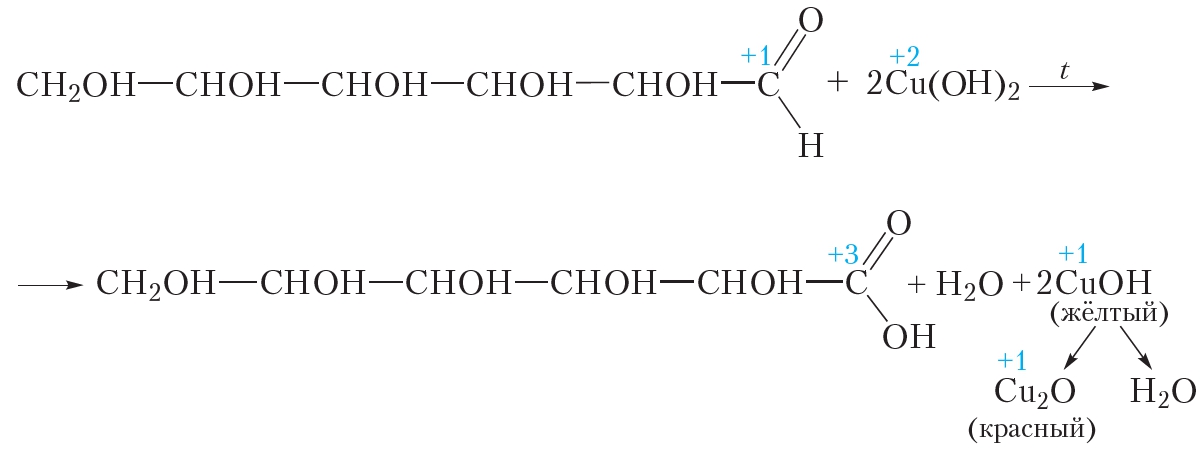Химические свойства глюкозы
В молекуле глюкозы имеются альдегидная и гидроксильные группы, поэтому для неё характерны химические свойства как альдегидов, так и многоатомных спиртов.
Сначала рассмотрим реакции с участием альдегидной группы молекулы глюкозы. Поскольку альдегидная группа имеется только в линейной форме глюкозы, в уравнениях реакции будем записывать формулу глюкозы в линейной форме.
1. Присоединение водорода. Восстановление
Альдегидная группа глюкозы может присоединить молекулу водорода. Эта реакция сопровождается разрывом π-связи между атомами углерода и кислорода альдегидной группы:
Образующийся шестиатомный спирт называется сорбит. Он имеет сладкий вкус и используется в качестве заменителя сахара.
В результате присоединения водорода молекула глюкозы восстанавливается, поэтому реакцию с водородом также называют реакцией восстановления.
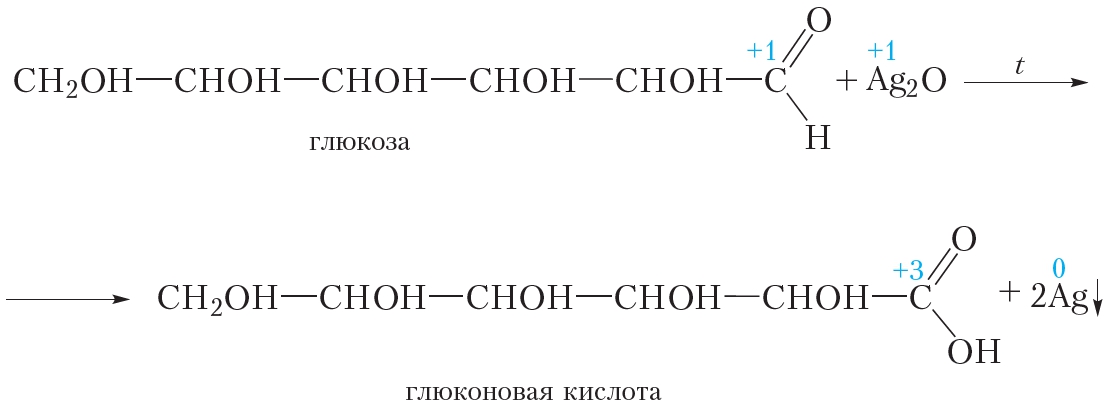
2. Окисление аммиачным раствором оксида серебра
Глюкоза даёт качественную реакцию на альдегиды, восстанавливая серебро из аммиачного раствора оксида серебра (реакция «серебряного зеркала»). При этом альдегидная группа молекулы глюкозы окисляется до карбоксильной:
В результате реакции образуется глюконовая кислота.
3. Взаимодействие с гидроксидом меди(II)
Взаимодействие с гидроксидом меди(II) является качественной реакцией как на многоатомные спирты, так и на альдегиды. Глюкоза проявляет свойства как многоатомных спиртов, так и альдегидов. Рассмотрим, что будет наблюдаться при взаимодействии глюкозы с гидроксидом меди(II). Смешаем в пробирке растворы щёлочи и сульфата меди(II). При этом выпадает голубой осадок гидроксида меди(II):
При добавлении в пробирку водного раствора глюкозы происходит растворение гидроксида меди(II) и образуется прозрачный раствор васильково-синего цвета. Такой же эффект наблюдается при действии многоатомных спиртов на свежеосаждённый гидроксид меди(II). Как и в случае многоатомных спиртов, растворение гидроксида меди(II) при взаимодействии с глюкозой происходит вследствие образования растворимого в воде комплексного соединения (§ 25). Эта реакция является качественной реакцией на многоатомные спирты.
В то же время взаимодействие глюкозы с гидроксидом меди(II) имеет интересную особенность, которая позволяет легко отличить глюкозу от многоатомных спиртов. Нагреем содержимое пробирки на пламени спиртовки. В случае многоатомного спирта васильково-синий раствор закипит, но окраска его не изменится. Проба с глюкозой ведёт себя совершенно иначе. При нагревании в пробирке сначала образуется жёлтый осадок, который затем краснеет. Образующаяся смесь напоминает морковный сок. Уравнение протекающей реакции:

Качественная реакция
на глюкозу с
гидроксидом меди(II)
Красный осадок представляет собой оксид меди(I) Cu2O. В данной реакции гидроксид меди(II) восстанавливается до оксида меди(I), а глюкоза окисляется до глюконовой кислоты.
В описанном эксперименте глюкоза сначала проявляет свойства многоатомного спирта, растворяя свежеосаждённый гидроксид меди(II). При нагревании смеси происходит реакция уже с альдегидной группой глюкозы — ионы меди(II) окисляют её до карбоксильной группы.
4. Спиртовое брожение
Некоторые микроорганизмы, например дрожжи, обладают способностью преобразовывать глюкозу в этиловый спирт. Этот процесс называется спиртовым брожением глюкозы:
5. Молочнокислое брожение
Молочнокислые бактерии обладают способностью преобразовывать глюкозу в молочную кислоту. Этот процесс называется молочнокислым брожением глюкозы:
Молочная кислота является замечательным природным консервантом. Она образуется при скисании молока и содержится в кисломолочных продуктах (простокваша, кефир, творог и др.) которые, в отличие от свежего молока, могут храниться достаточно долго. Наличием молочной кислоты обусловлен кислый вкус этих продуктов. Молочная кислота образуется также в процессах квашения капусты, мочения яблок, силосования зелёных кормов, она препятствует протеканию процессов гниения и позволяет сохранять продукты долгое время.
Глюкоза широко встречается в природе в составе многих овощей и фруктов. Особенно много её в винограде, поэтому глюкозу часто называют виноградным сахаром.
Глюкоза используется в медицине как лекарственный препарат, в частности при ослаблении и интоксикации организма.
В природе глюкоза образуется в зелёных растениях в процессе фотосинтеза:
В промышленности глюкозу получают из целлюлозы и крахмала, подробнее об этом — в следующих параграфах.
В молекуле глюкозы имеются альдегидная и гидроксильные группы, поэтому для неё характерны химические свойства как альдегидов, так и многоатомных спиртов.
Глюкоза даёт качественную реакцию на многоатомные спирты — образование раствора васильково-синего цвета при взаимодействии со свежеосаждённым гидроксидом меди(II).
Глюкоза даёт качественные реакции на альдегидную группу, окисляясь до глюконовой кислоты при нагревании с гидроксидом меди(II) или аммиачным раствором оксида серебра.
Как и альдегиды, глюкоза присоединяет водород. При этом происходит восстановление глюкозы и образуется шестиатомный спирт сорбит.
Под действием бактерий глюкоза подвергается спиртовому брожению с образованием этанола и молочнокислому брожению с образованием молочной кислоты.
2C6H12O6 + Cu(OH)2 ⇒ (C6H11O6)2Cu + 2H2O
Раствор окрашивается в ярко-синий цвет. Глюкоза в этой реакции реагирует как многоатомный спирт:
При нагревании в глюкозе реагирует уже альдегидная группа, глюкоза окисляется до глюконовой кислоты.
2HOСН2-(СНOH)4)-СН=O + Cu(OH)2 ⇒ 2HOСН2-(СНOH)4)-СOOH + Cu2O↓ + 2H2O
Сахароза реагирует, как многоатомный спирт:
C12H22O5 + Cu(OH)2 ⇒ (C12H20O5)Cu + 2H2O
Образуется синий раствор сахарата меди(II)
Помогите ответить!
1. В пробирку к 3-4 каплям раствора сульфата меди (II) прилейте 2-3 мл раствора гидроксида натрия. К полученному осадку прилейте равный объем раствора глюкозы и смесь взболтайте. Как изменилась окраска раствора? Почему?
2. Нагрейте содержимое пробирки. Какие изменения наблюдаются? О наличии какой функциональной группы в молекуле глюкозы говорит этот опыт? Составьте уравнение реакции окисления глюкозы гидроксидом меди (II).
3. К аммиачному раствору оксида серебра (I), налитому в чистую пробирку, добавьте в два раза меньше раствора глюкозы. Нагрейте смесь осторожно над пламенем спиртовки (нагрев должен быть равномерным и медленным). Объясните наблюдаемое явление.
4. Проверьте, взаимодействует ли глюкоза с фуксинсернистой кислотой (для этого воспользуйтесь несколькими каплями растворов веществ). Объясните результаты опыта.
Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
Глюкоза
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
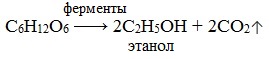
2) Молочнокислое брожение
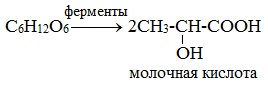
(образуется в организмах высших животных при мышечных сокращениях).
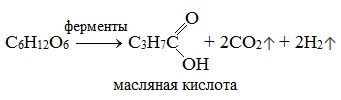
3) Маслянокислое брожение
4) Лимоннокислое брожение
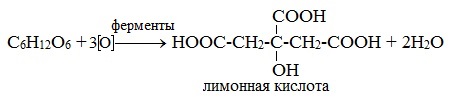
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
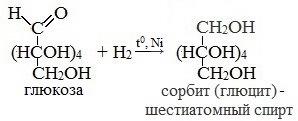
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
1) Окисление бромной водой
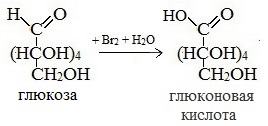
Качественные реакции на глюкозу как альдегид!
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
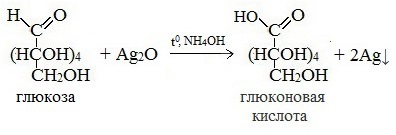
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
3) Окисление гидроксидом меди (II)
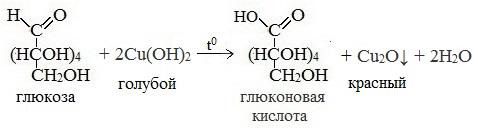
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
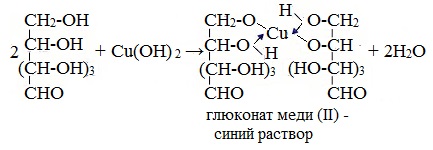
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
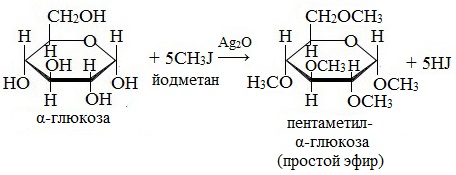
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
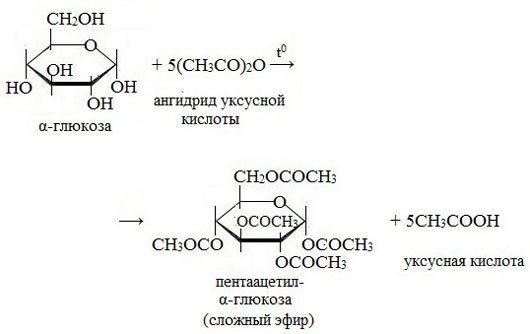
Реакции с участием полуацетального гидроксила
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
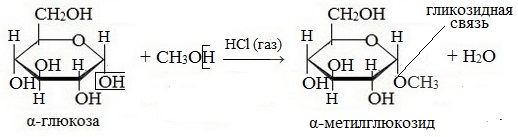
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
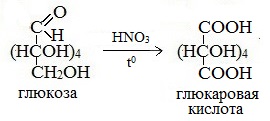
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Углеводы
Моносахариды
Химические свойства глюкозы. Получение, применение
I. Получение глюкозы
1. В промышленности
- Гидролиз крахмала:
(C6H10O5)n + nH2O t,H+→ nC6H12O6
крахмал глюкоза
2. В лаборатории
- Из формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
3. В природе
- Фотосинтез:
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2
4. Другие способы
- Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза глюкоза
C12H22O11 + H2O t,H+→ C6H12O6 + C6H12O6
сахароза глюкоза фруктоза
II. Химические свойства глюкозы
1. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑
2. Свойства альдегидов
1. Реакция серебряного зеркала:
Видео-опыт: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH — глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
Рис. 1 Cu2O↓
3. Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
3. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
|
α — глюкоза |
+ СH3ОН |
HCl(газ)→ |
|
+ H2О |
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
Видео-опыт: «Качественная реакция глюкозы с гидроксидом меди (II)»
Рис. 2. Глюконат меди (II)
4. Реакции окисления
Видео-опыт: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого”
Видео-опыт: “Определение глюкозы в виноградном соке”
Видео-опыт: “Распознавание глюкозы с помощью качественных реакций”
III. Применение
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
IV. Тренажеры
Тренажер №1: “Химические свойства глюкозы”
ЦОРы
Видео: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
Видео: «Качественная реакция глюкозы с гидроксидом меди (II)»
Видео: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого”
Видео: “Определение глюкозы в виноградном соке”
Видео: “Распознавание глюкозы с помощью качественных реакций”