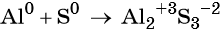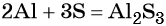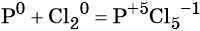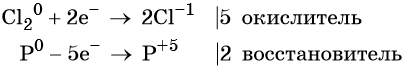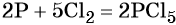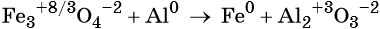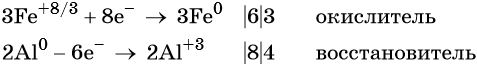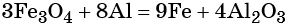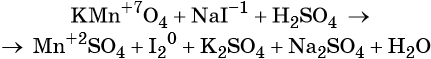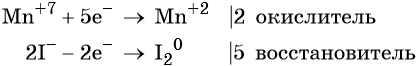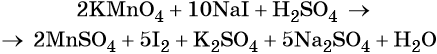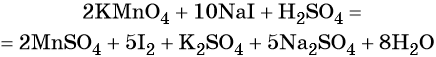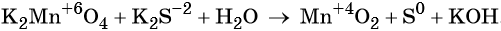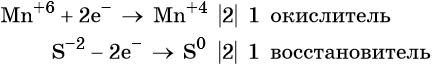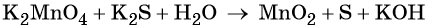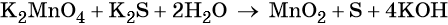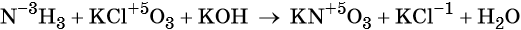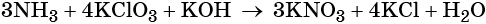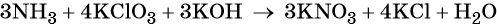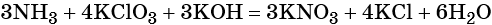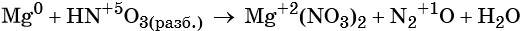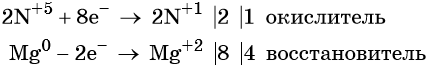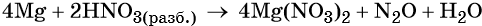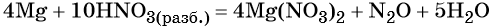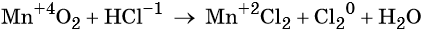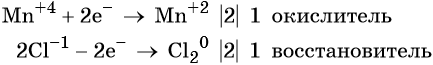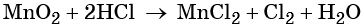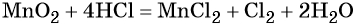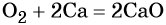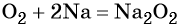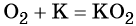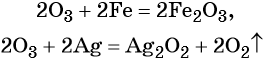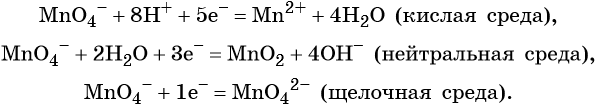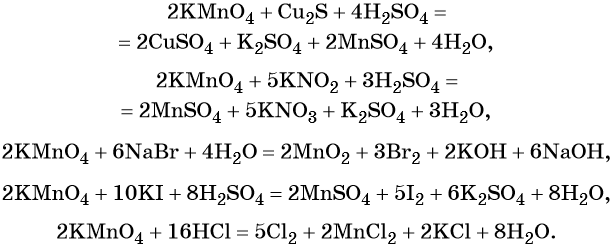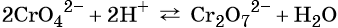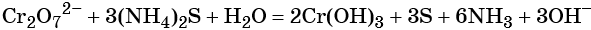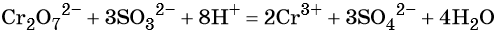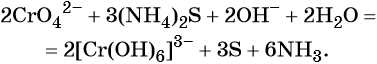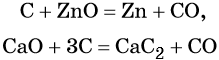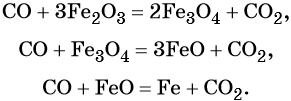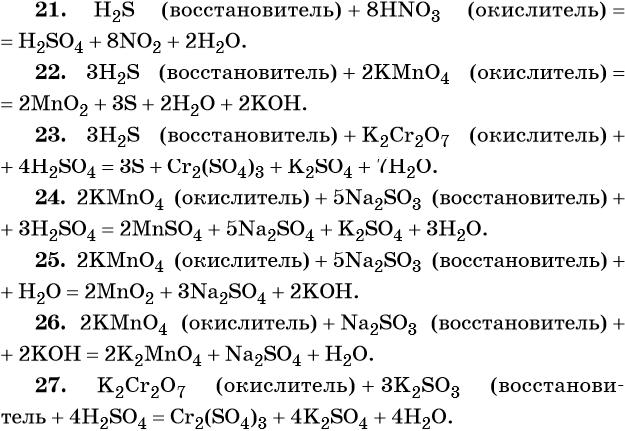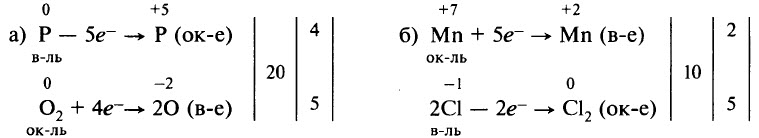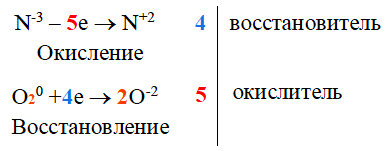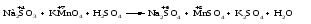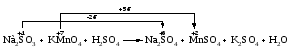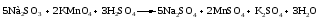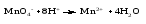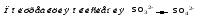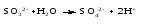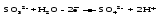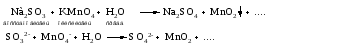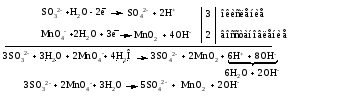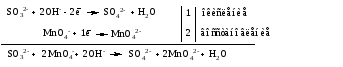Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы
в реакции меди с разбавленной азотной кислотой кислота расходуется на ОВР и на образование нитрата:
HNO3¯+Cu→Cu(NO3)2¯+NO¯+H2O.
1.
HN¯O3+5+Cu¯0→Cu¯(NO3)2+2+N¯O+4+H2O.
2. Составим электронный баланс:
Cu0−2e_→Cu+2|2|×3−окисление;N+5+3e_→N+2|3|×2−восстановление.
3. Переносим полученные коэффициенты в схему реакции: (3) — перед формулами меди и нитрата меди((II)), (2) — перед формулой оксида азота, (2 + 6 = 
8HNO3+3Cu→3Cu(NO3)2+2NO+H2O.
4. Определяем коэффициент перед формулой воды:
8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O.
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Ключевые слова конспекта: окислительно-восстановительные реакции, метод электронного баланса, окисление, восстановление, расстановка коэффициентов.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых изменяются степени окисления элементов вследствие перехода электронов от восстановителя к окислителю. Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Темы, связанные с настоящим конспектом:
- Степень окисления химических элементов
- Окислительно-восстановительные реакции
- Окислители и восстановители
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Рассмотрим составление схем электронного баланса на примере горения фосфора (а) и взаимодействия перманганата калия с концентрированной соляной кислотой (б).
- Запишем схемы реакций, вычислим степени окисления элементов и определим элементы, у которых они меняются:
- Составим схемы, отражающие процессы перехода электронов:
- Определим, какой процесс является окислением, а какой – восстановлением; какой элемент является окислителем, а какой – восстановителем:
- Уравняем число отданных и принятых электронов. Для этого найдём наименьшее общее кратное для числа отданных и числа принятых электронов. В результате деления наименьшего общего кратного на число отданных и принятых электронов находим коэффициенты:
- Перенесём коэффициенты в исходную схему (п. 1), преобразуя её в уравнение реакции:
Перед формулой HCl мы не поставили коэффициент, так как не все ионы Cl– участвовали в окислительно-восстановительном процессе, часть из них участвовала в образовании солей.
В уравнении (б) требуется уравнять количество атомов элементов, не участвующих в окислительно-восстановительном процессе (К, Н, частично Cl). Получаем уравнение:
При правильной расстановке коэффициентов количество атомов кислорода в левой и правой частях уравнения будет одинаково (в случае (б) – 8).
Алгоритм расстановки коэффициентов на примерах
Пример 1. Cu + HNO3 → Cu(NO3)2 + NO + H2O
1) Определяем степени окисления всех элементов;
2) Выбираем те элементы, у которых изменилась степень окисления;
3) Составляем электронный баланс
Число принятых и отданных электронов переносим крест –накрест и сокращаем. Это множители, которые позволяют осуществить закон сохранения: число принятых электронов должно быть равно числу отданных электронов.
Теперь эти множители нужно внести в схему реакции, они должны стать коэффициентами. Перед атомами меди в левой и правой части уравнения нужно поставить коэффициент 3. В этом действии можно не сомневаться, так как медь в левой и правой части встречается только по одному разу.
3Cu + HNO3 → 3Cu(NO3)2 + NO + H2O
А вот с азотом возникает вопрос: к какому из атомов азота относится коэффициент 2? Ответ: к тому, степень окисления которого в уравнении встречается единожды, то есть +2. Ставим коэффициент 2 перед NO.
3Cu + HNO3 → 3Cu(NO3)2 + 2NO + H2O
Дальше сравниваем левую и правую часть схемы и достраиваем коэффициенты в таком порядке: в правой части после выставления коэффициентов из баланса перед всеми атомами азота есть коэффициенты, пересчитаем азот в правой части – 8, ставим этот коэффициент перед азотной кислотой.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + H2O
Теперь в левой части поставлен коэффициент перед водородом, число его атомов 8. Ставим в правую часть перед водой 4.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Осталось сравнить число атомов кислорода в левой и правой части уравнения. 24 = 24.
Если равно – коэффициенты расставлены правильно, если нет – ищем ошибку.
Пример 2. KMnO4 + K2SO3 + H2SO4 → MnSO4 + K2SO4 + H2O
1) Определяем степени окисления всех элементов;
2) Выбираем те элементы, у которых изменилась степень окисления;
3) Составляем электронный баланс
Перед атомами марганца в левой и правой части уравнения нужно поставить коэффициент 2. В этом действии можно не сомневаться, так как марганец в левой и правой части встречается только по одному разу.
2KMnO4 + K2SO3 + H2SO4 → 2MnSO4 + K2SO4 + H2O
С серой возникает вопрос: к какому из атомов серы относится коэффициент 5? К тому, степень окисления которого в уравнении встречается единожды, то есть +4. Ставим коэффициент 5 перед K2SO3.
2KMnO4 + 5K2SO3 + H2SO4 → 2MnSO4 + K2SO4 + H2O
Дальше сравниваем левую и правую часть схемы и достраиваем коэффициенты в таком порядке: калий (в левой части 10+2=12, перед K2SO4 поставим 6.
2KMnO4 + 5K2SO3 + H2SO4 → 2MnSO4 + 6K2SO4 + H2O
Теперь в правой части поставлены коэффициенты перед серой, число её атомов 8. В левой части уже есть коэффициент перед серой 5, не хватает еще 3.
2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + H2O
Сравниваем число атомов водорода. Ставим перед водой 3.
2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + 3H2O
Осталось сравнить число атомов кислорода в левой и правой части уравнения. 35 = 35.
Случаи, когда индекс при химическом элементе
вносится в электронный баланс.
Случай 1. Если формула простого вещества записывается с индексом: NH3 + O2 → NO + H2O
5 ставим перед простым веществом – кислородом,
4 – перед азотом в левой и правой части уравнения,
уравниваем водород, проверяем кислород.
4NH3 + 5O2 = 4NO + 6H2O
Случай 2. Если в молекуле атомы одного элемента соединены между собой (то есть присутствует ковалентная неполярная связь): пероксиды, дисульфиды, тиосульфат, веселящий газ, органические вещества: Cr(OH)3 + H2O2 + KOH –> K2CrO4 + H2O
3 ставим перед пероксидом водорода,
2 – перед хромом в левой и правой части уравнения,
уравниваем калий, потом – водород, проверяем кислород.
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
Случай 3. Если у одного элемента в левой и правой части уравнения есть одинаковый индекс: K2Cr2O7 + K2SO3 + H2SO4 –> Cr2(SO4)3 + K2SO4 + H2O
Перед сульфитом ставим 3, перед хромом в левой и правой части коэффициент не нужен, уравниваем калий (в правой части перед сульфатом калия ставим 4), затем – серу (в левой части перед серной кислотой – 4), водород – перед водой 4, проверяем кислород.
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O
Вы смотрели конспект урока по химии «Метод электронного баланса».
Следующая тема: «Окислители и восстановители».
При
написании уравнений ОВР используют два
метода расстановки коэффициентов: метод
электронного баланса (окислительных
чисел) и метод полуреакций (ионно-молекулярный
метод).
В
методе
электронного баланса
сравнивают степени окисления атомов в
исходных веществах и в продуктах реакции,
при этом руководствуются правилом:
число электронов, отданных восстановителем,
должно равняться числу электронов,
присоединённых окислителем.
Метод
электронного баланса рассмотрим на
примере реакции
Для
расстановки коэффициентов выполняем
следующие действия.
1.
Определяем элементы, атомы которых
изменяют степень окисления:
2.
Находим окислитель и восстановитель в
данной ОВР и пишем отдельно электронные
уравнения процессов окисления и
восстановления:
3.
Уравниваем число электронов в процессе
окисления и восстановления (электронный
баланс):
4.
Коэффициенты 5 и 2 из электронных уравнений
переносим в молекулярное уравнение
ОВР:
5.
Окончательно уравниваем число атомов
каждого элемента в обеих частях
молекулярного уравнения:
-
Составление
уравнений ОВР методом полуреакций
Mетод
полуреакций
основан на составлении уравнений
процессов окисления и восстановления
с помощью ионов и молекул, реально
существующих в растворе. Этот метод
используется для записи ОВР, протекающих
в водных растворах.
Следует
иметь в виду, что в водных растворах
связывание избыточного кислорода и
присоединение его восстановителем
происходит по-разному в кислой, нейтральной
и щелочной средах в соответствии со
следующими правилами:
1) если
исходные вещества полуреакции содержат
больше атомов кислорода, чем продукты
реакции, то в кислых растворах кислород
связывается протонами водорода в воду,
а в нейтральных и в щелочных средах
молекулами воды в гидроксид-ионы:
O2-+2H+
=
H 2O
O2-+HOH
= 2OH—
2) если
исходные вещества полуреакции содержат
меньше атомов кислорода, чем образующие,
то недостаток их восполняется в кислых
и нейтральных растворах за счет молекул
воды, а в щелочных за счет гидроксид-ионов:
H2O
= O2-+2H+
2OH—
=
O2-+
H2O
Используем
метод полуреакций для записи реакции
взаимодействия сульфита натрия с
перманганатом калия в кислой среде.
Для
расстановки коэффициентов выполняем
следующие действия.
1.
Записываем полное ионно-молекулярное
уравнение реакции. При этом, сильные
электролиты записываем в виде ионов, а
слабые электролиты, газы и малорастворимые
вещества – в виде молекул:
2. Записываем
полуреакции окисления и восстановления,
уравниваем число атомов кислорода и
водорода, алгебраическую сумму зарядов
слева и справа в полуреакциях.
Чтобы связать 4
моль атомов кислорода, требуется 8 моль
атомов водорода (процесс идет в кислой
среде):
Уравниваем
алгебраическую сумму зарядов слева и
справа
с помощью определенного числа электронов,
которые участвуют в процессе:
Чтобы получить 1
моль атомов кислорода для окисления
SO32-до
SO42-,
требуется 1 моль молекул H2O
(процесс идет в кислой среде):
Уравниваем
алгебраическую сумму зарядов слева и
справа:
3. Уравниваем число
электронов в полуреакциях окисления и
восстановления с
помощью дополнительных коэффициентов
(как в методе электронного баланса). С
учетом этих коэффициентов записывают
сокращенное ионно-молекулярное уравнение
ОВР:
4. Записываем
молекулярное уравнение ОВР:
Метод
полуреакций позволяет определить все
продукты окислительно-восстановительной
реакции.
Составим
уравнения реакций взаимодействия
сульфита натрия Nа2SO4
с перманганатом калия КМпО4
в нейтральной и щелочной среде.
В
нейтральной среде:
В
щелочной среде:
Лекция
11
Вопросы
11.1
Типичные окислители и восстановители
11.2
Поведение в окислительно-восстановительных
реакциях некоторых типичных окислителей
и восстановителей
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Окислительно-восстановительные реакции.
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав молекул реагирующих веществ:
0 0 +2 -2
2Mg + O2 2MgO,
+5 -2 -1 0
2KClO3 2KCl + 3O2.
Напомним, что степень окисления – это условный заряд атома в молекуле, возникающий исходя из предположения, что электроны не смещены, а полностью отданы атому более электроотрицательного элемента.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью – положительные.
Степень окисления – формальное понятие; в ряде случаев значение степени окисления элемента не совпадает с его валентностью.
Для нахождения степени окисления атомов элементов, входящих в состав реагирующих веществ, следует иметь в виду следующие правила:
1. Степень окисления атомов элементов в молекулах простых веществ равна нулю.
Например:
Mg0, Cu0.
2. Степень окисления атомов водорода в соединениях обычно равна +1.
Например: +1 +1
HCl, H2S
Исключения: в гидридах (соединениях водорода с металлами) cтепень окисления атомов водорода равна –1.
Например:
NaH–1.
3. Степень окисления атомов кислорода в соединениях обычно равна –2.
Например:
Н2О–2, СаО–2.
Исключения:
степень окисления кислорода во фториде кислорода (OF2) равна +2.
степень окисления кислорода в пероксидах (Н2О2, Na2O2), содержащих группу –O–O–, равна –1.
4. Степень окисления металлов в соединениях обычно положительная величина.
Например: +2
СuSO4.
5. Степень окисления неметаллов может быть и отрицательной, и положительной.
Например: –1 +1
HCl, HClO.
6. Сумма cтепеней окисления всех атомов в молекуле равна нулю.
Окислительно-восстановительные реакции представляют собой два взаимосвязанных процесса – процесса окисления и процесса восстановления.
Процесс окисления – это процесс отдачи электронов атомом, молекулой или ионом; при этом степень окисления увеличивается, а вещество является восстановителем:
– 2ē 2H+ процесс окисления,
Fe+2 – ē Fe+3 процесс окисления,
2J– – 2ē процесс окисления.
Процесс восстановления – это процесс присоединения электронов, при этом степень окисления уменьшается, а вещество является окислителем:
+ 4ē 2O–2 процесс восстановления,
Mn+7 + 5ē Mn+2 процесс восстановления,
Cu+2 +2ē Cu0 процесс восстановления.
Окислитель – вещество, которое принимает электроны и при этом восстанавливается (степень окисления элемента понижается).
Восстановитель – вещество, которое отдает электроны и при этом окисляется (степень окисления элемента понижается).
Сделать обоснованное заключение о характере поведения вещества в конкретных окислительно-восстановительных реакциях можно на основании значения окислительно-восстановительного потенциала, который рассчитывается по величине стандартного окислительно-восстановительного потенциала. Однако, в ряде случаев, можно, не прибегая к расчетам, а зная общие закономерности, определить, какое вещество будет являться окислителем, а какое — восстановителем, и сделать заключение о характере протекания окислительно — восстановительной реакции.
Типичными восстановителями являются:
некоторые простые вещества:
металлы: например, Na, Mg, Zn, Al, Fe,
неметаллы: например, H2, C, S;
некоторые сложные вещества: например, сероводород (H2S) и сульфиды (Na2S), сульфиты (Na2SO3), оксид углерода (II) (CO), галогеноводороды (HJ, HBr, HCI) и соли галогеноводородных кислот (KI, NaBr), аммиак (NH3);
катионы металлов в низших степенях окисления: например, SnCl2, FeCl2, MnSO4, Cr2(SO4)3;
катод при электролизе.
Типичными окислителями являются:
некоторые простые вещества – неметаллы: например,галогены (F2, CI2, Br2, I2), халькогены (О2, О3, S);
некоторые сложные вещества: например, азотная кислота (HNO3),серная кислота (H2SO4 конц.), прерманганат калия (K2MnO4), бихромат калия (K2Cr2O7), хромат калия (K2CrO4), оксид марганца (IV) (MnO2), оксид свинца (IV) (PbO2), хлорат калия (KCIO3), пероксид водорода (H2O2);
анод при электролизе.
При составлении уравнений окислительно-восстановительных реакций следует иметь в виду, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Существуют два метода составления уравнений окислительно-восстановительных реакций – метод электронного баланса и электронно-ионный метод (метод полуреакций).
При составлении уравнений окислительно-восстановительных реакций методом электронного баланса следует придерживаться определенного порядка действий. Рассмотрим порядок составления уравнений этим методом на примере реакции между перманганатом калия и сульфитом натрия в кислой среде.
- Записываем схему реакции (указываем реагенты и продукты реакции):
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
- Определяем степени окисления у атомов элементов, изменяющих ее величину:
+7 + 4 + 2 + 6
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
3) Составляем схему электронного баланса. Для этого записываем химические знаки элементов, атомы которых изменяют степень окисления, и определяем, сколько электронов отдают или присоединяют соответствующие атомы или ионы.
Указываем процессы окисления и восстановления, окислитель и восстановитель.
Уравниваем количество отданных и принятых электронов и, таким образом, определяем коэффициенты при восстановителе и окислителе (в данном случае они соответственно равны 5 и 2):
5 S+4 – 2 e- → S+6 процесс окисления, восстановитель
2 Mn+7 + 5 e- → Mn+2 процесс восстановления, окислитель.
4) Далее остальные элементы уравниваем обычным путем и заменяем стрелку в схеме на знак равенства в уравнении реакции:
2KMnO4 +5Na2SO3 + 8H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O.
5) Если водород и кислород не меняет своих степеней окисления, то их количество подсчитывают в последнюю очередь и добавляют нужное количество молекул воды в левую или правую часть уравнения.
Окислительно-восстановительные реакции подразделяются на три типа: межмолекулярные, внутримолекулярные и реакции самоокисления – самовосстановления (диспропорционирования).
Реакциями межмолекулярного окисления – восстановления называются окислительно-восстановительные реакции, окислитель и восстановитель в которых представлены молекулами разных веществ.
Например:
0 +3 0 +3
2Al + Fe2O3 = 2Fe + Al2O3,
Al0 – 3e– → Al+3 окисление, восстановитель,
Fe+3 +3e– → Fe0 восстановление, окислитель.
В этой реакции восстановитель (Al) и окислитель (Fe+3) входят в состав различных молекул.
Реакциями внутримолекулярного окисления – восстановления называются реакции, в которых окислитель и восстановитель входят в состав одной молекулы (и представлены либо разными элементами, либо одним элементом, но с разными степенями окисления):
+5 –1 0
2 KClO3 = KCl + 3O2
2 CI+5 + 6e– → CI–1 восстановление, окислитель
3 2O–2 – 4е– → окисление, восстановитель
В этой реакции восстановитель (O–2) и окислитель (CI+5) входят в состав одной молекулы и представлены различными элементами.
В реакции термического разложения нитрита аммония меняют свои степени окисления атомы одного и того же химического элемента – азота, входящие в состав одной молекулы:
-3 +3 0
NH4NO2 = N2 + 2H2O
N–3 – 3e– → N0 восстановление, окислитель
N+3 + 3e– → N0 окисление, восстановитель.
Реакции подобного типа часто называют реакциями контрпропорционирования.
Реакции самоокисления – самовосстановления (диспропорционирования) – это реакции, при протекании которых один и тот же элемент с одной и той же степенью окисления сам и повышает, и понижает свою степень окисления.
Например: 0 -1 +1
Cl2 + H2O = HCI + HCIO
CI0 + 1e– → CI–1 восстановление, окислитель
CI0 – 1e– → CI+1 окисление, восстановитель.
Реакции диспропорционирования возможны, когда в исходном веществе элемент имеет промежуточную степень окисления.
Свойства простых веществ могут прогнозироваться по положению атомов их элементов в периодической системе элементов Д.И. Менделеева. Так, все металлы в окислительно-восстановительных реакциях будут являться восстановителями. Катионы металлов могут быть и окислителями. Неметаллы в виде простых веществ могут быть как окислителями, так и восстановителями (исключая фтор и инертные газы).
Окислительная способность неметаллов усиливается в периоде слева направо, а в группе – снизу вверх.
Восстановительные способности, наоборот, уменьшаются слева направо и снизу вверх как для металлов, так и для неметаллов.
Если окислительно-восстановительная реакция металлов происходит в растворе, то для определения восстановительной способности используют ряд стандартных электродных потенциалов (ряд активности металлов). В этом ряду металлы расположены по мере убывания восстановительной способности их атомов и возрастания окислительной способности их катионов (см. табл. 9 приложения).
Наиболее активные металлы, стоящие в ряду стандартных электродных потенциалов до магния, могут реагировать с водой, вытесняя из нее водород.
Например:
Ca + 2H2O = Ca(OH)2 + H2 ↑
При взаимодействии металлов с растворами солей следует иметь в виду, что каждый более активный металл (не взаимодействующий с водой) способен вытеснять (восстанавливать) стоящий за ним металл из раствора его соли.
Так, атомы железа могут восстановить катионы меди из раствора сульфата меди (CuSO4):
Fe + CuSO4 = Cu + FeSO4
Fe0 – 2e– = Fe+2 окисление, восстановитель
Cu+2 + 2e– = Cu0 восстановление, окислитель.
В этой реакции железо (Fe) расположено в ряду активности до меди (Cu) и является более активным восстановителем.
Реакция, например, серебра с раствором хлорида цинка будет невозможна, так как серебро расположено в ряду стандартных электродных потенциалов правее цинка и является менее активным восстановителем.
Ag + ZnCl2 ≠
Все металлы, которые стоят в ряду активности до водорода, могут вытеснять водород из растворов обычных кислот, то есть восстанавливать его:
Zn + 2HCl = ZnCI2 + H2↑
Zn0 – 2e– = Zn+2 окисление, восстановитель
2H+ + 2e– → восстановление, окислитель.
Металлы, которые стоят в ряду активности после водорода, не будут восстанавливать водород из растворов обычных кислот.
Cu + HCI ≠
Чтобы определить, может ли быть окислителем или восстановителем сложное вещество, необходимо найти степень окисления элементов, его составляющих. Элементы, находящиеся в высшей степени окисления, могут ее только понижать, принимая электроны. Следовательно, вещества, молекулы которых содержат атомы элементов в высшей степени окисления, будут только окислителями.
Например, HNO3, KMnO4, H2SO4 в окислительно-восстановитель-ных реакциях будут выполнять функцию только окислителя. Степени окисления азота (N+5), марганца (Mn+7) и серы (S+6) в этих соединениях имеют максимальные значения (совпадают с номером группы данного элемента).
Если элементы в соединениях имеет низшую степень окисления, то они могут ее только повышать, отдавая электроны. При этом такие вещества, содержащие элементы в низшей степени окисления, будут выполнять функцию только восстановителя.
Например, аммиак, сероводород и хлороводород (NH3, H2S, НCI) будут только восстановителями, так как степени окисления азота (N–3), серы (S–2) и хлора (Cl–1) являются для этих элементов низшими.
Вещества, в состав которых входят элементы, имеющие промежуточные степени окисления, могут быть как окислителями, так и восстановителями, в зависимости от конкретной реакции. Таким образом, они могут проявлять окислительно-восстановительную двойственность.
К таким веществам относятся, например, пероксид водорода (H2O2), водный раствор оксида серы (IV) (сернистая кислота), сульфиты и др. Подобные вещества, в зависимости от условий среды и наличия более сильных окислителей (восстановителей) могут проявлять в одних случаях окислительные свойства, а в других — восстановительные.
Как известно, многие элементы имеют переменную степень окисления, входя в состав различных соединений. Например, сера в соединениях H2S, H2SO3, H2SО4 и сера S в свободном состоянии имеет соответственно степени окисления –2, +4, +6 и 0. Сера относится к элементам р-электронного семейства, ее валентные электроны расположены на последнем s— и р-подуровнях (…3s3р). У атома серы со степенью окисления – 2 валентные подуровни полностью укомплектованы. Поэтому, атом серы с минимальной степенью окисления (–2) может только отдавать электроны (окисляться) и быть только восстановителем. Атом серы со степенью окисления +6 потерял все свои валентные электроны и в данном состоянии может только принимать электроны (восстанавливаться). Поэтому атом серы с максимальной степенью окисления (+6) может быть только окислителем.
Атомы серы с промежуточными степенями окисления (0, +4) могут и терять и присоединять электроны, то есть быть как восстановителями, так и окислителями.
Аналогичные рассуждения правомочны при рассмотрении окислительно-восстановительных свойств атомов других элементов.
На характер протекания окислительно-восстановительной реакции влияет концентрация веществ, среда раствора и сила окислителя и восстановителя. Так, концентрированная и разбавленная азотная кислота по-разному реагирует с активными и малоактивными металлами. Глубина восстановления азота (N+5) азотной кислоты (окислителя) будет определяться активностью металла (восстановителя) и концентрацией (разбавлением) кислоты.
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2 + 2H2O,
8HNO3(разб.) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O,
10HNO3(конц.) + 4Мg = 4Mg(NO3)2 + N2O + 5H2O,
10HNO3(c. разб.) + 4Мg = 4Mg(NO3)2 + NH4NO3 + 3H2O.
Существенное влияние на протекание окислительно-восстановительных процессов оказывает реакция среды.
Если в качестве окислителя используют перманганат калия (KMnO4), то в зависимости от реакции среды раствора, Mn+7 будет восстанавливаться по-разному:
в кислой среде (до Mn+2) продуктом восстановления будет соль, например, MnSO4,
в нейтральной среде (до Mn+4) продуктом восстановления будет MnO2 или MnO(OH)2,
в щелочной среде (до Mn+6) продуктом восстановления будет манганат, например, К2MnO4.
Например, при восстановлении раствора перманганата калия сульфитом натрия, в зависимости от реакции среды, будут получаться соответствующие продукты:
кислая среда –
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 +H2O
нейтральная среда –
2KMnO4 + 3Na2SО3 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
щелочная среда –
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + Na2MnO4 + K2MnO4 + H2O.
Температура системы также влияет на ход окислительно-восстановительной реакции. Так, продукты взаимодействия хлора с раствором щелочи будут различны в зависимости от температурных условий.
При взаимодействии хлора с холодным раствором щелочи реакция идет с образованием хлорида и гипохлорита:
0 -1 +1
Cl2 + KOH → KCI + KCIO + H2O
CI0 + 1e– → CI–1 восстановление, окислитель
CI0 – 1e– → CI+1 окисление, восстановитель.
Если взять горячий концентрированный раствор КОН, то в результате взаимодействия с хлором получим хлорид и хлорат:
0 t° -1 +5
3CI2 + 6KOH → 5KCI + KCIO3 + 3H2O
5 │ CI0 + 1e– → CI–1 восстановление, окислитель
1 │ CI0 – 5e– → CI+5 окисление, восстановитель.
Вопросы для самоконтроля по теме
«Окислительно-восстановительные реакции»
1. Какие реакции называются окислительно-восстановитель-ными?
2. Что такое степень окисления атома? Как она определяется?
3. Чему равна степень окисления атомов в простых веществах?
4. Чему равна сумма степеней окисления всех атомов в молекуле?
5. Какой процесс называется процессом окисления?
6. Какие вещества называются окислителями?
7. Как меняется степень окисления окислителя в окислительно-восстановительных реакциях?
8. Приведите примеры веществ, являющихся в окислительно-восстановительных реакциях только окислителями.
9. Какой процесс называется процессом восстановления?
10. Дайте определение понятию «восстановитель».
11. Как меняется степень окисления восстановителя в окислительно-восстановительных реакциях?
12. Какие вещества могут быть только восстановителями?
13. Какой элемент является окислителем в реакции взаимодействия разбавленной серной кислоты с металлами?
14. Какой элемент является окислителем при взаимодействии концентрированной серной кислоты с металлами?
15. Какую функцию выполняет азотная кислота в окислительно-восстановительных реакциях?
16. Какие соединения могут образоваться в результате восстановления азотной кислоты в реакциях с металлами?
17. Какой элемент является окислителем в концентрированной, разбавленной и очень разбавленной азотной кислоте?
18. Какую роль в окислительно-восстановительных реакциях может выполнять пероксид водорода?
19. Как классифицируются все окислительно-восстановительные реакции?
Тесты для самоконтроля знаний теории по теме «Окислительно-восстановительные реакции»
Вариант № 1
1. Под каким номером приведено уравнение окислительно-восстановительной реакции?
1) CuSO4 + Zn = ZnSO4 + Cu,
2) CaCO3 + CO2 + H2O = Ca(HCO3)2,
3) SO3 + H2O = H2SO4,
4) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl,
5) NaHCO3 + NaOH = Na2CO3 + H2O.
2. Руководствуясь строением атомов, определите, под каким номером указана формула иона, который может быть только окислителем:
1) Mn, 2) NO3–, 3) Br –, 4) S2– , 5) NO2–?
3. Под каким номером приведена формула вещества, являющегося наиболее сильным восстановителем, из числа приведенных ниже:
1) NO3–, 2) Сu, 3) Fe, 4) Ca, 5) S?
4. Под каким номером указано количество вещества KMnO4, в молях, которое взаимодействует с 10 моль Na2SO3 в реакции, представленной следующей схемой:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O?
1) 4, 2) 2, 3) 5, 4) 3, 5) 1.
5. Под каким номером приведена реакция диспропорционирования (самоокисления – самовосстановления)?
1) 2H2S + H2SO3 = 3S + 3H2O,
2) 4KClO3 = KCl + 3KClO4,
3) 2F2 + 2H2O = 4HF + O2.
4) 2Au2O3 = 4Au + 3O2,
5) 2KClO3 = 2KCl + 3O2.
Вариант № 2
1. Под каким номером приведено уравнение окислительно-восстановительной реакции?
1) 4KClO3 = KCl + 3KClO4,
2) CaCO3 = CaO + CO2,
3) CO2 + Na2O = Na2CO3,
4) CuOHCl + HCl = CuCl2 + H2O,
5) Pb(NO3)2 + Na2SO4 = PbSO4 + 2NaNO3.
2. Под каким номером приведена формула вещества, которое может быть только восстановителем:
1) SO2, 2) NaClO, 3) KI, 4) NaNO2, 5) Na2SO3?
3. Под каким номером приведена формула вещества, являющегося наиболее сильным окислителем, из числа приведенных:
1) I2, 2) S, 3) F2, 4) O2, 5) Br2?
4. Под каким номером приведен объем водорода в литрах при нормальных условиях, который можно получить из 9 г Al в результате следующей окислительно-восстановительной реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2
1) 67,2, 2) 44,8, 3) 33,6, 4) 22,4, 5) 11,2?
5. Под каким номером приведена схема окислительно-восстано-вительной реакции, которая протекает при рН > 7?
1) I2 + H2O → HI + HIO,
2) FeSO4 + HIO3 + … → I2 + Fe(SO4)3 + …,
3) KMnO4 + NaNO2 + … → MnSO4 + …,
4) KMnO4 + NaNO2 + … → K2MnO4 + …,
5) CrCl3 + KMnO4 + … → K2Cr2O7 + MnO(OH)2 + … .
Вариант № 3
1. Под каким номером приведено уравнение окислительно-восстановительной реакции?
1) H2SO4 + Mg → MgSO4 + H2,
2) CuSO4 + 2NaOH →Cu(OH)2 + Na2SO4,
3) SO3 + K2O → K2SO4,
4) CO2 + H2O → H2CO3,
5) H2SO4 + 2KOH → K2SO4 + 2H2O.
2. Руководствуясь строением атома, определите, под каким номером приведена формула иона, который может быть восстановителем:
1) Ag+, 2) Al3+, 3) Cl7+, 4) Sn2+, 5) Zn2+?
3. Под каким номером приведен процесс восстановления?
1) NO2– → NO3–, 2) S2– → S0, 3) Mn2+ → MnO2,
4) 2I– → I2, 5) → 2Cl–.
4. Под каким номером приведена масса прореагировавшего железа, если в результате реакции, представленной следующей схемой:
Fe + HNO3 → Fe(NO3)3 + NO + H2O
образовалось 11,2 л NO (н.у.)?
1) 2,8, 2) 7, 3) 14, 4) 56, 5) 28.
5. Под каким номером приведена схема реакции самоокисления-самовосстановления (дисмутации)?
1) HI + H2SO4 → I2 + H2S + H2O,
2) FeCl2 + SnCl4 → FeCl3 + SnCl2,
3) HNO2 → NO + NO2 + H2O,
4) KClO3 → KCl + O2,
5) Hg(NO3)2 → HgO + NO2 + O2.
Ответы на задания тестов см. на стр.
Вопросы и упражнения для самостоятельной
работы по изучению темы.
1. Укажите номер или сумму условных номеров, под которыми расположены схемы окислительно-восстановительных реакций:
1) MgCO3 + HCl MgCl2 + CO2 + H2O,
2) FeO + P Fe + P2O5,
4) H2O2 H2O + O2, 
2. Укажите номер или сумму условных номеров, под которыми расположены окислительно-восстановительные процессы:
1) электролиз раствора хлорида натрия,
2) обжиг пирита,
3) гидролиз раствора карбоната натрия,
4) гашение извести.
3. Укажите номер или сумму условных номеров, под которыми расположены названия групп веществ, характеризующихся возрастанием окислительных свойств:
1) хлор, бром, фтор,
2) углерод, азот кислород,
3) водород, сера, кислород,
4) бром, фтор, хлор.
4. Какое из веществ – хлор, сера, алюминий, кислород – является более сильным восстановителем? В ответе укажите значение молярной массы выбранного соединения.
5. Укажите номер или сумму условных номеров, под которыми расположены только окислители:
1) K2MnO4, 2) KMnO4, 4) MnO3 , 
16) K2Cr2O7, 32) K2SO3.
6. Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, обладающих окислительно-восстановительной двойственностью:
1) KI, 2) H2O2, 4) Al, 
7. Какое из соединений – оксид железа (III), оксид хрома (III), оксид серы (IV), оксид азота (II), оксид азота (V) – может быть только окислителем? В ответе укажите значение молярной массы выбранного соединения.
8. Укажите номер или сумму условных номеров, под которыми расположены формулы веществ, которые имеют степень окисления кислорода – 2:
1) H2O, Na2O, Cl2O, 2) HPO3, Fe2O3, SO3,
4) OF2, Ba(OH)2, Al2O3, 
9. Какое из указанных соединений может быть только окислителем: нитрит натрия, сернистая кислота, сероводород, азотная кислота? В ответе укажите значение молярной массу выбранного соединения.
10. Какое из приведенных соединений азота – NH3; HNO3; HNO2; NO2 – может быть только окислителем? В ответе запишите значение относительной молекулярной массы выбранного соединения.
11. Под каким номером, среди перечисленных ниже названий веществ, указан наиболее сильный окислитель?
1) концентрированная азотная кислота,
2) кислород,
3) электрический ток на аноде при электролизе,
4) фтор.
12. Какое из приведенных соединений азота – HNO3; NH3; HNO2; NO – может быть только восстановителем? В ответе запишите значение молярной массы выбранного соединения.
13. Какое из соединений – Na2S; K2Cr2O7; KMnO4; NaNO2; KClO4 – может быть и окислителем и восстановителем, в зависимости от условий протекания реакции? В ответе запишите значение молярной массы выбранного соединения.
14. Укажите номер или сумму условных номеров, где указаны ионы, которые могут быть восстановителями:
1) (MnO4)2–, 2) (CrO4) –2, 4) Fe+2, 
15. Укажите номер или сумму условных номеров, под которым расположены только окислители:
1) K2MnO4, 2) HNO3, 4) MnO3, 
16. Укажите номер или сумму условных номеров, под которыми расположены только названия веществ, между которыми не возможно протекание окислительно-восстановительных реакций:
1) углерод и серная кислота,
2) серная кислота и сульфат натрия,
4) сероводород и иодоводород,

17. Укажите номер или сумму условных номеров, под которыми расположены процессы окисления:
1) S+6 S–2, 2) Mn+2 Mn+7, 4) S–2 S+4,

18. Укажите номер или сумму условных номеров, под которыми расположены процессы восстановления:
1) 2I–1 I2, 2) 2N+3 N2, 4) S–2 S+4,

19. Укажите номер или сумму условных номеров, под которыми расположены процессы восстановления:
1) С0 CО2, 2) Fe+2 Fe+3,
4) (SO3)2– (SO4)2–, 
20. Укажите номер или сумму условных номеров, под которыми расположены процессы восстановления:
1) Mn+2 MnO2, 2) (IO3) – (IO4) –,
4) (NO2) – (NO3) –, 
21. Укажите номер или сумму условных номеров, под которыми расположены ионы, являющиеся восстановителями.
1) Ca+2, 2) Al+3, 4) K+, 
22. Под каким номером приведена формула вещества, при взаимодействии с которым водород выполняет роль окислителя?
1) O2, 2) Na, 3) S, 4) FeO.
23. Под каким номером приведено уравнение реакции, в которой проявляются восстановительные свойства хлорид-иона?
1) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2О,
2) CuO + 2HCl = CuCl2 + H2O,
3) Zn + 2HCl = ZnCl2 + H2,
4) AgNO3 + HCl = AgCl + HNO3.
24. При взаимодействии с каким из указанных веществ – O2, NaOH, H2S – оксид серы (IV) проявляет свойства окислителя? Напишите уравнение соответствующей реакции и в ответе укажите сумму коэффициентов у исходных веществ.
25. Укажите номер или сумму условных номеров, под которыми расположены схемы реакций диспропорционирования:
1) NH4NO3 N2O + H2O, 2) NH4NO2 N2 + H2O,
4) KClO3 KClO4 + KCl, 
26. Составьте схему электронного баланса и укажите, какое количество вещества перманганата калия участвует в реакции c десятью моль оксида серы (IV). Реакция протекает по схеме:
KMnO4 + SO2 MnSO4 + K2SO4 + SO3.
27. Составьте схему электронного баланса и укажите, какое количество вещества сульфида калия взаимодействует с шестью моль перманганата калия в реакции:
K2S + KMnO4 + H2O MnO2 + S + KOH.
28. Составьте схему электронного баланса и укажите, какое количество вещества перманганата калия взаимодействует с десятью молями сульфата железа (II) в реакции:
KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2(SO4)3 + K2SO4 + H2O.
29. Составьте схему электронного баланса и укажите, какое количество вещества хромита калия (KCrO2) взаимодействует с шестью моль брома в реакции:
KCrO2 + Br2 + KOH K2CrO4 + KBr + H2O.
30. Составьте схему электронного баланса и укажите, какое количество вещества оксида марганца (IV) взаимодействует с шестью моль оксида свинца (IV) в реакции:
MnO2 + PbO2 + HNO3 HMnO4 + Pb(NO3)2 + H2O.
31. Составьте уравнение реакции:
KMnO4 + NaI + H2SO4 I2 + K2SO4 + MnSO4 + Na2SO4 + H2O.
В ответе укажите сумму стехиометрических коэффициентов в уравнении реакции.
32. Составьте уравнение реакции:
KMnO4 + NaNO2 + H2O MnO2 + NaNO3 + KOH.
В ответе укажите сумму стехиометрических коэффициентов в уравнении реакции.
33. Составьте уравнение реакции:
K2Cr2O7 + HClконц. KCl + CrCl3 + Cl2 + H2O.
В ответе укажите сумму стехиометрических коэффициентов в уравнении реакции.
34. Составьте схему электронного баланса и укажите, какое количество вещества нитрита натрия (NaNO2) взаимодействует с четырьмя моль перманганата калия в реакции:
KMnO4 + NaNO2 + H2SO4 MnSO4 + NaNO3 + K2SO4 + H2O.
35. Составьте схему электронного баланса и укажите, какое количество вещества сероводорода взаимодействуют с шестью моль перманганата калия в реакции:
KMnO4 + H2S + H2SO4 S + MnSO4 + K2SO4 + H2O.
36. Какое количество вещества железа в молях окислится кислородом объемом 33,6 л (н.у.) в реакции, протекающей по нижеприведенной схеме?
Fe + H2O + O2 Fe(OH)3.
37. Какой из приведенных металлов – Zn, Rb, Ag, Fe, Mg – не растворяется в разбавленной серной кислоте? В ответе укажите значение относительной атомной массы этого металла.
38. Какой из приведенных металлов – Zn, Rb, Ag, Fe, Mg – не растворяется в концентрированной серной кислоте? В ответе укажите порядковый номер элемента в периодической системе Д.И. Менделеева.
39. Укажите номер или сумму условных номеров, под которыми расположены металлы, пассивирующиеся в концентрированных растворах кислот-окислителей.
1) Zn, 2) Cu, 4) Au, 
40. Укажите номер или сумму условных номеров, под которыми расположены химические знаки металлов, не вытесняющих водород из разбавленного раствора серной кислоты, но вытесняющих ртуть из растворов солей Hg2+:
1) Fe, 2) Zn, 4) Au, 
41. Под каким номером указаны химические знаки металлов, каждый из которых не реагируют с азотной кислотой?
1) Zn, Ag; 2) Pt, Au; 3) Cu, Zn; 4) Ag, Hg.
42. Под каким номером указан способ получения хлора в промышленности?
1) электролизом раствора хлорида натрия;
2) действием оксида марганца (1V) на соляную кислоту;
3) термическим разложением природных соединений хлора;
4) действием фтора на хлориды.
43. Под каким номером расположена химическая формула газа, преимущественно выделяющегося при действии концентрированного раствора азотной кислоты на медь?
1) N2, 2) NO2, 3) NO, 4) H2.
44. Под каким номером указаны формулы продуктов реакции горения сероводорода на воздухе при недостатке кислорода?
1) SO2 + H2O, 2) S + H2O,
3) SO3 + H2O, 4) SO2 + H2.
Укажите номер правильного ответа.
45. Составьте уравнение реакции взаимодействия концентрированной серной кислоты с медью. В ответе укажите сумму коэффициентов в уравнении реакции.
Ответы на задания тестов для самоконтроля
знания теории по теме.
«Окислительно-восстановительные реакции»
|
Вариант № 1 |
Вариант № 2 |
Вариант № 3 |
|||
|
Вопрос |
Ответ |
Вопрос |
Ответ |
Вопрос |
Ответ |
|
1 |
1 |
1 |
1 |
1 |
1 |
|
2 |
2 |
2 |
3 |
2 |
4 |
|
3 |
4 |
3 |
3 |
3 |
5 |
|
4 |
1 |
4 |
5 |
4 |
5 |
|
5 |
2 |
5 |
4 |
5 |
3 |