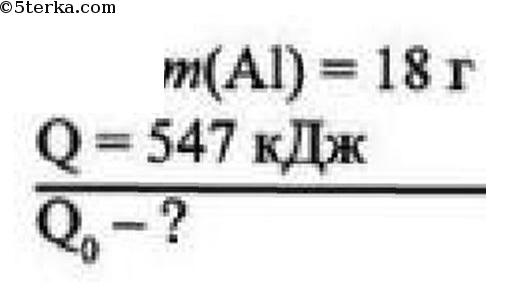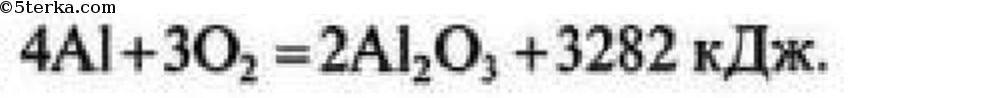Термохимическое уравнение горения алюминия имеет вид:
Al + О2 = Al2O3 + 3350 кДж.
В результате реакции выделилось 502,5 кДж теплоты. Сколько граммов алюминия вступило в реакцию? Ответ округлите до десятых.
Решение задачи
Запишем термохимическое уравнение горения алюминия:
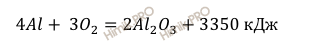
В условии задачи сказано, что в результате реакции горения алюминия выделилось 502,5 кДж теплоты. Учитывая, что молярная масса алюминия (Al) равна 27 г/моль (смотри таблицу Менделеева), найдём по уравнению реакции горения алюминия какая масса алюминия вступила в реакцию:
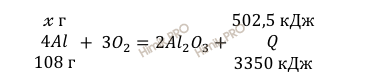
при сгорании х г Al выделяется 502,5 кДж энергии
при сгорании 108 г Al выделяется 3350 кДж
энергии
Откуда:
В реакцию горения алюминия вступило 16,2 г алюминия (Al).
Ответ:
16,2 грамма
алюминия вступило в реакцию горения алюминия.
7 При соединении 18 г алюминия в кислороде выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции.

задача №7
к главе «§ 14 Классификация химических реакций, протекающих с изменением состава веществ».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
химэко
Меню сайта
Категории каталога
| 8 класс [27] |
| 9 класс [16] |
| 10 класс [30] |
| 11 класс [5] |
| Экзамен [4] |
| Лаборатория [7] |
| Опорные конспекты [0] |
| Переменка [6] |
| НОТ школьника [9] |
| Решение задач [9] |
| Творческие работы учащихся [3] |
| Учебные пособия [5] |
Форма входа
Приветствую Вас Гость!
Поиск
Друзья сайта
Наш опрос
Статистика
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O 2 = 2 MqO + 1204 кДж
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n ( MqO ) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
источники:
http://chemege.ru/termochemistry/
http://himekoscho.ucoz.ru/load/termokhimicheskie_uravnenija/27-1-0-130
Составьте термохимическое уравнение, если при сгорании алюминия массой 28 г в кислороде выделяется 860 кДж теплоты.
Вопрос Составьте термохимическое уравнение, если при сгорании алюминия массой 28 г в кислороде выделяется 860 кДж теплоты?, расположенный на этой странице сайта, относится к
категории Химия и соответствует программе для 10 — 11 классов. Если
ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска
похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему.
Для этого ключевые фразы введите в строку поиска, нажав на кнопку,
расположенную вверху страницы. Воспользуйтесь также подсказками посетителей,
оставившими комментарии под вопросом.
dexitung
Вопрос по химии:
Очень СРОЧНО!!!!!!
Термохимическое уравнение горения алюминия 4AL+3O2=2AL2O3 кДж сколько теплоты выделяется при сгорании 5,4 г алюминия?????
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
ulouthare526
N(Al)=5,4/27=0,2 моль
4 моль — 3164 кДж
0,2 моль — y кДж
y=0,2*3164/4=158,2 кДж
Ответ: 158,2 кДж
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Термохимическое уравнение горения алюминия имеет вид 4Al + 3O2 = 2Al2O3 + 3350 кДж. В результате реакции выделилось 502,5 кДж теплоты. Сколько граммов алюминия вступило в реакцию? Ответ округлите до десятых.
Ответ оставил Гость
Х г. 502,5 кДж 4Al. +. 3O2. = 2Al2O3 +3350 кДжn=4 мольМ=27 г/мольm=108 гХ г Al. -. 502,5 кДж108 г Al. -. 3350 кДжm(Al)=108*502,5/3350=16,2 г
Если твой вопрос не раскрыт полностью, то попробуй воспользоваться поиском на сайте и найти другие ответы по предмету Химия.
По термохимическому уравнению реакции : 4Al + 3O2 = 2Al2O3 + 3350, 4 кДж нужно вычислить количество теплоты, которое может выделиться при полном сжигании 10, 8г алюминия?
Химия | 5 — 9 классы
По термохимическому уравнению реакции : 4Al + 3O2 = 2Al2O3 + 3350, 4 кДж нужно вычислить количество теплоты, которое может выделиться при полном сжигании 10, 8г алюминия.
Найдём n(Al) = m(Al) / M(Al) = 10, 6 / 27 = 0, 393
По уравнению при сжигании 4 моль Al выделяется 3350, 4 кДж теплоты
393 моль выделяется x кДж теплоты
x = (0, 393 * 3350, 4) / 4 = 328, 8 кДж
Ответ : 328, 8 кДж.
Помогите с задачками пожалуйста 1?
Помогите с задачками пожалуйста 1.
Согласно термохимическому уравнению реакции CH4(г) + 2O2(г) = CO2(г) + 2H2O(г) + 802 кДж вычислите количество теплоты, выделившейся при сжигании 24 гр.
В результате реакции, термохимическое уравнение которой 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г) + 902 кДж выделилось 1127 кДж теплоты.
Вычислите объём образовавшегося N2O.
Термохимическое уравнение реакции полного сгорания ацетилена : 2С2Н2 + 5О2 = 4СО2 + 2Н2О + 2610 кДж?
Термохимическое уравнение реакции полного сгорания ацетилена : 2С2Н2 + 5О2 = 4СО2 + 2Н2О + 2610 кДж.
Вычислите количество теплоты, которая выделится при сгорании 1, 12 л ацетилена (н.
Для реакции алюминия с серой термохимическое уравнение реакции имеет вид : 2Al + 3S = Al2S3 + 509 кДж Какое количество теплоты выделится в реакции, для которых взяты 81 г алюминия и 128 г серы?
Для реакции алюминия с серой термохимическое уравнение реакции имеет вид : 2Al + 3S = Al2S3 + 509 кДж Какое количество теплоты выделится в реакции, для которых взяты 81 г алюминия и 128 г серы.
По термохимическому уравнению С + О2 = СО2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 200 кДж?
По термохимическому уравнению С + О2 = СО2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 200 кДж.
Решите две задачи : 1)При полном сжигании 42 литров метана (н?
Решите две задачи : 1)При полном сжигании 42 литров метана (н.
У) выделилось 1674 кДж теплоты .
Составьте термохимическое уравнение реакции горения метана.
2) По термохимическому уравнению реакции горения спирта ( C2H5OH + 3O2 = 2CO2 + 3H2O + 1374 кДж) вычислите , сколько выделится теплоты при сгорании 200 грамм спирта ?
Вычеслите количество теплоты, которое может выделяться при сжигании 50л водорода по термохимическому уравнению реакции : 2H2 + O2 = 2H2O + 573, 2 кДЖ?
Вычеслите количество теплоты, которое может выделяться при сжигании 50л водорода по термохимическому уравнению реакции : 2H2 + O2 = 2H2O + 573, 2 кДЖ.
ПОМОГИТЕ?
По термохимическому уравнению реакции : C + O2 = CO2 + 402 кДж вычисли количество теплоты, которое выделится при сжигании 60 г угля.
При сжигании 45г глюкозы С6Н12О6 выделилось 704 кДж теплоты?
При сжигании 45г глюкозы С6Н12О6 выделилось 704 кДж теплоты.
Составьте термохимическое уравнение этой реакции.
При сжигании 1, 2 углерода выделилась теплота, равная 40, 2 кДж?
При сжигании 1, 2 углерода выделилась теплота, равная 40, 2 кДж.
Составьте термохимическое уравнение этой реакции.
По термохимическому уравнению реакции вычислите количество теплоты, выделившийся при сжигании 33?
По термохимическому уравнению реакции вычислите количество теплоты, выделившийся при сжигании 33.
H2 + 1 2 O2 = H2O + 242 кДж.
Вопрос По термохимическому уравнению реакции : 4Al + 3O2 = 2Al2O3 + 3350, 4 кДж нужно вычислить количество теплоты, которое может выделиться при полном сжигании 10, 8г алюминия?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 5 — 9 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
KOH = K + OH FeCl3 = Fe + 3Cl HNO3 = H + NO3 Ca(OH)2 = Ca + 2OH K3PO4 = 3K + PO4 Na2HPO4 = 2Na + H + PO4 Al(NO3)3 = Al + 3NO3 H2S = 2H + S Cu(OH)2 = Cu + 2OH AlCl3 = Al + 3Cl.
F + 9 ) ) 2 7 As + 33 ) ) ) ) 2 8 18 5 характеристики дать не могу г).
1. Cu(OH)2 + (2H + ) + (Cl — ) — — > (Cu + ) + (2Cl — ) + 2H2O 2. Cu(OH)2 + (2H + ) + (SO4 2 — ) — — > (Cu + ) + (SO4 2 — ) + 2H2O.
180 * 0, 126 = 22, 68 380 * 0, 037 = 14, 06 m = 22, 68 + 14, 06 = 36, 74г.
См картинку в низу Если помог, нажми кнопку Спасибо)).
Ответ на фото находится.
Для обрахунку скористаємося такою формулою Підставимо дані позначивши атомну масу металу через х Рахуємо х (атомну масу металу) Отже метал — Калій (К).
Ответ на фотографии.
Это всё потому что вырабатывается очень тёплый воздух даже слишком горячий и благодаря этому медная стружка начинает плавиться.
Термохимическое уравнение горения алюминия имеет вид 4al 3o2 2al2o3 3350
Вопрос по химии:
по термохимическому уравнению реакции: 4Al+3O2=2Al2O3+3350,4 кДж нужно вычислить количество теплоты, которое может выделиться при полном сжигании 10,8г алюминия
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
4Al + 3O2 = 2Al2O3 + 3350,4 кДж
По уравнению реакции, горит 4 моль алюминия — выделяется 3350,4 кДж энергии.
Рассчитаем количество вещества 10,4 грамм алюмини:
n = m/M = 10,4г/27г/моль = 0,4 моль
4 моль —-> 3350,4 кДж
х = 0,4моль*3350,4кДж/4 моль = 335,04 кДж
Найдём n(Al) = m(Al) / M(Al) = 10,6 / 27 = 0,393
По уравнению при сжигании 4 моль Al выделяется 3350,4 кДж теплоты
а из 0.393 моль выделяется x кДж теплоты
x = (0,393 * 3350,4) / 4 = 328,8 кДж
Ответ: 328,8 кДж
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
http://himia.my-dict.ru/q/3717621_po-termohimiceskomu-uravneniu-reakcii-4al-3o2/
http://online-otvet.ru/himia/5b749730f04705572e530394