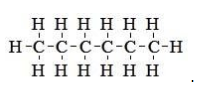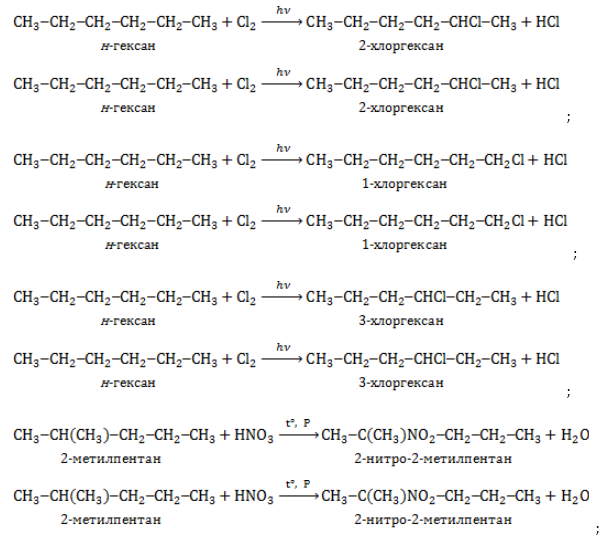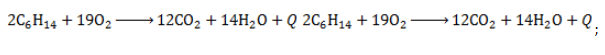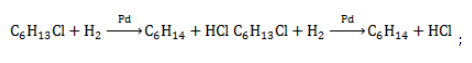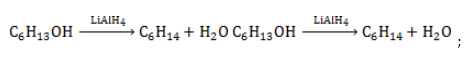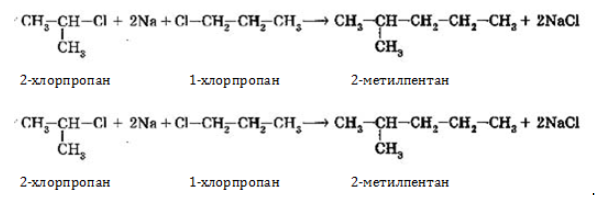Изомеры гексана
Содержание
- 1 Формула и строение гексана
- 2 Изомерия гексана
- 3 Свойства гексана
- 3.1 Физические свойства (таблица)
- 3.2 Химические свойства
- 4 Получение гексана
- 5 Применение гексана
- 6 Заключение
Гексан является шестым членом гомологического ряда алканов. Существуют различные варианты строения молекулы – изомеры гексана. Структурные различия изомеров обусловливают разные свойства.
Формула и строение гексана
Как насыщенный углеводород, гексан характеризуется максимально возможным количеством водорода в молекуле. При этом все четыре валентности углеродных атомов задействованы в простых ковалентных связях.
Молекулярная формула гексана показывает, что любой его изомер, независимо от строения, представляет собой предельное соединение с линейной (не имеющей замкнутых участков) молекулой, в которой отсутствуют кратные связи.
Наглядным примером может служить изомер с простейшим строением – н-гексан. Структурная формула нормального гексана имеет вид
Необходимо отметить, что она не отражает зигзагообразного пространственного расположения атомов в цепи , возникающего вследствие тетраэдрических валентных углов (
)
-гибридизованного углерода.
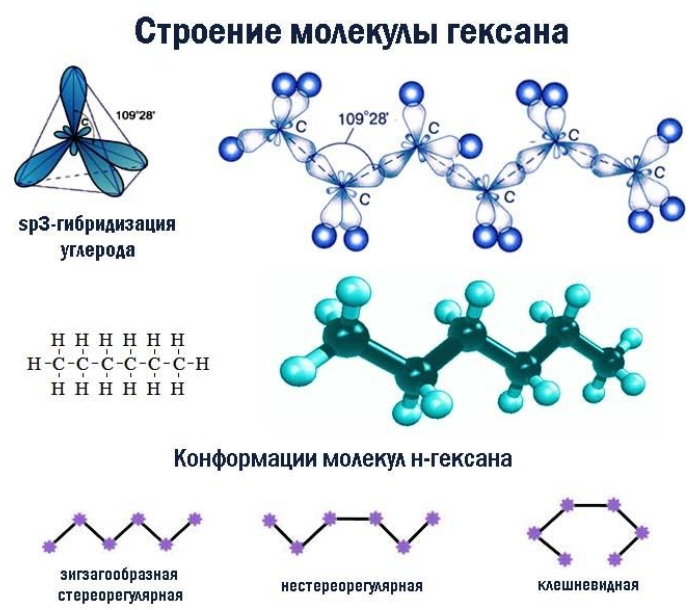
Цепь может принимать различные конформации за счет вращения вокруг простых -связей. Изменения конформации не являются изомерами, поскольку не вызывают перестройки углеродной цепочки.
Изомерия гексана
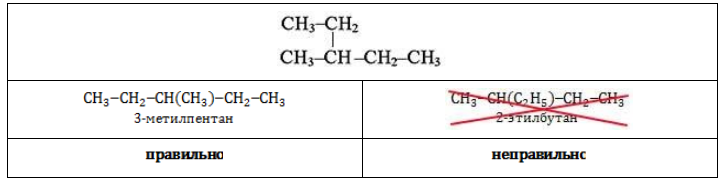
Как представитель ряда алканов, гексан обладает структурной изомерией, обусловленной различиями в расположении звеньев углеродного скелета. Изомеры гексана отличаются друг от друга наличием или отсутствием в молекуле алкильных радикалов, их количеством и позицией.
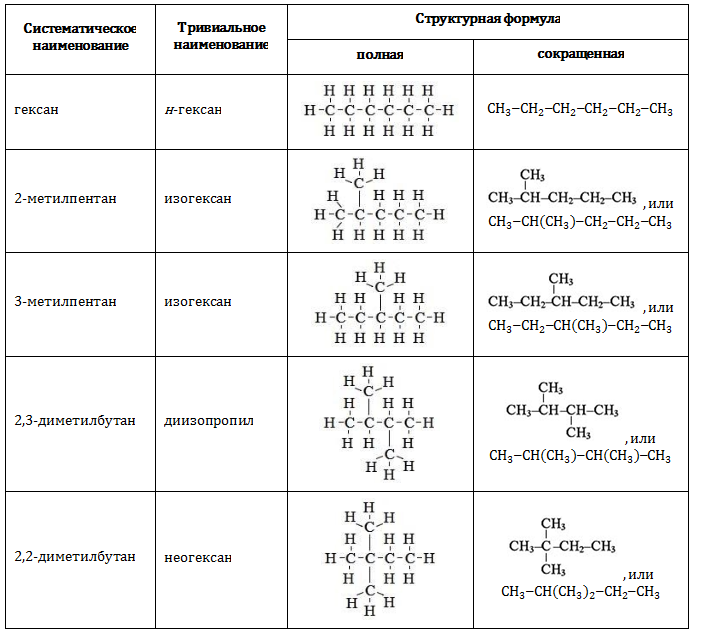
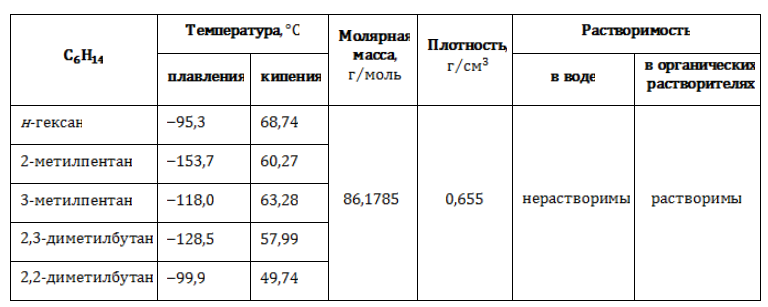
Существует всего пять изомерных соединений с составом , которые имеют распространенные тривиальные наименования помимо систематических.
В таблице представлены полные и сокращенные структурные формулы всех возможных для гексана изомеров.
Это интересно:
Изомеры пентена
Гомологи бензола
Свойства гексана
Вследствие структурных различий при одном и том же атомном составе изомеры представляют собой разные вещества, характеризующиеся неодинаковыми свойствами.
Физические свойства (таблица)
Все изомеры состава представляют собой бесцветные жидкости со слабо выраженным специфическим запахом. Изомерия оказывает влияние на термические характеристики веществ:
Химические свойства
Поскольку у алканов нет межклассовых изомеров, все вещества состава проявляют свойства, типичные для предельных углеводородов:
- неспособность к реакциям присоединения;
- участие в реакциях замещения:
- устойчивость к окислению при низких температурах;
- горючесть:
- разложение (крекинг) при энергичном термическом воздействии:
- способность к отщеплению водорода с образованием непредельных и циклических углеводородов:
Получение гексана
В промышленности гексан и его изомеры получают в процессах переработки нефтепродуктов:
- нормальный гексан – при прямой перегонке;
- изогексаны – при каталитическом разделении (крекинге).
Для лабораторных нужд используют следующие методы:
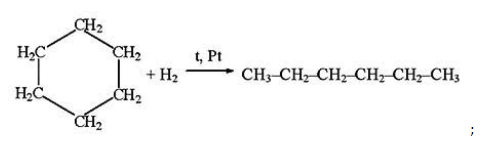
- гидрирование циклогексана:
- восстановление галогенгексана:
- восстановление спирта:
- гидрирование непредельных углеводородов:
- сшивание галогеналканов (синтез Вюрца):
Применение гексана
Различные изомеры состава находят широкое применение в топливной и химической промышленности:
- В качестве компонентов топлива используются изомеры с наиболее разветвленной цепью – диметилгексаны (н-гексан ввиду склонности к детонации, наоборот, снижает качество бензина).
- В производстве ароматических углеводородов при нефтепереработке.
- Как растворитель гексан используется в органическом синтезе, хроматографии, при экстракции из натурального сырья растительных масел, в лакокрасочном производстве и нефтедобыче.
- При обработке порошковых материалов в нанотехнологии.
Заключение
Гексан – соединение, незаменимое во многих отраслях, однако работа с ним сопряжена с риском. Гексан отличается взрывоопасностью и высокой степенью воспламеняемости, обладает негативными биологическими (наркотическими) свойствами. Это токсичное соединение относится к умеренно опасным (третий класс) веществам.
При работе с гексаном и его изомерами необходимо соблюдение техники безопасности и правильное использование средств защиты (респираторов, перчаток) и оборудования.
Оценка статьи:
Загрузка…
Гексан C6H14 – это предельный углеводород, содержащий шесть атомов углерода в углеродной цепи. Бесцветная жидкость с характерным запахом, нерастворим в воде и не смешивается с ней.
CH3-CH2-CH2-CH2-CH2-CH3
Гомологический ряд гексана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение гексана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
Например, в молекуле гексана C6H14 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение.
Изомерия гексана
Структурная изомерия
Для гексана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
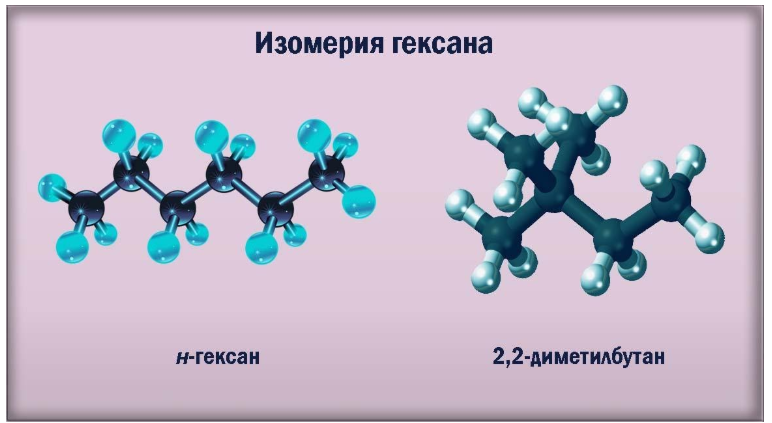
Для углеводородов состава С6Н14 существуют пять изомеров углеродного скелета: н-гексан, 2-метилпентан, 3 -метилпентан, 2,2-диметилбутан, 2,3-диметилбутан
| Гексан | 2-Метилпентан |
| CH3-CH2-CH2-CH2-CH2-CH3 | CH3-CH(CH3)-CH2-CH2-CH3 |
Для пентана не характерна пространственная изомерия.
Химические свойства гексана
Гексан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для гексана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для гексана характерны радикальные реакции.
Гексан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Гексан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании гексана образуется смесь хлорпроизводных.
CH3-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH2-CH2-CH2-CH2-CH2Cl + HCl
CH3-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH2-CH2-CH2-CHCl-CH3 + HCl
CH3-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH2-CHCl-CH2-CH2-CH3 + HCl
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
CH3-CH2-CH2-CH2-CH2-CH3 + Br2 → CH3-CH2-CH2-CH2-CHBr-CH3 + HBr
CH3-CH2-CH2-CH2-CH2-CH3 + Br2 → CH3-CH2-CHBr-CH2-CH2-CH3 + HBr
1.2. Нитрование гексана
Гексан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в гексане замещается на нитрогруппу NO2.
Например. При нитровании гексана образуются преимущественно 2-нитрогексан и 3-нитрогексан:
CH3-CH2-CH2-CH2-CH2-CH3 + HNO3 → CH3-CH2-CH2-CH2-CHNO2-CH3 + H2O
CH3-CH2-CH2-CH2-CH2-CH3 + HNO3 → CH3-CH2-CHNO2-CH2-CH2-CH3 + H2O
2. Дегидрирование гексана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
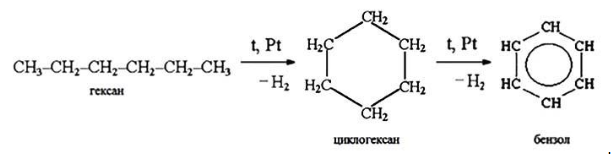
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
3. Крекинг
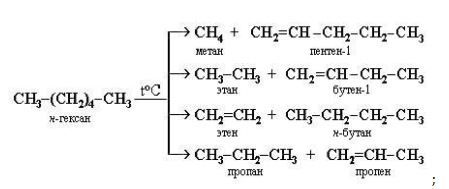
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Например, при крекинге н-гексана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
4. Окисление гексана
Гексан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
Полное окисление – горение
Гексан горит с образованием углекислого газа и воды. Реакция горения гексана сопровождается выделением большого количества теплоты.
2C6H14 + 19O2 → 12CO2 + 14H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении гексана в недостатке кислорода может образоваться угарный газ СО или сажа С.
5. Изомеризация гексана
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Например, н-гексан под действием катализатора хлорида алюминия и при нагревании образует 2-метилпентан, 3-метилпентан и другие изомеры.
Получение гексана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Реакция больше подходит для получения симметричных алканов.
Гексан можно получить из 1-хлорпропана и натрия:
2CH3-CH2-CH2-Cl + 2Na → CH3-CH2-CH2-CH2-CH2-CH3 + 2NaCl
2. Гидрирование алкенов и алкинов
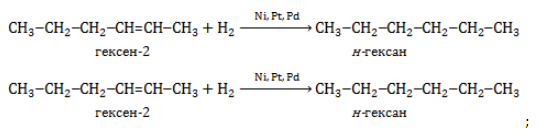
Гексан можно получить из гексена или гексина:
При гидрировании гексена-1, гексена-2 или гексена-3 образуется гексан:
CH2=CH-CH2-CH2-CH2-CH3 + H2 → CH3-CH2-CH2-CH2-CH3
CH3-CH=CH-CH2-CH2-CH3 + H2 → CH3-CH2-CH2-CH2-CH3
При полном гидрировании гексина-1, гексина-2 или гексина-3 также образуется гексан:
CH≡C-CH2-CH2-CH2-CH3 + 2H2 → CH3-CH2-CH2-CH2-CH3
CH3-C≡C-CH2-CH2-CH3 + 2H2 → CH3-CH2-CH2-CH2-CH3
3. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Из угарного газа и водорода можно получить гексан:
6CO + 13H2 = C6H14 + 6H2O
4. Получение гексана в промышленности
В промышленности гексан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Формула гексана
Определение и формула гексана
В обычных условиях представляет собой бесцветную жидкость со слабым запахом, который напоминает дихлорэтан. Плотность – 0,6548 г/см3. Обладает сильным наркотическим действием.
Химическая формула гексана
Химическая формула гексана C6H14. Она показывает, что в состав данной молекулы входят шесть атомов углерода (Ar = 12 а.е.м.) и четырнадцать атомов водорода (Ar = 1 а.е.м.). По химической формуле можно вычислить молекулярную массу оксида алюминия:
Mr(C6H14) = 6×Ar(C) + 14×Ar(H);
Mr(C6H14) = 6×12 + 14×1 = 72 + 14 = 86
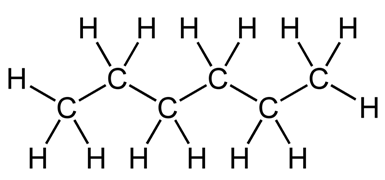
Графическая (структурная) формула гексана
Структурная (графическая) формула гексана является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 1).
Рис. 1. Графическая формула гексана.
В молекуле гексана можно выделить первичные (т.е. связанные одной связью) и вторичные (т.е. связанные двумя связями)атомы углерода.Атомы углерода в гексане находятся в sp3 –гибридизации.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.