Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
CH2=CH–CH2–CH=CH2
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода. Например, пропадиен:
CH2=C=CH2
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С. Например, бутадиен-1,3:
CH2=CH–CH=CH2
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
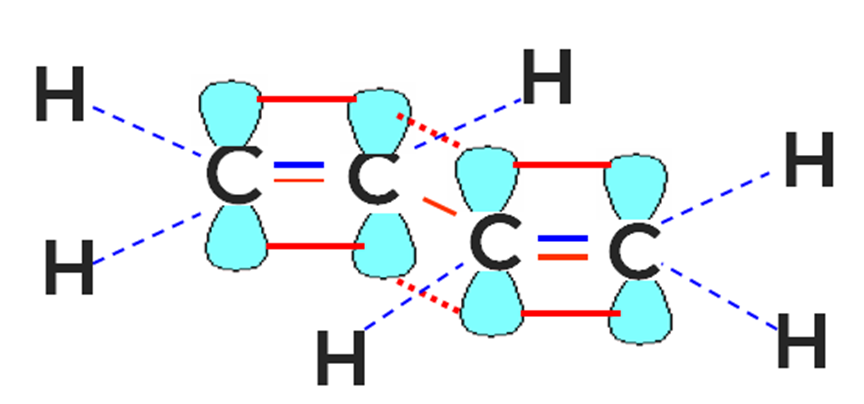
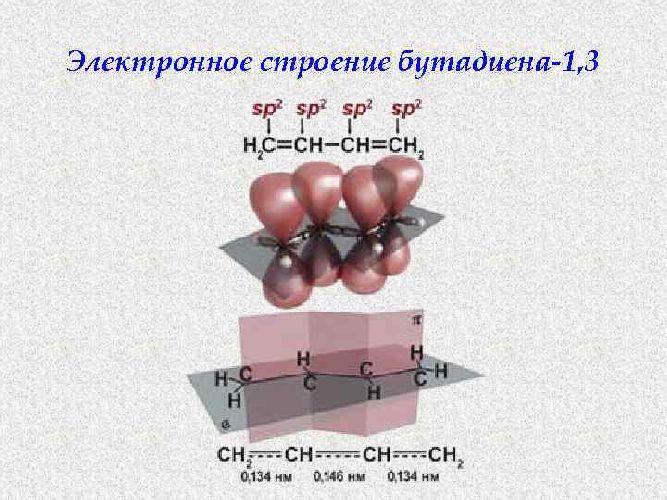
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2—гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей.
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Например, 2-метилбутадиен-1,3:
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4
| Гексадиен-1,3 |
Гексадиен-2,4 |
 |
 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен)
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
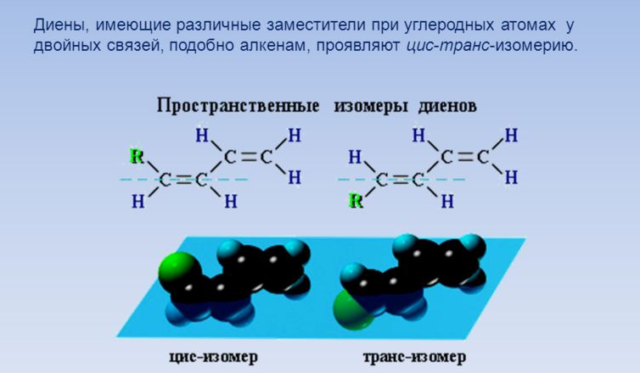
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен |
транс-Алкадиен |
 |
 |
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
CH2=CH–CH=CH2
Номенклатура алкадиенов
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
Например, алкадиен имеет название бутадиен-1,3.
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
План урока:
Алкадиены или диены
Алкины
Алкадиены или диены
Алкадиены (их также называют диенами) – это углеводороды, которые имеют в своем составе 2 двойных связи.
Строение и номенклатура алкадиенов
Рассмотрим более подробно, что из себя представляют молекулы диенов, какой они имеют атомный состав, узнаем подробнее их структуру и изомерию.
Молекулярная формула диенов
Для начала определим: как связаны между собой число атомов углерода и водорода в молекуле диена. Общая формула алкадиенов выглядит так:
Из уроков про алканы и алкены мы знаем, что n – число атомов углерода в молекуле, и задается любое. Так как в молекуле диена присутствуют две двойных связи, то минимальное число атомов углерода должно быть 3, т.е. 3 атома углерода будут связаны между собой только двойными связями, как показано формулой ниже:
Для примера воспользуемся формулой, чтобы узнать молекулярный состав диенов, у которых 3, 4 или 7 атомов углерода.
Подставляем эти числа в формулу, и получаем молекулярные составы:
Теперь, зная молекулярный состав молекул, разберемся с их структурой.
Структурное строение молекул диенов
Всего существует 3 варианта расположение двойных связей, от которого будет зависеть гибридизация атомов углерода.
Рассмотрим каждый из них.
- Кумулированные связи. Что же означает это сложное слово? Кумулированные – это двойные связи, которые стоят у соседних атомов углерода, например у 1 и 2. Для наглядности посмотрим на рисунок ниже. У 1 и 3 атома углеродов тип гибридизации –sp2, и это означает, что у них есть 1 p-орбиталь, имеющая свою обычную форму в виде восьмерки. Только у 1 атома эта восьмерка расположена «горизонтально», а у 3 – «вертикально» (показано на рисунке 1).
У 2 атома углерода тип гибридизации – sp, и у него есть 2 p-орбитали с обычной формой – одна расположена «вертикально», а вторая «горизонтально» (смотрим на 2 атом углерода на рисунке 1).
Между первым и вторым атомом углерода образуются σ-связь (при перекрывании гибридных орбиталей, выделена синей линией) и π-связь (от перекрывания «горизонтальных» p-орбиталей, выделено зеленой линией). Между вторым и третьим также образуются σ-связь (от перекрывания гибридных орбиталей, выделена синей линией) и π-связь (от перекрывания «вертикальных» p-орбиталей, выделена зеленой линией).
Рисунок 1. – Образование кумулированных двойных связей
- Сопряженные связи. Если между двумя двойными связями есть одна одинарная связь, то такие связи называются сопряженными. Все 4 атома углерода, которые участвуют в образовании этих связей, имеют sp2-гибридизацию. При этом негибридизованные p-орбитали образуют так называемую пи-систему кратных связей, что представлено на рисунке 2. Пример структурной формулы диена с сопряженными кратными связями представлен ниже.
Рисунок 2. – Образование сопряженных кратных связей на примере бутадиена-1,3.
- Изолированные связи. Такой вид связей можно увидеть, если между двойными связями будут находиться несколько одинарных. Гибридизация атомов углерода при двойных связях, как мы уже знаем из первого и третьего уроков – sp2. Пример диена с изолированными связями представлен ниже.
Изомерия диенов
Рассмотрим структурные формулы разных веществ, которые имеют одинаковый атомный состав, (если вспомним, то это ни что иное, как определение «изомерии») на примере диена с названием пентадиен-1,3. Внимательно посмотрим на рисунок ниже и порассуждаем:
- Двойные связи в молекуле могут расположиться у разных атомов углерода. Например, у 1 и 3 или у 1 и 2, а как известно, у соединений с разным строением будут и разные свойства. Не забываем, что такой вид изомерии называется изомерией положения связей (стрелочка 1).
- Предположим, что кратные связи остались у 1 и 3 атома углеродов, но длина углеродного скелета теперь не 5, а 4 атома углерода, но зато есть метил-радикал. Если посчитаем число атомов углерода и водорода в полученном соединении (которое имеет название 2-метилбутадиен-1,3) и пентадиене-1,3, то выяснится, что их количество одинаково. Помним, что такой вид изомерии называется структурной (стрелочка 2).
- Сделаем так, что теперь в соединении вообще не будет никаких двойных связей, но зато будет 1 тройная. Посчитаем атомы углеродов и водородов. Получилось, что их ровно столько же, сколько и в пентадиене-1,3. Углеводород с 1 тройной связью – это один из отдельных классов углеводородов. А теперь вспомним, как называется вид изомерии, когда вещества относятся к разным классам, но имеют одинаковый состав? Если забыли, то ответ: межклассовая изомерия (стрелочка 3).
- Теперь немного поиграем с расположением атомов водорода и у атомов при одной из двойных связей. Если оба атома водорода будут, например, только снизу, то это цис-пентадиен-1,3. Если один атом водорода снизу, а второй сверху относительно двойной связи, то это транс-пентадиен-1,3. Такая изомерия называется пространственной (стрелочки 4 и 5).
Номенклатура алкадиенов
Выше уже были даны названия некоторым диенам, например пентадиен-1,3, 2-метилбутадиен-1,3 и другие. Почему их называют именно так? Есть ли какие-то закономерности? Если внимательно присмотримся к строению диенов и вспомним уроки 2 и 3, где рассказывалось про номенклатуры алканов и алкенов, то сразу станет понятно, что названия даются таким образом, чтобы учесть число атомов в самой длинной углеродной цепочке, наличие заместителей, и расположение кратных связей.
Сравним известный нам из третьего урока пентен-1 и пентадиен-1,3. Структурные формулы этих соединений выглядят так:
Что видим общего? И там и там атомы пронумерованы с того конца, где расположение кратных связей ближе. В углеродных цепочках по 5 атомов углерода (а из второго урока помним, что 5 – это корень пент-..). Названия оканчиваются суффиксом –ен, и через дефис в конце указывается, от каких атомов углерода берет начало двойная связь.
Какие видим различия? То, что в названии диена перед –ен стоит частичка ди, и корень не просто пент-, а пента-.
В органической химии, если в соединении несколько кратных связей, то в названии прописывается их количество, но только не по-русски, а по-древнегречески. Вспомним, что тоже самое делалось, когда давалось название сложному алкану, у которого было много одинаковых заместителей и нужно было указать их число (например 2,5,6,7-тетраметилдекан).
Точно также указывается количество двойных связей, но не перед корнем, а перед суффиксом. В алкадиенах их всегда две, а значит и все названия диенов будут оканчиваться одинаково: вот-такой диен. И обязательно указать, у каких атомов берут начало кратные связи в конце названия через запятые. Например: октадиен-1,2; гептадиен-2,5 илинонадиен-4,8.
Номенклатура диенов с заместителями строится по такому же принципу, как и у алкенов с заместителями, но только нужно помнить про разницу, указанную выше. Если забыли эту тему – срочно открывайте третий урок по органической химии, а если помним, то смотрим таблицу с номенклатурой алкадиенов для закрепления знаний.
Таблица 1. — Номенклатура алкадиенов
Физические свойства алкадиенов
Пропадиен и бутудиен по агрегатному состоянию – газы.
Диены, в составе которых от 5 до 17 атомов углерода, относятся к легкокипящим бесцветным жидкостям, температуры кипения и плавления некоторых представлены в таблице ниже. Выше 18 атомов углерода – твердые вещества.
Получение сопряженных алкадиенов
В органической химии большой интерес вызывают диены с сопряженными кратными связями, строение которых рассматривалось выше. Поэтому ниже будет повествование о способах синтеза и химических свойствах соединениях именно этого типа.
Рассмотрим способы получения алкадиенов
- Реакция Лебедева С.В. В 1928 году в мире наступала эпоха, когда люди хотели получать резину не из природных материалов, а с помощью химических превращений из дешевых реагентов. Такой интерес был вызван тем, что началось развитие машиностроения, и необходимо было добывать материалы, которые использовались бы для создания шин. Изначально такие материалы делались только в странах, где росло особое дерево – гевея, сок которого отверждался на воздухе и превращался в гибкий материал (рисунок 3). Но такое дерево может расти не везде, а кататься на машинах хотелось всем, вот и придумали особый способ получения вещества, которое впоследствии превращалось в резину.
Такой способ включает в себя одновременно 2 реакции: дегидрирование и дегидратацию (что это за реакции было подробно рассказано на 2 и 3 уроках).
Реакция Лебедева записывается следующим образом:
Рисунок 3. – Добыча сока гивеи.
- Дегидратация гликолей в присутствии серной кислоты.
Чтобы получить сопряженный диен данным методом, необходимо подобрать правильно гликоль.
На представленном ниже рисунке видно, какая у него должна быть структурная формула: фрагмент углеродной цепи, где позже будут находиться сопряженные двойные связи, должен содержать 4 атома углерода (каждый из них пронумерован), причем ОН-группы стоят именно у 1 и 4 атомов углерода. Помимо этого, у 2 и 3 атомов углерода обязательно должны стоять атомы водородов (хотя бы по 1 штуке).
При протекании реакции у 1 и 4 атомов углерода разрушаются связи С-ОН, а у 2 и 3 разрушаются связи С-Н, что видно на рисунке ниже.
После этого начинают образовываться связи между 1 и 2, 3 и 4 атомами углерода, а также между атомами водорода и ОН-группами, что показано на рисунке ниже.
Вещество Н-ОН – это не что иное, как Н2О, т.е. молекула воды, которая является побочным продуктом данной реакции.
Если совместим первый и последний рисунки, добавим условия реакции, то получим схему образования диена с помощью дегидратации гликолей:
- Получение из дигалогеналканов.
Теперь рассмотрим схему получения сопряженных диенов из дигалогеналканов, которая изображена вверху рисунка, который представлен ниже. Как и в случае с гликолями, фрагмент углеродной цепочки, где будут двойные связи, должен содержать 4 атома углерода, только теперь вместо ОН-групп у 1 и 4 атомов углеродов стоят заместители-галогены (хлор, бром или иод).При протекании реакции происходит разрыв связей между атомами галогена и углерода, а также водорода и углерода (как показано на нижнем рисунке).
Затем происходит образование двойных связей и образование молекул галогенводородов (в данном случае хлороводорода НСl). Галогенводород взаимодействует с щелочью, в результате чего получается соль и вода.
Химические свойства сопряженных алкадиенов
Рассмотрим некоторые химические реакции сопряженных диенов: присоединения, горения и полимеризации.
Реакции присоединения сопряженных диенов
Один вариант присоединений выглядит следующим образом: в диене есть 2 двойные связи, и между ними находится одинарная. После протекания реакции там, где были двойные связи(т.е. между 1 и 2, 3 и 4 атомами углерода), появляются одинарные, а там, где стояла одинарная (т.е. между 2 и 3 атомами углерода) – появляется двойная. Вещество А-Б распадается на 2 части (на частичку А и частичку Б), которые присоединяются к 1 и 4 атомам углерода, как это показано на рисунке ниже.
Рассмотрим, как к молекуле диена присоединяются галогены, водород и вода.
- Качественная реакция диенов – галогенирование. Аналогично, как и алкены, диены могут взаимодействовать с бромной водой, обесцвечивая ее. Но в этом уроке рассмотрим взаимодействие диена с чистым хлором.
- Гидрирование. На платиновом или никелевом катализаторе диен превращается в алкен. Можно правильно заметить, что получившийся алкен также может подвергаться реакции гидрирования, образуя насыщенный углеводород.
- Гидратация. Эта реакция проходит в кислой среде, например в присутствии серной кислоты. Молекула воды разрывается по связи Н-ОН на 2 частички, которые присоединяются к диену в соответствии с вышеупомянутым правилом.
Также есть еще один вариант протекания реакций присоединения: в этом случае вещество А-Б присоединяется только к 1 из кратных связей, как показано на схеме ниже. Такой вариант присоединения на практике хоть и встречается, но очень редко (например, при взаимодействии 10 молекул бутадиена с бромом, 8 молекул превратятся в 1,4-дибромбутен-2, и только 2 молекулы в 3,4-дибромбутен-1).
Реакции полимеризации и горения
При полимеризации сопряженных диенов происходит тоже самое, что и при реакциях присоединения: одинарная связь между кратными превращается в двойную, а кратные становятся одинарными. Рассмотрим пример образования полимера из диена. Условия реакции – использование катализатора (например, хлороводородной кислоты) и повышенной температуры. Помним, что n – большое число молекул, например 200 или даже 1000.
При горении диенов в кислороде образуются углекислый газ и вода. Общая формула горения диенов выглядит так:
Воспользуемся формулой и определим коэффициенты в реакции горения гептадиена-1,5:
Применение алкадиенов
Основная область применения диенов – органический синтез, цель которого получить каучуки с определенным набором свойств. Каучуки – это полимерные материалы, обладающие упругостью, из которых впоследствии делают резину.
Алкины
На данный момент были рассмотрены почти все возможные углеводороды ациклического строения. Рассматривались соединения только с одинарными связями, с одной двойной связью и даже с двумя двойными. И остался еще один тип углеводородов – такие, которые содержат в своем составе 1 тройную связь между атомами углерода – алкины.
Общая формула алкинов, как и у диенов:
Однако, в отличии от них, минимальное число атомов углерода в составе алкина – 2 (т.к. тройная связь может образоваться между 2 атомов углерода). А вот и пример – молекула ацетилена:
Тройная связь образуется между рядом стоящими атомами углерода, находящихся в sp-гибридизации по схеме, изображенной на рисунке 4.
Рисунок 4. Перекрывание «горизонтальных» и «вертикальных» негибридных p-орбиталей при образовании двух π-связей (желтые и синие), и перекрывание гибридных орбиталей при образовании σ-связи (серые) Источник
Номенклатура алкинов
Правила и алгоритмы названия алкинов идентичны алкенам, с той лишь разницей, что суффикс используется не –ен, а –ин. По точно такому же принципу даются названия и алкинам с заместителями.
Изомерия алкинов
Подробно про некоторые виды изомерии рассказывалось в первой части урока и чтобы не повторяться, просто перечислим слева направо, какие виды изомерии характерны для алкинов, на примере пентина-1:
- Углеродного скелета,
- Положение кратной связи,
- Межклассовая.
Физические свойства алкинов
По своим физическим свойствам алкины схожи с алкенами, у которых такой же структурный состав, однако имеют более высокие температуры плавления и кипения, что отражено в таблице.
Таблица сравнения температуры кипения и плавления алкинов и соответствующих алкенов
Агрегатное состояние алкинов меняется от газообразного до твердого, в зависимости от содержания атомов углерода в них.
C2H2-C4H6 бесцветные газы, не имеющие запаха
C5H8-C15H28 жидкости
С C16H30 твердые вещества
Алкины плохо растворяются в воде и хорошо растворяются в органических растворителях.
Способы получение алкинов
Рассмотрим некоторые реакции получения алкинов.
Общие способы получения алкинов
- Взаимодействие дигалогеналканов со спиртовым раствором щелочи. В этой реакции обязательно условие, чтобы атомы галогенов были заместителями у 1 и 2 или 2 и 3, или 3 и 4 и т.д, другими словами: у двух соседних атомов углерода.
- Взаимодействием металлорганического соединения, содержащего тройную связь, с алкилгалогенидом. В этой реакции происходит разрыв связи между атомами галогена и углерода в алкилгалогениде, и разрыв связи между атомом металла и углерода в металлорганическом соединении. После этого образовавшиеся радикалы соединяются между собой, а металл соединяется с галогеном, образуя соль.
Способы получения этина
Для получения этина можно использовать некоторые уникальные реакции.
- Дегидрирование метана. При 1500 °С метан превращается в этин.
- Гидролиз карбида кальция. Раньше среди детских забав была одна опасная игра – найти где-нибудь карбид кальция и бросить его в лужу. В результате гидролиза выделялся прозрачный газ, который хулиганы поджигали, и смотрели за тем, как «горит лужа». Повторять такие «уличные» опыты нельзя, т.к. для этого есть специальные лаборатории, где почти полностью исключена возможность получить опасные травмы.
Химические свойства алкинов
Для алкинов характерны реакции присоединения, окисления, горения тримеризации и «серебряного зеркала». Ниже рассмотрим, как протекают эти реакции и разберемся, что такое тримеризация и «серебряное зеркало».
Реакции присоединения
Как и в алкенах или диенах, присоединение веществ происходит по кратной связи. Изначально при присоединении образуется алкен, который дальше также может вступать с присоединяемым веществом в реакцию, в результате чего получаются алканы различного состава. Рассмотрим схематично, как происходит присоединение к молекулам алкинов галогенов, водорода, галогенводородов и воды.
- Галогенирование. Стоит отметить, что этот тип реакций является качественным на алкины. Еще раз разберемся, что такое качественная реакция. Предположим, что учительница Ванечки, Зинаида Алексеевна, дала ему две пробирки с бесцветными жидкостями и сказала: «Ванечка, вот в одной пробирке есть алкан, а в другой – диен. Как узнать, в какой пробирке какое вещество?». Что сделает Ванечка? Он возьмет бромную воду, которая коричневого цвета, и добавит в каждую пробирку. В одной пробирке бромная вода станет прозрачной, а в другой цвет ее не изменится. Это будет означать, что в одной пробирке реакция прошла, а в другой нет.
Как мы помним, алканы не взаимодействуют с бромной водой, и с ней взаимодействуют только соединения с кратными связями. Реакции, которые характерны только для определенных веществ называются качественными.
На бумаге протекание реакции можно изобразить следующим образом:
- Гидрирование в присутствии палладия:
- Гидрогалогенирование. Здесь следует помнить про правило Марковникова и правильно располагать водород и галоген у атомов углерода.
- Реакция Кучерова. Гидролиз алкинов в присутствии солей ртути в кислой среде позволяет получать кетоны – кислородсодержащие соединения, о которых поговорим подробнее через несколько уроков.Для понимания на данный момент уясним, что кетоны – это такие органические вещества, в которых атом углерода соединен двойной связью с кислородом. Оба водорода от молекулы воды присоединяются к гидрированному атому углерода, а кислород – к менее гидрированному. Отличительная особенность от гидролиза углеводородов с двойными связями: там молекула воды распадалась на Н и ОН частицы.
Некоторые другие реакции
Рассмотрим еще некоторые химические реакции алкинов, и поймем, что такое тримеризация и странные «серебряные зеркала».
Реакции окисления
При взаимодействии с окислителем алкин превращается в карбоновую кислоту. Реакция протекает в кислой среде. При окислении происходят окислительно-восстановительные процессы с переносом электронов между атомами, и, основываясь на этом, можно составлять полноценные химические уравнения с расстановкой коэффициентов.
Реакция тримеризации
А вот и первое непонятное слово. Тримеризация – это реакция взаимодействия между собой трех молекул алкена, из которых получается одна молекула, которая называется бензол.
Реакция серебряного зеркала
Как и галогенирование, эта реакция является качественной на алкины. Почему же ее так назвали? Все дело в том, что для ее проведения используется особый реагент – аммиачный раствор оксида серебра. При взаимодействии этого реагента с алкином выделяется серебристо-белый осадок, который покрывает равномерным слоем внутреннюю поверхность посуды, в которой проводился опыт. Если присмотреться, то в таком осадке можно увидеть свое отражение, как в зеркале.
Источник
Реакция горения
Алкины горят в присутствии кислорода, и для описания этой реакции можно воспользоваться формулой, которую уже встречали у диенов:
Как и при горении многих других органических веществ, основными продуктами реакции будут СО2 и Н2О.
Применение алкинов
Алкины нашли свое применение в качестве исходных материалов при синтезе различных полимеров, таких как: каучуки, пленки и пластмассы. Также из алкинов синтезируют клеющие вещества.
Но стоит помнить: алкины – ядовитые вещества, которые могут вызывать наркотический эффект или судороги. Поэтому обращаться с ними следует очень осторожно.
План урока
- Строение алкадиенов. Классификация и номенклатура. Сопряжённые алкадиены
- Изомерия алкадиенов
- Физические свойства алкадиенов
- Химические свойства алкадиенов
- Полимеризация алкадиенов. Каучуки
- Получение алкадиенов
- Применение алкадиенов
Цели урока
- рассмотреть особенности строения сопряжённых алкадиенов
- научиться составлять структурные формулы непредельных углеводородов — алкадиенов
- научиться составлять изомеры алкадиенов и давать им названия
- научиться составлять уравнения химических реакций с участием алкадиенов
- рассмотреть особенности полимеризации сопряжённых алкадиенов
- рассмотреть основные способы получения алкадиенов
- рассмотреть основные направления применения алкадиенов и каучуков
Разминка
- Какие виды изомерии характерны для алкенов?
- Как связаны строение и химические свойства алкенов?
- Какие химические реакции характерны для непредельных углеводородов — алкенов? Почему?
- Укажите способы получения алкенов.
- Расскажите о применении алкенов.
Строение алкадиенов. Номенклатура
Алкадиены
являются непредельными углеводородами. В отличие от алкенов они содержат 2 двойные связи. Поэтому и в названии алкадиенов мы встречаем суффиксы
ди
(два) и
ен
(двойная связь). Соответственно общая формула алкадиенов на 2 водорода меньше по сравнению с алкенами:
CnH2n-2
.
Алкадиены классифицируют на 3 группы.
1.
Изолированные
Двойные связи разделены минимум 2 одинарными связями. Например, пентадиен-1,4.

2.
Кумулированные
Двойные связи у одного атома углерода.
Самый простой пример данных алкадиенов — это пропадиен.

3.
Сопряжённые
Наибольшее значение в промышленности и технике имеют сопряжённые алкадиены, в молекулах которых две двойные углерод-углеродные связи разделены одной одинарной связью. Так возникает общая сопряжённая система между 4 атомами углерода (рис. 1).
Рисунок 1. Строение бутадиена-1,3
Это и обусловливает специфические свойства алкадиенов.
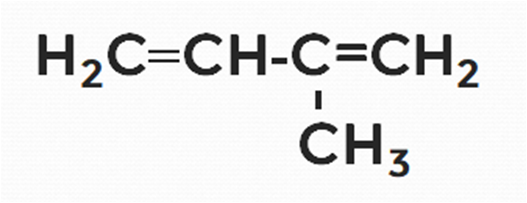
Пример 1
Дайте название следующему алкадиену.
Решение
1. Нумерацию цепи делаем справа, где ближе разветвление от основной цепи.
2. Называем радикалы, цифрами указываем их расположение.
Получается следующее название 2-метил…
3. Даём название основной цепи, содержащей 4 атома углерода (бутадиен):
2-метилбутадиен.
4. Цифрами указываем расположение двойных связей: 2-метилбутадиен-1,3.
5. В итоге получаем следующее название: 2-метилбутадиен-1,3.
Упражнение 1
Составьте сокращённые структурные формулы следующих алкадиенов: бутадиен-1,3, 2-метилпентадиен-1,4, бутадиен-1,2.
Изомерия алкадиенов
Для алкадиенов, как и для алкенов, будут характерны следующие виды изомерии:
углеродного скелета, положения кратных связей
.
Такую же общую формулу, как у алкадиенов, имеют непредельные углеводороды
алкины
, содержащие
тройную связь
в составе. Следовательно, алкадиены являются изомерами алкинов.
Это
межклассовая изомерия
.
В результате реакции полимеризации сопряжённые алкадиены могут образовывать
пространственные изомеры
.
Физические свойства алкадиенов
Алкадиены различны по свойствам. Мы остановимся на самых значимых представителях этого класса углеводородов.
Бутадиен-1,3, или дивинил — легко сжижающийся газ с неприятным запахом, не растворяется в воде.
2-Метилбутадиен-1,3 (изопрен) — летучая жидкость, растворяется в большинстве углеводородных растворителях, не растворим в воде.
Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды
, поэтому для них, как и для алкенов, будут характерны
реакции присоединения
.
Мы рассмотрим реакции на основе сопряжённых алкадиенов, имеющих большое значение в промышленности.
У сопряжённых алкадиенов две двойные связи разделены одинарной, поэтому возможны три варианта протекания реакций присоединения.
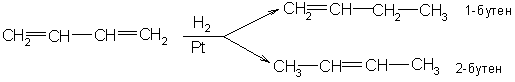
1. 1,2 присоединение. Атомы присоединяются к первому и второму атомам углерода.
2. Полное (исчерпывающее) присоединение. Атомы присоединяются к четырём атомам углерода, соединённых двойными связями.
3. 1, 4 присоединение. Атомы присоединяются к первому и четвёртому атомам углерода, а между вторым и третьим атомами появляется двойная связь.
Рассмотрим эти варианты на примерах.
Реакции присоединения
1. Гидрирование
Гидрирование
, как у вы уже знаете, это реакция присоединения водорода.
Рассмотрим варианты присоединения на примере сопряжённого алкадиена бутадиена-1,3.
1 вариант. 1,2 присоединение
H2C=CH-CH=CH2 + H2 →t, кат H3C-CH2-CH=CH2
Атомы водорода присоединяются к первому и второму атомам углерода. Одна двойная связь остаётся, образуется алкен бутен-1.
Реакция каталитическая и протекает при высокой температуре.
2 вариант. 1,2,3,4 присоединение
В данном случае образуется алкан — бутан:
H2C=CH-CH=CH2 + 2H2 →t, кат H3C-CH2-CH2-CH3.
3 вариант. 1,4 присоединение
H2C=CH-CH=CH2 + H2 →t, кат H3C-CH=CH-CH3
В нашем примере из бутадиена-1,3 получился алкен бутен-2.
Следующие реакции протекают аналогично реакциям гидрирования. Мы будем рассматривать 1,2 и 1,4 присоединение.
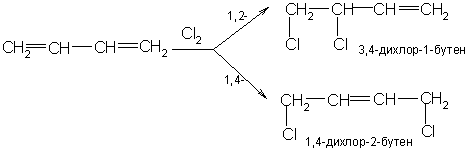
2. Галогенирование
1,2 присоединение
H2C=CH-CH=CH2 + Cl2 → Cl-CH2-CH(Cl)-CH=CH2
1,4 присоединение
H2C=CH-CH=CH2 + Cl2 → Cl-CH2-CH=CH-CH2-Cl
Алкадиены, как и алкены,
обесцвечивают бромную воду
. Это качественная реакция на вещества с кратными связями.
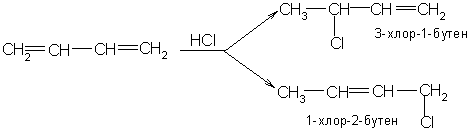
3. Гидрогалогенирование
Реакции протекают аналогично предыдущим.
1,2 присоединение протекает по правилу Марковникова, поэтому водород присоединяется к первому атому углерода, а галоген (хлор) ко второму:
H2C=CH-CH=CH2 + HBr →CH3-CH(Br)-CH=CH2.
1,4 присоединение
H2C=CH-CH=CH2 + HBr → CH3-CH=CH-CH2-Br
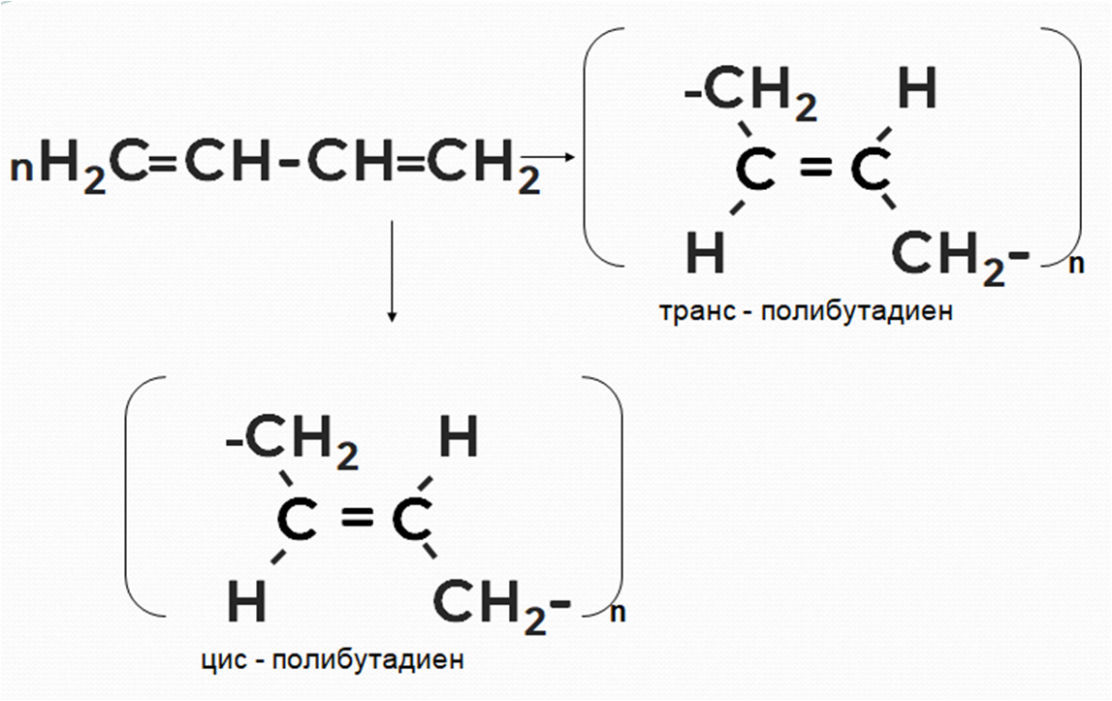
4. Реакция полимеризации
В результате реакции
полимеризации
сопряжённых алкадиенов образуются
полимеры
, которые называют
каучуками
.
Рассмотрим механизм реакции на примере полимеризации бутадиена-1,3. Двойная связь возникает между 2 и 3 атомами углерода. У крайних же атомов связи разрываются, благодаря чему образуются длинноцепочечные молекулы — каучуки (рис. 2).
Рисунок 2. Схема пространственной полимеризации бутадиена-1,3
Бутадиеновый каучук
— это первый
синтетический каучук
. В природе каучуки содержатся в соке некоторых растений, называемых каучуконосами, например гевеи (рис. 3). В XIX веке природный каучук, являющийся полимером 2-метилбутадиена-1,3, добывали только из растений. Не удивительна поэтому высокая стоимость
резины
, которую изготавливали из природного каучука.
Сейчас известно много различных каучуков. Все они синтезируются искусственно.
Рисунок 3. Добыча каучука из гевеи бразильской
Окислительно-восстановительные реакции
Все алкадиены горят с образованием углекислого газа и воды:
2H2C=CH-CH=CH2 + 11O2 →8CO2 +6H2O.
Получение алкадиенов
1. Дегидрирование алканов
CH3-CH2-CH2-CH3→-t,катCH2=CH-CH=CH2 + 2H2
В результате из бутана, содержащегося в природном газе, получают бутадиен-1,3
Рисунок 4.
С. В. Лебедев
2. Синтез Лебедева
Лебедев Сергей Васильевич в 1927 году первым разработал промышленный способ получения синтетического каучука из этилового спирта.
2CH3-CH2-OH→t, кат
CH2=CH-CH=CH2 + 2H2O + H2
Упражнение 2
Допишите левые части уравнений реакций с участием алкадиенов, укажите условия их протекания.
а) →CH3–C(CH3)=CH–CH3
б) →CH3–CH(Br)-CH=CH2
в) →Cl-CH2–CH(Cl)-CH(Cl)–CH2-Cl
г) →[-CH2–C(CH3)=CH–CH2-]n
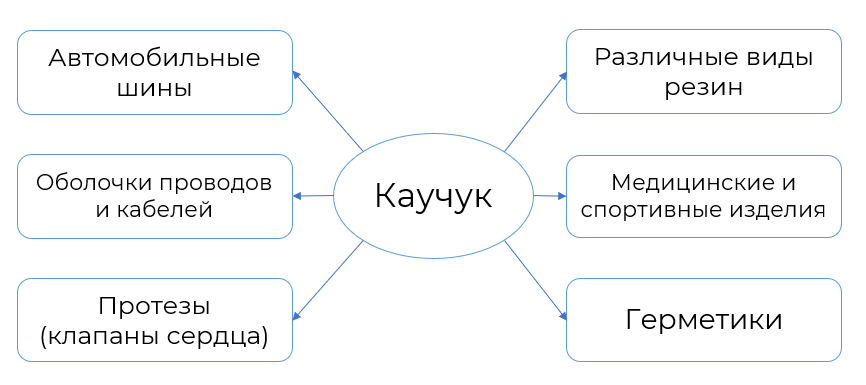
Применение алкадиенов
Сопряжённые алкадиены применяются для получения каучуков. Каучуки обладают эластичностью
(эластомеры)
, не пропускают воду и газы. Поэтому из каучуков изготавливают шины, строительные материалы, обувь. Более подробно области применения представлены на рисунке 5.
Рисунок 5. Применение каучуков
Однако натуральный каучук очень чувствителен к перепадам температур, поэтому приходится проводить процесс вулканизации с помощью серы, которая соединяет полимерные цепи каучука. Так появляется известный нам продукт —
резина
.
В отличие от каучуков она выдерживает как низкие, так и высокие температуры, лучше устойчива к механическому воздействию.
Упражнение 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
этанол → бутадиен-1,3 → 1,4-дибромбутен-2.
Формулы веществ записывайте структурно.
Контрольные вопросы
- В чём особенности строения сопряжённых алкадиенов?
- Какие виды изомерии характерны для алкадиенов?
- Почему реакции присоединения у сопряжённых алкадиенов протекают в разных положениях?
- Назовите способы получения алкадиенов.
- Что такое каучуки? Где они применяются?
Ответы
Упражнение 1
H2C=CH-CH=CH2 бутадиен-1,3,
H2C=C(CH3)-CH2-CH=CH2 2-метилпентадиен-1,4,
H2C=C=CH-CH3 бутадиен-1,2
Упражнение 2
а) H2C=C(CH3)-CH=CH2 + H2 →CH3–C(CH3)=CH–CH3
б) H2C=CH-CH=CH2 + HBr →CH3–CH(Br)-CH=CH2
в) H2C=CH-CH=CH2 + 2Cl2→Cl-CH2–CH(Cl)-CH(Cl)–CH2-Cl
г) nH2C=C(CH3)-CH=CH2→[-CH2–C(CH3)=CH–CH2-]n
Упражнение 4
этанол → бутадиен-1,3 → 1,4-дибромбутен-2
2CH3-CH2-OH→ t, кат CH2=CH-CH=CH2 + 2H2O + H2
CH2=CH-CH=CH2 + Br2→Br-CH2-CH=CH-CH2-Br
Диеновые
углеводороды имеют две двойные связи
в молекуле и отвечают общей формуле
СnH2n-2.
В
зависимости от взаимного расположения
двойных связей диеновые углеводороды
можно разделить на три основных типа:
1)
углеводороды с кумулированными
(примыкающими к одному атому углерода)
двойными связями – аллен и его гомологи;
2)
углеводороды с сопряженными
(конъюгированными) двойными связями –
дивинил и его гомологи;
3)
углеводороды с изолированными
двойными связями.
Диеновые
углеводороды по систематической
номенклатуре называются так же, как и
этиленовые углеводороды, только вместо
суффикса «ен» ставится суффикс «адиен»
(так как двойных связей две). Положение
двойных связей, как обычно, показывают
цифрами. Для некоторых диенов сохранились
тривиальные или старые рациональные
названия:

Диеновые
углеводороды первых двух типов проявляют
своеобразные свойства. Для углеводородов
третьего типа характерны обычные реакции
алкенов, только в них принимают участие
не одна, а обе связи с большей или меньшей
селективностью.
Наибольшего
внимания заслуживают углеводороды с
сопряженными двойными связями.
3.3.1 Способы получения важнейших диенов
Способы
получения углеводородов ряда дивинила
в большинстве случаев не отличаются от
способов получения олефинов, только
соответствующие реакции необходимо
проводить дважды или в качестве исходного
вещества применять соединения, уже
содержащие двойную связь.
Дивинил
и изопрен получают в промышленности
дегидрированием соответственно
бутано-бутиленовых или изопентан-изоамиленовых
смесей обычно над катализаторами,
содержащими Cr2O3:

2.
Очень большую роль в промышленном
производстве дивинила сыграл метод С.
В. Лебедева:
2С2Н5ОН
→ СН2=СН–СН=СН2
+ 2Н2О
+ Н2
(70% от теоретического)
3.
Дивинил, изопрен, диизопропенил получают
дегидратацией гликолей:
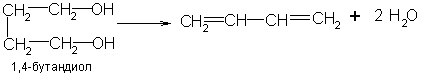
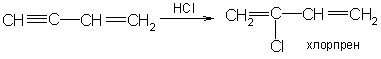
4.
Хлорпрен получают присоединением
хлористого водорода к винилацетилену:
Физические
свойства 1,3-алкадиенов
Дивинил
при обычных условиях – газ. Изопрен и
другие простейшие алкадиены – жидкости.
Обычные закономерности, свойственные
гомологическим рядам углеводородов,
действуют и в этом ряду.
Для
алкадиенов с сопряженными двойными
связями характерны аномально высокие
показатели преломления света. Благодаря
этой особенности найденные молекулярные
рефракции алкадиенов значительно больше
вычисленных. Разница между найденной
и вычисленной величинами составляет
обычно 1 ÷ 1,5 единицы. Она называется
молекулярной
экзальтацией.
3.3.2 Химические особенности 1,3-алкадиенов
Две
сопряженные π-связи образуют общее
электронное облако – все четыре
углеродных атома находятся в состоянии
sp2-гибридизации
(см. главу 2). Это приводит к укорочению
простой связи (до 0,146 нм) и к стабилизации
молекулы. Так, например, энергия
образования молекулы дивинила на 14,6
кДж/моль больше по сравнению с вычисленной
энергией образования углеводорода того
же состава, но без учета сопряжения
двойных связей. Эту разность называют
энергией резонанса. Эта особенность в
строении диеновых углеводородов делает
их способными присоединять различные
вещества не только по одной из двойных
связей, но и к крайним атомам сопряженной
системы – в 1,4-положения с перемещением
двойной связи. Такое присоединение
определяется динамическим эффектом
сопряжения, т.е. перераспределением
электронной плотности молекулы под
влиянием атакующего агента.
Гидрирование
Каталитически
возбужденный водород присоединяется
в 1,2- и 1,4-положения:
Галогенирование
Галогены
также способны присоединяться к
сопряженным системам в 1,2- и 1,4-положения:
Как
и в случае этиленовых углеводородов,
присоединение может проходить как по
ионному, так и по радикальному механизму.
При
ионном механизме присоединения
первоначально возникающий π-комплекс
(I)
быстро превращается в сопряженный
карбониевый ион с положительным зарядом
на втором и четвертом углеродных атомах.
Этот ион можно изобразить или двумя
граничными формулами (II)
или одной формулой (III).
Этот карбкатион присоединяет анион
галогена с образованием продуктов 1,2-
и 1,4-присоединения:
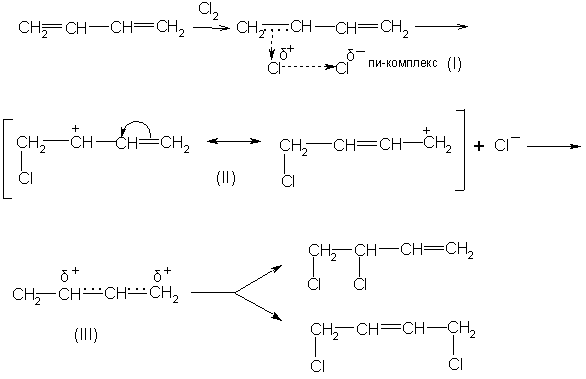
Гидрогалогенирование
В
реакциях присоединения галогеноводородов
действуют те же закономерности:
Гипогалогенирование
Гипогалогенитные
кислоты и их эфиры присоединяются
преимущественно в 1,2-положение:

Димеризация
При
нагревании молекулы диеновых углеводородов
способны присоединяться друг к другу
таким образом, что одна из них реагирует
в 1,2-, а другая в 1,4- положениях. Одновременно
в небольших количествах образуется
продукт, когда обе молекулы реагируют
в 1,4-положениие:
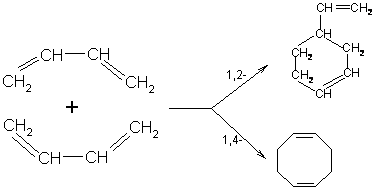
Диеновый
синтез
Диеновые
углеводороды особенно легко димеризуются
с молекулами, имеющими активированную
двойную связь. Реакции этого типа
называются диеновым синтезом или
реакциями Дильса-Альдера:

Полимеризация
Важной
особенностью диеновых углеводородов
с сопряженными связями является их
способность полимеризоваться в
каучукоподобные продукты.
Промышленный
интерес представляет цепная полимеризация
диеновых углеводородов под влиянием
катализаторов или инициаторов. В качестве
катализаторов используются щелочные
металлы, металлоорганические соединения,
в качестве инициаторов – органические
и неорганические пероксиды.
При
полимеризации отдельные молекулы
мономеров могут соединяться друг с
другом в 1,2-, в 1,4-положения или одна
молекула реагирует в 1,2-, а другая – в
1,4- положение:
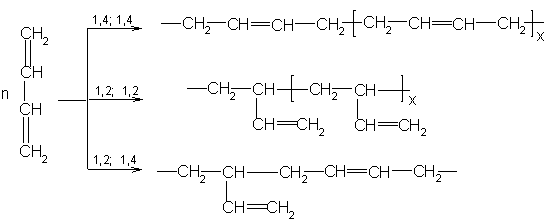
Скорость
полимеризации зависит от строения
диенов и условий полимеризации.
Заместители в середине молекулы
облегчают, а на конце молекулы затрудняют
полимеризацию. Изопрен полимеризуется
быстрее, а пиперилен медленнее, чем
дивинил.
Наиболее
ценные продукты получаются при
стереорегулярной (пространственно
упорядоченной) полимеризации в
1.4-положение с образованием цис-конфигурации
каждого остатка:
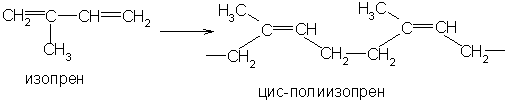
По
химическому составу и строению натуральный
каучук представляет собой стереорегулярный
цис-полимер изопрена.
Строение
каучука и других полимеров диеновых
углеводородов было доказано методом
озонирования (по Гарриесу). Получение
при озонолизе левулинового альдегида
подтверждает упорядоченное 1,4-строение.

Различные
виды синтетического и натурального
каучука широко применяются в промышленности.
Пионером в организации крупного
промышленного производства синтетического
каучука был Советский Союз.
ЗАДАЧИ
ДЛЯ САМОПРОВЕРКИ
1.
Рассчитать массу (г) 1,3-бутадиена,
образующегося в результате дегидрирования
20 дм3
бутана (н. у.), если выход бутадиена
составляет 50%.
2.
При пропускании 200 дм3
(при н. у.) паров этилового спирта над
дегидратирующим и дегидрирующим
катализаторами было получено 90 дм3
газообразного (при н. у.) дивинила.
Определить выход реакции.
3.
Рассчитайте максимальную массу (г)
брома, который может присоединиться к
1,3-бутадиену, если его объем составляет
12 дм3
(условия нормальные).
4.
При окислении по Гарриесу непредельного
углеводорода получен ацетон, масса
которого оказалась равной 29 г. Определить
массу (в г) непредельного углеводорода,
вступившего в реакцию, исходя из
предположения, что выход продуктов
озонолиза – количественный.
5.
Назовите углеводород по международной
номенклатуре
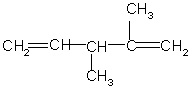
6.
Написать структурную формулу
2,5-диметил-4-изопропил-1,5-гексадиена.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Алкадиены

3.9
Средняя оценка: 3.9
Всего получено оценок: 800.
3.9
Средняя оценка: 3.9
Всего получено оценок: 800.
Ненасыщенные углеводороды, содержащие две двойные связи, называются алкадиенами или диеновыми углеводородами («ди» означает «два»). Общая формула алкадиенов – CnH2n-2.
Гомологи
Диены образуют гомологический ряд пропандиена. Это простейший представитель алкадиенов. Названия гомологов согласно номенклатуре ИЮПАК составляются из греческого числительного и суффикса «диен». Например, пентадиен, бутадиен, гексадиен.
Ряд гомологов С3-С10:
- пропадиен (С3Н4);
- бутадиен (С4Н6);
- пентадиен (С5Н8);
- гексадиен (С6Н10);
- гептадиен (С7Н12);
- октадиен (С8Н14);
- нонадиен (С9Н16);
- декадиен (С10Н18).
Для диенов, начиная с пентадиена, характерна пространственная и структурная изомерия. Например, пентадиен-1,3 с переносом метильной группы ко второму атому углерода превращается в 2-метилбутадиен-1,3 или изопрен.
Виды
В зависимости от расположения двойных связей друг к другу в углеродном скелете выделяют три вида диеновых углеводородов.
|
Вид |
Описание |
Пример |
|
Кумулированные |
Двойные связи располагаются у одного атома углерода. Такие соединения называются алленами. Простейший аллен – пропадиен, содержащий три атома углерода |
СН2=С=СН2 |
|
Сопряжённые |
Двойные связи разделены одной одинарной связью. Простейший представитель – бутадиен |
CH2=CH-CH=CH2 |
|
Изолированные |
Двойные связи разделены несколькими простыми связями. Простейший представитель – пентадиен |
CH2=CH-CH2-CH=CH2 |
Сопряжённые диены отличаются электронным строением. Атомы углерода в таких соединениях находятся в состоянии sp2-гибридизации и образуют единое р-облако за счёт сопряжения двух двойных связей. Такой тип сопряжения называется π,π-сопряжение.
Получение
Диеновые углеводороды получают несколькими способами:
- методом Лебедева из этанола (получение бутадиена):
2СН3-СН2-ОН → СН2=СН-СН=СН2 + 2H2O + Н2;
- дегидрированием из нефтепродуктов:
СН3-СН2-СН2-СН3 → CH2=CH-СН=СН2 + 2Н2;
- дегидрогалогенированием галогеналканов:
CH2Br-CH2-CH2-CH2Br + 2KOH → CH2=CH-CH=CH2 + 2KBr + 2H2O.
Физические свойства
При обычных условиях алкадиены имеют аналогичные с алкенами физические свойства. Простейшие представители ряда алкадиенов – пропадиен и бутадиен – бесцветные легко сжижаемые газы с неприятным запахом. Алкадиены, содержащие от пяти до 17 атомов углерода, а также их изомеры, являются жидкостями. Высшие диены с 18 и более атомами углерода – твёрдые вещества.
Температуры плавления и кипения, а также плотность увеличиваются с увеличением молекулярной массы. При этом разветвлённые изомеры плавятся и кипят при более низких температурах, чем линейные аналоги.
Диены распространены в природе в виде растительных пигментов, гуттаперчи, каучука, холестерина.
Химические свойства
Реакционная способность обусловлена определением положения двойной связи в молекуле диена. Атомы присоединяются в местах разрыва двойных связей, образуя 1,4-, 1,2-, 1,3-присоединение и т.д. В результате одних и тех же реакций образуются разные структурные соединения. Основные свойства диеновых углеводородов представлены в таблице.
|
Реакция |
Описание |
Уравнение |
|
Гидрирование |
Реакция протекает в присутствии катализатора – никеля |
CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3 |
|
Галогенирование |
Присоединение галогенов с образованием тетрагалогеноалканов |
CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 или CH2(Br)-CH=CH-CH2-Br |
|
Гидрогалогенирование |
Присоединение галогеноводородов аналогично реакции с алканами. Реакция протекает в водной или спиртовой среде в присутствии хлорида лития |
CH2=CH-CH=CH2 +HBr → CH3-CH(Br)-CH=CH2 или CH3-CH=CH-CH2-Br |
|
Полимеризация |
Реакция используется для получения искусственного каучука |
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n |
Что мы узнали?
Из урока химии 10 класса узнали, что такое алкадиены или диеновые углеводороды. Диены отличаются от других классов ненасыщенных углеводородов наличием двух двойных связей, которые могут располагаться у одного атома углерода, через одинарную связь или через несколько простых связей. Гомологический ряд образует пропадиен. Простейшие диены – пропадиен и бутадиен – газы, диены С5-С17 – жидкости, высшие диены – твёрдые соединения. Начиная с пентадиена, диеновые углеводороды имеют изомеры. Соединения реагируют с галогенами, водородом, галогеноводородами, а также образуют полимеры.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александра Викторова
10/10
-
Albina Wolf
10/10
Оценка доклада
3.9
Средняя оценка: 3.9
Всего получено оценок: 800.
А какая ваша оценка?