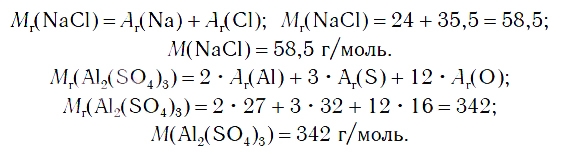В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
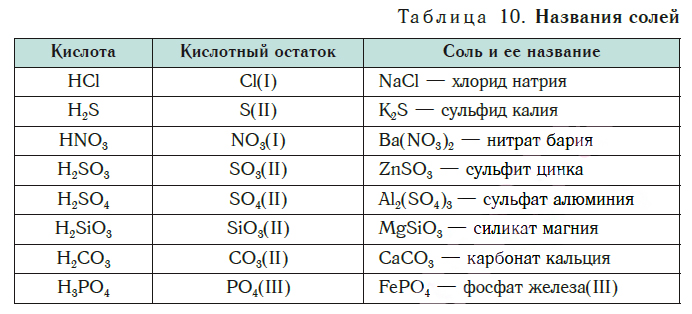
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
похожие вопросы 5
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная
кислота Cl хлорид
—
HF фтороводородная
кислота F фторид
—
HBr бромоводородная
кислота Br бромид
—
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
—
HNO3
азотная кислота NO3 нитрат
—
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
—
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
|
Составьте формулы солей натрия, кальция и алюминия азотной, серной и фосфорной кислот. Какие из этих солей растворимы в воде? (Габриелян. Химия. 8 класс. Параграф 17, № 2) NaNO3- растворима Ca(NO3)2-растворима Al(NO3)3-растворима Na2SO4-растворима CaSO4-малорастворима Al2(SO4)3-растворима Na3PO4-растворима Ca3(PO4)2-растворима AlPO4-нерастворима Знаете ответ? |
Смотрите также: ВПР по химии 8 класс 2020, задания, ответы, демоверсии, где найти? Химия 8 класс учебник Аббасов, где читать онлайн, краткое содержание? Химия 8 класс учебник Усманова, Сакарьянова, где читать онлайн? Химия 8 класс учебник Григорович, где читать онлайн, краткое содержание? Химия 8 класс учебник Еремин, Кузьменко, Дроздов, Лунин, где читать онлайн? Химия 8 класс учебник Габриелян, где читать онлайн, краткое содержание? Химия 8 класс учебник Кузнецова, Титова, Гара, где читать онлайн? ВПР 2022, химия, 8 класс, все варианты с ответами — где найти, скачать? ВПР по химии 8 класс 2021, задания, ответы, демоверсии, где найти? ВПР по химии 8 класс с ответами 2019 год все варианты — где найти/скачать? |
Натрий и калий образуют соли почти со всеми известными кислотами.
Соли можно получить при взаимодействии оксидов или гидроксидов металлов с соответствующими кислотами:
Соли бескислородных кислот образуются при непосредственном взаимодействии простых веществ:
Важнейшие соли натрия:
хлорид натрия (NaCl) (каменная соль, поваренная соль),
карбонат натрия
Na2CO3
(сода, кальцинированная сода) и его кристаллогидрат
Na2CO3⋅10H2O
(кристаллическая сода),
гидрокарбонат натрия
NaHCO3
(питьевая сода),
сульфат натрия
Na2SO4
и его кристаллогидрат
Na2SO4⋅10H2O
(глауберова соль),
нитрат
NaNO3
(натриевая селитра).
Важнейшие соли калия:
хлорид калия (KCl) (сильвин),
карбонат калия
K2CO3
(поташ),
нитрат калия
KNO3
(калийная селитра),
Соединения щелочных металлов окрашивают пламя в характерные цвета.
Рис. (1). Окраска пламени ионами металлов
Соли лития придают ему карминово-красный цвет, соли натрия — жёлтый, калия — фиолетовый, рубидия и цезия — светло-фиолетовый.
Источники:
Рис. 1. Окраска пламени ионами металлов © ЯКласс