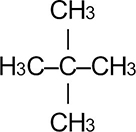
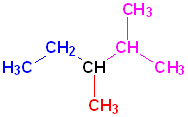
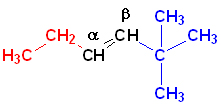
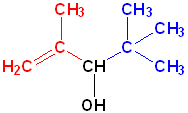
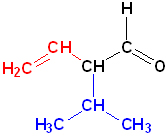
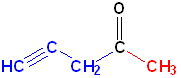
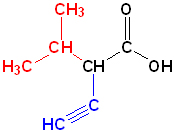
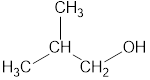
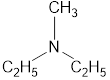
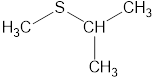
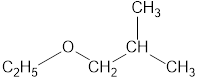
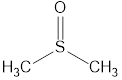
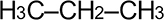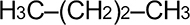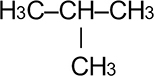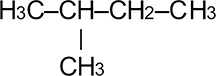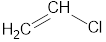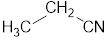Номенклатура органических веществ – это система правил, которые позволяют дать уникальное название каждому химическому соединению.
Перед изучением номенклатуры органических веществ обязательно рекомендую познакомиться с темой Классификация органических соединений.
| Номенклатура органических соединений | ||
| Тривиальная | Систематическая | Рациональная |
Систематическая номенклатура ИЮПАК
В настоящее время используется номенклатура ИЮПАК (IUPAC) — Международный союз теоретической и прикладной химии (International Union of Pure and Applied Chemistry).
Основа названия органических соединений в зависимости от числа атомов углерода:
| Количество атомов С в цепи | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Корень | Мет- | Эт- | Проп- | Бут- | Пент- | Гекс- | Гепт- | Окт- | Нон- |
Наличие двойных или тройных связей в молекулах органических соединений обозначают, добавляя в конце слова суффикс -ен или -ин:
| Тип связей | Одинарная связь (С–С) | Двойная связь (С=С) | Тройная связь (СΞС) |
| Суффикс | -ан | -ен | -ин |
Наличие функциональных групп в органической молекуле обозначают добавлением в название приставки или суффикса:
| Функциональная группа | Приставка | Суффикс |
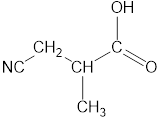
| –СООН | -карбокси | |
| –СООН | — овая кислота | |
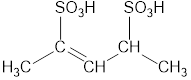
| –SO3H | Сульфо- | -сульфокислота |
| –(С)Н=O | Оксо- | -аль |
| –ОН | Гидрокси- | -ол |
| –SН | Мерканто- | -тиол |
| –NH2 | Амино- | -амин |
| –NО2 | Нитро- | |
| –OR | Алкокси- | |
| –F, –Cl, –Br, –I, –Hal | Фтор-, хлор-, бром-, йод- (галоген-) |
Для обозначения числа кратных связей и числа функциональных групп используют следующие числительные:
| Количество кратных связей и функциональных групп | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Числительное | Ди | Три | Тетра | Пента | Гекса | Гепта | Окта |
Название углеводородных радикалов:
| Название | Углеводородный радикал |
| Метил- | –CH3 |
| Этил- | –CH2CH3 |
| Пропил- | –CH2CH2CH3 |
| Изопропил- | –CH(CH3)CH3 |
| Бутил- | – CH2CH2CH2CH3 |
| Изобутил- | – CH2CH(CH3)CH3 |
| Втор-бутил | – CH(CH3)CH2CH3 |
| Трет-бутил | – C(CH3)3 |
Правила составления названий алканов
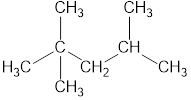
1. Выбирают главную углеродную цепь
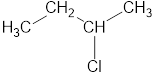
Главная цепь — это самая длинная и самая разветвленная непрерывная последовательность углеродных атомов. При этом неважно, как нарисованы на схеме углеродные атомы (вверх, вниз, влево, вправо). При этом углеводородные радикалы, которые не входят в главную цепь, являются в ней заместителями. Главная цепь должна быть самой длинной.
Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а
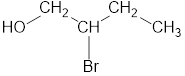
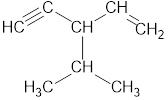
2. Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от главной цепи на рисунке б – один:
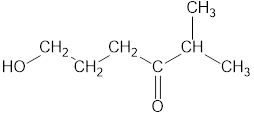
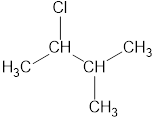
3. Нумеруют атомы углерода в главной цепи.
Нумерацию следует начинать с более близкого к старшей группе конца цепи.
При наличии двух и более заместителей цепь стараются пронумеровать так, чтобы заместителям принадлежали минимальные номера.
Например, правильная нумерация в главной углеродной цепи
Тривиальная номенклатура
Тривиальная номенклатура сложилась исторически по мере зарождения и развития исторической химии, до появления единой системы наименования органических веществ.
Многие тривиальные названия используются и сейчас. В таблице ниже приведены тривиальные названия основных органических веществ, а также их названия по систематической номенклатуре.
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
|
Углеводороды и галогенпроизводные |
||
| Изобутан | 2-метилпропан | CH3-CH(CH3)-CH3 |
| Этилен | Этен | |
| Пропилен | Пропен | CH2=CH-CH3 |
| Дивинил | Бутадиен-1,3 | CH2=CH-CH=CH2 |
| Изопрен | 2-Метилбутадиен-1,3 | CH2=C(СH3)-CH=CH2 |
| Винилацетилен | Бутен-1-ин-3 | CH≡C-CH=CH2 |
| Толуол | Метилбензол |  |
| Кумол | Изопропилбензол |  |
| орто-Ксилол,
мета-ксилол, пара-ксилол |
1,2-Диметилбензол,
1,3-Диметилбензол, 1,4-Диметилбензол |
 
|
| Стирол | Винилбензол |  |
| Хлороформ | Трихлорметан | СHCl3 |
| Хлоропрен | 2-хлорбутадиен-1,3 | CH2=C(Cl)-CH=CH2 |
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
|
Кислородсодержащие и азотсодержащие вещества |
||
| Бензиловый спирт | Фенилметанол |  |
| Этиленгликоль | Этандиол-1,2 | CH2OH-CH2OH |
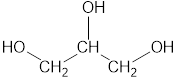
| Глицерин | Пропантриол-1,2,3 | CH2OH-CHOH-CH2OH |
| орто-Крезол,
мета-крезол, пара-крезол |
2-Метилфенол,
3-метилфенол, 4-метилфенол |
 
|
| Формальдегид | Метаналь | CH2=O |
| Ацетальдегид | Этаналь | CH3-CH=O |
| Анилин | Фениламин |  |
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
|
Карбоновые кислоты |
||
| Муравьиная кислота | Метановая кислота | HCOOH |
| Уксусная кислота | Этановая кислота | CH3COOH |
| Пропионовая кислота | Пропановая кислота | CH3CH2COOH |
| Масляная кислота | Бутановая кислота | CH3CH2CH2COOH |
| Щавелевая кислота | Этандиовая кислота | HOOC-COOH |
| Бензойная кислота | Фенилмуравьиная кислота | C6H5COOH |
Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:
Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:
Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.
2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:
3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |
Найди девять отличий |
Правила составления изомеров на примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:
4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность С – IV. В результате получают изомер а):
5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):
Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):
6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4с углеродным заместителем при С-2 и С-3:
Записывают структурные формулы новых изомеров:
7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:
8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:
Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.
Тривиальная номенклатура
На начальном этапе развития химии природа органических веществ не была полностью понятна, поэтому им давались тривиальные названия, связанные с их свойствами (глицин – сладкий) или источниками их получения (винный спирт). Устоявшиеся тривиальные названия допускаются к употреблению правилами ИЮПАК.
Тривиальные названия носят простейшие предельные углеводороды, и они лежат в основе названий всех других классов ациклических соединений, а названия радикалов применяются в номенклатурах ИЮПАК и рациональной номенклатуре.
Названия н-алканов СnH2n+2
| Формула алкана | Название |
| CH4 | Метан |
| C2H6 | Этан |
| C3H8 | Пропан |
| C4H10 | Бутан |
| C5H12 | Пентан |
| C6H14 | Гексан |
| С7Н16 | Гептан |
| С8Н18 | Октан |
| C9H20 | Нонан |
| С10H22 | Декан |
| С11Н24 | Ундекан |
| С12Н26 | Додекан |
| С13H28 | Тридекан |
| C14-C19 | Тетрадекан и т. д. |
| С20Н42 | Эйкозан |
| C21H44 | Генэйкозан |
| С22Н46 | Докозан |
| С23Н48 | Трикозан |
| С24-C29 | Тетракозан и т.д. |
| С30Н62 | Триаконтан |
| C31H64 | Гентриаконтан |
| С32-C39 | Дотриаконтан и т.д. |
| С40Н82 | Тетраконтан |
| С41Н84 | Гентетраконтан и т.д. |
Названия некоторых одновалентных радикалов
| Формула алкана и его название | Формула алкила | Название алкила | |
| тривиальное | систематическое | ||
|
Пропан |
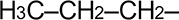 |
Пропил | Пропил |
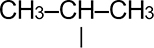 |
Изопропил | 1-метилэтил | |
|
Бутан |
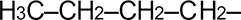 |
Бутил | Бутил |
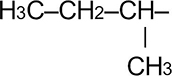 |
Втор. бутил | 1-метилпропил | |
|
Изобутил |
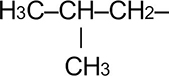 |
Изобутил | 2-метилпропил |
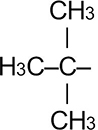 |
Трет. бутил | 1,1-диметилэтил | |
|
Изопентан |
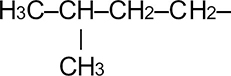 |
Изопентил | 3-метилбутил |
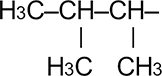 |
Втор. Изопентил | 1,2-диметилпропил | |
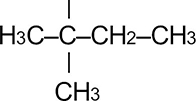 |
Трет. пентил | 1,1-диметилпропил | |
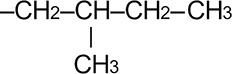 |
— | 2-метилбутил | |
|
Неопентан |
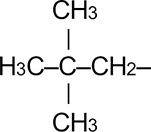 |
Неопентил | 2,2-диметилпропил |
Названия некоторых непредельных радикалов
| Формула радикала | Название радикала | |
| Тривиальное | Систематическое | |
| H2C=CH– | Винил | Этенил |
| HC≡C– | — | Этинил |
| H2C=CH–CH2– | Аллил | Пропен-2-ил |
| HC≡C–CH2– | Пропаргил | Пропин-2-ил |
| H3C–CH=CH– | Пропенил | Пропен-1-ил |
| H2C=C–CH3 | |
Изопропенил | 1-метилэтенил |
Рациональная номенклатура
За основу рационального названия органического соединения берется название прототипа, атомы водорода которого замещены радикалами. В качестве прототипа выступает, как правило, простейший член гомологического ряда.
| Класс | Прототип | Правило | Пример |
| Алканы | Метан |
за метановый углерод выбирают наиболее разветвленный атом углерода примыкающие радикалы должны быть наименее сложными наличие нескольких одинаковых радикалов обозначается соответствующей умножающей приставкой «ди-«, «три-«, «тетра-« |
Метилэтилизопропилметан |
| Непредельные углеводороды | Этилен, ацетилен | Для указания местоположения заместителей С-атомы прототипа обозначают греческими буквами α и β или цифрами 1 и 2. |
α-этил-β-третбутилэтилен |
| Спирты | Карбинол |
Изопропенилтретбутилкарбинол |
|
| Альдегиды | Уксусный альдегид |
Винилизопропилуксусный альдегид |
|
| Кетоны | Кетон |
Метилпропаргилкетон |
|
| Карбоновые кислоты | Уксусная кислота |
Изопропилэтинилуксусная кислота |
Радикально-функциональная номенклатура
- применяется для названия простых моно- и бифункциональных соединений
- подчеркивает главную химическую особенность соединений
Правила построения названия по радикально-функциональной номенклатуре:
- выбирают старшую характеристическую группу (обозначается названием функционального класса), затем добавляют название органического радикала
- название функционального класса определяется старшей характеристической группой, другие группы обозначаются приставками
- в соединениях с многовалентными характеристическими группами различные радикалы перечисляются в алфавитном порядке
- одинаковые радикалы обозначаются умножающими приставками (ди-, три-)
Названия функциональных классов, используемых в радикально-функциональной номенклатуре (в порядке убывания старшинства)
| Группа | Название функционального класса |
| Х-производные кислот RCO–X, RSO2–X и т.п. | X: фторид, хлорид, бромид, йодид, цианид, азид; сернистые аналоги, селеновые аналоги |
| –CN, –NC | Цианид, изоцианид |
| >CO | Кетон, затем S – и далее Se-аналоги |
| –OH | Спирт, затем S – и далее Se-аналоги |
| –O–OH | Гидропероксид |
| –O– | Эфир или окись (оксид) |
| >S, >SO, >SO2 | Сульфид, сульфоксид, сульфон |
| >Se. >SeO, >SeO2 | Селенид, селеноксид, селенон |
| –F, –Cl, –Br, –I | Фторид, хлорид, бромид, йодид |
| –N3 | Азид |
Примеры названий соединений по радикально-функциональной номенклатуре
изобутиловый спирт
Винилхлорид
Этилцианид
Пропионилхлорид
бензилэтилкетон
метилдиэтиламин
изопропилметилсульфид
Изобутилэтиловый эфир
Диметилсульфоксид
Втор.бутилхлорид
2-Бромбутиловый спирт
3-Гидроксиизопропилкетон
Заместительная номенклатура
- строится на принципе замещения в структуре, служащей основой названия, атомов водорода различными заместителями
- название строится как сложное слово, состоящее из корня (название главной цепи), суффиксов, отражающих степень его ненасыщенности (ен, ин), приставок и окончаний, характеризующих число и характер заместителей, с указанием цифрами (локантами) их местонахождения
Предельные углеводороды
- Выбирают самую длинную цепь углеродных атомов (главная цепь); если в разветвленном углеводороде имеются цепи равной длины, то в качестве главной выбирают наиболее разветвленную
- Цепь нумеруют; направление нумерации выбирают так, чтобы локанты (цифры, указывающие положение заместителей) были наименьшими.
- К локанту с названием заместителя добавляют название углеводорода с числом, отвечающим длине главной цепи. При этом нужно соблюдать следующие правила:
- заместители перечисляются в алфавитном порядке
- повторяющиеся одинаковые заместители называют с добавлением умножающих приставок (ди-, три-, тетра-и т.д.). Приставки не влияют на алфавитный порядок перечисления
- цифры отделяются от букв дефисом, а друг от друга – запятой
- каждому заместителю отвечает свой локант
2,3,5-Триметилметин-4-пропилгептан
2,2,4-Триметилпентан
Непредельные углеводороды
- название непредельных углеводородов с одной двойной связью образуют от названия соответствующего алкана путем замены суффикса «ан» на «ен»
- в качестве главной выбирают самую длинную углеродную цепь, содержащую двойную связь
- цепь нумеруют так, чтобы двойная связь получила наименьший порядковый номер
- название углеводородов с тройной связью образуют от названий соответствующих алканов, заменяя суффикс «ан» на «ин», а далее по аналогии с алкенами
- ненасыщенные углеводороды с двумя двойными связями получают суффикс «диен», с тремя – «триен», с двумя тройными – «диин» и т.д.
- если в соединении имеется и двойная, и тройная связь, добавляют суффикс «енин»
- двойная связь считается старше тройной и получает меньший номер
3-Изопропилпентен-1-ин-4
Монофункциональные производные углеводородов
Два типа характеристических групп:
- обозначаются в виде приставок и перечисляются в алфавитном порядке одновременно с углеводородными радикалами
- могут включаться в заместительное название либо в форме суффикса, либо в форме приставки в зависимости от их относительного старшинства
Характеристические группы, обозначаемые в заместительной, номенклатуре только в приставках
| Класс соединения | Характеристические группы | |
| Формула | Приставка | |
| Галоидпроизводные | –Br, –Cl, –F, –I | Бромо, хлоро, фторо, йодо |
| Простые эфиры | –OR | R-окси (алкокси, арилокси) |
| Сульфиды | –SR | R-тио (алкилтио, арилтио) |
| Нитросоединения | –NO2 | Нитро |
| Нитрозосоединения | –NO | Нитрозо |
| Азосоединения | –N=N– | Азо |
Обозначения важнейших групп в префиксах и суффиксах в порядке падения старшинства (атом углерода в скобках является составной частью главной углеродной цепи)
| Классы | Формула | Обозначение в префиксе | Обозначение в суффиксе |
| Катион | –онио– | –онио– | –ониум |
| Карбоксил | –COOH –(C)(=O),OH |
–карбокси– — |
–карбоновая кислота –овая кислота |
| Сульфоновая кислота | –SO3H | –сульфо | –сульфоновая кислота |
| Сложные эфиры | –COOR –(C)(= O),R |
R-оксикарбонил — |
R…карбоксилат R…оат |
| Нитрилы | –C≡N –(C)≡N |
циано– — |
–карбонитрил –нитрил |
| Альдегиды | –CHO | формил | –карбальдегид |
| –(C)H(=O) | оксо– | –аль | |
| Кетоны | (C=O) | оксо– | –он |
| Спирты | –OH | гидрокси– | –ол |
| Фенолы | –OH | гидрокси– | — |
| Тиолы | –SH | меркапто– | –тиол |
| Гидропероксиды | –O–OH | гидроперокси– | — |
| Амины | –NH2 | амино– | –амин |
| Имины | =NH | имино– | –имин |
| Эфиры | –OR | R-окси– | — |
| Сульфиды | –SR | R-тио– | — |
| Пероксиды | –O–OR | R-диокси– | — |
- в монофункциональных соединениях характеристические группы второго рода обозначаются только суффиксами
- цепь нумеруют так, чтобы заместитель, перечисляемый по алфавиту первым, получил наименьший номер
- если цепь не насыщена, то при нумерации предпочтение отдают кратной связи
2-Метил-3-хлорбутан
4-Бром-2-пентен
Пропантриол
2-Метилбутеналь
5-Метил-3-гептен-2,6-дион
4-Бром-2-гептен-5-индиовая кислота
Полифункциональные соединения
1. Выбор старшей функциональной группы
Из всех функциональных групп выбирают старшую – эта группа указывается в суффиксе, остальные помещаются в виде префиксов.
2. Выбор главной цепи
- Главная цепь должна содержать максимальное число старших групп
- В главной цепи должно быть максимальное количество двойных и тройных связей; при одинаковом количестве предпочтение отдается двойным
- Главная цепь должна иметь максимальную протяженность
- В главной цепи должно быть максимальное число заместителей, обозначаемых префиксами
3. Нумерация цепи
Начало и направление нумерации выбирают таким образом, чтобы наименьшие цифровые индексы получили следующие структурные элементы соединения (в приведенном порядке):
- основные группы, обозначаемые суффиксом
- суммарная ненасыщенность (т.е. сумма двойных и тройных связей)
- двойные связи
- тройные связи
- атомы или группы, указываемые в префиксах
- префиксы в порядке перечисления (по алфавиту)
4. Составление названия соединения
Префиксы располагают в алфавитном порядке. Сложные радикалы образуют единый префикс, который включается в алфавитный порядок по первой букве наименования. В случае идентичных префиксов с разными цифровыми локантами первым ставится префикс с младшим локантом. Курсивы (например, транс-, втор., сим.) в алфавитном порядке не учитываются.
| Приставки | Название основной структуры | Суффикс и окончание | |
| Корень | Суффикс | ||
| Характеристические группы первого типа, младшие характеристические группы, углеводородные радикалы | Главная углеродная цепь | Степень насыщенности: ан, ен, ин | Только старшая характеристическая группа второго типа |
2-Пентен-2,4-дисульфоновая кислота
2-Метил-3-цианопропановая кислота
Классификация неорганических веществ и их номенклатура основаны на наиболее простой и постоянной во времени характеристике —химическом составе, который показывает атомы элементов, образующих данное вещество, в их числовом отношении. Если вещество из атомов одного химического элемента, т.е. является формой существования этого элемента в свободном виде, то его называют простымвеществом; если же вещество из атомов двух или большего числа элементов, то его называют сложным веществом. Все простые вещества (кроме одноатомных) и все сложные вещества принято называть химическими соединениями, так как в них атомы одного или разных элементов соединены между собой химическими связями.
Номенклатура неорганических веществ состоит из формул и названий. Химическая формула — изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков. Химическое название — изображение состава вещества с помощью слова или группы слов. Построение химических формул и названий определяется системой номенклатурных правил.
Символы и наименования химических элементов приведены в Периодической системе элементов Д.И. Менделеева. Элементы условно делят на металлы и неметаллы. К неметаллам относят все элементы VIIIА-группы (благородные газы) и VIIА-группы (галогены), элементы VIА-группы (кроме полония), элементы азот, фосфор, мышьяк (VА-группа); углерод, кремний (IVА-группа); бор (IIIА-группа), а также водород. Остальные элементы относят к металлам.
При составлении названий веществ обычно применяют русские наименования элементов, например, дикислород, дифторид ксенона, селенат калия. По традиции для некоторых элементов в производные термины вводят корни их латинских наименований:
|
Ag — аргент |
N — нитр |
|
As — арс, арсен |
Ni — никкол |
|
Au — аур |
O — окс, оксиген |
|
C — карб, карбон |
Pb — плюмб |
|
Cu — купр |
S — сульф |
|
Fe — ферр |
Sb — стиб |
|
H — гидр, гидроген |
Si — сил, силик, силиц |
|
Hg — меркур |
Sn — станн |
|
Mn — манган |
Например: карбонат, манганат, оксид, сульфид, силикат.
Названия простых веществ состоят из одного слова — наименования химического элемента с числовой приставкой, например:
|
Mg — (моно)магний |
O3 — трикислород |
|
Hg — (моно)ртуть |
P4 — тетрафосфор |
|
O2 — дикислород |
S8 — октасера |
Используются следующие числовые приставки:
|
1 — моно |
7 — гепта |
|
2 — ди |
8 — окта |
|
3 — три |
9 — нона |
|
4 — тетра |
10 — дека |
|
5 — пента |
11 — ундека |
|
6 — гекса |
12 — додека |
Неопределенное число указывается числовой приставкой n — поли.
Для некоторых простых веществ используют также специальные названия, такие, как О3 — озон, Р4 — белый фосфор.
{banner_rca-news-1-1}
Химические формулы сложных веществ составляют из обозначения электроположительной (условных и реальных катионов) иэлектроотрицательной (условных и реальных анионов) составляющих, например, CuSO4 (здесь Cu2+ — реальный катион, SO42— — реальный анион) и PCl3 (здесь P+III — условный катион, Cl-I — условный анион).
Названия сложных веществ составляют по химическим формулам справа налево. Они складываются из двух слов — названий электроотрицательных составляющих (в именительном падеже) и электроположительных составляющих (в родительном падеже), например:
CuSO4 — сульфат меди(II)
PCl3 — трихлорид фосфора
LaCl3 — хлорид лантана(III)
СО — монооксид углерода
Число электроположительных и электроотрицательных составляющих в названиях указывают числовыми приставками, приведенными выше (универсальный способ), либо степенями окисления (если они могут быть определены по формуле) с помощью римских цифр в круглых скобках (знак плюс опускается). В ряде случаев приводят заряд ионов (для сложных по составу катионов и анионов), используя арабские цифры с соответствующим знаком.<border=1>
Для распространенных многоэлементных катионов и анионов применяют следующие специальные названия:<border=1>
|
H2F+ — фтороний |
C22— — ацетиленид |
|
H3O+ — оксоний |
CN— — цианид |
|
H3S+ — сульфоний |
CNO— — фульминат |
|
NH4+ — аммоний |
HF2— — гидродифторид |
|
N2H5+ — гидразиний(1+) |
HO2— — гидропероксид |
|
N2H6+ — гидразиний(2+) |
HS— — гидросульфид |
|
NH3OH+ — гидроксиламиний |
N3— — азид |
|
NO+ — нитрозил |
NCS— — тиоционат |
|
NO2+ — нитроил |
O22— — пероксид |
|
O2+ — диоксигенил |
O2— — надпероксид |
|
PH4+ — фосфоний |
O3— — озонид |
|
VO2+ — ванадил |
OCN— — цианат |
|
UO2+ — уранил |
OH— — гидроксид |
<border=1>Для небольшого числа хорошо известных веществ также используют специальные названия:<border=1>
|
AsH3 — арсин |
HN3 — азидоводород |
|
B2H6 — боран |
H2S — сероводород |
|
B4H10 — тетраборан(10) |
NH3 — аммиак |
|
HCN — циановодород |
N2H4 — гидразин |
|
HCl — хлороводород |
NH2OH — гидроксиламин |
|
HF — фтороводород |
PH3 — фосфин |
|
HI — иодоводород |
SiH4 — силан |
1. Кислотные и основные гидроксиды. Соли
Гидроксиды — тип сложных веществ, в состав которых входят атомы некоторого элемента Е (кроме фтора и кислорода) и гидроксогруппы ОН; общая формула гидроксидов Е(ОН)n, где n = 1÷6. Форма гидроксидов Е(ОН)n называется орто-формой; при n > 2 гидроксид может находиться также в мета-форме, включающей кроме атомов Е и групп ОН еще атомы кислорода О, например Е(ОН)3 и ЕО(ОН), Е(ОН)4 и Е(ОН)6 и ЕО2(ОН)2.
Гидроксиды делят на две противоположные по химическим свойствам группы: кислотные и основные гидроксиды.<border=1>
Кислотные гидроксиды содержат атомы водорода, которые могут замещаться на атомы металла при соблюдении правила стехиометрической валентности. Большинство кислотных гидроксидов находится в мета-форме, причем атомы водорода в формулах кислотных гидроксидов ставят на первое место, например H2SO4, HNO3 и H2CO3, а не SO2(OH)2, NO2(OH) и CO(OH)2. Общая формула кислотных гидроксидов — НхЕОу, где электроотрицательную составляющую ЕОух— называют кислотным остатком. Если не все атомы водорода замещены на металл, то они остаются в составе кислотного остатка.
{banner_rca-news-1-2}
Названия распространенных кислотных гидроксидов состоят из двух слов: собственного названия с окончанием «ая» и группового слова «кислота». Приведем формулы и собственные названия распространенных кислотных гидроксидов и их кислотных остатков (прочерк означает, что гидроксид не известен в свободном виде или в кислом водном растворе):<border=1>
|
кислотный гидроксид |
кислотный остаток |
|
HAsO2 — метамышьяковистая |
AsO2— — метаарсенит |
|
H3AsO3 — ортомышьяковистая |
AsO33— — ортоарсенит |
|
H3AsO4 — мышьяковая |
AsO43— — арсенат |
|
— |
В4О72— — тетраборат |
|
— |
ВiО3— — висмутат |
|
HBrO — бромноватистая |
BrO— — гипобромит |
|
HBrO3 — бромноватая |
BrO3— — бромат |
|
H2CO3 — угольная |
CO32— — карбонат |
|
HClO — хлорноватистая |
ClO—— гипохлорит |
|
HClO2 — хлористая |
ClO2—— хлорит |
|
HClO3 — хлорноватая |
ClO3—— хлорат |
|
HClO4 — хлорная |
ClO4—— перхлорат |
|
H2CrO4 — хромовая |
CrO42— — хромат |
|
— |
НCrO4—— гидрохромат |
|
H2Cr2О7 — дихромовая |
Cr2O72— — дихромат |
|
— |
FeO42— — феррат |
|
HIO3 — иодноватая |
IO3—— иодат |
|
HIO4 — метаиодная |
IO4—— метапериодат |
|
H5IO6 — ортоиодная |
IO65— — ортопериодат |
|
HMnO4 — марганцовая |
MnO4—— перманганат |
|
— |
MnO42— — манганат |
|
— |
MоO42— — молибдат |
|
HNO2 — азотистая |
NO2—— нитрит |
|
HNO3 — азотная |
NO3—— нитрат |
|
HPO3 — метафосфорная |
PO3—— метафосфат |
|
H3PO4 — ортофосфорная |
PO43— — ортофосфат |
|
НPO42— — гидроортофосфат |
|
|
Н2PO4—— дигидроотофосфат |
|
|
H4P2O7 — дифосфорная |
P2O74— — дифосфат |
|
— |
ReO4—— перренат |
|
— |
SO32— — сульфит |
|
HSO3—— гидросульфит |
|
|
H2SO4 — серная |
SO42— — сульфат |
|
— |
НSO4—— гидросульфат |
|
H2S2O7 — дисерная |
S2O72— — дисульфат |
|
H2S2O6(O2) — пероксодисерная |
S2O6(O2)2— — пероксодисульфат |
|
H2SO3S — тиосерная |
SO3S2—— тиосульфат |
|
H2SeO3 — селенистая |
SeO32— — селенит |
|
H2SeO4 — селеновая |
SeO42— — селенат |
|
H2SiO3 — метакремниевая |
SiO32— — метасиликат |
|
H4SiO4 — ортокремниевая |
SiO44— — ортосиликат |
|
H2TeO3 — теллуристая |
TeO32— — теллурит |
|
H2TeO4 — метателлуровая |
TeO42— — метателлурат |
|
H6TeO6 — ортотеллуровая |
TeO66— — ортотеллурат |
|
— |
VO3—— метаванадат |
|
— |
VO43— — ортованадат |
|
— |
WO43— — вольфрамат |
<border=1>Менее распространенные кислотные гидроксиды называют по номенклатурным правилам для комплексных соединений, например:<border=1>
|
IO42— — тетраоксоиодат (2- ) |
SO22— — диоксосульфат(IV) |
|
MoO32— — триоксомолибдат(IV) |
TeO52— — пентаоксотеллурат(IV) |
|
PoO32— — триоксополонат(IV) |
XeO64— — гексаоксоксенонат(VIII) |
Названия кислотных остатков используют при построении названий солей.<border=1>
Основные гидроксиды содержат гидроксид-ионы, которые могут замещаться на кислотные остатки при соблюдении правила стехиометрической валентности. Все основные гидроксиды находятся в орто-форме; их общая формула М(ОН)n, где n = 1,2 (реже 3,4) и М n +—катион металла. Примеры формул и названий основных гидроксидов:<border=1>
|
NaOH — гидроксид натрия |
Ba(OH)2 — гидроксид бария |
|
KOH — гидроксид калия |
La(OH)3 — гидроксид лантана(III) |
Важнейшим химическим свойством основных и кислотных гидроксидов является их взаимодействие их между собой с образованием солей (реакция солеобразования), например:
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Соли — тип сложных веществ, в состав которых входят катионы Мn+ и кислотные остатки*.
{banner_rca-news-1-3}
Соли с общей формулой Мх(ЕОу) n называют средними солями, а соли с незамещенными атомами водорода, — кислыми солями. Иногда соли содержат в своем составе также гидроксид — или(и) оксид — ионы; такие соли называют основными солями. Приведем примеры и названия солей:
|
Ca3(PO4)2 |
— ортофосфат кальция |
|
Ca(H2PO4)2 |
— дигидроортофосфат кальция |
|
CaHPO4 |
— гидроортофосфат кальция |
|
CuCO3 |
— карбонат меди(II) |
|
Cu2CO3(OH)2 |
— дигидроксид-карбонат димеди |
|
La(NO3)3 |
— нитрат лантана(III) |
|
Ti(NO3)2O |
— оксид-динитрат титана |
Кислые и основные соли могут быть превращены в средние соли взаимодействием с соответствующим основным и кислотным гидроксидом, например:<border=1>
Ca(HSO4)2 + Ca(OH) = CaSO4 + 2H2O<border=1>
Ca2SO4(OH)2 + H2SO4 = Ca2SO4 + 2H2O
Встречаются также соли, содерхащие два разных катиона: их часто называют двойными солями, например:
|
KAl(SO4)2 |
— сульфат алюминия-калия |
|
CaMg(CO3)2 |
— карбонат магния-кальция |
2. Кислотные и оснόвные оксиды
Оксиды ЕхОу — продукты полной дегидратации гидроксидов:
|
H2SO4 ¾ ® SO3 — H2O |
H2CO3 ¾ ® CO2 — H2O |
|
NaOH ¾ ® Na2O — H2O |
Ca(OH)2 ¾ ® CaO — H2O |
Кислотным гидроксидам (H2SO4, H2CO3) отвечают кислотные оксиды (SO3, CO2), а основным гидроксидам (NaOH, Ca(OH)2) — основныеоксиды (Na2O, CaO), причем степень окисления элемента Е не изменяется при переходе от гидроксида к оксиду. Пример формул и названий оксидов:
|
SO3 — триоксид серы |
Na2O — оксид натрия |
|
N2O5 — пентаоксид диазота |
La2O3 — оксид лантана(III) |
|
P4O10 — декаоксид тетрафосфора |
ThO2 — оксид тория(IV) |
Кислотные и основные оксиды сохраняют солеобразующие свойства соответствующих гидроксидов при взаимодействии с противоположными по свойствам гидроксидами или между собой:
N2O5 + 2NaOH = 2NaNO3 + H2O
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
La2O3 + 3SO3 = La2(SO4)3
3. Амфотерные оксиды и гидроксиды
Амфотерность гидроксидов и оксидов — химическое свойство, заключающееся в образовании ими двух рядов солей, например, для гидроксида и оксида алюминия:
(а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
(б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Так, гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов и оксидов, т.е. реагируют с кислотными гидроксидам и оксидом, образуя соответствующую соль — сульфат алюминия Al2(SO4)3, тогда как в реакциях (б) они же проявляют свойствакислотных гидроксидов и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль — диоксоалюминат (III) натрия NaAlO2. В первом случае элемент алюминий проявляет свойство металла и входит в состав электроположительной составляющей (Al3+), во втором — свойство неметалла и входит в состав электроотрицательной составляющей формулы соли (AlO2—).
Если указанные реакции протекают в водном растворе, то состав образующихся солей меняется, но присутствие алюминия в катионе и анионе остаётся:
2Al(OH)3 + 3H2SO4 = [Al(H2O)6]2(SO4)3
Al(OH)3 + NaOH = Na[Al(OH)4]
Здесь квадратными скобками выделены комплексные ионы [Al(H2O)6]3+ — катион гексаакваалюминия(III), [Al(OH)4]— — тетрагидроксоалюминат(III)-ион.
Элементы, проявляющие в соединениях металлические и неметаллические свойства, называют амфотерными, к ним относятся элементы А-групп Периодической системы — Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп — Cr, Mn, Fe, Zn, Cd, Au и др. Амфотерные оксиды называют так же, как и основные, например:
|
BeO — оксид бериллия |
FeO — оксид железа(II) |
|
Al2O3 — оксид алюминия |
Fe2O3 — оксид железа(III) |
|
SnO — оксид олова(II) |
MnO2 — оксид марганца(IV) |
|
SnO2 — диоксид олова(IV) |
ZnO — оксид цинка(II) |
Амфотерные гидроксиды (если степень окисления элемента превышает + II) могут находиться в орто — или (и) мета — форме. Приведем примеры амфотерных гидроксидов:
|
Be(OH)2 |
— гидроксид берилия |
|
Al(OH)3 |
— гидроксид алюминия |
|
AlO(OH) |
— метагидроксид алюминия |
|
TiO(OH)2 |
— дигидроксид-оксид титана |
|
Fe(OH)2 |
— гидроксид железа(II) |
|
FeO(OH) |
— метагидроксид железа |
Амфотерным оксидам не всегда соответствуют амфотерные гидроксиды, поскольку при попытке получения последних образуются гидратированные оксиды, например:
|
SnO2. nH2O |
— полигидрат оксида олова(IV) |
|
Au2O3. nH2O |
— полигидрат оксида золота(I) |
|
Au2O3. nH2O |
— полигидрат оксида золота(III) |
Если амфотерному элементу в соединениях отвечает несколько степеней окисления, то амфотерность соответствующих оксидов и гидроксидов (а следовательно, и амфотерность самого элемента) будет выражена по-разному. Для низких степеней окисления у гидроксидов и оксидов наблюдается преобладание основных свойств, а у самого элемента — металлических свойств, поэтому он почти всегда входит в состав катионов. Для высоких степеней окисления, напротив, у гидроксидов и оксидов наблюдается преобладание кислотных свойств, а у самого элемента — неметаллических свойств, поэтому он почти всегда входит в состав анионов. Так, у оксида и гидроксида марганца(II) доминируют основные свойства, а сам марганец входит в состав катионов типа [Mn(H2O)6]2+, тогда как у оксида и гидроксида марганца(VII) доминируют кислотные свойства, а сам марганец входит в состав аниона типа MnO4— . Амфотерным гидроксидам с большим преобладанием кислотных свойств приписывают формулы и названия по образцу кислотных гидроксидов, например НMnVIIO4 — марганцовая кислота.
Таким образом, деление элементов на металлы и неметаллы — условное; между элементами (Na, K, Ca, Ba и др.) с чисто металлическими и элементами (F, O, N, Cl, S, C и др.) с чисто неметаллическими свойствами существует большая группа элементов с амфотерными свойствами.
4. Бинарные соединения
Обширный тип неорганических сложных веществ — бинарные соединения. К ним относятся, в первую очередь все двухэлементные соединения (кроме основных, кислотных и амфотерных оксидов), например H2O, KBr, H2S, Cs2(S2), N2O, NH3, HN3, CaC2, SiH4. Электроположительная и электроотрицательная составляющие формул этих соединений включают отдельные атомы или связанные группы атомов одного элемента.
Многоэлементные вещества, в формулах которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения, например CSO, IO2F3, SBrO2F, CrO(O2)2, PSI3, (CaTi)O3, (FeCu)S2, Hg(CN)2, (PF3)2O, VCl2(NH2). Так, CSO можно представить как соединение CS2, в котором один атом серы заменен на атом кислорода.
Названия бинарных соединений строятся по обычным номенклатурным правилам, например:
|
OF2 — дифторид кислорода |
K2O2 — пероксид калия |
|
HgCl2 — хлорид ртути(II) |
Na2S — сульфид натрия |
|
Hg2Cl2 — дихлорид диртути |
Mg3N2 — нитрид магния |
|
SBr2O — оксид-дибромид серы |
NH4Br — бромид аммония |
|
N2O — оксид диазота |
Pb(N3)2 — азид свинца(II) |
|
NO2 — диоксид азота |
CaC2 — ацетиленид кальция |
Для некоторых бинарных соединений используют специальные названия, список которых был приведен ранее.
Химические свойства бинарных соединений довольно разнообразны, поэтому их часто разделяют на группы по названию анионов, т.е. отдельно рассматривают галогениды, халькогениды, нитриды, карбиды, гидриды и т. д. Среди бинарных соединений встречаются и такие, которые имеют некоторые признаки других типов неорганических веществ. Так, соединения CO, NO, NO2, и (FeIIFe2III)O4, названия которых строятся с применением слова оксид, к типу оксидов (кислотных, основных, амфотерных) отнесены быть не могут. Монооксид углерода СО, монооксид азота NO и диоксид азота NO2 не имеют соответствующих кислотных гидроксидов (хотя эти оксиды образованы неметаллами С и N), не образуют они и солей, в состав анионов которых входили бы атомы СII, NII и NIV. Двойной оксид (FeIIFe2III)O4 — оксид дижелеза(III)-железа(II) хотя и содержит в составе электроположительной составляющей атомы амфотерного элемента — железа, но в двух разных степенях окисления, вследствие чего при взаимодействии с кислотными гидроксидами образует не одну, а две разные соли.
Такие бинарные соединения, как AgF, KBr, Na2S, Ba(HS)2, NaCN, NH4Cl, и Pb(N3)2, построены, подобно солям, из реальных катионов и анионов, поэтому их называют солеобразными бинарными соединениями (или просто солями). Их можно рассматривать как продукты замещения атомов водорода в соединениях НF, НCl, НBr, Н2S, НCN и НN3. Последние в водном растворе обладают кислотной функцией, и поэтому их растворы называют кислотами, например НF(aqua) — фтороводородная кислота, Н2S(aqua) — сероводородная кислота. Однако они не принадлежат к типу кислотных гидроксидов, а их производные — к солям в рамках классификации неорганических веществ.
Источник: https://rusthim.ru/
Обсудить на форуме
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
Классификация неорганических веществ с примерами соединений
Теперь проанализируем представленную выше классификационную схему более детально.
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные:
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H2, кислород O2, железо Fe, углерод С и т.д.
Среди простых веществ различают металлы, неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O2 и O3. Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Сложные вещества
Сложными веществами называют вещества, образованные атомами двух или более химических элементов.
Так, например, сложными веществами являются аммиак NH3, серная кислота H2SO4, гашеная известь Ca(OH)2 и бесчисленное множество других.
Среди сложных неорганических веществ выделяют 5 основных классов, а именно оксиды, основания, амфотерные гидроксиды, кислоты и соли:
Оксиды — сложные вещества, образованные двумя химическими элементами, один из которых кислород в степени окисления -2.
Общая формула оксидов может быть записана как ЭxOy, где Э — символ какого-либо химического элемента.
Номенклатура оксидов
Название оксида химического элемента строится по принципу:
Например:
Fe2O3 — оксид железа (III); CuO — оксид меди (II); N2O5 — оксид азота (V)
Нередко можно встретить информацию о том, что в скобках указывается валентность элемента, однако же это не так. Так, например, степень окисления азота N2O5 равна +5, а валентность, как это ни странно, равна четырем.
В случае, если химический элемент имеет единственную положительную степень окисления в соединениях, в таком случае степень окисления не указывается. Например:
Na2O — оксид натрия; H2O — оксид водорода; ZnO — оксид цинка.
Классификация оксидов
Оксиды по их способности образовывать соли при взаимодействии с кислотами или основаниями подразделяют соответственно на солеобразующие и несолеобразующие.
Несолеобразующих оксидов немного, все они образованы неметаллами в степени окисления +1 и +2. Список несолеобразующих оксидов следует запомнить: CO, SiO, N2O, NO.
Солеобразующие оксиды в свою очередь подразделяются на основные, кислотные и амфотерные.
Основными оксидами называют такие оксиды, которые при взаимодействии с кислотами (или кислотными оксидами) образуют соли. К основным оксидам относят оксиды металлов в степени окисления +1 и +2, за исключением оксидов BeO, ZnO, SnO, PbO.
Кислотными оксидами называют такие оксиды, которые при взаимодействии с основаниями (или основными оксидами) образуют соли. Кислотными оксидами являются практически все оксиды неметаллов за исключением несолеобразующих CO, NO, N2O, SiO, а также все оксиды металлов в высоких степенях окисления (+5, +6 и +7).
Амфотерными оксидами называют оксиды, которые могут реагировать как с кислотами, так и основаниями, и в результате этих реакций образуют соли. Такие оксиды проявляют двойственную кислотно-основную природу, то есть могут проявлять свойства как кислотных, так и основных оксидов. К амфотерным оксидам относятся оксиды металлов в степенях окисления +3, +4, а также в качестве исключений оксиды BeO, ZnO, SnO, PbO.
Некоторые металлы могут образовывать все три вида солеобразующих оксидов. Например, хром образует основный оксид CrO, амфотерный оксид Cr2O3 и кислотный оксид CrO3.
Как можно видеть, кислотно-основные свойства оксидов металлов напрямую зависят от степени окисления металла в оксиде: чем больше степень окисления, тем сильнее выражены кислотные свойства.
Основания
Основания — соединения с формулой вида Me(OH)x, где x чаще всего равен 1 или 2.
Исключения: Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2 не относятся к основаниям, несмотря на степень окисления металла +2. Данные соединения являются амфотерными гидроксидами, которые еще будут рассмотрены в этой главе более подробно.
Классификация оснований
Основания классифицируют по количеству гидроксогрупп в одной структурной единице.
Основания с одной гидроксогруппой, т.е. вида MeOH, называют однокислотными основаниями, с двумя гидроксогруппами, т.е. вида Me(OH)2, соответственно, двухкислотными и т.д.
Также основания подразделяют на растворимые (щелочи) и нерастворимые.
К щелочам относятся исключительно гидроксиды щелочных и щелочно-земельных металлов, а также гидроксид таллия TlOH.
Номенклатура оснований
Название основания строится по нижеследующему принципу:
Например:
Fe(OH)2 — гидроксид железа (II),
Cu(OH)2 — гидроксид меди (II).
В тех случаях, когда металл в сложных веществах имеет постоянную степень окисления, указывать её не требуется. Например:
NaOH — гидроксид натрия,
Ca(OH)2 — гидроксид кальция и т.д.
Кислоты
Кислоты — сложные вещества, молекулы которых содержат атомы водорода, способные замещаться на металл.
Общая формула кислот может быть записана как HxA, где H — атомы водорода, способные замещаться на металл, а A — кислотный остаток.
Например, к кислотам относятся такие соединения, как H2SO4, HCl, HNO3, HNO2 и т.д.
Классификация кислот
По количеству атомов водорода, способных замещаться на металл, кислоты делятся на:
— одноосновные кислоты: HF, HCl, HBr, HI, HNO3;
— двухосновные кислоты: H2SO4, H2SO3, H2CO3;
— трехосновные кислоты: H3PO4, H3AsO4.
Следует отметить, что количество атомов водорода в случае органических кислот чаще всего не отражает их основность. Например, уксусная кислота с формулой CH3COOH, несмотря на наличие 4-х атомов водорода в молекуле, является не четырех-, а одноосновной. Основность органических кислот определяется количеством карбоксильных групп (-COOH) в молекуле.
Также по наличию кислорода в молекулах кислоты подразделяют на бескислородные (HF, HCl, HBr и т.д.) и кислородсодержащие (H2SO4, HNO3, H3PO4 и т.д.). Кислородсодержащие кислоты называют также оксокислотами.
Более детально про классификацию кислот можно почитать здесь.
Номенклатура кислот и кислотных остатков
Нижеследующий список названий и формул кислот и кислотных остатков обязательно следует выучить.
В некоторых случаях облегчить запоминание может ряд следующих правил.
Как можно видеть из таблицы выше, построение систематических названий бескислородных кислот выглядит следующим образом:
Например:
HF — фтороводородная кислота;
HCl — хлороводородная кислота;
H2S — сероводородная кислота.
Названия кислотных остатков бескислородных кислот строятся по принципу:
Например, Cl— — хлорид, Br— — бромид.
Названия кислородсодержащих кислот получают добавлением к названию кислотообразующего элемента различных суффиксов и окончаний. Например, если кислотообразующий элемент в кислородсодержащей кислоте имеет высшую степень окисления, то название такой кислоты строится следующим образом:
Например, серная кислота H2S+6O4, хромовая кислота H2Cr+6O4.
Все кислородсодержащие кислоты могут быть также классифицированы как кислотные гидроксиды, поскольку в их молекулах обнаруживаются гидроксогруппы (OH). Например, это видно из нижеследующих графических формул некоторых кислородсодержащих кислот:
Таким образом, серная кислота иначе может быть названа как гидроксид серы (VI), азотная кислота — гидроксид азота (V), фосфорная кислота — гидроксид фосфора (V) и т.д. При этом число в скобках характеризует степень окисления кислотообразующего элемента. Такой вариант названий кислородсодержащих кислот многим может показаться крайне непривычным, однако же изредка такие названия можно встретить в реальных КИМах ЕГЭ по химии в заданиях на классификацию неорганических веществ.
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды металлов, проявляющие двойственную природу, т.е. способные проявлять как свойства кислот, так и свойства оснований.
Амфотерными являются гидроксиды металлов в степенях окисления +3 и +4 (как и оксиды).
Также в качестве исключений к амфотерным гидроксидам относят соединения Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2, несмотря на степень окисления металла в них +2.
Для амфотерных гидроксидов трех- и четырехвалентных металлов возможно существование орто- и мета-форм, отличающихся друг от друга на одну молекулу воды. Например, гидроксид алюминия (III) может существовать в орто-форме Al(OH)3 или мета-форме AlO(OH) (метагидроксид).
Поскольку, как уже было сказано, амфотерные гидроксиды проявляют как свойства кислот, так и свойства оснований, их формула и название также могут быть записаны по-разному: либо как у основания, либо как у кислоты. Например:
| Амфотерный гидроксид в форме основания | Амфотерный гидроксид в форме кислоты | «Кислотный» остаток |
| Zn(OH)2 гидроксид цинка | H2ZnO2 цинковая кислота | ZnO22- цинкат |
| Al(OH)3 (орто)гидроксид алюминия | H3AlO3 ортоалюминиевая кислота | AlO33- ортоалюминат |
| AlO(OH) метагидроксид алюминия | HAlO2 метаалюминиевая кислота | AlO2— метаалюминат |
Соли
Соли — это сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков.
Так, например, к солям относятся такие соединения как KCl, Ca(NO3)2, NaHCO3 и т.д.
Представленное выше определение описывает состав большинства солей, однако же существуют соли, не попадающие под него. Например, вместо катионов металлов в состав соли могут входить катионы аммония или его органические производные. Т.е. к солям относятся такие соединения, как, например, (NH4)2SO4 (сульфат аммония), [CH3NH3]+Cl— (хлорид метиламмония) и т.д.
Также противоречат определению солей выше класс так называемых комплексных солей, которые будут рассмотрены в конце данной темы.
Классификация солей
С другой стороны, соли можно рассматривать как продукты замещения катионов водорода H+ в кислоте на другие катионы или же как продукты замещения гидроксид-ионов в основаниях (или амфотерных гидроксидах) на другие анионы.
При полном замещении образуются так называемые средние или нормальные соли. Например, при полном замещении катионов водорода в серной кислоте на катионы натрия образуется средняя (нормальная) соль Na2SO4, а при полном замещении гидроксид-ионов в основании Ca(OH)2 на кислотные остатки нитрат-ионы образуется средняя (нормальная) соль Ca(NO3)2.
Соли, получаемые неполным замещением катионов водорода в двухосновной (или более) кислоте на катионы металла, называют кислыми. Так, при неполном замещении катионов водорода в серной кислоте на катионы натрия образуется кислая соль NaHSO4.
Соли, которые образуются при неполном замещении гидроксид-ионов в двухкислотных (или более) основаниях, называют основными солями. Например, при неполном замещении гидроксид-ионов в основании Ca(OH)2 на нитрат-ионы образуется основная соль Ca(OH)NO3.
Соли, состоящие из катионов двух разных металлов и анионов кислотных остатков только одной кислоты, называют двойными солями. Так, например, двойными солями являются KNaCO3, KMgCl3 и т.д.
Если соль образована одним типом катионов и двумя типами кислотных остатков, такие соли называют смешанными. Например, смешанными солями являются соединения Ca(OCl)Cl, CuBrCl и т.д.
Существуют соли, которые не попадают под определение солей как продуктов замещения катионов водорода в кислотах на катионы металлов или продуктов замещения гидроксид-ионов в основаниях на анионы кислотных остатков. Это — комплексные соли. Так, например, комплексными солями являются тетрагидроксоцинкат- и тетрагидроксоалюминат натрия с формулами Na2[Zn(OH)4] и Na[Al(OH)4] соответственно. Распознать комплексные соли среди прочих чаще всего можно по наличию квадратных скобок в формуле. Однако нужно понимать, что, чтобы вещество можно было отнести к классу солей, в его состав должны входить какие-либо катионы, кроме (или вместо) H+, а из анионов должны быть какие-либо анионы помимо (или вместо) OH—. Так, например, соединение H2[SiF6] не относится к классу комплексных солей, поскольку при его диссоциации из катионов в растворе присутствуют только катионы водорода H+. По типу диссоциации данное вещество следует скорее классифицировать как бескислородную комплексную кислоту. Аналогично, к солям не относится соединение [Ag(NH3)2]OH, т.к. данное соединение состоит из катионов [Ag(NH3)2]+ и гидроксид-ионов OH—, т.е. его следует считать комплексным основанием.
Номенклатура солей
Номенклатура средних и кислых солей
Название средних и кислых солей строится по принципу:
Если степень окисления металла в сложных веществах постоянная, то ее не указывают.
Названия кислотных остатков были даны выше при рассмотрении номенклатуры кислот.
Например,
Na2SO4 — сульфат натрия;
NaHSO4 — гидросульфат натрия;
CaCO3 — карбонат кальция;
Ca(HCO3)2 — гидрокарбонат кальция и т.д.
Номенклатура основных солей
Названия основных солей строятся по принципу:
Например:
(CuOH)2CO3 — гидроксокарбонат меди (II);
Fe(OH)2NO3 — дигидроксонитрат железа (III).
Номенклатура комплексных солей
Номенклатура комплексных соединений значительно сложнее, и для сдачи ЕГЭ многого знать из номенклатуры комплексных солей не нужно.
Следует уметь называть комплексные соли, получаемые взаимодействием растворов щелочей с амфотерными гидроксидами. Например:
*Одинаковыми цветами в формуле и названии обозначены соответствующие друг другу элементы формулы и названия.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |