Что пользы в том, что ты многое узнал,
раз ты не умел применять твои знания к твоим нуждам.
Ф. Петрарка
Концепция
методики контекстного обучения разработана А.А.Вербицким в 1991 году. Контекстное обучение опирается на теорию
деятельности, в соответствии с которой, усвоение социального опыта
осуществляется в результате активной образовательной и практической деятельности
субъекта.
В нём получают
воплощение следующие принципы:
-активности
личности;
-проблемности;
— единства
обучения и воспитания;
—
последовательного моделирования в формах учебной деятельности;
-межпредметности.
Преподавание
общеобразовательных дисциплин предлагается трактовать в контексте образовательной
деятельности, не отходя в этом от академичного изложения научного знания. В
качестве средств реализации теоретических подходов в контекстном обучении
предлагается в полном объеме использовать методы активного обучения (в трактовке А. А. Вербицкого — методы контекстного
обучения). Вместе с тем отмечается, что необходимо комплексно подходить к
использованию различных форм, методов и средств активного обучения в
органическом сочетании с традиционными методами.
Как показывают
результаты международных исследований, современные российские школьники, хорошо
справляются с заданиями на воспроизведение знаний, но затрудняются применять
полученные знания в ситуациях, близких к жизненным.
Для достижения
современных требований к результатам обучения химии необходимо применение
заданий, в которых химическое содержание интегрировано с практикой. Опыт
педагогической деятельности показывает, что для решения обозначенных задач
целесообразно использовать методы и средства контекстного обучения.
Сущность
контекстного обучения определяется как организация такой деятельности, которая
требует приобретения новых знаний и их последующего применения, объясняет и
оправдывает усилия, затраченные на их усвоение. Одним из средств контекстного
обучения, которые будут наиболее эффективны в условиях реализации ФГОС,
являются контекстные задачи.
Контекстная
задача – это задача мотивационного характера, в условии
которой описана конкретная жизненная ситуация, ассоциирующая с имеющимся социокультурным
опытом учащихся (известное, данное); требованием (неизвестным) задачи
является анализ, осмысление и объяснение этой ситуации или выбор способа
действия в ней, а результатом решения задачи является работа с учебной
проблемой и осознание ее личностной значимости.
Чтение
текста подобных задач понимается как деятельность… имеющая значение не только
для развития мыслительных операций учащегося, но и для приобретения им
духовного и жизненного опыта.
С помощью
контекстных задач выявляются не только предметные знания и умения, но и их
системность, и функциональность, самостоятельность и креативность мышления. А
также контексные задачи являются инструментом оценивания естественнонаучной
грамотности
При
разработке контекстных задач необходимо учитывать несколько принципов:
1.Принцип
доступности подразумевает, что для выполнения таких заданий не требуется
фактических знаний за пределами программного материала. Это важно, потому что
во время контроля знаний на уроке, на экзамене, использование справочной
литературы не допускается. Необходимо оценить уровень развития ключевых
компетенций школьников на основе той знаниевой базы, которая заложена в
образовательный стандарт в качестве обязательного уровня планируемых
результатов. Свою эрудицию учащиеся, которые проявляют особые способности и
устойчивый интерес к изучению химии, могут продемонстрировать при подготовке и
проведении олимпиад, на внеклассных занятиях, мероприятиях предметной недели.
2.Принцип актуальности
практически реализуется при использовании материалов СМИ. Обращение к новостям
науки, анализу текущих событий в мире с точки зрения изучаемого предмета
позволяет избежать искусственности заданий, что существенно влияет на рост
мотивации при работе над ними.
3.Принцип учета
возрастных особенностей учащихся.
Предполагаемое задание должно быть интересно школьнику, а не вызывать скуку,
описывая надуманную ситуацию.
Как правило, в
контекстных заданиях содержатся вопросы и проблемы, с которыми ученик сталкивается в своей обыденно-практической жизни,
литературных источниках, либо они
соответствуют его профессиональным интересам и найдут применение в дальнейшем
обучении.
Наибольшее количество
представленных в современной методической литературе контекстных задач основаны
на двух подходах: историческом и практико-ориентированном.
Практика
показывает, что большой интерес у обучающихся вызывают вопросы, связанные с
применением химических соединений в производстве и быту, с влиянием химически
произведенных веществ на здоровье и физиологию человека, на качество пищи,
возникновение экологических проблем.
В процессе
решения таких задач у учащихся формируются способности искать, отбирать, анализировать
и систематизировать информацию и создавать на её основе новую. Учащиеся
приобретают умения формулировать вопрос, объяснять результат его решения,
применяют знания в реальной жизненной ситуации, выбирают соответствующие формы
для представления полученных результатов. Развивается химическая компетенция
учащихся: они усваивают химические понятия, законы, учатся воспринимать
химические знания и на их основе самостоятельно оценивать информацию, объяснять
результаты.
Задачи могут быть расчётные, творческие,
экспериментальные.
Подходы к
конструированию контекстной задачи
1.
Определив тему предстоящего урока, подумайте, что в этой теме ученикам уже может
быть известно. Скажем, данный вопрос изучался ранее, в младших классах,
или в курсе другого предмета. Что-то ученики могли почерпнуть из различных
«внешкольных» источников: книг, радио, телевидения, газет — или в
результате собственных жизненных наблюдений.
2. Определите,
что в содержании темы будет для учеников новым, ранее им неизвестным или
неосознанным.
3. Подумайте,
в чем может заключаться личностная значимость тех новых знаний, которые
приобретут ученики на предстоящем уроке. Другими словами, сформулируйте для
себя ответы на следующие вопросы: почему я считаю нужным, важным для учащихся
приобретение ими этих знаний? Какой интерес они могут представлять для них? Что
в новой теме может их удивить, заставить по-новому осмыслить уже известное? Где
они могут найти применение полученным знаниям?
4. Сформулируйте
ответы на все предыдущие вопросы обобщенно — в виде личностно значимой
проблемы. Ее формулировка также может иметь характер вопроса, но заданного как
бы от лица учеников.
5. Вспомните
или придумайте какую-либо жизненную ситуацию, анализируя которую или
действуя в которой ученики смогут выйти на осознание и формулирование той
личностно значимой проблемы, которую вы наметили как отправную точку для
вхождения в новую тему.
6. Составьте
текст — описание данной ситуации, т.е. описание условия контекстной задачи, или воспользуйтесь, если это
возможно, готовыми текстами, рисунками, видеоматериалами и т.п.
7. Сформулируйте
задание, требующее анализа ситуации или осуществления соответствующих ситуации
действий, т.е. сформулируйте требование контекстной
задачи.
8. Оцените
качество и предполагаемую эффективность полученной контекстной задачи с двух позиций:
— во-первых,
способствует ли она «встрече» с основной проблемой, решение которой
потребует от учащихся осуществления деятельности по приобретению новых знаний,
соответствующих теме урока;
—
во-вторых, содержит ли данная задача ориентиры для
получения учениками ответа на вопрос о личностной значимости новых знаний и
умений
Задачи
подбираются по следующим критериям:
Содержание
задачи должно опираться на программу соответствующего класса
(Пример. Фармацевту
необходимо приготовить 5%раствор иода, который используют для обработки ран.
Какой объём раствора он может приготовить из10г кристаллического иода, если
плотность раствора должна быть 0,950г/мл?- химия 8класс)
Искомые и
заданные величины (если они указаны) должны быть реальными и нести
познавательную нагрузку
(Пример, В организме
взрослого человека содержится 4г железа на 70кг массы тела. Почти 2/3 этого
железа входит в состав гемоглобина крови. Много железа содержится в печёнке
20мг/100г – химия 9 класс).
Для успешного
решения задачи необходимо не только и не столько знание учащимися фактического
материала, сколько умение логически мыслить и химическая интуиция.
(Пример. Почему в хлебе
много дырочек?- тема оксиды углерода, химия 9 класс)
Содержание
и результат решения задачи должны демонстрировать применение химических знаний
в различных сферах деятельности человека.
(Пример. Почему человеку, нечаянно
выпившему соляную кислоту, рекомендуют принять водную суспензию жжёной
магнезии? Ответ: Жжёная магнезия – это оксид магния, он проявляет основные
свойства и нейтрализует кислоту).
Вопрос
задачи должен быть представлен так, как он обычно формулируется в практической
деятельности.
(Пример. Почему при ожоге
белым фосфором рекомендуют наложить мокрую повязку, пропитанную раствором
медного купороса? Ответ: происходит химическая реакция, благодаря которой белый
фосфор обезвреживается: 2P + 5CuSO4 + 8H2O = 2H3PO4 + 5Cu
+ 5H2SO4.)
Задача
должна быть сложной (комбинированной), включать как качественные, так и
расчётные вопросы; желательно, чтобы она включала и межпредметный материал.
(Пример. Почему ягоды облепихи
остаются мягкими на морозе?
(Научно – популярная информация
(подсказка). В состав облепихового масла входит олеиновая кислота, у неё низкая
температура плавления, поэтому на морозе ягоды облепихи остаются мягкими.
Задание. Установите молекулярную формулу олеиновой кислоты, которая не дает
ягодам облепихи обледенеть, если массовые доли элементов в ней составляют:
углерода – 76,60%, водорода – 12,06%, кислорода – 11,34%. Относительная
молекулярная масса олеиновой кислоты равна 282- химия 10 класс )
(Пример В прошлом были
частыми случаи отравления людей в угольных шахтах угарным газом. Поскольку
оксид углерода(II) не имеет запаха, то опасность подступала незаметно.
Шахтеры, спускаясь в шахты, брали с собой в качестве своеобразного индикатора
канарейку в клетке: канарейки падают в обморок от присутствия в воздухе следов
СО.
Задание: Вычислите,
какой объем (н. у.) займут 0,5 моль СО; 56 г СО.(Ответ:11,2л; 44,8л.)
Установите
молекулярную формулу данного оксида углерода, если массовые доли элементов в
его молекуле составляют: С – 42,86 %; О – 57,14 %.
Задача для
родителей на мастер-классе в рамках проведения Дня открытых дверей:
Всем знакомо
красное вино. Представьте бокал вина в руках, При покачивании бокала что
замечали? А задумывались вы над этим явление Что это?
Сладкий и вязкий
глицерин благотворно влияет на качество вин. При определенных условиях одна из
разновидностей микроорганизмов поселяется и растет на виноградных гроздьях,
повреждая кожуру ягод таким образом содействуя частичному испарению
содержащейся в ягодах воды. Подвергшийся действию этого гриба виноград
обогащается глицерином, а получаемые из него вина отличаются чрезвычайно
сладким и мягким вкусом. Если бокал с вином слегка покачать, то иногда на
стенках бокала остается медленно стекающая пленка, это считается признаком
высокого качества вина и объясняется присутствием высоковязкого глицерина.
(Химия 10 класс-Многоатомные спирты).
Сегодня обществу
необходимы инициативные и самостоятельные субъекты, способные постоянно
совершенствовать свою личность и деятельность. В классическом обучении задания
лишены того жизненного контекста, который придает социальную значимость и
личностный смысл процессу познания, исследования, поиска, знания не ведут
автоматически к пониманию смысла жизни. С помощью контекстных задач выявляются
не только предметные знания и умения, но и их системность, и функциональность,
самостоятельность и креативность мышления, другие личностные характеристики.
Примеры контекстных задач
8 класс
Тема: Молекулярные массы веществ
Задача
1.Установлено, что крапива увеличивает содержание гемоглобина и количество
эритроцитов в крови. Поэтому она является хорошим “кровоочищающим” средством и
чрезвычайно полезна при самых различных заболеваниях крови; используется также
для лечения фурункулов, угрей, лишаев и других кожных заболеваний. Гемоглобин
содержится в эритроцитах крови. Это красный пигмент (гем), содержащий железо, в
сочетании с протеином. Когда кровь проходит через легкие, к атому железа гема (C34H32O4N4)
присоединяется кислород.
Задание. Вычислите относительную молекулярную массу
гема. (Ответ: 616.)
Тема: Количество вещества. Молярный объем газа
Задача 1. Фосфид
цинка Zn₃P₂
весьма ядовит и используется для борьбы с грызунами. Летальная доза для средней
серой крысы составляет 20,56 мг, а для мыши — 4,1 мг.
Вопрос: Какое количество мышей и крыс может погибнуть
от 0,16 ммоль фосфида цинка? (Ответ: 10 мышей, 2 крысы.)
Задача 2. Для
уничтожения микробов и бактерий можно использовать диоксид серы(SO2),
его также применяют в качестве консервирующего средства при сушке чернослива и
других фруктов.
Задание: Вычислите, какой объем займут 1,5 моль диоксида
серы (н. у.).
(Ответ: У(802) =33,6 л.)
Задача 3. В
прошлом были частыми случаи отравления людей в угольных шахтах угарным газом.
Поскольку оксид углерода(2)( СО) не имеет запаха, то опасность подступала
незаметно. Шахтеры, спускаясь в шахты, брали с собой в качестве своеобразного
индикатора канарейку в клетке: канарейки падают в обморок от присутствия в воздухе
следов СО. Задание: Вычислите, какой объем (н. у.) займут
0,5 моль СО; 56 г СО.(Ответ:11,2л; 44,8л)
Тема: Простые вещества-неметаллы.
Задача 1. В
составе приземного воздуха в хвойных лесах обнаруживается большое количество
различных терпеноидов (альфа и бетапинены, камфен, дельта-3-карен, лимонен,
терпинолен и др.), которые участвуют в процессах окисления и фотоокисления
(особенно в жаркие летние дни) и приводят к повышенному содержанию в воздухе
озона и аэроионов, поэтому в хвойных лесах дышится легко. Такой воздух
благотворно действует на легочных больных, но противопоказан при астме и
гипертонической болезни.
Задания:
1.
Составьте уравнение
химической реакции образования озона из кислорода.
2.
Сравните физические
свойства аллотропных модификаций кислорода.
3.
Творческое задание.
Написать сочинение «от имени» озона.
Тема: Массовая доля вещества в растворе
Задача 1. Первым
кровезаменителем, которым воспользовались хирурги еще в 1960-х гг., был
0,85%-ный водный раствор хлорида натрия.
Задание: Вычислите количество вещества хлорида натрия,
необходимого для получения
550.6
г раствора, массовая доля
соли в котором 0,85%. (Ответ: (№аС1) = 0,08 моль.)
Задача 2.
Вычислите массу сульфата цинка, который необходим для получения 10 г раствора
глазных капель, применяемых при лечении конъюнктивита, если известно, что
массовая доля соли в растворе 0,25%. (Ответ: т(2,п804) = 0,025
г.)
Тема: Растворы.
Приготовление растворов
Задача 1. В
середине марта, т.е. за месяц до посева, начинают готовить семена огурцов. Их
подвешивают для прогревания над батареей. Затем на 10 мин. помещают в раствор
поваренной соли NaС1 с массовой долей 0,05 или 5%. Для посева отбирают
лишь потонувшие семена, всплывшие выбрасывают. Кстати, обработка раствором соли
не только помогает отобрать полноценные семена, но и удаляет с их поверхности
возбудителей заболеваний.
Задание: Приготовьте 80 г такого раствора.
Задача 2. В
реанимацию попадают больные, потерявшие много крови. В этих случаях используют
0,85%-й раствор поваренной соли плотностью 1 г/мл), который называется
физиологическим раствором.
Задание:
Представьте, что вы
медсестра реанимационного отделения и должны срочно приготовить 800 мл такого
раствора. Как вы на месте медсестры приготовили бы такой раствор? (Ответ: Растворить 6,8 г соли в 793 мл воды.)
Задача 3.
Фармацевту необходимо приготовить 5%-ный раствор иода, который используют для
обработки ран. Какой объем раствора он может приготовить из 10 г
кристаллического иода, если плотность раствора должна быть 0,950г/мл?
Вопросы:
1.
Какую формулу имеет
кристаллический иод?
2. Что значит «приготовить раствор»?
3. Сделайте по условию задачи необходимые
расчеты для приготовления раствора.
9 класс
Тема: Сплавы.
Задача 1. В
настоящее время в качестве материала для изготовления ювелирных украшений
нередко используют белое золото. Белое золото 585-й пробы — это сплав, состоящий
из трех металлов (массовая доля золота 58,5%, серебра — 26%, остальное
палладий).
Вопросы:
1.
Какие металлы образуют
сплав «белое золото»?
2.
Атомов какого химического
элемента больше всего в сплаве белого золота, а какого меньше всего? Ответ
подтвердите расчетами.
3.
Какие еще металлы могут
входить в состав сплавов золота, используемых для изготовления ювелирных
изделий.
4.
Рассчитайте массу чистого
золота, содержащегося в обручальном кольце ручной работы из белого золота 585
пробы, украшенного 23 бриллиантами общей массой 0, 23 карата. Масса кольца 3,8
г. 1 карат = 0,2 г.
Тема: Коррозия металлов
Задача 1.
На улицах
городов и поселков нередко можно увидеть образцы разрушения металла под
действием
окружающей среды.
Вопрос: Как вы думаете, какие факторы окружающей
среды могли быть причиной коррозии металлов?
Задача 2. Затонувшие корабли «Русалка» —
русский броненосец береговой обороны,
погибший
в 1893 году при переходе из Ревеля (Таллинн) в Гельсингфорс (Хельсинки). На борту
его было 177 моряков. Гибель «Русалки» в конце XIX века была страшной
трагедией для России (своего рода катастрофа «Курска» тех дней). В
Ревеле в 1902 году экипажу «Русалки» поставили памятник, на него
собирала деньги вся держава — там и пожертвованные царем 5000 рублей, и медяки
бедняков.
Российский
корабль нашли эстонские морские археологи в финских территориальных водах —
кому он сегодня принадлежит? «Русалка» — братская могила. Трогать ее
— кощунство. На памятнике в Таллинне выбито: «Россияне не забывают своих
героев-мучеников». Броненосец покоится на глубине около 90 метров, его
корпус и крупные детали коррозия не уничтожила.
Задача 3. По
Черному морю издревле проходили важнейшие морские пути, связывавшие Европу с
Азией. В черноморских глубинах до сих пор без изменений сохраняются не только
сами останки затонувших кораблей, но и все товары, перевозимые ими (металлы,
золото не окисляются и не подвергаются коррозии, дерево, ткани не стареют и не
разрушаются). Но, как только корабли поднимают на поверхность, их корпуса очень
быстро покрываются ржавчиной и разрушаются.
Задания:
1. Объясните, почему на морской глубине скорость
коррозии незначительна,
2. Опишите причины возникновения коррозии в
предложенных ситуациях,
3. Напишите необходимые уравнения химических
реакций и процессов,
4. Определите тип коррозии и предложите способы
защиты.
Задача 4. В
III в. до н. э считался одним из семи чудес света, основой 36-ти метровой
статуи на острове Родос был построен маяк в виде огромной статуи Гелиоса.
Колосс Родосский послужили три массивных каменных столба, скрепленные железными
балками, сверху крепился железных каркас, который покрыли чеканными листами бронзы.
Однако Колосс Родосский просуществовал всего 66 лет и рухнул во время
землетрясения.
Задача 5. В 20-е гг. XX в. произошла менее известная
катастрофа. Рассказывают, что по заказу одного американского миллионера была
построена роскошная яхта «Зов моря». Для обшивки корпуса яхты использовался
сплав никеля с медью (монель — сплав), другие детали корпуса были изготовлены
из специальных нержавеющих сталей. Еще до
выхода в
открытое море яхта полностью вышла из строя.
Ученые считают,
что в обоих случаях причиной произошедших событий были
окислительно-восстановительные
процессы.
Задания:
1.
Объясните, какие именно
окислительно-восстановительные процессы были причиной разрушения металлов,
2.
Опишите причины
возникновения коррозии в предложенных ситуациях,
3.
Напишите необходимые
уравнения химических реакций и процессов,
4.
Определите тип коррозии и
предложите способы защиты.
Тема: Соединения щелочных металлов.
Задача
1.17дека6ря1916г. князь Феликс Юсупов с сообщниками пытался отравить Григория
Распутина, который пользовался неограниченным влиянием на семью последнего
российского императора и которого считают одной из самых одиозных фигур
российской истории. Для этого заговорщики до6авили яд Х в пирожные. Однако яд
не подействовал и Распутин 6ыл убит 11 выстрелами. Проведённый анализ позволил
определить состав яда. Он состоял из калия (60’/’), углерода(18,46%) и азота
(21,54%).
Задание: выведите формулу вещества, которым пытались
отравить Распутина.
Задача 2. В
Англии в последние десятилетия наблюдается снижение смертности от болезней
сосудов головного мозга. Это связано с увеличением потребления свежих фруктов и
овощей. В свежих овощах и фруктах всегда много калия и мало натрия. Натрий задерживает
воду в организме, повышая артериальное давление, а калий, напротив,
способствует его снижению. Вот почему увеличение потребления овощей, фруктов, в
частности яблок, можно рассматривать как существенную меру предупреждения
болезней сосудов головного мозга.
Задания:
1. Составьте уравнения электролитической
диссоциации хлорида калия, хлорида натрия.
2. Какова биологическая роль ионов натрия и калия
в живом организме7
Задача 3. Какой объем (н.у.) углекислого газа
заполнит поры бисквитного торта, если для его приготовления Алена взяла 2 г
питьевой соды с содержанием примесей 0,1% и обработала уксусной кислотой?
Ответ: Количеством углекислого газа, попавшего в воздух,
пренебречь при протекании реакции по уравнению:
Дано:
т(NaHС03) = 2 г,
(примесей) = 0,1 %.
Найти:
У(С02).
Решение
ш(NaHС03)(чист.) = 2^9,9(%)Л00(%) = 1,998 г;
1,998/84 = х/22,4, х = 0,53 л СО2.
Ответ. V(С02) = 0,53 л — такой объем углекислого газа
заполнит поры бисквитного торта.
Тема: Металлы 2 группы главной подгруппы.
Задача 1.У жителей южных районов спазмы
кровеносных сосудов происходят реже, чем у северян. Врачи связывают это с
содержанием в организме магния, т.к. известно, что внутривенные и
внутримышечные вливания растворов солей магния снимают спазмы и судороги. В
организм человека магний поступает с овощами и фруктами. Особенно богаты им
абрикосы, персики и цветная капуста.
Задание.
1. Составьте уравнения электролитической
диссоциации хлорида магния.
2. Подготовьте сообщение о биологической роли
магния.
Задача 2. Какой объем (н.у.) углекислого газа
поглотят стены только что выбеленной квартиры, если на побелку затрачено ведро
известкового молока? Для его приготовления к 4 кг негашеной извести (кипелки)
прилили 5 л (кг) воды, процедили, отбросили 100 г мелких камешков, затем добавили
еще 6 л воды и хорошо все перемешали. Полученной массой выбелили стены.
Ответ.
Дано:
т(СаО) = 4 кг, т(Н2О) = 5 кг, т(примесей) =
0,1 кг.
Найти:
У(СО2).
Решение
т(100%-гоСаО) = 4 — 0,1 = 3,9 кг.
Найдем необходимую массу Н2О:
3,9/56 = х/18, х = 1,25 кг Н20. у = 3,9 + 1,25
= 5,15 кг Са(ОН)2;
5,15/74 = 2/22,4, 2 = 1,56 м3 СО2.
Ответ.: V(СО2) = 1,56 м3 — такой объем углекислого газа
поглотят выбеленные стены помещения.
Тема: Водород.
Задача 1.Сейчас посмотрите — сказал Челленджер
— Последние дни я напрягал все силы своего ума, чтобы разрешить задачу, как нам
выбраться отсюда. Мы уже убедились, что спуск по отвесным скалам невозможен, а
туннеля больше не существует. Перебросить мост на утёс нам, безусловно, не
удаётся. Но что, же тогда делать? Я как — то говорил нашему юному другу, что
эти гейзеры выделяют водород в свободном состоянии. Отсюда логически вытекала
мысль о воздушном шаре.
Вопросы:
1. Увидели ли вы логику в рассуждениях героя
романа «Затерянный мир».
2. Рассчитайте, какая масса цинка потребовалась
бы, чтобы наполнить шар объёмом 1 м3, которым воспользовались участники
неудавшейся экспедиции.
Тема: Галогены.
Задача 1.В ходе Первой мировой войны
руководство германской армии пошло на чудовищное преступление — применение
отравляющих веществ. Жидкий хлор немцы транспортировали к линии фронта в
специальных цистернах и в подходящий момент, когда ветер дул в нужную сторону,
разливали в баллоны. Тысячи таких баллонов они тайно устанавливали на передовых
позициях. Вентили их баллонов открывали одновременно. При этом хлор выходил
наружу и устремлялся на позиции в виде гонимого попутным ветром облака,
губительного для всего живого. Если газовая атака оказывалась внезапной, гибли
тысячи людей. Узнать вовремя о намерении противника применить хлор — значило
выиграть время для принятия защитных мер и сохранить человеческие жизни. Однако
долго не знали, как это осуществить. Русский офицер нашел способ решения этой
задачи. Он изобрел прибор, предупреждающий об опасности звонком.
Вопрос: На каких свойствах хлора мог основываться принцип
действия этого прибора?
Задача 2.
А. Первым боевым отравляющим веществом был
хлор. Германия применила его 22 апреля 1915 г. в долине р. Ипр против
французской дивизии. Только в один этот день было отравлено 15 тыс. человек, из
которых 5 тыс. погибли.
Б. Согласно ГОСТу 2874 — 54 после 30 минутного
контакта хлора с водой при выходе воды из очистных сооружений в ней должно быть
остаточного хлора не более 0,5мг/л не менее 0,3 мг/л, в наиболее отдаленных
точках водозабора — не менее 0,1 мг/л.
Вопросы:
Ежедневный прием небольших доз соединений йода
помогает избавиться от зоба. Морские губки, морская капуста богаты йодом.
Поэтому в Китае и Японии больных зобом издавна лечат золой морских губок.
Задание. Вычислите, сколько граммов морской капусты необходимо
съедать ежесуточно для того, чтобы восполнить суточную потребность (800 мг)
организма в йоде. В 100 г морской капусты содержание йода составляет 250 мг. (Ответ:
320 г в сутки.)
Тема:
«Соединения серы»
Что может быть
известно учащимся о кислородных соединениях серы? Кислотные оксиды. Им
соответствуют кислоты, степень окисления.
Что может вызвать
интерес у учащихся и быть личностно значимым для них? Способы получения,
физические и химические свойства оксидов.
Все мы показываем сжигание
серы. После этого опыта чувствуется сладковатый привкус в горле, голос
пропадает. Что это?
2) Со времен Гомера известен этот
оксид – бесцветный газ с резким запахом. Одиссей, хитроумный герой Троянской
войны, окуривал им помещение, в котором сражался, и в конце концов победил
женихов Пенелопы. Плиний Старший, римский историк (23-79 гг. н. э.), тоже
упоминал в своих сочинениях о газообразном оксиде, который уничтожает инфекцию
и вредных насекомых. Тот же оксид стал причиной смерти Плиния во время
извержения Везувия в 79 г н.э. В наши дни это соединение выбрасывается в
атмосферу с дымом тепловых электростанций и металлургических заводов и является
причиной «кислотных дождей».
Человек начинает ощущать едкий
запах этого оксида серы, если в 1 м3 воздуха содержится 3 мг этого
вредного газа. При вдыхании воздуха с таким содержанием этого газа в течение
пяти минут у человека наступает ларингит — потеря голоса. Какое суммарное
количество (моль) диоксида серы приводит к этому неприятному заболеванию?
Примите объем легких человека равным 3,5
л, а периодичность дыхания — 4 с.
Укажите источники диоксида серы в
воздухе. Когда
«газ Одиссея» смешивают с влажным сероводородом, выделяется сера, а пероксид
водорода в водном растворе превращает его в сильную кислоту, окисляется
кислородом
Вопросы:
1.Что это за газ?
2.Какие свойства он проявляет: окислительные или
восстановительные. Подтвердите уравнениями реакций.
17дека6ря1916г.
князь Феликс Юсупов с сообщниками пытался отравить Григория Распутина, который
пользовался неограниченным влиянием на семью последнего российского императора
и которого считают одной из самых одиозных фигур российской истории. Для этого
заговорщики до6авили несколько граммов яда Х в пирожные. Однако яд не
подействовал, Распутин лишь почувствовал лёгкое недомогание… Распутин 6ыл убит
11 выстрелами.
Проведённый анализ позволил
определить состав яда. Он состоял из калия (60’/’), углерода(18,46%) и азота
(21,54%).
Задание: выведите формулу вещества,
которым пытались отравить Распутина и почему смертельная доза яда не
подействовала. Составьте уравнение реакции
KCN соль слабой и летучей синильной
кислоты, разлагается даже угл газом
2KCN +H2O + CO2
= K2CO3 + HCN↑
Соединение с
молекулярной формулой С3Н8О подвергли окислительному
дегидрированию, в результате чего получили продукт состава С3Н6О.
Это вещество вступает в реакцию «серебряного зеркала», образуя соединение
состава С3Н6О2. При действии на последнее
гидроксидом кальция получили вещество, используемое в качестве пищевой добавки
под кодом Е282. Оно препятствует росту плесени на хлебобулочных и кондитерских
изделиях и, кроме того, содержится в таких продуктах, как швейцарский сыр.
1.Напишите
уравнения реакций, рассматриваемых в задаче. Приведите названия образующихся
органических веществ.
2.Определите
формулу добавки Е282.
3.Объясните, с
какой целью рассматриваемое вещество добавляют в сыр.
4.Что вы знаете о пищевых добавках?
Применяете ли вы их? Ответ обоснуйте.
Тема: Кислород.
Задача 1.На
практической работе класс получал кислород из марганцовки. Внезапно у Никиты
лопнула пробирка, и 2 г марганцовки высыпалось в пламя горелки с сухим горючим.
Эффект был ошеломляющим.
Задание: Определите объем (н.у.) кислорода,
позволивший пламени вырасти до потолка и лишить Никиту возможности дальнейшего
выполнения практических работ из-за нарушения правил техники безопасности (что
категорически запрещено), если в марганцовке было 0,02 г примесей.
Ответ.
Дано:
т(КМпO4) = 2
г, т(примесей) = 0,02 г.
Найти:
У(02).
Решение
1,98/316 = х/22,4, х = 0,14 л О2.
Ответ: У(02) = 0,14 л — такой объем кислорода
оказался для Никиты роковым.
Тема: Соединения серы.
Задача 1.Если
верить легенде, Черное море получило свое название из-за почернения опускаемых
в его пучинах серебряных предметов. Это связано с тем, что на глубине более 200
м морская вода содержит сероводород (продукт жизнедеятельности некоторых
микроорганизмов). Наличие сероводорода делает невозможной жизнь морских растений
и животных в этой зоне. В последние годы по непонятным причинам сероводород
стал медленно подниматься к поверхности воды. Если этот процесс не прекратится,
то Черное море станет безжизненным.
Задания:
1.
Предложите способ борьбы
с «наступлением сероводорода».
2.
Оцените предложенный вами
способ с экономической и экологической стороны.
3.
В одном из стихотворений
К.И. Чуковского есть такие строки:
«А лисички взяли спички, к морю синему пошли,
море сине зажгли». Реально ли это сделать?
Задача 2.Со
времен Гомера известен этот оксид — бесцветный газ с резким запахом. Одиссей,
хитроумный герой Троянской войны, окуривал им помещение, в котором сражался, и
в конце концов победил женихов Пенелопы. Плиний Старший, римский историк (23-79
гг. н. э.), тоже упоминал в своих сочинениях о газообразном оксиде, который
уничтожает инфекцию и вредных насекомых. Тот же оксид стал причиной смерти
Плиния во время извержения Везувия в 79 г н.э. В наши дни это соединение
выбрасывается в атмосферу с дымом тепловых электростанций и металлургических
заводов и является причиной «кислотных дождей». Когда «газ Одиссея» смешивают с
влажным сероводородом, выделяется сера, а пероксид водорода в водном растворе
превращает его в сильную кислоту.
Вопросы:
1.
Что это за газ?
2.
Какие свойства он
проявляет: окислительные или восстановительные. Подтвердите уравнениями
реакций.
Задача 3… .Тогда услышал я, о, диво, запах
скверный Как будто тухлое разбилось яйцо Иль карантинный страж курил жаровней
серной.
Я, нос себе, сжав, отворотил лицо.
Вопросы:
1.О каких соединениях серы написано в
стихотворении А.С. Пушкина?
2.
Какими физическими
свойствами обладают эти соединения?
Тема: Подгруппа азота
Задача 1. По
официальной версии Наполеон умер от рака желудка. Спустя 140 лет ученые пришли
к выводу, что, скорее всего, он был отравлен ядовитыми соединениями элемента Х.
Вероятно, Наполеону длительное время подмешивали в пищу вещество состава Х2О3 в
малых дозах.
Задания:
1.
Установи элемент X, если
известно, что его массовая доля в оксиде составляет 75,7%.
2.
Дайте характеристику
элемента Х на основании его положения вПСХЭ Д. И. Менделеева и строения атома.
3.
К металлам или неметаллам
относится простое вещество, образованное элементом X?
4.
Установите химический
характер оксида Х2О3 .
5.
Найдите в интернете или
других источниках информации, как можно использовать простое вещество,
образованное элементом X?
Тема: Аммиак. Соли аммония
Задача 1.Огнев Н. Повесть « Дневник Кости
Рябцева».
… Сегодня
Черная Зоя сдавала экзамен за октябрь Алмакфишу и вдруг как шлепнется в
обморок. Ну, теперь этим никого не удивишь. Сейчас же опрыскали водой, дали
понюхать нашатырю, и она встала.
Вопросы:
1.
Какое вещество называется
нашатырем?
2.
Что дают нюхать человеку,
потерявшему сознание?
Задача 2. В.Солоухин в романе «Продолжение
времени» писал : Современные модернисты создают свои шедевры, не отходя от
холста. Потому что зачем трудиться, если все равно никто ничего не поймет.
Можно даже перерисовать из школьного учебника схему получения аммиачной
кислоты, и выставить под названием «Зимний пейзаж».
Вопросы:
1.
Существует ли в природе
аммиачная кислота?
2.
Схему получения какого
вещества вероятнее всего имел в виду автор отрывка?
Задача 3.Как
известно, при выпечке хлеба в тесто добавляют сухие дрожжи — это смесь солей:
гидрокарбоната аммония, карбоната аммония и карбамата аммония КН/ШН2СОО. Все
эти соли при нагревании разлагаются и придают тесту желанную пористость.
Задание:
Проведите опыт и составьте
уравнения химических реакций, происходящих при выпечке хлеба, замешанного на
сухих дрожжах.
Задача
4.Теннисные мячи. Знаете ли вы, что теннисные не надувают? В них входят
специальные вещества — «вздуватели». Эти вещества при нагревании разлагаются с
образованием газообразных продуктов. В заготовки теннисного мяча, которые имеют
вид полусфер и предварительно смазаны клеем, кладут таблетки, содержащие смесь
нитрата натрия и хлорида аммония. Склеенные половинки мяча помещают в форму для
вулканизации и нагревают.
Вопросы:
1.
Составьте уравнение
реакции нитрата натрия с хлоридом аммония.
2.
Рассчитайте массу
таблетки, состоящей из стехиометрической смеси нитрата натрия и хлорида
аммония, которую нужно поместить в мяч объёмом 162 мл для достижения внутри
мяча давления1,2 атм. при 25°С.
Подгруппа
Углерода
Задача 1.
В.Ф.Одоевский «Мороз Иванович»- «Между тем Рукодельница воротится, воду
процедит, в кувшин нальет, да ещё какая затейница: коли вода нечиста, так
свернет лист бумаги, наложит в неё угольков да песку крупного насыплет, вставит
ту бумагу в кувшин да нальет в нее воды. А вода-то, знай, проходит сквозь песок
да сквозь уголья и капает в кувшин чистая, словно хрустальная».
Вопросы:
1.
Назовите метод очистки
веществ.
2.
Зачем Рукодельница брала
угольки?
Задача 2. 5
октября 2010 г. в Стокгольме были названы имена лауреатов Нобелевской премии по
физике за 2010 г. Самую престижную из премий получили два выходца из России —
Константин Новосёлов и Андрей Гейм за эксперименты с графеном. Графен
представляет собой одинарный слой атомов углерода, соединённых между собой в
структуру, напоминающую пчелиные соты. Для получения графена плоские куски
графита помещают между липкими лентами (скоч) и расщепляют раз за разом,
создавая достаточно тонкие слои (среди многих пленок могут попадаться
однослойные и двухслойные, которые и представляют интерес). Ожидается, что
графен:
•
заменит кремний в
микросхемах. Чипы на его основе станут легче, производительнее, стабильнее в
работе, будут потреблять меньше электроэнергии и рассеивать меньше тепла;
•
придет на смену тяжелым
медным проводам в космонавтике и авиации;
•
будет использован при
создании гибких сенсорных дисплеев и солнечных батарей;
•
найдет применение в
качестве сенсора для обнаружения отдельных молекул.
К тому же графен
по прочности превосходит все известные материалы, Г амак, выполненный из
графена, не видим глазом, но сможет выдержать четырехкилограммового кота.
Вопросы:
1.
Обладает ли графен
электропроводностью?
2.
Горит ли графен?
3.
Можно ли использовать
графен при создании полупроводниковых материалов?
4.
Какова гибридизация
атомов углерода в графене?
5.
Имеются ли в графене
делокализованные связи?
6.
Назовите еще 4
аллотропных модификации углерода, кроме графита и графена.
7.
В какой из аллотропных
модификаций углерода атомы находятся в состоянии $р 3—
гибридизации?
Задача 1.В
прошлом были частыми случаи отравления людей в угольных шахтах угарным газом
СО. Поскольку оксид углерода не имеет запаха, то опасность подступала
незаметно. Шахтеры брали с собой канарейку в клетке в качестве индикатора:
канарейки падают в обморок от присутствия в воздухе следов угарного газа и
метана.
Задание. Установите молекулярную формулу данного
оксида углерода, если массовые доли элементов в его молекуле составляют: С —
42,86 %; О — 57,14 %.
Задача 2.Чтобы
получить этот оксид в твердом виде достаточно взять его в жидком состоянии и.
вылить прямо в бумажный пакет. Получится белый порошок, с которым хорошо
знакомы уличные продавцы мороженного. Этот оксид честно служит людям: его
хорошо знают те, кто хотя бы однажды пользовался огнетушителем или пил
газированную воду. А голландский ученый Ян Баптист ванГельмонт в 1620 г. назвал
этот оксид «лесным духом».
Вопросы:
1. Что это за вещество?
2. Обьясните, почему этот оксид называют
«сухой и холодный».
Задача
3.Углекислый газ СО2 не ядовит, но при вдыхании его в больших количествах
наступает удушье из-за недостатка кислорода. В Италии находится «Собачья
пещера», в которой человек стоя может находиться длительное время, а забежавшая
туда собака задыхается и гибнет.
Задания:
1.
Составьте молекулярную
формулу углекислого газа.
2.
Определите относительную
плотность углекислого газа по воздуху.
3.
Обоснуйте, почему
углекислый газ в «Собачьей пещере» скапливается внизу?
4.
Составить карточку
«Анкетные данные углекислого газа».
Задача 4. Какой
объем (н.у.) углекислого газа заполнит помещение кухни, если Петя в отсутствие
родителей решил прокалить на газе 700 г толченого мела, в котором 2% примесей?
(Так он решил проверить правдивость утверждения своего учителя химии о
необходимости постоянного проветривания помещения, где проводится такой опыт).
Задание: Что произойдет, если Петя не откроет
форточку? Ответ подтвердите расчетом.
Ответ.
Дано:
т(мела) = 700 г,
(примесей) = 2%.
Найти:
У(С02).
Решение
Из условия следует, что содержание СаСО3 в
меле 98%. т(СаСОз) = 700 • 98(%)/100(%) = 686 г;
686/100 = х/22,4, х = 153,7 л СО2.
Ответ. V(С02) = 153,7 л — такой объем СО2
скопится на кухне. Если Петя не откроет форточку, то он может задохнуться.
Задача 5. Многие люди любят парится в бане. Однако в русской бане не
исключена угроза отравления угарным газом. Признаки отравления им детально
описаны: сначала сильное головокружение, необыкновенная бледность лица, у
некоторых бывает рвота, потом глубокий обморок, а при продолжительном
воздействии газа — летальный исход. Чтобы избежать опасности, необходимо
придерживаться следующих правил: когда баня истоплена и уже достаточно
прогрета, надо тщательно перемешать угли в топке, чтобы не осталось даже
маленькой тлеющей головешки. Большие тлеющие головешки следует убрать и
погасить в ведре. Из поддувала печки также нужно всё выгрести, так как там
могут находиться долго тлеющие угли.
Задание:
Выведите формулу угарного газа, если известно,
что он относится к оксидам, а массовая доля углерода в нём составляет 42,86%
Соли угольной кислоты.
Задача 1.Большой популярностью среди туристов
пользуются сталактитовые пещеры в горах Кавказа и Крыма, среди которых есть не
пройденные до конца. Известняковые пещеры- лабиринты Крыма служили партизанам
убежищем в период Великой отечественной войны. Реакция превращении карбоната в
бикарбонат обратима, поэтому на потолке известняковой пещеры из капли воды,
насыщенной гидрокарбонатом кальция, выделяется диоксид углерода, и прежде чем
капля успеет упасть вниз, часть растворенного гидрокарбоната превращается в
твердый карбонат. Так зарождаются свисающие вниз сосульки сталактитов. Из воды,
капающей со сталактита, на полу пещеры тоже осаждается карбонат кальция, и с
течением времени навстречу свисающей сосульке поднимается такой же столб снизу
— сталагмит.
Задания:
1. Запищите химические формулы веществ:
гидрокарбонат кальция, карбонат кальция, диоксид углерода.
2. Составьте схемы превращения веществ, о
которых говорится в задаче.
3. Определите тип каждой химической реакции.
4. Сделайте вывод о свойствах солей угольной
кислоты, их растворимости.
5. Сделайте сообщение о распространении солей
угольной кислоты в природе.
Задача 2. Побывав на Урале у деда —
малахитовых дел мастера, Никита привез красивый зелено-голубой порошок
(малахитовую пыль). На занятиях в кружке по химии все решили попробовать
получить из него оксид меди. В процессе нагревания мальчик случайно чихнул, и
из выпарной чашки вылетела половина содержимого. Однако черный порошок оксида
меди Никита все же получил в количестве 2 г.
Задание: Какую массу малахита (Си0Н)2С0з взял Никита изначально,
если в нем содержится 5% примесей?
Ответ:
Дано:
т(СиО) = 2 г,
(примесей) = 5%.
Найти:
т(малахита).
Решение
х/222 = 2/160, х = 2,8 г 100%-го (Си0Н)2С03;
т(малахита) = 2,8 100(%)/95(%) = 2,9 г.
Поскольку Никита половину малахита высыпал, то
результат нужно увеличить в два раза. Изначальная масса малахита: 2,9*2 = 5,8
г.
Ответ. 5,8 г малахита взял изначально Никита.
Задача 3. Какой объем (н.у.) углекислого газа
попадет в вытяжной шкаф, если при прокаливании 20 г малахита Никита наденет
противопыльную маску? Примесей в малахите содержится 5%..
Ответ.
Дано:
т(малахита) = 20 г,
(примесей) = 5%.
Найти:
У(С02).
Решение
т(100%-го (Си0Н)2С0з) = 20 • 95(%)/100(%) = 19
г;
19/222 = х/22,4, х = 1,9 л С02.
Ответ. V(С02)
=1,9 л — такой объем углекислого газа попадет в вытяжной шкаф, а надетая маска
на химический процесс не повлияет.
Интересные задачи:
По официальной
версии Наполеон умер от рака желудка. В записи, сделанной Наполеоном в апреле
1821г, за 20 дней до смерти, говорится «Я умираю не своей смертью. Меня убила
английская олигархия и её наёмный убийца» Спустя 140 лет ученые пришли к
выводу, что, скорее всего, он был отравлен ядовитыми соединениями элемента Х.
Вероятно, Наполеону длительное время подмешивали в пищу вещество состава Х2О3
в малых дозах.
Задания:
1.Установи элемент Х, если
известно, что его массовая доля в оксиде составляет 75,7%.
2.Дайте характеристику элемента Х
на основании его положения вПСХЭ Д. И. Менделеева и строения атома.
3.К металлам или неметаллам
относится простое вещество, образованное элементом Х?
4.Установите химический характер
оксида Х2О3 .
5.Встречается ли Х в природе в виде
простого вещества?
Вы прокипятили
белое белье со стиральным порошком и содой в старом баке из оцинкованной жести
и обнаружили, что на белье, которое находилось на дне бака, появились желтые
пятна, а на стенках бака – белых рыхлый налет. Почему это произошло? Напишите
уравнения реакций. Как можно удалить пятна с белья и налет со стенок бака? Что
надо было делать, чтобы не испортить белье?
В кондитерском и
хлебном производстве часто применяют так называемые пекарские порошки. Где же
их найти? Его можно сделать дома. Этот рецепт я узнала в старших классах на
уроках труда. Пекарский порошок – изобретение XX века. Он очень популярен в
кулинарии стран Западной Европы и Америки.
Простейший состав
пекарского порошка:
1 часть пищевой
соды;
1 часть лимонной
кислоты или другой кислой соли (например дигидрофосфата натрия)
1 часть муки,
крахмала, сахарной пудры (или их смеси).
Вопросы:
Поясните, какими
свойствами обладает сода, чтобы улучшать качество теста?
Можно ли использовать
соду без лимонной кислоты?
Сода и лимонная
кислота хорошо растворяются в воде. Нужно ли их растворять, перед тем как
положить в тесто?
Можно ли заменить
соду в пекарском порошке на другое вещество, и если да, то какое?
Поясните, зачем в пекарском
порошке мука, ведь она есть в тесте.
Напишите уравнения
химических реакций, происходящих с пекарским порошком в результате выпечки
теста».
В одном царстве
жил капризный царь, захотел он выкрасить весь дворец в белый цвет и позвал
мастера. Выслушал мастер и спрашивает: “ Где же я такой краски возьму, чтоб не
портилась и на весь дворец хватило? “. Рассердился царь и дал мастеру сутки
сроку. Взял мастер металлическую пластину с крыши, растворил ее в желудочной
микстуре (3%-ный раствор соляной кислоты), зашипел в колбе газ; добавил щелочи
едкой, выпал осадок белоснежный. Но, видно, не рассчитал, и исчез осадок. В
другой раз аккуратнее он был. Получил осадок и отделил, потом на печке прокалил
его. Так и получил он знатную краску, царь остался доволен.
Опишите химические
превращения мастера. (Zn – ZnCl2 – Zn(OH)2 – ZnO.)
Шел солдат
по полю, решил привал сделать, письмо написать родным, да нечем. Тут он нашел
черный камешек, попробовал – рисует. Написал этим камешком письмо, да поспать
решил. Бросил камешек в огонь – тот вспыхнул, только дым пошел. Дождь дым
остановил, к земле прибил; водица текла тяжелая, известковая. Стала сохнуть
вода, кое-где осталась, а где высохла – там уж белые камешки лежали. Проснулся
солдат, удивился, как дождь из черного камешка белый сделал. Взял он белый
камешек, провел им по белому валуну, глядь – а он рисует. Удивился солдат и
пошел дальше.
Опишите химические
превращения (С – СO2 – H2CO3 – CaCO3)
Как известно, после
Бородинского сражения (26.08.1812 года) главнокомандующий русской армией
генерал – фельдмаршал М.И.Кутузов (1745-1813 г.) принял очень нелегкое решение
сжечь Москву: «Мы оставим Москву, но спасем армию, а значит, и всю Россию».
Москва горела шесть
дней. Погибло три четверти построек. Пожар уничтожил и монетный двор.
Впоследствии, при разборке пожарища были обнаружены медные монеты, покрытые
черным налетом. Монеты промыли, но налет остался.
- Объясните
причину образования черного налета на медных монетах? - Каким
образом можно придать первозданный вид монетам? - Докажите
экспериментально на примере медной проволоки свои выводы.
Большой
популярностью среди туристов пользуются сталактитовые пещеры в горах Кавказа и
Крыма, среди которых есть не пройденные до конца. Известняковые
пещеры-лабиринты Крыма служили партизанам убежищем в период Великой
отечественной войны. Реакция превращении карбоната в бикарбонат обратима,
поэтому на потолке известняковой пещеры из капли воды, насыщенной
гидрокарбонатом кальция, выделяется диоксид углерода, и прежде чем капля успеет
упасть вниз, часть растворенного гидрокарбоната превращается в твердый карбонат.
Так зарождаются свисающие вниз сосульки сталактитов. Из воды, капающей со
сталактита, на полу пещеры тоже осаждается карбонат кальция, и с течением
времени навстречу свисающей сосульке поднимается такой же столб снизу –
сталагмит.
Задания:
1.Запищите химические формулы
веществ: гидрокарбонат кальция, карбонат кальция, диоксид углерода.
2. Составьте схемы превращения
веществ, о которых говорится в задаче.
3. Определите тип каждой химической
реакции.
4. Сделайте вывод о свойствах солей
угольной кислоты, их растворимости.
5. Сделайте сообщение о
распространении солей угольной кислоты в природе.
10 класс
Тема: Ароматические углеводороды.
Задача 1. Клюква
и брусника могут очень долго храниться в свежем виде без сахара, так как этому
способствует наличие в них прекрасного консерванта — бензойной кислоты.
Задания.
1.
Установите молекулярную
формулу кислоты, если массовые доли элементов в ней
составляют: углерода — 68,85%, водорода —
4,92%, кислорода — 26,23% (М = 122 г/моль).
2.
При окислении какого
ароматического углеводорода образуется бензойная кислота, напишите уравнение
реакции.
Тема: Спирты.
Задача 1. Задание: Какую массу 96% этилового спирта С2Н5ОН подвергнет
Алексей сжиганию в спиртовке при получении кислорода из марганцовки, если в течение
опыта спиртовка выделяет 800 мл (н.у.) углекислого газа? А сколько граммов
спирта раздаст учитель в классе 27 ученикам, которые проведут такой опыт?
Ответ:
Дано:
(С2Н5ОН) = 96%,
У(С02) = 0,8 л,
N = 27 человек.
Найти:
т(С2Н5ОН).
Решение
т(96%-го С2Н5ОН) = 0,8 х100(%)/96(%) = 0,83 г.
На этот опыт 27 учеников израсходуют спирта:
27 х 0,83 = 22,5 г.
Ответ. Алексей
сожжет 0,83 г, а учитель раздаст в классе для проведения опыта 22,5 г 96%-го
этилового спирта.
Тема: Карбоновые кислоты.
Задача 1.Соединение
с молекулярной формулой С3Н8О, подвергли окислительному дегидрированию, в
результате чего получили продукт состава С3Н6О. Это вещество вступает в реакцию
«серебряного зеркала», образуя соединение состава С3Н6О2. При действии на
последнее гидроксидом кальция получили вещество, используемое в качестве
пищевой добавки под кодом Е282. Оно препятствует росту плесени на хлебобулочных
и кондитерских изделиях и, кроме того, содержится в таких продуктах, как
швейцарский сыр.
Задания:
1.
Напишите уравнения
реакций, рассматриваемые в задаче. Приведите названия образующихся органических
веществ.
2.Определите формулу добавки Е282.
3.Объясните, с какой целью рассматриваемое
вещество добавляют в сыр.
4.
Что вы знаете о пищевых
добавках? Применяете ли вы их? Ответ обоснуйте.
Задача 2.При
укусах муравьев возникает чувство боли — за счёт действия муравьиной кислоты.
Если место укуса смочить нашатырным спиртом, боль пропадает.
Задания:
1.
Запишите формулу
муравьиной кислоты.
2.
Составьте уравнение
химической реакции нейтрализации, которая лежит в основе применения нашатырного
спирта для уменьшения боли при укусах муравьев.
3.
Назовите продукт
химической реакции.
4.
Составьте уравнения еще
2-х химических реакций, в которых может участвовать муравьиная кислота.
5.
Подготовьте сообщение
«Химический характер житейских ситуаций» (Уравнения химических реакций,
встречающихся в быту).
Задача 3. Всем известно, что крапива больно
жжётся.
Задания:
1.
Установите формулу
вещества, которое вызывает жжение, если массовые доли элементов в этом веществе
составляют: 26,08%(С), 4,35%(Н), 69,56%(О).
2.
Назовите вещество. К
какому классу органических соединений оно относится?
3.
Напишите пошаговую
инструкцию-подсказку для соседа по парте — как вывести молекулярную формулу
вещества по его составу.
Задача 4. В
северных широтах местные жители применяют лишайники (паргелия, кладония
альпийская) для очищения кишечника. В них содержится мощный антибиотик —
усниновая кислота. Механизм действия лишайника в человеческом организме таков:
лишайники содержат много слизеобразующих веществ, которые отлично абсорбируют
токсины и выводят их из организма человека. Обволакивая слизистую, они создают
защитный слой, а значит, создают условия для быстрого заживления язвенных и
эрозийных дефектов (например, при дизентерии),поэтому нанайцы редко болеют
дисбактериозом.
Задание. Установите молекулярную формулу кислоты,
если массовые доли элементов в ней составляют: С — 62,79 %; Н — 4,65 %; О —
32,56 %; Мг = 344.
(Ответ. С18Н16О7.)
Перед вами таблица, используя данные, составьте задачу
олифы получают из
растительных масел путём их частичной полимеризации. Поскольку все растительные
масла содержат триглецериды непредельных карбоновых кислот:
олеиновой: C8H17CH=CH(CH2)7COOH,
линолевой: CH3(CH2)3(CH2CH=CH)2(CH2)7COOH,
и линоленовой: C2H5(CH=CHCH2)3(CH2)6COOH,
теоретически олифу можно получить из
любого масла. Но чаще всего для этой цели используют льняное и конопляное
масла, т.к. именно из них получаются самые лучшие олифы. Объясните это на
основании информации о составе различных растительных масел, приведенных в
таблице.
|
Масло |
содержание |
||
|
олеиновой |
линолевой |
линоленовой |
|
|
льняное |
13-29 |
15-30 |
44-61 |
|
хлопковое |
23-35 |
34-57 |
— |
|
конопляное |
6-16 |
36-50 |
15-28 |
|
подсолнечное |
24-40 |
46-62 |
— |
|
оливковое |
54-81 |
15 |
— |
|
рапсовое |
5-44 |
11-42 |
1-12 |
|
соевое |
20-30 |
44-60 |
5-14 |
Тема: Сложные эфиры. Жиры.
Задача1. Неприятный
запах горелого масла и любых перегретых жиров объясняется образованием
акролеина (пропеналя), который является продуктом дегидратации глицерина.
Вопросы:
1.
Какие реакции, протекающие
при жарке пищи, приводят к образованию акролеина из жиров?
2.
Как в домашних условиях
избавиться от этого запаха?
3.
На каких свойствах основан
предложенный Вами способ?
Задача 2.Часто в
магазине мы покупаем масло, содержащее в своем составе не только животные, но и
растительные жиры.
Вопросы:
1.
Отличается ли такое масло
по своим свойствам от маргарина? Если да, то в чем?
2.
Как отличить растительное
масло от машинного (минерального)?
3.
Продемонстрируйте
предложенные Вами способы решения поставленной задачи.
Задача 3.
Автомеханик во время приема пищи капнул на одежду растительным маслом.
Образовалось масляное пятно. Он подумал: «Какая неудача. Сегодня нет времени. Но
в конце недели обязательно избавлюсь от пятна на жилете с помощью растворителя,
как в прошлый раз вывел пятно от сливочного масла». Он повесил жилетку на
спинку стула и забыл о ней. Через некоторое время автомеханик решил постирать
свою рабочую одежду: она была в машинном масле. Сосед-кондитер посоветовал ему
купить моющее средство «Мыло с желчью», которым он стирает свою рабочую одежду,
пропитанную растительными и животными жирами. Автомеханик так и поступил. Но
машинное масло не отстиралось.
Вопрос: Почему?
Тема:Углеводы.
Задача 1.У
дельфина слёзы сладкие, потому что в слезе дельфина содержатся сахара —
галактоза и фруктоза. Углеводно-белковые, напоминающие белок куриного яйца,
слёзы служат смазкой. Дельфины плачут, чтобы лучше видеть и быстрее плавать.
Вопросы:
1.
Установите молекулярную
формулу фруктозы, которая придаёт дельфиньим слезам сладкий вкус, если массовые
доли элементов в ней составляют: 40,0%(С), 6,6%(Н), 53,4%(О).
2.
Сравните (в табличной
форме) физические свойства глюкозы и фруктозы.
Тема:Аминокислоты.
Задача 1.Одной
из причин долголетия японцев является широкое употребление в пищу
морепродуктов. Содержащиеся в них жиры являются ненасыщенными. В их состав
входит большое число незаменимых жирных кислот и жирорастворимых витаминов. Как
незаменимые жирные кислоты, так и жирорастворимые витамины являются важнейшими
составляющими рациона питания, необходимыми для поддержания здоровья человека и
продления его жизни.
Задание.
1.
Установите
относительную молекулярную массу незаменимой аминокислоты — триптофана
С11Н12О2№. (Ответ. 204.)
Тема: Альдегиды и кетоны
У насекомых, образующих семьи, имеются особые
химические вещества, предназначенные для оповещения членов группы об опасности
(феромоны тревоги). Таким веществом у некоторых муравьев является цитраль С10Н16О,
которое обладает следующими свойства: а) дает реакцию серебряного зеркала; б)
при взаимодействии с бромом образует 2,3,6,7-тетрабром-3, 7-диметилоктаналь-1.
Какое заключение можно сделать о строении соединения?
11 класс
Тема: Строение атома.
Задача
1.Туристы, приехавшие в Индию, обязаны искупаться в водах “священного Ганга”.
На берегах Ганга омываются ежедневно тысячи людей, при этом не обнаружено ни
одного возбудителя инфекционного заболевания. Это связано с тем, что в устье
реки Ганг располагаются залежи самородного серебра, в прибрежных зонах реки
находятся самые крупные в Индии месторождения серебра. Поэтому в воде Ганга
находятся ионы серебра, обладающие бактерицидным действием.
Задание.
Составьте электронную
формулу иона серебра Ag+ обладающего бактерицидным действием.
Задача 2.Цвет и
форма цветков многих растений зависят от химического состава почвы. Геоботаники
используют это свойство растений для поиска рудных месторождений. В частности,
цветки сон-травы (пульсатиллы) на Южном Урале обесцвечиваются при повышенном
содержании в почве определенного металла.
Задание: Определите элемент и его положение в
периодической системе элементов (период, группа, подгруппа) по электронной
формуле: 1з[1]
2з2 2р6 3з2 3р6 4з2 3ё8.
Тема: Химические реакции.
Задача 1.Петр I
для проведения рождественского фейерверка пригласил голландских пиротехников,
но из-за морозов фейерверк чуть не был сорван.
Задания:
1.
Докажите правдивость этого исторического случая, если вспышки петард
были обусловлены распадом бертолетовой соли 2KClO3 = 2KCl + 3O2
2.
Определите, насколько
быстрее горела петарда в Голландии при 10 градусах тепла, чем в России при 30
градусах мороза, если температурный коэффициент реакции равен 3?
Тема:Дисперсные системы.
Задача 1
.Приготовление кофе — целое искусство. Важно знать о сущности физико-химических
явлений происходящих в кофейне. Когда кофе заливают кипящей водой, начинается
процесс экстрагирования — вытяжка из кофе его растворимых компонентов.
Одновременно всплывающие пузырьки пара увлекают за собой ароматические
вещества. Варят кофе в лужёных изнутри сосудах. Сначала наливают воду и
добавляют сахар по вкусу. Это не случайно, а потому, что водопроводная вода
жёсткая, ионы кальция тормозят процесс экстрагирования. При кипячении кофе
образуется густая шапка пены — это своеобразная крышка, не позволяющая летучим
веществам покидать сосуд, сохраняя аромат и вкус напитка. Пене дают подняться
один раз, так как бурлящая жидкость может разрушить пенистую крышку. Подогретый
кофе не имеет аромата.
Задания:
1.Определить
место дисперсной системы кофе в классификации по агрегатному состоянию фазы и
среды.
2.
Определить компоненты
фазы и среды.
3.
Где на практике можно
встретиться с пеной.
4.
Условия сохранения
вкусовых качеств. Зачем кофе готовят на подслащённой воде?
Контекстные задачи в обучении химии
Творческая мастерская
Комозина Н.В.
Ум заключается не только в знании,
но и в умении прилагать знания на деле.
Аристотель
Как показывают результаты международных исследований, современные российские школьники, хорошо справляются с заданиями на воспроизведение знаний, но затрудняются применять полученные знания в ситуациях, близких к жизненным. Для достижения современных требований к результатам обучения химии необходимо применение заданий, в которых химическое содержание интегрировано с практикой. Опыт педагогической деятельности показывает, что для решения обозначенных задач целесообразно использовать методы и средства контекстного обучения. Сущность контекстного обучения определяется как организация такой деятельности, которая требует приобретения новых знаний и их последующего применения, объясняет и оправдывает усилия, затраченные на их усвоение. Одним из средств контекстного обучения, которые будут наиболее эффективны в условиях освоения требований ФГОС, являются контекстные задачи. Контекстная задача – это задача мотивационного характера, в условии которой описана конкретная жизненная ситуация, ассоциирующая с имеющимся социокультурным опытом учащихся (известное, данное); требованием (неизвестным) задачи является анализ, осмысление и объяснение этой ситуации или выбор способа действия в ней, а результатом решения задачи является встреча с учебной проблемой и осознание ее личностной значимости.
Чтение текста подобных задач понимается как деятельность… имеющая значение не только для развития мыслительных операций учащегося, но и для приобретения им духовного и жизненного опыта.
С помощью контекстных задач выявляются не только предметные знания и умения, но и их системность, и функциональность, самостоятельность и креативность мышления. А также контексные задачи являются инструментом оценивания естественнонаучной грамотности
При разработке контекстных задач необходимо учитывать несколько принципов.
1.Принцип доступности подразумевает, что для выполнения таких заданий не требуется фактических знаний за пределами программного материала. Это важно, потому что во время контроля знаний на уроке, на экзамене использование справочной литературы не допускается. Необходимо оценить уровень развития ключевых компетенций школьников на основе той знаниевой базы, которая заложена в образовательный стандарт. Свою эрудицию учащиеся, которые проявляют особые способности и устойчивый интерес к изучению химии, могут продемонстрировать при подготовке и проведении олимпиад, на внеклассных занятиях.
2.Принцип актуальности практически реализуется при использовании материалов СМИ. Обращение к новостям науки, анализу текущих событий в мире с точки зрения изучаемого предмета позволяет избежать искусственности заданий, что существенно влияет на рост мотивации при работе над ними.
3.Принцип учета возрастных особенностей учащихся. Предполагаемое задание должно быть интересно школьнику, а не вызывать скуку, описывая надуманную ситуацию.
Как правило, в контекстных заданиях содержатся вопросы и проблемы, с которыми ученик сталкивается в своей обыденно-практической жизни, литературных источниках, либо они соответствуют его профессиональным интересам и найдут применение в дальнейшем обучении.
Наибольшее количество представленных в современной методической литературе контекстных задач основаны на двух подходах: историческом и практико-ориентированном. Практика показывает, что большой интерес у обучающихся вызывают вопросы, связанные с применением химических соединений в будущей профессиональной деятельности, с влиянием химически произведенных веществ на здоровье и физиологию человека, на качество пищи, возникновение экологических проблем. В процессе решения таких задач у учащихся формируются способности искать, отбирать, анализировать и систематизировать информацию и создавать на её основе новую. Учащиеся приобретают умения формулировать вопрос, объяснять результат его решения, применяют знания в реальной жизненной ситуации, выбирают соответствующие формы для представления полученных результатов. Развивается химическая компетенция учащихся: они усваивают химические понятия, законы, учатся воспринимать химические знания и на их основе самостоятельно оценивать информацию, объяснять результаты.
Задачи могут быть расчётные, творческие, экспериментальные.
Задачи подбираю по следующим критериям:
•Содержание задачи должно опираться на программу соответствующего класса (Пример. Фармацевту необходимо приготовить 5%раствор иода, который используют для обработки ран. Какой объём раствора он может приготовить из10г кристаллического иода, если плотность раствора должна быть 0,950г/мл?-8кл)
• Искомые и заданные величины (если они указаны) должны быть реальными и нести познавательную нагрузку (например, В организме взрослого человека содержится 4г железа на 70кг массы тела. Почти 2/3 этого железа входит в состав гемоглобина крови. Много железа содержится в печёнке 20мг/100г …).
• Для успешного решения задачи необходимо не только и не столько знание учащимися фактического материала, сколько умение логически мыслить и химическая интуиция. (Пример. Почему в хлебе много дырочек?)
• Содержание и результат решения задачи должны демонстрировать применение химических знаний в различных сферах деятельности человека. (Пример. Почему человеку, нечаянно выпившему соляную кислоту, рекомендуют принять водную суспензию жжёной магнезии? Ответ: Жжёная магнезия – это оксид магния, он проявляет основные свойства и нейтрализует кислоту).
• Вопрос задачи должен быть представлен так, как он обычно формулируется в практической деятельности. (Пример. Почему при ожоге белым фосфором рекомендуют наложить мокрую повязку, пропитанную раствором медного купороса? Ответ: происходит химическая реакция, благодаря которой белый фосфор обезвреживается: 2P + 5CuSO4 + 8H2O = 2H3PO4 + 5Cu + 5H2SO4.)
• Задача должна быть сложной (комбинированной), включать как качественные, так и расчётные вопросы; желательно, чтобы она включала и межпредметный материал. (Пример. Почему ягоды облепихи остаются мягкими на морозе?
Научно – популярная информация (подсказка). В состав облепихового масла входит олеиновая кислота, у неё низкая температура плавления, поэтому на морозе ягоды облепихи остаются мягкими. Задание. Установите молекулярную формулу олеиновой кислоты, которая не дает ягодам облепихи обледенеть, если массовые доли элементов в ней составляют: углерода – 76,60%, водорода – 12,06%, кислорода – 11,34%. Относительная молекулярная масса олеиновой кислоты равна 282
Предлагаю составить контекстные задачи вместе.
●В прошлом были частыми случаи отравления людей в угольных шахтах угарным газом. Поскольку оксид углерода(II) не имеет запаха, то опасность подступала незаметно. Шахтеры, спускаясь в шахты, брали с собой в качестве своеобразного индикатора канарейку в клетке: канарейки падают в обморок от присутствия в воздухе следов СО. Задание: Вычислите, какой объем (н. у.) займут 0,5 моль СО; 56 г СО.(Ответ:11,2л; 44,8л.)
Установите молекулярную формулу данного оксида углерода, если массовые доли элементов в его молекуле составляют: С – 42,86 %; О – 57,14 %.
Всем знакомо красное вино. Представьте бокал вина в руках, При покачивании бокала что замечали? А задумывались вы над этим явление Что это?
Это задача для нас.
1)Сладкий и вязкий глицерин благотворно влияет на качество вин. При определенных условиях одна из разновидностей микроорганизмов поселяется и растет на виноградных гроздьях, повреждая кожуру ягод таким образом содействуя частичному испарению содержащейся в ягодах воды. Подвергшийся действию этого гриба виноград обогащается глицерином, а получаемые из него вина отличаются чрезвычайно сладким и мягким вкусом. Если бокал с вином слегка покачать, то иногда на стенках бокала остается медленно стекающая пленка, это считается признаком высокого качества вина и объясняется присутствием высоковязкого глицерина.
Тема занятия: «Соединения серы», 9 класс.
Что может быть известно учащимся о кислородных соединениях серы? Кислотные оксиды. Им соответствуют кислоты, степень окисления.
Что может вызвать интерес у учащихся и быть личностно значимым для них? Способы получения, физические и химические свойства оксидов.
Все мы показываем сжигание серы. После этого опыта чувствуется сладковатый привкус в горле, голос пропадает. Что это?
2) Со времен Гомера известен этот оксид – бесцветный газ с резким запахом. Одиссей, хитроумный герой Троянской войны, окуривал им помещение, в котором сражался, и в конце концов победил женихов Пенелопы. Плиний Старший, римский историк (23-79 гг. н. э.), тоже упоминал в своих сочинениях о газообразном оксиде, который уничтожает инфекцию и вредных насекомых. Тот же оксид стал причиной смерти Плиния во время извержения Везувия в 79 г н.э. В наши дни это соединение выбрасывается в атмосферу с дымом тепловых электростанций и металлургических заводов и является причиной «кислотных дождей».
Человек начинает ощущать едкий запах этого оксида серы, если в 1 м3 воздуха содержится 3 мг этого вредного газа. При вдыхании воздуха с таким содержанием этого газа в течение пяти минут у человека наступает ларингит — потеря голоса. Какое суммарное количество (моль) диоксида серы приводит к этому неприятному заболеванию? Примите объем легких человека равным 3,5 л, а периодичность дыхания — 4 с.
Укажите источники диоксида серы в воздухе. Когда «газ Одиссея» смешивают с влажным сероводородом, выделяется сера, а пероксид водорода в водном растворе превращает его в сильную кислоту, окисляется кислородом
Вопросы:
1.Что это за газ?
2.Какие свойства он проявляет: окислительные или восстановительные. Подтвердите уравнениями реакций.
3) Вы прокипятили белое белье со стиральным порошком и содой в старом баке из оцинкованной жести и обнаружили, что на белье, которое находилось на дне бака, появились желтые пятна, а на стенках бака – белых рыхлый налет. Почему это произошло? Напишите уравнения реакций. Как можно удалить пятна с белья и налет со стенок бака? Что надо было делать, чтобы не испортить белье?
4)В кондитерском и хлебном производстве часто применяют так называемые пекарские порошки. Где же их найти? Его можно сделать дома. Этот рецепт я узнала в старших классах на уроках труда. Пекарский порошок – изобретение XX века. Он очень популярен в кулинарии стран Западной Европы и Америки.
Простейший состав пекарского порошка:
1 часть пищевой соды;
1 часть лимонной кислоты или другой кислой соли (например дигидрофосфата натрия)
1 часть муки, крахмала, сахарной пудры (или их смеси).
Вопросы:
Поясните, какими свойствами обладает сода, чтобы улучшать качество теста?
Можно ли использовать соду без лимонной кислоты?
Сода и лимонная кислота хорошо растворяются в воде. Нужно ли их растворять, перед тем как положить в тесто?
Можно ли заменить соду в пекарском порошке на другое вещество, и если да, то какое?
Поясните, зачем в пекарском порошке мука, ведь она есть в тесте.
Напишите уравнения химических реакций, происходящих с пекарским порошком в результате выпечки теста».
5)17дека6ря1916г. князь Феликс Юсупов с сообщниками пытался отравить Григория Распутина, который пользовался неограниченным влиянием на семью последнего российского императора и которого считают одной из самых одиозных фигур российской истории. Для этого заговорщики до6авили несколько граммов яда Х в пирожные. Однако яд не подействовал, Распутин лишь почувствовал лёгкое недомогание… Распутин 6ыл убит 11 выстрелами.
Проведённый анализ позволил определить состав яда. Он состоял из калия (60’/’), углерода(18,46%) и азота (21,54%).
Задание: выведите формулу вещества, которым пытались отравить Распутина и почему смертельная доза яда не подействовала. Составьте уравнение реакции
KCN соль слабой и летучей синильной кислоты, разлагается даже угл газом
2KCN +H2O + CO2 = K2CO3 + HCN↑
6) Соединение с молекулярной формулой С3Н8О подвергли окислительному дегидрированию, в результате чего получили продукт состава С3Н6О. Это вещество вступает в реакцию «серебряного зеркала», образуя соединение состава С3Н6О2. При действии на последнее гидроксидом кальция получили вещество, используемое в качестве пищевой добавки под кодом Е282. Оно препятствует росту плесени на хлебобулочных и кондитерских изделиях и, кроме того, содержится в таких продуктах, как швейцарский сыр.
1.Напишите уравнения реакций, рассматриваемых в задаче. Приведите названия образующихся органических веществ.
2.Определите формулу добавки Е282.
3.Объясните, с какой целью рассматриваемое вещество добавляют в сыр.
4.Что вы знаете о пищевых добавках? Применяете ли вы их? Ответ обоснуйте.
7)У насекомых, образующих семьи, имеются особые химические вещества, предназначенные для оповещения членов группы об опасности (феромоны тревоги). Таким веществом у некоторых муравьев является цитраль С10Н16О, которое обладает следующими свойства: а) дает реакцию серебряного зеркала; б) при взаимодействии с бромом образует 2,3,6,7-тетрабром-3, 7-диметилоктаналь-1. Какое заключение можно сделать о строении соединения?

Задания:
1.Установи элемент Х, если известно, что его массовая доля в оксиде составляет 75,7%.
2.Дайте характеристику элемента Х на основании его положения вПСХЭ Д. И. Менделеева и строения атома.
3.К металлам или неметаллам относится простое вещество, образованное элементом Х?
4.Установите химический характер оксида Х2О3 .
5.Встречается ли Х в природе в виде простого вещества?
Перед вами таблица, используя данные давайте составим задачу
9)олифы получают из растительных масел путём их частичной полимеризации. Поскольку все растительные масла содержат триглецериды непредельных карбоновых кислот:
олеиновой: C8H17CH=CH(CH2)7COOH,
линолевой: CH3(CH2)3(CH2CH=CH)2(CH2)7COOH,
и линоленовой: C2H5(CH=CHCH2)3(CH2)6COOH,
теоретически олифу можно получить из любого масла. Но чаще всего для этой цели используют льняное и конопляное масла, т.к. именно из них получаются самые лучшие олифы. Объясните это на основании информации о составе различных растительных масел, приведенных в таблице.
|
Масло |
содержание триглицеридов кислот, % |
||
|
олеиновой |
линолевой |
линоленовой |
|
|
льняное |
13-29 |
15-30 |
44-61 |
|
хлопковое |
23-35 |
34-57 |
— |
|
конопляное |
6-16 |
36-50 |
15-28 |
|
подсолнечное |
24-40 |
46-62 |
— |
|
оливковое |
54-81 |
15 |
— |
|
рапсовое |
5-44 |
11-42 |
1-12 |
|
соевое |
20-30 |
44-60 |
5-14 |
Посмотрим некоторые задачи
Задача 1.Установлено, что крапива увеличивает содержание гемоглобина и количество эритроцитов в крови. Поэтому она является хорошим “кровоочистительным” средством и чрезвычайно полезна при самых различных заболеваниях крови; используется также для лечения фурункулов, угрей, лишаев и других кожных заболеваний. Гемоглобин содержится в эритроцитах крови. Это красный пигмент (гем), содержащий железо, в сочетании с протеином. Когда кровь проходит через легкие, к атому железа гема C34 H32 O4 N4 Fe присоединяется кислород.
Задание. Вычислите относительную молекулярную массу гема. (Ответ: 616.)
Приготовление растворов.
Порошок «Регидрон» используют при обезвоживании организма. Одна доза порошка содержит 3,5г хлорида натрия, 2,5 г хлорида калия, 2,9 г цитрата натрия и 10г глюкозы. Перед употреблением дозу растворяют в 1л воды. Определите массовые доли всех компонентов порошка «Регидрон» в полученном растворе
Соединения щелочных металлов.
Задача 3. Какой объем (н.у.) углекислого газа заполнит поры бисквитного торта, если для его приготовления Алена взяла 2 г питьевой соды с содержанием примесей 0,1% и обработала уксусной кислотой?
- .
Металлы 2 группы главной подгруппы.
Задача 1.У жителей южных районов спазмы кровеносных сосудов происходят реже, чем у северян. Врачи связывают это с содержанием в организме магния, т.к. известно, что внутривенные и внутримышечные вливания растворов солей магния снимают спазмы и судороги. В организм человека магний поступает с овощами и фруктами. Особенно богаты им абрикосы, персики и цветная капуста.
Задание.
1.Составьте уравнения электролитической диссоциации хлорида магния.
2.Подготовьте сообщение о биологической роли магния.
Соединения серы.
Как известно, после Бородинского сражения (26.08.1812 года) главнокомандующий русской армией генерал – фельдмаршал М.И.Кутузов (1745-1813 г.) принял очень нелегкое решение сжечь Москву: «Мы оставим Москву, но спасем армию, а значит, и всю Россию».
Москва горела шесть дней. Погибло три четверти построек. Пожар уничтожил и монетный двор. Впоследствии, при разборке пожарища были обнаружены медные монеты, покрытые черным налетом. Монеты промыли, но налет остался.
- Объясните причину образования черного налета на медных монетах?
- Каким образом можно придать первозданный вид монетам?
- Докажите экспериментально на примере медной проволоки свои выводы.
Соли угольной кислоты. Большой популярностью среди туристов пользуются сталактитовые пещеры в горах Кавказа и Крыма, среди которых есть не пройденные до конца. Известняковые пещеры-лабиринты Крыма служили партизанам убежищем в период Великой отечественной войны. Реакция превращении карбоната в бикарбонат обратима, поэтому на потолке известняковой пещеры из капли воды, насыщенной гидрокарбонатом кальция, выделяется диоксид углерода, и прежде чем капля успеет упасть вниз, часть растворенного гидрокарбоната превращается в твердый карбонат. Так зарождаются свисающие вниз сосульки сталактитов. Из воды, капающей со сталактита, на полу пещеры тоже осаждается карбонат кальция, и с течением времени навстречу свисающей сосульке поднимается такой же столб снизу – сталагмит.
Задания:
1.Запищите химические формулы веществ: гидрокарбонат кальция, карбонат кальция, диоксид углерода.
2. Составьте схемы превращения веществ, о которых говорится в задаче.
3. Определите тип каждой химической реакции.
4. Сделайте вывод о свойствах солей угольной кислоты, их растворимости.
5. Сделайте сообщение о распространении солей угольной кислоты в природе.
10 класс
По легенде, Ф. Вёлер в 1862 г. Получал чистый кальций, нагревая его оксид с углем. При этом образовалась серая масса, которую он выбросил на мусорную свалку. Под дождём из мусорной кучи начал выделяться газ, горевший коптящим пламенем. В истории органической химии это открытие именуют “открытием на мусорной куче”.
Ароматические углеводороды.
В состав облепихового масла входит олеиновая кислота, у неё низкая температура плавления, поэтому на морозе ягоды облепихи остаются мягкими. Задание. Установите молекулярную формулу олеиновой кислоты, которая не дает ягодам облепихи обледенеть, если массовые доли элементов в ней составляют: углерода – 76,60%, водорода – 12,06%, кислорода – 11,34%. Относительная молекулярная масса олеиновой кислоты равна 282
●В одном царстве жил капризный царь, захотел он выкрасить весь дворец в белый цвет и позвал мастера. Выслушал мастер и спрашивает: “ Где же я такой краски возьму, чтоб не портилась и на весь дворец хватило? “. Рассердился царь и дал мастеру сутки сроку. Взял мастер металлическую пластину с крыши, растворил ее в желудочной микстуре (3%-ный раствор соляной кислоты), зашипел в колбе газ; добавил щелочи едкой, выпал осадок белоснежный. Но, видно, не рассчитал, и исчез осадок. В другой раз аккуратнее он был. Получил осадок и отделил, потом на печке прокалил его. Так и получил он знатную краску, царь остался доволен.
Опишите химические превращения мастера. (Zn – ZnCl2 – Zn(OH)2 – ZnO.)
● Шел солдат по полю, решил привал сделать, письмо написать родным, да нечем. Тут он нашел черный камешек, попробовал – рисует. Написал этим камешком письмо, да поспать решил. Бросил камешек в огонь – тот вспыхнул, только дым пошел. Дождь дым остановил, к земле прибил; водица текла тяжелая, известковая. Стала сохнуть вода, кое-где осталась, а где высохла – там уж белые камешки лежали. Проснулся солдат, удивился, как дождь из черного камешка белый сделал. Взял он белый камешек, провел им по белому валуну, глядь – а он рисует. Удивился солдат и пошел дальше.
(С – СO2 – H2CO3 – CaCO3)
При выполнении контекстных заданий учащиеся проявляют способности находить и использовать необходимую информацию в предлагаемом контексте, применять имеющиеся знания в незнакомой ситуации. Контекстные задачи мотивируют познавательную активность, имеют практическую направленность, показывают значимость химических знаний для жизни и деятельности.
Подход к конструированию контекстной задачи
1. Определив тему предстоящего урока, подумайте, что в этой теме ученикам уже может быть известно. Скажем, данный вопрос изучался ранее, в младших классах, или в курсе другого предмета. Что-то ученики могли почерпнуть из различных «внешкольных» источников: книг, радио, телевидения, газет — или в результате собственных жизненных наблюдений.
2. Определите, что в содержании темы будет для учеников новым, ранее им неизвестным или неосознанным.
3. Подумайте, в чем может заключаться личностная значимость тех новых знаний, которые приобретут ученики на предстоящем уроке. Другими словами, сформулируйте для себя ответы на следующие вопросы: почему я считаю нужным, важным для учащихся приобретение ими этих знаний? Какой интерес они могут представлять для них? Что в новой теме может их удивить, заставить по-новому осмыслить уже известное? Где они могут найти применение полученным знаниям?
4. Сформулируйте ответы на все предыдущие вопросы обобщенно — в виде личностно значимой проблемы. Ее формулировка также может иметь характер вопроса, но заданного как бы от лица учеников.
5. Вспомните или придумайте какую-либо жизненную ситуацию, анализируя которую или действуя в которой ученики смогут выйти на осознание и формулирование той личностно значимой проблемы, которую вы наметили как отправную точку для вхождения в новую тему.
6. Составьте текст — описание данной ситуации, т.е. описание условия контекстной задачи, или воспользуйтесь, если это возможно, готовыми текстами, рисунками, видеоматериалами и т.п.
7. Сформулируйте задание, требующее анализа ситуации или осуществления соответствующих ситуации действий, т.е. сформулируйте требование контекстной задачи.
8. Оцените качество и предполагаемую эффективность полученной контекстной задачи с двух позиций:
— во-первых, способствует ли она «встрече» с основной проблемой, решение которой потребует от учащихся осуществления деятельности по приобретению новых знаний, соответствующих теме урока;
— во-вторых, содержит ли данная задача ориентиры для получения учениками ответа на вопрос о личностной значимости новых знаний и умений
2) Со времен Гомера известен этот оксид – бесцветный газ с резким запахом. Одиссей, хитроумный герой Троянской войны, окуривал им помещение, в котором сражался, и в конце концов победил женихов Пенелопы. Плиний Старший, римский историк (23-79 гг. н. э.), тоже упоминал в своих сочинениях о газообразном оксиде, который уничтожает инфекцию и вредных насекомых. Тот же оксид стал причиной смерти Плиния во время извержения Везувия в 79 г н.э. В наши дни это соединение выбрасывается в атмосферу с дымом тепловых электростанций и металлургических заводов и является причиной «кислотных дождей».
Человек начинает ощущать едкий запах этого оксида серы, если в 1 м3 воздуха содержится 3 мг этого вредного газа. При вдыхании воздуха с таким содержанием этого газа в течение пяти минут у человека наступает ларингит — потеря голоса. Какое суммарное количество (моль) диоксида серы приводит к этому неприятному заболеванию? Примите объем легких человека равным 3,5 л, а периодичность дыхания — 4 с.
3) Вы прокипятили белое белье со стиральным порошком и содой в старом баке из оцинкованной жести и обнаружили, что на белье, которое находилось на дне бака, появились желтые пятна, а на стенках бака – белых рыхлый налет. Почему это произошло? Напишите уравнения реакций. Как можно удалить пятна с белья и налет со стенок бака? Что надо было делать, чтобы не испортить белье?
4)В кондитерском и хлебном производстве часто применяют так называемые пекарские порошки. Где же их найти? Его можно сделать дома. Этот рецепт я узнала в старших классах на уроках труда. Пекарский порошок – изобретение XX века. Он очень популярен в кулинарии стран Западной Европы и Америки.
Простейший состав пекарского порошка:
1 часть пищевой соды;
1 часть лимонной кислоты или другой кислой соли (например дигидрофосфата натрия)
1 часть муки, крахмала, сахарной пудры (или их смеси).
5)17дека6ря1916г. князь Феликс Юсупов с сообщниками пытался отравить Григория Распутина, который пользовался неограниченным влиянием на семью последнего российского императора и которого считают одной из самых одиозных фигур российской истории. Для этого заговорщики до6авили несколько граммов яда Х в пирожные. Однако яд не подействовал, Распутин лишь почувствовал лёгкое недомогание… Распутин 6ыл убит 11 выстрелами.
Проведённый анализ позволил определить состав яда. Он состоял из калия (60’/’), углерода(18,46%) и азота (21,54%).
6)По официальной версии Наполеон умер от рака желудка. В записи, сделанной Наполеоном в апреле 1821г, за 20 дней до смерти, говорится «Я умираю не своей смертью. Меня убила английская олигархия и её наёмный убийца» Спустя 140 лет ученые пришли к выводу, что, скорее всего, он был отравлен ядовитыми соединениями элемента Х. Вероятно, Наполеону длительное время подмешивали в пищу вещество состава Х2О3 в малых дозах.
7)У насекомых, образующих семьи, имеются особые химические вещества, предназначенные для оповещения членов группы об опасности (феромоны тревоги). Таким веществом у некоторых муравьев является цитраль С10Н16О, которое обладает следующими свойства: а) дает реакцию серебряного зеркала; б) при взаимодействии с бромом образует 2,3,6,7-тетрабром-3, 7-диметилоктаналь-1. Какое заключение можно сделать о строении соединения?

9)олифы получают из растительных масел путём их частичной полимеризации. Поскольку все растительные масла содержат триглецериды непредельных карбоновых кислот:
олеиновой: C8H17CH=CH(CH2)7COOH,
линолевой: CH3(CH2)3(CH2CH=CH)2(CH2)7COOH,
и линоленовой: C2H5(CH=CHCH2)3(CH2)6COOH,
теоретически олифу можно получить из любого масла. Но чаще всего для этой цели используют льняное и конопляное масла, т.к. именно из них получаются самые лучшие олифы. Объясните это на основании информации о составе различных растительных масел, приведенных в таблице.
|
Масло |
содержание триглицеридов кислот, % |
||
|
олеиновой |
линолевой |
линоленовой |
|
|
льняное |
13-29 |
15-30 |
44-61 |
|
хлопковое |
23-35 |
34-57 |
— |
|
конопляное |
6-16 |
36-50 |
15-28 |
|
подсолнечное |
24-40 |
46-62 |
— |
|
оливковое |
54-81 |
15 |
— |
|
рапсовое |
5-44 |
11-42 |
1-12 |
|
соевое |
20-30 |
44-60 |
5-14 |
10)В одном царстве жил капризный царь, захотел он выкрасить весь дворец в белый цвет и позвал мастера. Выслушал мастер и спрашивает: “ Где же я такой краски возьму, чтоб не портилась и на весь дворец хватило? “. Рассердился царь и дал мастеру сутки сроку. Взял мастер металлическую пластину с крыши, растворил ее в желудочной микстуре (3%-ный раствор соляной кислоты), зашипел в колбе газ; добавил щелочи едкой, выпал осадок белоснежный. Но, видно, не рассчитал, и исчез осадок. В другой раз аккуратнее он был. Получил осадок и отделил, потом на печке прокалил его. Так и получил он знатную краску, царь остался доволен.
Муниципальное общеобразовательное учреждение средняя
общеобразовательная школа №1 г.Камешково
Владимирской области
Контекстные задачи
на уроках химии
Учитель химии
высшей квалификационной категории
Галина Николаевна Драницына
2013
Содержание
|
Понятие знаково – контекстного обучения Особенности методики Применение контекстных задач на уроках химии Примеры контекстных задач для 8 класса
Примеры контекстных задач для 9 класса
Примеры контекстных задач для 10 класса
Примеры контекстных задач для 11 класса
|
2 2 3 3 3 4 4 5 5 7 8 9 10 10 11 11 12 13 14 15 17 17 17 19 19 20 20 21 21 |
Знаково-контекстное (или просто контекстное) обучение — форма активного обучения, ориентированная на профессиональную подготовку студентов и реализуемая посредством системного использования профессионального контекста, постепенного насыщения учебного процесса элементами профессиональной деятельности.
Особенности методики
Концепция разработана А. А. Вербицким в 1991 году. Контекстное обучение опирается на теорию деятельности, в соответствии с которой, усвоение социального опыта осуществляется в результате активной, пристрастной деятельности субъекта. В нём получают воплощение следующие принципы: активности личности; проблемности; единства обучения и воспитания; последовательного моделирования в формах учебной деятельности слушателей содержания и условий профессиональной деятельности специалистов Преподавание общеобразовательных дисциплин предлагается трактовать в контексте профессиональной деятельности, отходя в этом от академичного изложения научного знания. В качестве средств реализации теоретических подходов в контекстном обучении предлагается в полном объеме использовать методы активного обучения (в трактовке А. А. Вербицкого — методы контекстного обучения). Вместе с тем отмечается, что необходимо комплексно подходить к использованию различных форм, методов и средств активного обучения в органическом сочетании с традиционными методами.
«Применение контекстных задач на уроках химии»
Ум заключается не только в знании,
но и в умении прилагать знания на деле.
Аристотель
Как показывают результаты международных исследований, современные российские школьники, хорошо справляются с заданиями на воспроизведение знаний, но затрудняются применять полученные знания в ситуациях, близких к жизненным. Для достижения современных требований к результатам обучения химии необходимо применение заданий, в которых химическое содержание интегрировано с практикой. Опыт педагогической деятельности показывает, что для решения обозначенных задач целесообразно использовать методы и средства контекстного обучения. Сущность контекстного обучения определяется как организация такой деятельности, которая требует приобретения новых знаний и их последующего применения, объясняет и оправдывает усилия, затраченные на их усвоение. Одним из средств контекстного обучения, которые будут наиболее эффективны в условиях освоения требований ФГОС, являются контекстные задачи. Контекстная задача – это задача мотивационного характера, в условии которой описана конкретная жизненная ситуация, коррелирующая с имеющимся социокультурным опытом учащихся (известное, данное); требованием (неизвестным) задачи является анализ, осмысление и объяснение этой ситуации или
выбор способа действия в ней, а результатом решения задачи является встреча с учебной проблемой и осознание ее личностной значимости.
Уровневая дифференциация содержания контекстных задач позволяет ставить посильные учебные задачи перед каждым ребенком, создавать активный интеллектуальный фон уроков, полноценно реализовать в преподавании принципы научности, практической направленности, историзма, междисциплинарного подхода.
Сегодня обществу нужны инициативные и самостоятельные специалисты, способные постоянно совершенствовать свою личность и деятельность. В классическом обучении задания лишены того жизненного контекста, который придает социальную значимость и личностный смысл процессу познания, исследования, поиска, знания не ведут автоматически к пониманию смысла жизни. С помощью контекстных задач выявляются не только предметные знания и умения, но и их системность, и функциональность, самостоятельность и креативность мышления, другие личностные характеристики.
Примеры контекстных задач
8 класс
Молекулярные массы веществ
Задача 1.Установлено, что крапива увеличивает содержание гемоглобина и количество эритроцитов в крови. Поэтому она является хорошим “кровоочистительным” средством и чрезвычайно полезна при самых различных заболеваниях крови; используется также для лечения фурункулов, угрей, лишаев и других кожных заболеваний. Гемоглобин содержится в эритроцитах крови. Это красный пигмент (гем), содержащий железо, в сочетании с протеином. Когда кровь проходит через легкие, к атому железа гема C34H32O4N4Fe присоединяется кислород.
Задание. Вычислите относительную молекулярную массу гема. (Ответ: 616.)
Количество вещества. Молярный объем газа
Задача 1. Фосфид цинка Zn3P2 весьма ядовит и используется для борьбы с грызунами. Летальная доза для средней серой крысы составляет 20,56 мг, а для мыши — 4,1 мг.
Вопрос: Какое количество мышей и крыс может погибнуть от 0,16 ммоль фосфида цинка? (Ответ: 10 мышей, 2 крысы.)
Задача 2.Для уничтожения микробов и бактерий можно использовать диоксид серы, его также применяют в качестве консервирующего средства при сушке чернослива и других фруктов.
Задание: Вычислите, какой объем займут 1,5 моль диоксида серы (н. у.). (Ответ: V(S02) = 33,6 л.)
Задача 3. В прошлом были частыми случаи отравления людей в угольных шахтах угарным газом. Поскольку оксид углерода(2) не имеет запаха, то опасность подступала незаметно. Шахтеры, спускаясь в шахты, брали с собой в качестве своеобразного индикатора канарейку в клетке: канарейки падают в обморок от присутствия в воздухе следов СО. Задание: Вычислите, какой объем (н. у.) займут 0,5 моль СО; 56 г СО.(Ответ:11,2л; 44,8л.)
Простые вещества-неметаллы.
Задача 1.В составе приземного воздуха в хвойных лесах обнаруживается большое количество различных терпеноидов (альфа и бетапинены, камфен, дельта-3-карен, лимонен, терпинолен и др.), которые участвуют в процессах окисления и фотоокисления (особенно в жаркие летние дни) и приводят к повышенному содержанию в воздухе озона и аэроионов, поэтому в хвойных лесах дышится легко. Такой воздух благотворно действует на легочных больных, но противопоказан при астме и гипертонической болезни.
Задания:
1.Составьте уравнение химической реакции образования озона из кислорода.
2. Сравните физические свойства аллотропных модификаций кислорода.
3.Творческое задание. Написать сочинение «от имени» озона.
Массовая доля вещества в растворе
Задача 1.Первым кровезаменителем, которым воспользовались хирурги еще в 1960-х гг., был 0,85%-ный водный раствор хлорида натрия.
Задание: Вычислите количество вещества хлорида натрия, необходимого для получения 550,6 г раствора, массовая доля соли в котором 0,85%. (Ответ: (NaCl) = 0,08 моль.)
Задача 2. Вычислите массу сульфата цинка, который необходим для получения 10 г раствора глазных капель, применяемых при лечении конъюнктивита, если известно, что массовая доля соли в растворе 0,25%. (Ответ: m(ZnS04) = 0,025 г.)
Приготовление растворов.
Задача 1. В середине марта, т.е. за месяц до посева, начинают готовить семена огурцов. Их подвешивают для прогревания над батареей. Затем на 10 мин. помещают в раствор поваренной соли NaCl с массовой долей 0,05 или 5%. Для посева отбирают лишь потонувшие семена, всплывшие выбрасывают. Кстати, обработка раствором соли не только помогает отобрать полноценные семена, но и удаляет с их поверхности возбудителей заболеваний.
Задание: Приготовьте 80 г такого раствора.
Задача 2. В реанимацию попадают больные, потерявшие много крови. В этих случаях используют 0,85%-й раствор поваренной соли (ϸ= 1 г/мл), который называется физиологическим раствором.
Задание: Представьте, что вы медсестра реанимационного отделения и должны срочно приготовить 800 мл такого раствора. Как вы на месте медсестры приготовили бы такой раствор? (Ответ: Растворить 6,8 г соли в 793 мл воды.)
Задача 3. Фармацевту необходимо приготовить 5%-ный раствор иода, который используют для обработки ран. Какой объем раствора он может приготовить из 10 г кристаллического иода, если плотность раствора должна быть 0,950г/мл?
Вопросы:
1.Какую формулу имеет кристаллический иод?
2.Что значит «приготовить раствор»?
3.Сделайте по условию задачи необходимые расчеты для приготовления раствора.
9 КЛАСС
Сплавы.
Задача 1. В настоящее время в качестве материала для изготовления ювелирных украшений нередко используют белое золото. Белое золото 585-й пробы – это сплав, состоящий из трех металлов (массовая доля золота 58,5%, серебра – 26%, остальное палладий).
Вопросы:
1. Какие металлы образуют сплав «белое золото»?
2. Атомов какого химического элемента больше всего в сплаве белого золота, а какого меньше всего? Ответ подтвердите расчетами.
3. Какие еще металлы могут входить в состав сплавов золота, используемых для изготовления ювелирных изделий.
4. Рассчитайте массу чистого золота, содержащегося в обручальном кольце ручной работы из белого золота 585 пробы, украшенного 23 бриллиантами общей массой 0, 23 карата. Масса кольца 3,8 г. 1 карат = 0,2 г.
Коррозия металлов
Задача 1. Коррозия вокруг нас.
На улицах и стройплощадках Москвы нередко можно увидеть образцы разрушения металла под действием окружающей среды.
Не пощадила коррозия и металлоконструкции первой радиобашни на Шаболовке, разработанную инженером В. Г. Шуховым. Трансляция радиопередач с уникальной антенной башни ведется с марта 1922 года.
Вопрос: Как вы думаете, какие факторы окружающей среды могли быть причиной коррозии металлов?
Задачи 2, 3. Затонувшие корабли (при закреплении нового материала).
• «Русалка» — русский броненосец береговой обороны, погибший в 1893 году при переходе из Ревеля (Таллинн) в Гельсингфорс (Хельсинки). На борту его было 177 моряков. Гибель «Русалки» в конце ХIX века была страшной трагедией для России (своего рода катастрофа «Курска» тех дней). В Ревеле в 1902 году экипажу «Русалки» поставили памятник, на него собирала деньги вся держава — там и пожертвованные царем 5000 рублей, и медяки бедняков. Памятник и ныне — гордость Таллинна.
Российский корабль нашли эстонские морские археологи в финских территориальных водах — кому он сегодня принадлежит? «Русалка» — братская могила. Трогать ее — кощунство. На памятнике в Таллинне выбито: «Россияне не забывают своих героев-мучеников». Броненосец покоится на глубине около 90 метров, его корпус и крупные детали коррозия не уничтожила.
• По Черному морю издревле проходили важнейшие морские пути, связывавшие Европу с Азией. В черноморских глубинах до сих пор без изменений сохраняются не только сами останки затонувших кораблей, но и все товары, перевозимые ими (металлы, золото не окисляются и не подвергаются коррозии, дерево, ткани не стареют и не разрушаются). Но, как только корабли поднимают на поверхность, их корпуса очень быстро покрываются ржавчиной и разрушаются.
Задания:
1.Объясните, почемуна морской глубине скорость коррозии незначительна,
2.Опишите причины возникновения коррозии в предложенных ситуациях,
3.Напишите необходимые уравнения химических реакций и процессов,
4.Определите тип коррозии и предложите способы защиты.
Домашнее задание
.
|
|
Задача • В III в. до н. э считался одним из семи чудес света, основой 36-ти метровой статуи на острове Родос был построен маяк в виде. огромной статуи Гелиоса. Колосс Родосский послужили три массивных каменных столба, скрепленные железными балками, сверху крепился железных каркас, который покрыли чеканными листами бронзы. Однако Колосс Родосский просуществовал всего 66 лет и рухнул во время землетрясения. |
|
Задача • В 20-е гг. XX в. произошла менее известная катастрофа. Рассказывают, что по заказу одного американского миллионера была построена роскошная яхта «Зов моря». Для обшивки корпуса яхты использовался сплав никеля с медью (монель — сплав), другие детали корпуса были изготовлены из специальных нержавеющих сталей. Еще до выхода в открытое море яхта полностью вышла из строя. Ученые считают, что в обоих случаях причиной произошедших событий были окислительно-восстановительные процессы. |
Задания:
1.Объясните, какие именно окислительно-восстановительные процессы были причиной разрушения металлов,
2. Опишите причины возникновения коррозии в предложенных ситуациях,
3.Напишите необходимые уравнения химических реакций и процессов,
4.Определите тип коррозии и предложите способы защиты.
Соединения щелочных металлов.
Задача 1.17дека6ря1916г. князь Феликс Юсупов с сообщниками пытался отравить Григория Распутина, который пользовался неограниченным влиянием на семью последнего российского императора и которого считают одной из самых одиозных фигур российской истории. Для этого заговорщики до6авили яд Х в пирожные. Однако яд не подействовал и Распутин 6ыл убит 11 выстрелами. Проведённый анализ позволил определить состав яда. Он состоял из калия (60’/’), углерода(18,46%) и азота (21,54%).
Задание: выведите формулу вещества, которым пытались отравить Распутина.
Задача 2. В Англии в последние десятилетия наблюдается снижение смертности от болезней сосудов головного мозга. Это связано с увеличением потребления свежих фруктов и овощей. В свежих овощах и фруктах всегда много калия и мало натрия. Натрий задерживает воду в организме, повышая артериальное давление, а калий, напротив, способствует его снижению. Вот почему увеличение потребления овощей, фруктов, в частности яблок, можно рассматривать как существенную меру предупреждения болезней сосудов головного мозга.
Задания:
1.Составьте уравнения электролитической диссоциации хлорида калия, хлорида натрия. 2.Какова биологическая роль ионов натрия и калия в живом организме7
Задача 3. Какой объем (н.у.) углекислого газа заполнит поры бисквитного торта, если для его приготовления Алена взяла 2 г питьевой соды с содержанием примесей 0,1% и обработала уксусной кислотой?
Ответ: Количеством углекислого газа, попавшего в воздух, пренебречь при протекании реакции по уравнению:
Дано:
m(NaHCO3) = 2 г,
(примесей) = 0,1 %.
Найти:
V(СO2).
Решение
m(NaHCO3)(чист.) = 2•99,9(%)/100(%) = 1,998 г;
1,998/84 = х/22,4, х = 0,53 л СО2.
Ответ. V(СO2) = 0,53 л — такой объем углекислого газа заполнит поры бисквитного торта.
Металлы 2 группы главной подгруппы.
Задача 1.У жителей южных районов спазмы кровеносных сосудов происходят реже, чем у северян. Врачи связывают это с содержанием в организме магния, т.к. известно, что внутривенные и внутримышечные вливания растворов солей магния снимают спазмы и судороги. В организм человека магний поступает с овощами и фруктами. Особенно богаты им абрикосы, персики и цветная капуста.
Задание.
1.Составьте уравнения электролитической диссоциации хлорида магния.
2.Подготовьте сообщение о биологической роли магния.
Задача 2. Какой объем (н.у.) углекислого газа поглотят стены только что выбеленной квартиры, если на побелку затрачено ведро известкового молока? Для его приготовления к 4 кг негашеной извести (кипелки) прилили 5 л (кг) воды, процедили, отбросили 100 г мелких камешков, затем добавили еще 6 л воды и хорошо все перемешали. Полученной массой выбелили стены.
Ответ.
Дано:
m(СаО) = 4 кг,
m(Н2О) = 5 кг,
m(примесей) = 0,1 кг.
Найти:
V(СО2).
Решение
m(100%-гоСаО) = 4 — 0,1 = 3,9 кг.
Найдем необходимую массу Н2О:
3,9/56 = х/18, х = 1,25 кг H2O.
y = 3,9 + 1,25 = 5,15 кг Ca(OH)2;
5,15/74 = z/22,4, z = 1,56 м3 СО2.
Ответ.: V(СО2) = 1,56 м3 — такой объем углекислого газа поглотят выбеленные стены помещения.
Водород.
Задача 1.Сейчас посмотрите — сказал Челленджер — Последние дни я напрягал все силы своего ума, чтобы разрешить задачу, как нам выбраться отсюда. Мы уже убедились, что спуск по отвесным скалам невозможен, а туннеля больше не существует. Перебросить мост на утёс нам, безусловно, не удаётся. Но что, же тогда делать? Я как — то говорил нашему юному другу, что эти гейзеры выделяют водород в свободном состоянии. Отсюда логически вытекала мысль о воздушном шаре.
Вопросы:
1.Увидели ли вы логику в рассуждениях героя романа «Затерянный мир».
2.Рассчитайте, какая масса цинка потребовалась бы, чтобы наполнить шар объёмом 1 м3, которым воспользовались участники неудавшейся экспедиции.
Галогены.
Задача 1.В ходе Первой мировой войны руководство германской армии пошло на чудовищное преступление – применение отравляющих веществ. Жидкий хлор немцы транспортировали к линии фронта в специальных цистернах и в подходящий момент, когда ветер дул в нужную сторону, разливали в баллоны. Тысячи таких баллонов они тайно устанавливали на передовых позициях. Вентили их баллонов открывали одновременно. При этом хлор выходил наружу и устремлялся на позиции в виде гонимого попутным ветром облака, губительного для всего живого. Если газовая атака оказывалась внезапной, гибли тысячи людей. Узнать вовремя о намерении противника применить хлор – значило выиграть время для принятия защитных мер и сохранить человеческие жизни. Однако долго не знали, как это осуществить. Русский офицер нашел способ решения этой задачи. Он изобрел прибор, предупреждающий об опасности звонком.
Вопрос: На каких свойствах хлора мог основываться принцип действия этого прибора?
Задача 2.
А. Первым боевым отравляющим веществом был хлор. Германия применилаего 22 апреля 1915 г. в долине р. Ипр против фрацузской дивизии. Только в один этот день было отравлено 15 тыс. человек, из которых 5 тыс. погибли.
Б. Согласно ГОСТу 2874 – 54 после 30 минутного контакта хлора с водой при выходе воды из очистных сооружений в ней должно быть остаточного хлора не более 0,5мг/л не менее 0,3 мг/л, в наиболее отдаленных точках водозабора – не менее 0,1 мг/л.
Вопросы:
Ежедневный прием небольших доз соединений йода помогает избавиться от зоба. Морские губки, морская капуста богаты йодом. Поэтому в Китае и Японии больных зобом издавна лечат золой морских губок.
Задание. Вычислите, сколько граммов морской капусты необходимо съедать ежесуточно для того, чтобы восполнить суточную потребность (800 мг) организма в йоде. В 100 г морской капусты содержание йода составляет 250 мг. (Ответ: 320 г в сутки.)
Кислород.
Задача 1.На практической работе класс получал кислород из марганцовки. Внезапно у Никиты лопнула пробирка, и 2 г марганцовки высыпалось в пламя горелки с сухим горючим. Эффект был ошеломляющим.
Задание: Определите объем (н.у.) кислорода, позволивший пламени вырасти до потолка и лишить Никиту возможности дальнейшего выполнения практических работ из-за нарушения правил техники безопасности (что категорически запрещено), если в марганцовке было 0,02 г примесей.
Ответ.
Дано:
m(KMnO4) = 2 г,
m(примесей) = 0,02 г.
Найти:
V(O2).
Решение
1,98/316 = х/22,4, х = 0,14 л О2.
Ответ: V(O2) = 0,14 л — такой объем кислорода оказался для Никиты роковым.
Соединения серы.
Задача 1.Если верить легенде, Черное море получило свое название из-за почернения опускаемых в его пучинах серебряных предметов. Это связано с тем, что на глубине более 200 м морская вода содержит сероводород (продукт жизнедеятельности некоторых микроорганизмов). Наличие сероводорода делает невозможной жизнь морских растений и животных в этой зоне. В последние годы по непонятным причинам сероводород стал медленно подниматься к поверхности воды. Если этот процесс не прекратится, то Черное море станет безжизненным.
Задания:
1. Предложите способ борьбы с «наступлением сероводорода».
2.Оцените предложенный вами способ с экономической и экологической стороны.
3.В одном из стихотворений К.И. Чуковского есть такие строки: «А лисички взяли спички, к морю синему пошли, море сине зажгли». Реально ли это сделать?
Задача 2.Со времен Гомера известен этот оксид – бесцветный газ с резким запахом. Одиссей, хитроумный герой Троянской войны, окуривал им помещение, в котором сражался, и в конце концов победил женихов Пенелопы. Плиний Старший, римский историк (23-79 гг. н. э.), тоже упоминал в своих сочинениях о газообразном оксиде, который уничтожает инфекцию и вредных насекомых. Тот же оксид стал причиной смерти Плиния во время извержения Везувия в 79 г н.э. В наши дни это соединение выбрасывается в атмосферу с дымом тепловых электростанций и металлургических заводов и является причиной «кислотных дождей». Когда «газ Одиссея» смешивают с влажным сероводородом, выделяется сера, а пероксид водорода в водном растворе превращает его в сильную кислоту.
Вопросы:
1.Что это за газ?
2.Какие свойства он проявляет: окислительные или восстановительные. Подтвердите уравнениями реакций.
Задача 3.…Тогда услышал я, о, диво, запах скверный
Как будто тухлое разбилось яйцо
Иль карантинный страж курил жаровней серной.
Я, нос себе, сжав, отворотил лицо.
Вопросы:
1.О каких соединениях серы написано в стихотворении А.С. Пушкина?
2.Какими физическими свойствами обладают эти соединения?
Подгруппа азота
Задача 1. По официальной версии Наполеон умер от рака желудка. Спустя 140 лет ученые пришли к выводу, что, скорее всего, он был отравлен ядовитыми соединениями элемента Х. Вероятно, Наполеону длительное время подмешивали в пищу вещество состава Х2О3 в малых дозах.
Задания:
1.Установи элемент Х, если известно, что его массовая доля в оксиде составляет 75,7%.
2.Дайте характеристику элемента Х на основании его положения вПСХЭ Д. И. Менделеева и строения атома.
3.К металлам или неметаллам относится простое вещество, образованное элементом Х?
4.Установите химический характер оксида Х2О3 .
5.Найдите в интернете или других источниках информации, как можно использовать простое вещество, образованное элементом Х?
Аммиак. Соли аммония
Задача 1.Огнев Н. Повесть « Дневник Кости Рябцева».
…Сегодня Черная Зоя сдавала экзамен за октябрь Алмакфишу и вдруг как шлепнется в обморок. Ну, теперь этим никого не удивишь. Сейчас же опрыскали водой, дали понюхать нашатырю, и она встала.
Вопросы:
1.Какое вещество называется нашатырем?
2.Что дают нюхать человеку, потерявшему сознание?
Задача 2. В.Солоухин в романе «Продолжение времени» писал :
Современные модернисты создают свои шедевры, не отходя от холста. Потому что зачем трудиться, если все равно никто ничего не поймет… Можно даже перерисовать из школьного учебника схему получения аммиачной кислоты, и выставить под названием «Зимний пейзаж».
Вопросы:
1.Существует ли в природе аммиачная кислота?
2.Схему получения какого вещества вероятнее всего имел в виду автор отрывка?
Задача 3.Как известно, при выпечке хлеба в тесто добавляют сухие дрожжи – это смесь солей: гидрокарбоната аммония, карбоната аммония и карбамата аммония NH4NH2COO. Все эти соли при нагревании разлагаются и придают тесту желанную пористость.
Задание: Проведите опыт и составьте уравнения химических реакций, происходящих при выпечке хлеба, замешанного на сухих дрожжах.
Задача 4.Теннисные мячи. Знаете ли вы, что теннисные не надувают? В них входят специальные вещества – «вздуватели». Эти вещества при нагревании разлагаются с образованием газообразных продуктов. В заготовки теннисного мяча, которые имеют вид полусфер и предварительно смазаны клеем, кладут таблетки, содержащие смесь нитрата натрия и хлорида аммония. Склеенные половинки мяча помещают в форму для вулканизации и нагревают.
Вопросы:
1. Составьте уравнение реакции нитрата натрия с хлоридом аммония.
2.Рассчитайте массу таблетки, состоящей из стехиометрической смеси нитрата натрия и хлорида аммония, которую нужно поместить в мяч объёмом 162 мл для достижения внутри мяча давления1,2 атм при 25OС
Подгруппа углерода.
Задача 1. В.Ф.Одоевский «Мороз Иванович»: “Между тем Рукодельница воротится, воду процедит, в кувшин нальет, да ещё какая затейница: коли вода нечиста, так свернет лист бумаги, наложит в неё угольков да песку крупного насыплет, вставит ту бумагу в кувшин да нальет в нее воды. А вода-то, знай, проходит сквозь песок да сквозь уголья и капает в кувшин чистая, словно хрустальная”.
Вопросы:
1.Назовите метод очистки веществ.
2.Зачем Рукодельница брала угольки?
Задача 2. 5 октября 2010 г. в Стокгольме были названы имена лауреатов Нобелевской премии по физике за 2010 г. Самую престижную из премий получили два выходца из России — Константин Новосёлов и Андрей Гейм за эксперименты с графеном. Графен представляет собой одинарный слой атомов углерода, соединённых между собой в структуру, напоминающую пчелиные соты. Для получения графена плоские куски графита помещают между липкими лентами (скоч) и расщепляют раз за разом, создавая достаточно тонкие слои (среди многих пленок могут попадаться однослойные и двухслойные, которые и представляют интерес). Ожидается, что графен:
-
заменит кремний в микросхемах. Чипы на его основе станут легче, производительнее, стабильнее в работе, будут потреблять меньше электроэнергии и рассеивать меньше тепла;
-
придет на смену тяжелым медным проводам в космонавтике и авиации;
-
будет использован при создании гибких сенсорных дисплеев и солнечных батарей;
-
найдет применение в качестве сенсора для обнаружения отдельных молекул.
К тому же графен по прочности превосходит все известные материалы, Гамак, выполненный из графена, не видим глазом, но сможет выдержать четырехкилограммового кота.
Вопросы:
1. Обладает ли графен электропроводностью?
2. Горит ли графен?
3. Можно ли использовать графен при создании полупроводниковых материалов?
4. Какова гибридизация атомов углерода в графене?
5. Имеются ли в графене делокализованные связи?
6. Назовите еще 4 аллотропных модификации углерода, кроме графита и графена.
7. В какой из аллотропных модификаций углерода атомы находятся в состоянии sp 3— гибридизации?
Соединения углерода.
Задача 1.В прошлом были частыми случаи отравления людей в угольных шахтах угарным газом СО. Поскольку оксид углерода не имеет запаха, то опасность подступала незаметно. Шахтеры брали с собой канарейку в клетке в качестве индикатора: канарейки падают в обморок от присутствия в воздухе следов угарного газа и метана.
Задание. Установите молекулярную формулу данного оксида углерода, если массовые доли элементов в его молекуле составляют: С – 42,86 %; О – 57,14 %.
Задача 2.Чтобы получить этот оксид в твердом виде достаточно взять его в жидком состоянии и… вылить прямо в бумажный пакет. Получится белый порошок, с которым хорошо знакомы уличные продавцы мороженного. Этот оксид честно служит людям: его хорошо знают те, кто хотя бы однажды пользовался огнетушителем или пил газированную воду. А голландский ученый Ян Баптист ванГельмонт в 1620 г. назвал этот оксид «лесным духом».
Вопросы:
1.Что это за вещество?
2.Обьясните,почему этот оксид называют «сухой и холодный».
Задача 3.Углекислый газ СО2 не ядовит, но при вдыхании его в больших количествах наступает удушье из-за недостатка кислорода. В Италии находится «Собачья пещера», в которой человек стоя может находиться длительное время, а забежавшая туда собака задыхается и гибнет.
Задания:
1.Составьте молекулярную формулу углекислого газа.
2.Определите относительную плотность углекислого газа по воздуху.
3.Обоснуйте, почему углекислый газ в «Собачьей пещере» скапливается внизу?
4.Составить карточку «Анкетные данные углекислого газа».
Задача 4. Какой объем (н.у.) углекислого газа заполнит помещение кухни, если Петя в отсутствие родителей решил прокалить на газе 700 г толченого мела, в котором 2% примесей? (Так он решил проверить правдивость утверждения своего учителя химии о необходимости постоянного проветривания помещения, где проводится такой опыт).
Задание: Что произойдет, если Петя не откроет форточку? Ответ подтвердите расчетом.
Ответ.
Дано:
m(мела) = 700 г,
(примесей) = 2%.
Найти:
V(CO2).
Решение
Из условия следует, что содержание СаСО3 в меле 98%.
m(СаСО3) = 700 · 98(%)/100(%) = 686 г;
686/100 = х/22,4, х = 153,7 л СО2.
Ответ. V(CO2) = 153,7 л — такой объем СО2 скопится на кухне. Если Петя не откроет форточку, то он может задохнуться.
Задача 5. Многие люди любят парится в бане. Однако в русской бане не исключена угроза отравления угарным газом. Признаки отравления им детально описаны: сначала сильное головокружение, необыкновенная бледность лица, у некоторых бывает рвота, потом глубокий обморок, а при продолжительном воздействии газа – летальный исход. Чтобы избежать опасности, необходимо придерживаться следующих правил: когда баня истоплена и уже достаточно прогрета, надо тщательно перемешать угли в топке, чтобы не осталось даже маленькой тлеющей головешки. Большие тлеющие головешки следует убрать и погасить в ведре. Из поддувала печки также нужно всё выгрести, так как там могут находиться долго тлеющие угли.
Задание:
Выведите формулу угарного газа, если известно, что он относится к оксидам, а массовая доля углерода в нём составляет 42,86%
Соли угольной кислоты.
Задача 1.Большой популярностью среди туристов пользуются сталактитовые пещеры в горах Кавказа и Крыма, среди которых есть не пройденные до конца. Известняковые пещеры-лабиринты Крыма служили партизанам убежищем в период Великой отечественной войны. Реакция превращении карбоната в бикарбонат обратима, поэтому на потолке известняковой пещеры из капли воды, насыщенной гидрокарбонатом кальция, выделяется диоксид углерода, и прежде чем капля успеет упасть вниз, часть растворенного гидрокарбоната превращается в твердый карбонат. Так зарождаются свисающие вниз сосульки сталактитов. Из воды, капающей со сталактита, на полу пещеры тоже осаждается карбонат кальция, и с течением времени навстречу свисающей сосульке поднимается такой же столб снизу – сталагмит.
Задания:
1.Запищите химические формулы веществ: гидрокарбонат кальция, карбонат кальция, диоксид углерода.
2. Составьте схемы превращения веществ, о которых говорится в задаче.
3. Определите тип каждой химической реакции.
4. Сделайте вывод о свойствах солей угольной кислоты, их растворимости.
5. Сделайте сообщение о распространении солей угольной кислоты в природе.
Задача 2. Побывав на Урале у деда — малахитовых дел мастера, Никита привез красивый зелено-голубой порошок (малахитовую пыль). На занятиях в кружке по химии все решили попробовать получить из него оксид меди. В процессе нагревания мальчик случайно чихнул, и из выпарной чашки вылетела половина содержимого. Однако черный порошок оксида меди Никита все же получил в количестве 2 г.
Задание: Какую массу малахита (СuOH)2CO3 взял Никита изначально, если в нем содержится 5% примесей?
Ответ:
Дано:
m(СuO) = 2 г,
(примесей) = 5%.
Найти:
m(малахита).
Решение
х/222 = 2/160, х = 2,8 г 100%-го (СuOH)2CO3;
m(малахита) = 2,8 ·100(%)/95(%) = 2,9 г.
Поскольку Никита половину малахита высыпал, то результат нужно увеличить в два раза.
Изначальная масса малахита: 2,9•2 = 5,8 г.
Ответ. 5,8 г малахита взял изначально Никита.
Задача 3. Какой объем (н.у.) углекислого газа попадет в вытяжной шкаф, если при прокаливании 20 г малахита Никита наденет противопыльную маску? Примесей в малахите содержится 5%..
Ответ.
Дано:
m(малахита) = 20 г,
(примесей) = 5%.
Найти:
V(CO2).
Решение
m(100%-го (СuOH)2CO3) = 20 · 95(%)/100(%) = 19 г;
19/222 = х/22,4, х = 1,9 л CO2.
Ответ. V(CO2) =1,9 л — такой объем углекислого газа попадет в вытяжной шкаф, а надетая маска на химический процесс не повлияет.
10 класс
Ароматические углеводороды.
Задача 1. Клюква и брусника могут очень долго храниться в свежем виде без сахара, так как этому способствует наличие в них прекрасного консерванта – бензойной кислоты.
Задания.
1. Установите молекулярную формулу кислоты, если массовые доли элементов в ней составляют: углерода – 68,85%, водорода – 4,92%, кислорода – 26,23% (M = 122 г/моль). 2.При окислении какого ароматического углеводорода образуется бензойная кислота, напишите уравнение реакции.
Спирты.
Задача 1. Задание:Какую массу 96%-го этилового спирта С2Н5ОН подвергнет Алексей сжиганию в спиртовке при получении кислорода из марганцовки, если в течение опыта спиртовка выделяет 800 мл (н.у.) углекислого газа? А сколько граммов спирта раздаст учитель в классе 27 ученикам, которые проведут такой опыт?
Ответ:
Дано:
(С2Н5ОН) = 96%,
V(СO2) = 0,8 л,
N = 27 человек.
Найти:
m(С2Н5ОН).
Решение
m(96%-го С2Н5ОН) = 0,8 х100(%)/96(%) = 0,83 г.
На этот опыт 27 учеников израсходуют спирта: 27 х 0,83 = 22,5 г.
Ответ. Алексей сожжет 0,83 г, а учитель раздаст в классе для проведения опыта 22,5 г 96%-го этилового спирта.
Карбоновые кислоты.
Задача 1.Соединение с молекулярной формулой С3Н8О, подвергли окислительному дегидрированию, в результате чего получили продукт состава С3Н6О. Это вещество вступает в реакцию «серебряного зеркала», образуя соединение состава С3Н6О2. При действии на последнее гидроксидом кальция получили вещество, используемое в качестве пищевой добавки под кодом Е282. Оно препятствует росту плесени на хлебобулочных и кондитерских изделиях и, кроме того, содержится в таких продуктах, как швейцарский сыр.
Задания:
1.Напишите уравнения реакций, рассматриваемые в задаче. Приведите названия образующихся органических веществ.
2.Определите формулу добавки Е282.
3.Объясните, с какой целью рассматриваемое вещество добавляют в сыр.
4.Что вы знаете о пищевых добавках? Применяете ли вы их? Ответ обоснуйте.
Задача 2.При укусах муравьев возникает чувство боли — за счёт действия муравьиной кислоты. Если место укуса смочить нашатырным спиртом, боль пропадает.
Задания:
1.Запишите формулу муравьиной кислоты.
2.Составьте уравнение химической реакции нейтрализации, которая лежит в основе применения нашатырного спирта для уменьшения боли при укусах муравьев.
3. Назовите продукт химической реакции.
4. Составьте уравнения еще 2-х химических реакций, в которых может участвовать муравьиная кислота.
5.Подготовьте сообщение «Химический характер житейских ситуаций» (Уравнения химических реакций, встречающихся в быту).
Задача 3. Всем известно, что крапива больно жжётся.
Задания:
1.Установите формулу вещества, которое вызывает жжение, если массовые доли элементов в этом веществе составляют: 26,08%(С), 4,35%(Н), 69,56%(О).
2. Назовите вещество. К какому классу органических соединений оно относится?
3. Напишите пошаговую инструкцию-подсказку для соседа по парте — как вывести молекулярную формулу вещества по его составу.
Задача 4. В северных широтах местные жители применяют лишайники (паргелия, кладония альпийская) для очищения кишечника. В них содержится мощный антибиотик – усниновая кислота. Механизм действия лишайника в человеческом организме таков: лишайники содержат много слизеобразующих веществ, которые отлично абсорбируют токсины и выводят их из организма человека. Обволакивая слизистую, они создают защитный слой, а значит, создают условия для быстрого заживления язвенных и эрозийных дефектов (например, при дизентерии),поэтому нанайцы редко болеют дисбактериозом.
Задание. Установите молекулярную формулу усниновой кислоты, если массовые доли элементов в ней составляют: С – 62,79 %; Н – 4,65 %; О – 32,56 %; Mr = 344.
(Ответ. С18Н16О7.)
Сложные эфиры. Жиры.
Задача1.Неприятный запах горелого масла и любых перегретых жиров объясняется образованием акролеина (пропеналя), который является продуктом дегидратации глицерина.
Вопросы:
1.Какие реакции, протекающие при жарке пищи, приводят к образованию акролеина из жиров?
2.Как в домашних условиях избавиться от этого запаха?
3.На каких свойствах основан предложенный Вами способ?
Задача 2.Часто в магазине мы покупаем масло, содержащее в своем составе не только животные, но и растительные жиры.
Вопросы:
1.Отличается ли такое масло по своим свойствам от маргарина? Если да, то в чем?
2. Как отличить растительное масло от машинного (минерального)?
3.Продемонстрируйте предложенные Вами способы решения поставленной задачи.
Задача 3. Автомеханик во время приема пищи капнул на одежду растительным маслом. Образовалось масляное пятно. Он подумал: «Какая неудача… Сегодня нет времени…Но в конце недели обязательно избавлюсь от пятна на жилете с помощью растворителя, как в прошлый раз вывел пятно от сливочного масла». Он повесил жилетку на спинку стула и забыл о ней. Через некоторое время автомеханик решил постирать свою рабочую одежду: она была в машинном масле. Сосед-кондитер посоветовал ему купить моющее средство «Мыло с желчью», которым он стирает свою рабочую одежду, пропитанную растительными и животными жирами. Автомеханик так и поступил. Но машинное масло не отстиралось.
Вопрос: Почему?
Углеводы.
Задача 1.У дельфина слёзы сладкие, потому что в слезе дельфина содержатся сахара – галактоза и фруктоза. Углеводно-белковые, напоминающие белок куриного яйца, слёзы служат смазкой. Дельфины плачут, чтобы лучше видеть и быстрее плавать.
Вопросы:
1.Установите молекулярную формулу фруктозы, которая придаёт дельфиньим слезам сладкий вкус, если массовые доли элементов в ней составляют: 40,0%(С), 6,6%(Н), 53,4%(О).
2. Сравните (в табличной форме) физические свойства глюкозы и фруктозы.
Аминокислоты.
Задача 1.Одной из причин долголетия японцев является широкое употребление в пищу морепродуктов. Содержащиеся в них жиры являются ненасыщенными. В их состав входит большое число незаменимых жирных кислот и жирорастворимых витаминов. Как незаменимые жирные кислоты, так и жирорастворимые витамины являются важнейшими составляющими рациона питания, необходимыми для поддержания здоровья человека и продления его жизни.
Задание.
1.Установите относительную молекулярную массу незаменимой аминокислоты – триптофана С11Н12О2N2. (Ответ. 204.)
2.Приготовьте сообщение о незаменимых аминокислотах.
11 класс
Строение атома.
Задача 1.Туристы, приехавшие в Индию, обязаны искупаться в водах “священного Ганга”. На берегах Ганга омываются ежедневно тысячи людей, при этом не обнаружено ни одного возбудителя инфекционного заболевания. Это связано с тем, что в устье реки Ганг располагаются залежи самородного серебра, в прибрежных зонах реки находятся самые крупные в Индии месторождения серебра. Поэтому в воде Ганга находятся ионы серебра, обладающие бактерицидным действием.
Задание.Составьте электронную формулу иона серебра Ag+, обладающего бактерицидным действием.
Задача 2.Цвет и форма цветков многих растений зависят от химического состава почвы. Геоботаники используют это свойство растений для поиска рудных месторождений. В частности, цветки сон-травы (пульсатиллы) на Южном Урале обесцвечиваются при повышенном содержании в почве определенного металла.
Задание: Определите элемент и его положение в периодической системе элементов (период, группа, подгруппа) по электронной формуле: 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Химические реакции.
Задача 1.Петр I для проведения рождественского фейерверка пригласил голландских пиротехников, но из-за морозов фейерверк чуть не был сорван.
Задания:
1.Докажите правдивость этого исторического случая, если вспышки петард были обусловлены распадом бертолетовой соли 2КСIО3 → 2КСI + 3О2 + Q?
2.Определите, насколько быстрее горела петарда в Голландии при 10 градусах тепла, чем в России при 30 градусах мороза, если температурный коэффициент реакции равен 3?
Дисперсные системы.
Задача 1.Приготовление кофе – целое искусство. Важно знать о сущности физико-химических явлений происходящих в кофейне. Когда кофе заливают кипящей водой, начинается процесс экстрагирования – вытяжка из кофе его растворимых компонентов. Одновременно всплывающие пузырьки пара увлекают за собой ароматические вещества. Варят кофе в лужёных изнутри сосудах. Сначала наливают воду и добавляют сахар по вкусу. Это не случайно, а потому, что водопроводная вода жёсткая, ионы кальция тормозят процесс экстрагирования. При кипячении кофе образуется густая шапка пены – это своеобразная крышка, не позволяющая летучим веществам покидать сосуд, сохраняя аромат и вкус напитка. Пене дают подняться один раз, так как бурлящая жидкость может разрушить пенистую крышку. Подогретый кофе не имеет аромата.
Задания:
1.Определить место дисперсной системы кофе в классификации по агрегатному состоянию фазы и среды.
2. Определить компоненты фазы и среды.
3. Где на практике можно встретиться с пеной.
4. Условия сохранения вкусовых качеств.
5.Зачем кофе готовят на подслащённой воде?
20
СЕКРЕТЫ КОНТЕКСТНОЙ ЗДДАЧК
Марат Анварович Ахметов, кандидат химических наук, доцент, ФГБОУ ВО «УлГПУ им. И.Н. Ульянова», г. Ульяновск
• контекстные задачи • образовательный процесс • результаты обучения
• контекстное содержание • познавательный интерес • химическое знание
Контекстные задачи — это задачи, в которых демонстрируется взаимосвязь изучаемого материала с различными сторонами жизни человека — историей, литературой, практической деятельностью, — подчёркивается роль предмета в жизни каждого человека и общества. Необходимость использования контекстных задач в практике образовательного процесса трудно переоценить, так как способность учащихся к применению естественнонаучных знаний во взаимосвязи с различными аспектами жизни человека является ахиллесовой пятой, слабым местом российского образования.
С начала нового тысячелетия ведётся работа по повышению рейтинга общего образования РФ в международных исследованиях, в частности, в международном исследовании PISA. Недавно опубликованные результаты PISA-2015 показывают, что школьники РФ способны решать определённые задачи в области естественнонаучных дисциплин на уровне чуть ниже среднего. Одной из причин невысоких результатов является недостаточное использование в обучении задач, связанных с применением знаний в жизни человека. Мы полагаем, что широкое использование приближенных к практике PISA контекстных задач позволит дать новый импульс развития школьных образовательных технологий.
Слово «контекст» появилось в русском языке в конце XVII века. Оно было заимствовано из французского языка, где contexte произошло от латинского contextus, что означает соединение или сплетение. Исходным является слово texere — плести или ткать. В русском языке имеются и другие слова аналогичного происхождения — текстиль, текст.
Под контекстными задачами понимаются такие задачи, в которых предметное содер-
жание сплетено с различными сторонами жизни и деятельности человека. Наиболее значимыми для контекстных задач, применяемых в обучении химии, являются взаимосвязи:
• с историей химии, включая алхимический период, перспективы развития химии;
• с литературой, поэзией, живописью, скульптурой, художественным и документальным кино;
• с практической деятельностью человека (быт, здоровье, профессия);
• со средствами массовой информации (газеты, журналы, телевидение, Интернет);
• с другими учебными дисциплинами.
Контекстные задачи обычно включают текст (иллюстрацию) и вопросы к тексту. Текст такой задачи соединяет различные, казалось бы, несовместимые стили: художественный, бытовой, научный и др. Учащемуся для успешного решения контекстной задачи нужно хорошо знать содержание учебника и применить это знание в ситуации, описанной в задаче.
Следует отметить, что контекстные задачи способствуют развитию такого свойства личности учащихся, как познавательная активность. Согласно исследованиям советского психолога Е.И. Бойко, при межрефлекторном совмещении в мозгу человека имеющейся у него информации и новой информации, поступающей в мозг, путём осмысления текста контекстной задачи рождается новое знание, ключ к решению поставленной в задаче проблемы. Этот мыслительный процесс сопровождается пси-хофизиологичес-кой реакцией организма -выделением в кровь гормонов, приносящих удовольствие. Самостоятельное систематическое решение контекстных задач дарит
ИНШШ£…….У…….ПРАНТИИА
учащимся ни с чем не сравнимую радость успеха деятельности и творчества, что может стать основой для развития познавательной активности учащихся как свойства личности.
Контекстные задачи благодаря взаимосвязи с различными сторонами жизни способны формировать смыслы познавательной деятельности. Художественный текст, интегрированный в содержание контекстной задачи, позволяет усилить положительные эмоции от работы с такими заданиями.
Включение учащихся в деятельность по решению контекстных задач позволяет достигать метапредметных и личностных результатов обучения, в числе которых:
• любовь к Родине, уважение к своему народу, к его культуре и духовным традициям;
• осознание и принятие ценностей человеческой жизни, семьи, гражданского общества, многонационального народа России, человечества;
• осознание ценности труда, науки, творчества, познавательная активность как свойство личности;
• осознание важности образования и самообразования для жизни и деятельности, умение учиться;
• способность применять полученные знания на практике;
• уважение к закону и правопорядку, нравственность, осознание своих обязанностей перед семьёй, обществом, Отечеством;
• уважение к другим людям, умение вести конструктивный диалог, достигать взаимопонимания, сотрудничать для достижения общих результатов;
• потребность выполнения правил здорового и экологически целесообразного образа жизни, безопасного для человека и окружающей среды;
• способность ориентироваться в мире профессий, понимание значения профессиональной деятельности для человека в интересах устойчивого развития общества и природы.
Контекстные задачи также направлены на достижение предметных результатов обучения, способствуют формированию познава-
тельного интереса, что позволяет включать их в учебный процесс для изучения и осмысления роли химических символов, формул, уравнений, химических расчётов в химии и жизни человека.
Контекстное содержание может актуализировать мотив «полезно»: в этом случае химическое знание является инструментом для решения личностно-значимых проблем. Контекстное содержание также способно актуализировать мотив «интересно»: контекстные задачи позволяют удовлетворить любопытство учащихся. Контекст учебного содержания образно можно сравнить с солью и специями, превращающими потребление пищи в удовольствие. Так и контекстные задания превращают изучение химии в радость.
Следует отметить, что в каждом классе имеются учащиеся, которые способны воспринимать химическое содержание вне всякого контекста. Но доля таких детей, как правило, невелика. Отсутствие содержательного контекста даже для таких учащихся делает их химическое образование неполноценным, так как при этом в полной мере не создаётся и не актуализируется ценностно-мотивационный компонент познавательной деятельности.
В отличие от задач с практическим содержанием, контекстные задачи построены по-другому. Для них характерно усиление художественного, смыслового, личностно-значимого, эмоционального, практического компонентов. Контекстная задача обычно содержит больше информации, чем необходимо для её решения. Учащемуся при решении контекстной задачи придётся проанализировать текст, найти в нём главное и ответить на поставленные вопросы. Контекстные задачи оценивают способность к применению знаний, их невозможно решить, используя готовые алгоритмы.
Как научиться конструировать контекстные задачи? В основу такой задачи берётся какой-то реальный факт, историческое событие, практическая ситуация, фрагмент книги, журнальной или газетной статьи, телепередачи или фильма. В контекстной задаче происходит описание некоторого события или ситуации, в которой их участники сталкиваются с какой-либо проблемой,
Рис. 1. Прибор А. Лавуазье для изучения состава воздуха
либо сама ситуация требует какого-либо пояснения, выявления причин на основе полученных знаний.
В качестве иллюстрации рассмотрим задачу «Исследование состава воздуха».
«В 1775 году Антуан Лавуазье взялся исследовать состав воздуха. Он собрал прибор, изображённый на рис. 1, поместив некоторое количество ртути в реторту, изогнутое горло которой сообщалось с воздухом в стеклянном колоколе, погруженном в ртуть.
Учёный нагревал реторту до температуры чуть ниже температуры кипения ртути в течение 12 дней и ночей — до тех пор, пока поглощение ртутью воздуха с образованием красного оксида ртути НдО не прекратилось. Объём воздуха в колоколе сократился более чем на одну шестую часть. Оставшийся в колоколе газ гасил горящую свечу, мышь не могла в нём жить.
При нагревании с помощью линзы и солнечного света 2,7 г оксида ртути (рис. 2) Лавуазье получил 2,5 г ртути и 8 кубических дюймов неизвестного газа. При исследовании свойств этого газа выяснилось, что свеча горит в нём ослепительным пламенем, а мышь чувствует себя превосходно.
Вопросы и задания:
1) Какой газ главным образом остался в колоколе? Какова формула этого газа?
Рис. 2. Прибор А. Лавуазье для разложения оксида ртути
2)
Какой газ поглотился и какова формула этого газа?
Оцените объёмную долю поглощённого газа в воздухе (в %) на основании опыта учёного.
Чему равно современное значение объёмной доли поглощённого газа в воздухе? Объясните, в связи с чем имеется расхождение значений, полученных учёным, и современных научных данных. Приведите соответствующее уравнение химической реакции.
Какое вещество вы посоветовали бы использовать учёному для изучения состава воздуха?
Используя современные значения относительных атомных масс, выясните, удалось ли Лавуазье полностью разложить оксид ртути.
Считая, что объём кислорода был измерен Лавуазье при нормальных условиях, оцените объём кубического дюйма (в см3) и найдите, чему равен 1 дюйм (в см). Вычислите число молекул кислорода, получившихся в результате реакции.
10) Как можно получить оксид ртути (II)? Составьте два уравнения соответствующих реакций.
11) Получение кислорода разложением оксида ртути (II) небезопасно, так как образующиеся при этом пары ртути чрезвычайно ядовиты. Предложите безопасные способы получения кислорода в лаборатории.
12) Какие свойства кислорода позволяют собирать его методом вытеснения воды и методом вытеснения воздуха?
3)
4)
5)
6)
7)

ИНШШ£…….У…….ПРАНТИИА
Проанализируем текст контекстной задачи. Во-первых, следует обратить внимание на элементы, усиливающие эмоциональность задачи. Из содержания задачи следует, что учёный нагревал реторту «в течение 12 дней и ночей», что в сочетании с рисунком — печурки, нагреваемой углём или дровами, способно произвести сильное впечатление на школьника. Вторым элементом задачи, усиливающим её эмоциональность, является описание газа, полученного в результате окисления оксида ртути: «свеча горит в нём ослепительным пламенем, а мышь чувствует себя превосходно». Именно слово «превосходно» рисует образ мыши, которая себя так хорошо чувствует.
Во-вторых, контекстная задача стимулирует воображение учащихся. Этой цели служит художественный стиль текста, рисунки, например, портрет Лавуазье, рисунки экспериментального оборудования в авторском исполнении. Воображение рисует увлечённого исследованием гения химии господина Лавуазье с кочергой в руках, который в течение 12 суток не покидает лабораторию, доверяя управление пламенем печурки своим ассистентам лишь на время отдыха и приёма пищи.
В-третьих, текст контекстной задачи неполный, он содержит элементы недосказанности, т.е. не отвечает на все вопросы, которые возникают после её прочтения. Какой газ остался после нагревания ртути? Почему мышь не могла в нём жить, а свеча погасла? Какой газ выделился при нагревании оксида ртути? В чём причина расхождения данных, полученных Лавуазье, с современными научными данными? Это подталкивает учащихся к размышлению.
В-четвёртых, контекстная задача содержит специальный блок заданий и вопросов. Если вдруг в голове у школьника вопросов возникло недостаточно, то это с лихвой компенсируется вопросами и заданиями, поставленными во второй части задачи. Иными словами, контекстная задача обычно включает блок с вопросами и заданиями.
В-пятых, порядок вопросов не случаен. Автор задания шаг за шагом направляет мысль учащегося на выявление расхождений между данными, полученными Лавуазье о составе воздуха, и современными
научными данными. Ключом к решению проблемы является понимание обратимости образования оксида ртути: сначала при нагревании ртути на воздухе образуется оксид ртути и расходуется воздух, затем при нагревании оксида ртути выделяется газ, поддерживающий дыхание и горение.
В-шестых, контекстная задача позволяет учащемуся самостоятельно получить новую, ранее неизвестную ему информацию. Так, учащийся имеет возможность, с опорой на понятие «молярный объём газа», оценить размер как кубического дюйма, так и дюйма в см3 и см, соответственно.
В-седьмых, поставленные вопросы позволяют связать информацию из контекстной задачи с имеющимися у школьника знаниями по данной проблеме. Так, ученику предлагается заменить ртуть другим веществом, при котором точность измерения объёмной доли кислорода возрастёт, или предложить другие, более безопасные, чем разложение оксида ртути (II), способы получения кислорода.
Рассмотрим ещё одну контекстную задачу «Секрет Чёрного моря» (9 класс).
«Летом 1890 года в Чёрном море на борту канонерской лодки «Чёрноморец» работала экспедиция русского географического общества. В один из дней боцман, понюхав пробы воды и грунта, поднятые со дна, с восторгом доложил руководителю Н.И. Анд-русову: «Воняет, ваше благородие!».
Интересно, что в верхних слоях моря сероводород практически отсутствует. Я.К. Гололо-бов в 40-х годах ХХ века определил, что граница сероводородного слоя в зависимости от сезона составляет от 126 до 169 м.
Жизнь в Чёрном море, в привычном её понимании, существует только в верхних слоях. Всё, что ниже — безжизненное сероводородное пространство. Концентрация сероводорода у дна составляет 11-14 мл/л.
Вопросы и задания:
1) Подъёму сероводорода в верхние слои моря препятствует кислород, который его окисляет. Составьте уравнение реакции окисления сероводорода кислородом.
2) Соотнесите глубину сероводородного слоя с временем года.
3) Рассчитайте молярную концентрацию сероводорода в придонной воде.
Эмоциональность задачи следует из её текста. Слова боцмана: «Воняет, ваше благородие!», «безжизненное сероводородное пространство». Эмоции стимулируют воображение учащихся. Так обучаемый представляет восторженного боцмана, докладывающего руководителю экспедиции Н.И. Андрусову о безжизненном сероводородном пространстве на глубине моря. Текст контекстной задачи неполный. Учащемуся неясно: почему сероводород не поднимается в верхние слои моря? По какой причине колеблется глубина сероводородного слоя? Если вдруг вопросы не возникли, то контекстная задача содержит специальный блок заданий и вопросов. Для составления правильного уравнения химической реакции учащийся должен вспомнить, что сероводород может быть окислен сероводородом двумя способами: при его недостатке и при его избытке. Для верного выбора обучающемуся предстоит оценить содержание кислорода в морской воде на глубине 150-200 м. Для ответа на второй вопрос следует привлечь знания из курса физики о связи растворимости газов в жидкостях с температурой воды. Для расчёта молярной концентрации сероводорода в придонном слое воды нужны знания из курса химии.
Текст контекстной задачи позволяет школьнику получать новые знания, школьник самостоятельно получает знания о круговороте серы в нижних слоях Чёрного моря, о глубине сероводородного слоя — летом и зимой.
Очевидно, что контекстные задачи могут создаваться не только по химии, но и по
другим предметам. Познакомиться с другими примерами контекстных задач можно, обратившись к приведённому ниже списку литературы. □
Литература
1. Ахметов М.А. Контекстные задачи по химии. Сероводород, сернистый газ и многое другое / М.А. Ахметов // Химия: учебно-методический журнал. — 2016. -№1. — С. 28-31.
2. Ахметов М.А. Контекстные задачи по химии. Углерод и его соединения. Соединения кремния в нашей жизни / М.А. Ахметов // Химия: учебно-методический журнал. — 2016. — №2. — С. 17-21.
3. Ахметов М.А. Контекстные задачи по химии. О металлах, подводных лодках и созревании плодов / М.А. Ахметов // Химия: учебно-методический журнал. -2016. — №3. — С. 24-28.
4. Ахметов М.А. Контекстные задачи по химии. Ацетилен, аспирин и наблюдательность Нобеля / М.А. Ахметов // Химия: учебно-методический журнал. -2016. — №4. — С. 23-25.
5. Ахметов М.А. Контекстные задачи по химии. Защита окружающей среды, ал-лотропы и открытия Ф. Глаубера / М.А. Ахметов // Химия: учебно-методический журнал. — 2016. — №5-6. — С. 28-33.
6. Ахметов М.А. Контекстные задачи по химии. Реакции органические, неорганические, электрохимические / М.А. Ахметов // Химия: учебно-методический журнал. — 2016. — №5-6. — С. 34-40.
7. Ахметов М.А. 100 контекстных задач по химии: учебно-методическое пособие. Часть 1 / М.А. Ахметов. — Ульяновск: Центр ОСИ, 2015. — 68 с.
8. Ахметов М.А. 100 контекстных задач по химии: учебно-методическое пособие. Часть 2 / М.А. Ахметов. — Ульяновск: Центр ОСИ, 2015. — 48 с.
Фреоны
Задача. В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
Данная задача предназначена для десятиклассников, которые еще не освоили курс кислородсодержащих органических соединений, поэтому даны массовые доли.
1. Начнем с фреона № 1. При его сжигании образовалось 2,24 л углекислого газа. Найдем количество углекислого газа. Делим его объем на молярный объем и получаем 0,1 моль. Соответственно, атомов углерода тоже 0,1 моль, поскольку в каждой молекуле углекислого газа содержится один атом углерода.
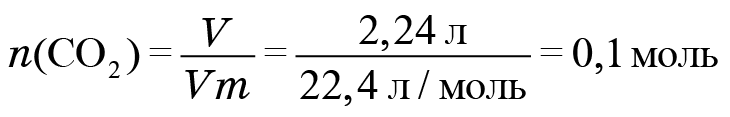
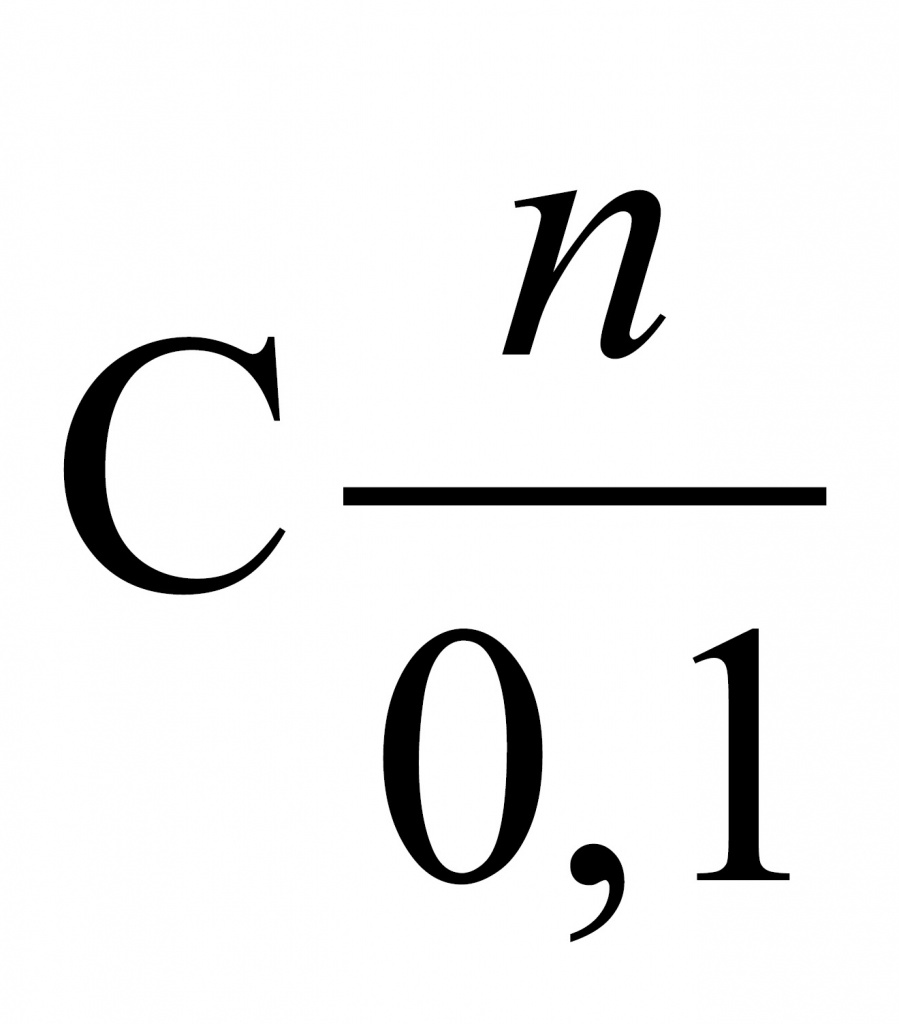
Информацию по водороду возьмем из фтороводорода. Найдем количество фтороводорода. Поскольку дана его масса, мы должны поделить массу (4 г) на молярную массу. Молекула фтороводорода состоит из атома фтора и атома водорода. Масса атома фтора 19, у водорода масса 1, значит, молярная масса 20. И мы получаем 0,2 моль.
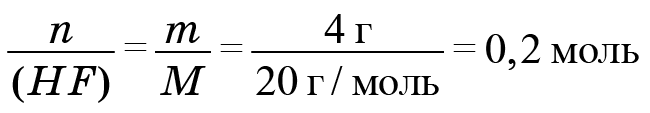
Следовательно, H = 0,2 и F = 0,2. Формула вещества, фреона № 1: CH2F2 (на один атом углерода приходится два атома водорода и два атома фтора).

2. Узнаем, что скрывается под фреоном № 2. Известно, что он не горит, и дана его плотность по водороду. Это относительная плотность, которая показывает, во сколько раз молярная масса вещества больше молярной массы (в данном случае) водорода. Молярная масса фреона № 2 равна 121 г/моль.
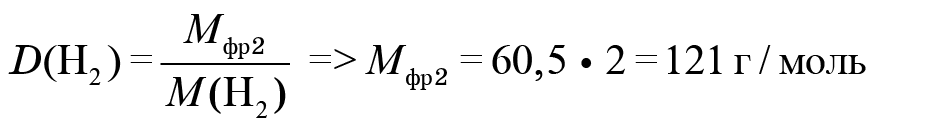
Сколько атомов углерода во фреоне № 2? Для подсчета используем массовую долю углерода. Масса углерода равна: молярную массу умножить на массовую долю. Получаем 12. Значит, в данной молекуле фреона № 2 содержится только один атом углерода.
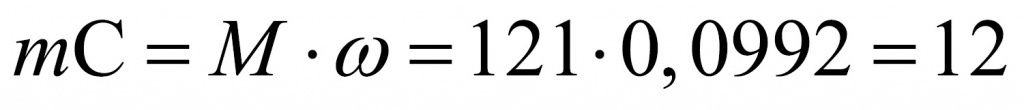
Нарисуем этот атом углерода. У него имеется четыре связи, поскольку в органической химии углерод четырехвалентный. Попробуем определить атомы, исходя из того, что в сумме один атом углерода и все остальные атомы должны равняться молярной массе (равной молекулярной) 121. Попробуем рассчитать. Если это четыре атома фтора, то получается мало. А если это четыре атома хлора, то много. Возьмем нечто среднее: половина — атомы фтора и половина — атомы хлора. Единица в показателе 121 говорит о том, что имеются нечетные значения. Молярная масса хлора 35,5. Для того чтобы получить целое численное значение, вероятно, нужны два атома хлора.
121 – 71 – 12 = 38 (ровно на два атома фтора)
3. Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
100 – 39,58 – 10,42 = 50
Проверим вариант, что там только хлор и нет других атомов. Предположим, что там всего один атом углерода (его масса будет равна 12). Посчитаем, какая масса при этом будет приходиться, например, на атом фтора.
12 ∙ 39,58 : 50 = 9,5
Как указано в периодической системе Менделеева, атомная масса фтора — 19. Ровно половина одного атома фтора — 9,5, так что в составе этой молекулы не может быть один атом углерода, их должно быть как минимум два. Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
24 ∙ 10,42 : 50 = 5
Поскольку у нас один атом фтора, пять атомов водорода и два атома углерода, мы имеем дело с фторэтаном.

4. Что касается фреона № 4, то в реакции с натрием образовались этан и фторид натрия. Это реакция Вюрца — Фиттига. Мы имеем исходное вещество фторметан, которое реагирует с натрием, и образуются этан и фторид натрия.
5. Переходим к фреону № 5. Формиат натрия образуется при гидролизе трифторметана. Получается формиат натрия, фторид натрия и две молекулы воды.
Посмотрев в справочную информацию, вы можете соотнести с кодами каждый из найденных фреонов.
Изучение фреонов очень интересно. Каждый тип холодильного оборудования требует особую марку фреона. Сегодня холодильное оборудование часто заполняют и углеводородами, поскольку, как известно, фреоны способствуют разрушению озонового слоя Земли. Но на сегодняшний день полного отказа от фреонов еще не произошло.

Химия. 10 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
Купить
Вильгельм Рудольф Фиттиг
Задача. Вещество, открытое в 1862 году немецким ученым Вильгельмом Рудольфом Фиттигом, представляет собой бесцветные кристаллы (tпл = +690С). Они широко применяются в качестве пищевой добавки для сохранения товарного вида фруктов (например, цитрусовых) путем нанесения на кожуру плода. Для установления состава вещество массой 15,4 г сожгли, образовалось 26,88 л (н.у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.
Похожую задачу часто можно встретить на ЕГЭ.
Начнем с определения молекулярной формулы вещества, то есть узнаем состав этой молекулы. Найдем количество углекислого газа, а оно равно количеству углерода. Разделим объем на молярный объем. Поскольку условия нормальные, молярный объем для газообразного вещества составляет около 22,4 л/моль.
26,88 л : 22,4 л/моль = 1,2 моль
Поскольку воды 9 г, а молярная масса воды 18 г, следовательно, воды 0,5 моль, а водорода 1 моль. Как такое может быть? В одной молекуле воды содержится целых два атома водорода. Но нам не сказано: соединение ли углеводородом? содержит ли кислород? Мы должны проверить наличие кислорода и найти массу углерода и водорода.
1,2 моль ∙ 12 = 14,4 г
Сумма углерода и водорода: 14,4 + 1 = 15,4. Следовательно, в составе неизвестного вещества нет кислорода.

Молярное соотношение показывает, что формула вещества С12H10. Почему не С6H5? Потому что в углеводородах никогда не бывает нечетного числа атомов водорода. Радикал С6H5 в химии называется фенилом. Иными словами, мы имеем соединение, которое называется в химии дифенил. На это также указывают химические свойства дифенила, и он является разрешенной пищевой добавкой. В магазинах можно встретить, например, апельсины, покрытые белым веществом — это и есть дифенил. Иногда его применяют в изрядном количестве, поэтому нужно тщательно мыть фрукты.
Составим уравнение реакции с избытком водорода. Очень просто посчитать, сколько атомов водорода потребуется на реакцию с дифенилом. Мы видим шесть двойных связей. Следовательно, на одну двойную связь нужна одна молекула водорода, а на шесть двойных связей — шесть молекул водорода при исчерпывающем гидрировании. Конечно, на platinum-катализаторе, потому что соединение ароматическое и требует преодоления достаточно высокого энергетического барьера. Мы получаем соединение, которое нельзя назвать никак иначе, кроме как дициклогексил.

Соединение дифенил и было открыто Рудольфом Фиттигом в 1862 году с температурой плавления 69°С.
Желеобразующая жидкость
Задача. Некоторая нерастворимая в воде жидкость при хранении на воздухе способна уплотняться, превращаясь в желе. Химик отобрал, отмерив, некоторый объем этой жидкости и установил, что при действии избытка раствора брома в четыреххлористом углероде образовалось 26,4 г дибромида. А при действии раствора хлора на такой же объем этой жидкости образовалось 17,5 г дихлорида. Определите структурную формулу этой жидкости, если известно, что в ее состав входят только атомы водорода и углерода. Составьте уравнение реакции полимеризации этой жидкости.
Обозначим неизвестную жидкость-углеводород через формулу CXHY. О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
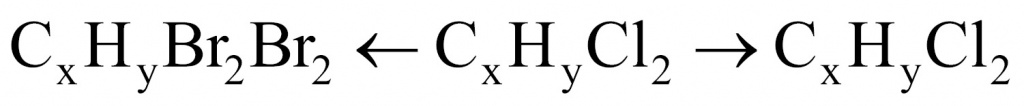
Для решения данной задачи нужно применить прием, известный в учебной химии как прием вычитания массы. Представим, что жидкости у нас ровно 1 моль. В этом случае разница между массой дибромида и дихлорида будет разницей между массой брома и хлора.
Молекула брома имеет массу 160, а молекула хлора — 71. Получаем 89. То есть если бы вещества у нас было 1 моль, то разница составила бы 89 г. Вычислим разницу массы дибромида и дихлорида:
26,4 – 17,5 = 8,9
Искомого вещества 0,1 моль.
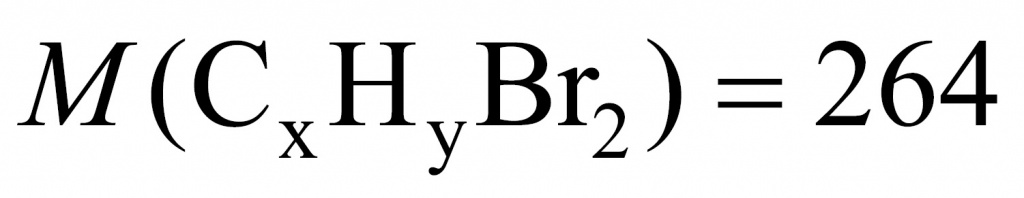
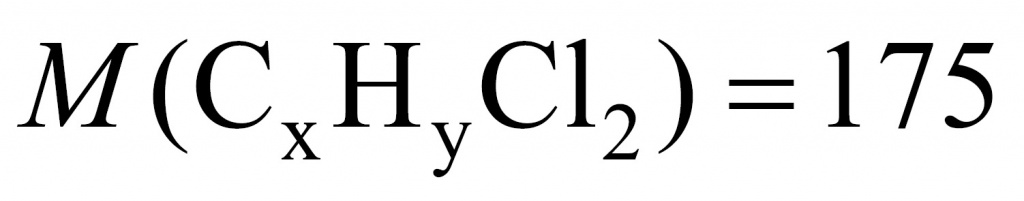
Теперь установим формулу. Обратимся к молекулярной записи. На углеводородную часть приходится 104. Сколько там может быть углеродов и водородов? Если углеродов 8 (что подходит), тогда на углероды приходится 96 и на водороды — 8.
Формула углеводорода C8H8.
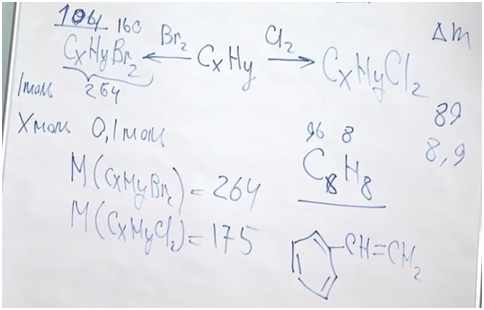
Разберемся, о каком углеводороде идет речь. Обратим внимание, что соединение непредельное, но оно способно присоединить только одну молекулу брома или одну молекулу хрома. Значит, исходя из малого числа атомов водорода по отношению к атомам углерода, скорее всего, это соединение есть не что иное, как производное бензола, то есть ароматическое соединение. В бензоле шесть атомов углерода и пять атомов водорода в остатке. У нас получается кетастирол.
Чтобы не было полимеризации, обычно в тот стирол, который можно купить в магазине, добавляют стабилизатор.
Уравнение полимеризации. Из n молекул стирола получается полимер, состоящий из n фрагментов.
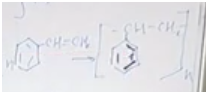
Полистирол — это, например, одноразовая посуда. Она наносит существенный вред окружающей среде, и сейчас идет речь о том, чтобы ее запретить.
Отдушка для мыла
Задача. Некоторое легкоплавкое вещество, обладающее приятным запахом, используют в качестве ингибитора полимеризации, в качестве отдушки для мыла. При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.
По данным задачи, углекислый газ составляет 0,1 моль, соответственно, столько же и углерода. Поскольку воды 7,2 г, что в молях 0,4, то водорода 0,8. Проверим на наличие кислорода. Масса углерода 6, масса водорода – 0,8. Поскольку общая масса сожженного вещества составляет 8,4, то на кислород приходится масса 1,6 (в молях 0,1). Получается молекулярная формула C5H8O.

Перейдем к структурой формуле вещества. Вещество не реагирует с бромной водой — из этого можно делать вывод, что нет кратных соединений (то есть двойных, тройных углерод-углеродных связей). Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
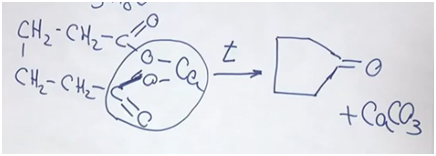
Циклопентанон как раз используют в качестве отдушки для мыла.
Ошибка А. М. Бутлерова
Задача. Установите структурную формулу альдегида, в определении которой немного ошибся великий А. М. Бутлеров, если известно, что в результате взаимодействия 100 г 0,9%-го раствора этого вещества с избытком раствора перманганата калия образуется осадок массой 3,48 г. Составьте уравнение реакции этого альдегида с раствором перманганата калия.
Все великие химики ошибались, в том числе и А. М. Бутлеров.
Для начала вспомним, как альдегиды взаимодействуют с перманганатом калия. Мы не знаем, о каком альдегиде идет речь. Допустим, у него была одна альдегидная группа (хотя, если в соединении две альдегидные группы, он все равно будет альдегидом). Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
После составления уравнения найдем массу альдегида и массу осадка. Но осадок — это, разумеется, оксид марганца (IV).
Поскольку у нас 100 г 0,2%-го раствора и на 1% приходится 1 г, масса альдегида 0,9 г. Чтобы найти количество оксида марганца, 3,48 разделим на молярную масса оксида марганца — 87. Получаем 0,04 моль. В соответствии с этим уравнением альдегида у нас должно быть больше в полтора раза: 0,06 моль.
Найдем молярную массу альдегида.
Где вы видели альдегид с молярной массой 15? Только на атом кислорода приходится 16. Значит, что либо альдегид содержал две альдегидные группы, либо это был формальдегид. Если бы он содержал две альдегидные группы, он бы отдал не два, а четыре электрона. Столько же отдал бы и формальдегид. Перманганат калия принимал бы три электрона. У оксида марганца (IV) было бы 4 моль. В этом случае оксида марганца 0,4 моль, а альдегида 0,3 моль.

Тогда
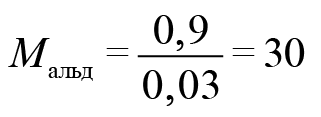
Следовательно, искомый альдегид — формальдегид. CH2O.
А. М. Бутлеров изначально определил формулу как C2H4O2.

Химия. 11 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии для старшей школы, изложенный в учебнике «Химия. Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
…ловая кислота
Задача. На полке в химической лаборатории стояла склянка с полустертой надписью. Единственное, что можно было разобрать: «…ловая кислота». Для установления состава кислоты провели ряд экспериментов. Для полной нейтрализации раствора, содержащего 0,36 г этой кислоты, понадобилось 50 мл 0,1-молярного раствора гидроксида натрия. Такая же навеска кислоты смогла обесцветить V = 80 мл (ω = 1%, ρ ≈ 1 г/мл) бромной воды. Восстановите надпись на склянке.
Обозначим формулу кислоты (будем считать, что она монокарбоновая). Если она одноосновная, то реакция идет один к одному. Найдем количество гидроксида натрия: 50 миллилитров 0,1-молярного раствора. У нас раствор, в одном литре которого содержится 0,1 моль вещества. Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
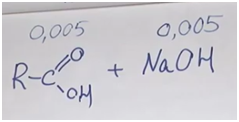
Отсюда легко находим молекулярную массу карбоновой кислоты.
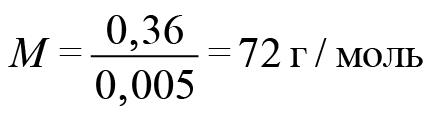
На карбоксильную группу приходится 45. Значит, на углеводородную часть приходится 27. В них поместятся два атома углерода и три атома водорода. Искомая кислота — акриловая.
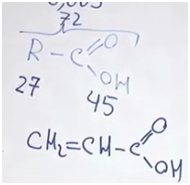
Электроны
Задача. 0,800000 кг вещества содержит 0,2743 г электронов. Установите формулу вещества, если известно, что масса электрона равна 0,0005486 а.е.м.
Начнем с количества электронов. Масса электронов у нас известна и молярная масса тоже.
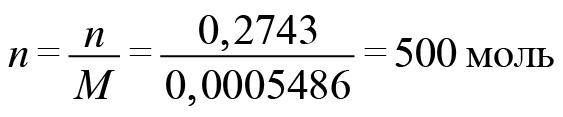
Число протонов равно количеству электронов:
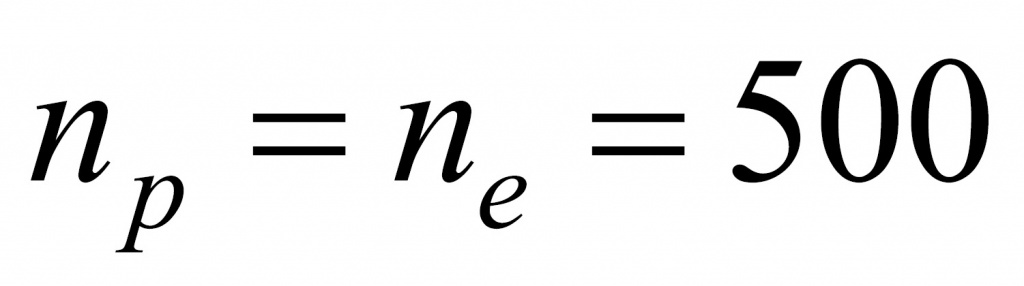
Отсюда находим массу, которая приходится на нейтроны (поскольку с точки зрения школьной химии любое число состоит из протонов, нейтронов и электронов). Обычно мы пренебрегаем массой электронов, но в данной задаче ей пренебрегать не нужно.
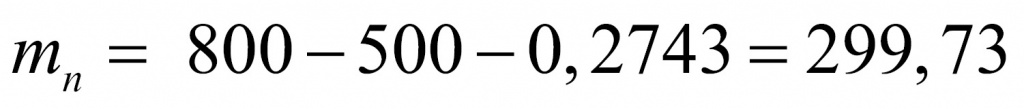
Получается интересное вещество. Обычно в атомах число нейтронов либо равно числу протонов, либо больше. В данном веществе протоны преобладают. Скорее всего, мы имеем дело с водородным соединением. Найдем соотношение между числом протонов и числом нейтронов.
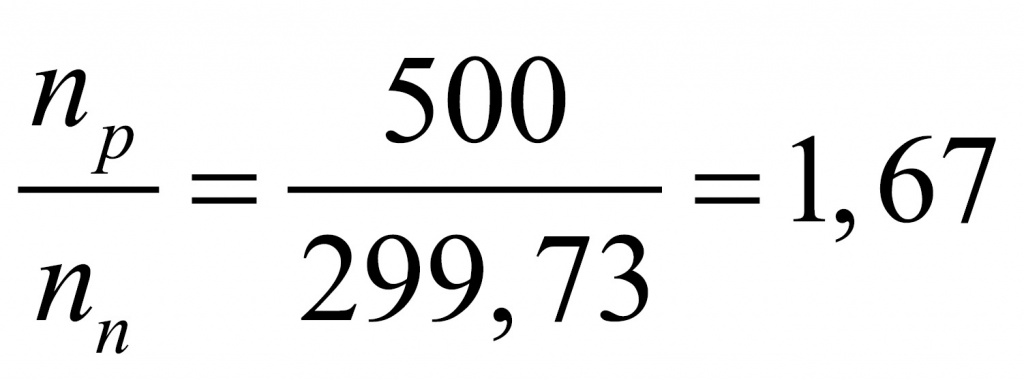
Если мы переберем водородные соединения элементов второго периода, то для метана получим, что в составе метана протонов буде 10, а нейтронов — 6.
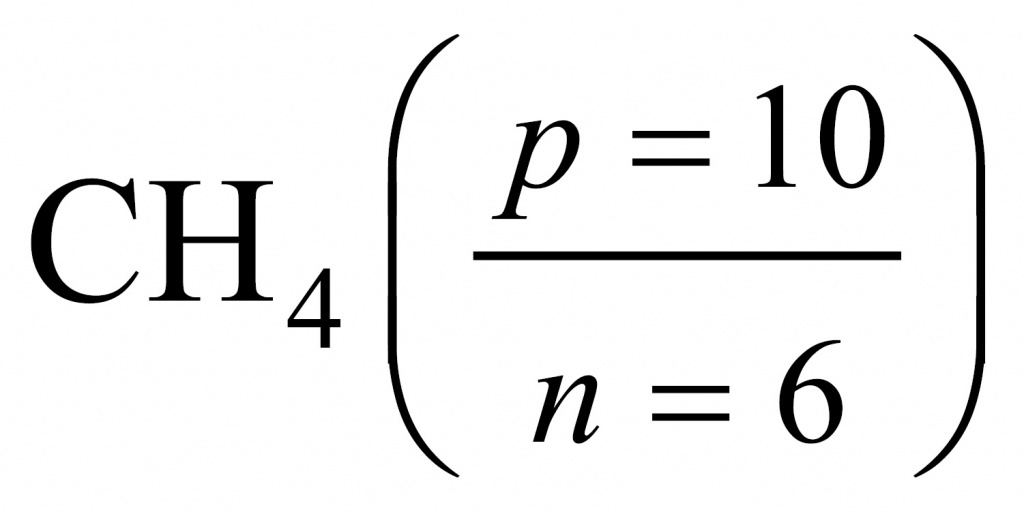
Поделив 10 на 6, получаем 1,67. Следовательно, искомым соединением был родоначальник предельных углеводородов, первый член гомологического ряда — метан.
#ADVERTISING_INSERT#






