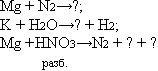Комплексная дидактическая цель:
- опираясь на ранее полученные знания учащихся, подвести их к пониманию
различий в представлениях о металлах как химических элементах и металлах как
простых веществах; - закрепить знания о физических и химических свойствах металлов, их
нахождении в природе, основных областях применения; - акцентировать внимание учащихся на возможности интеграции курсов химии,
литературы и истории; - развивать умения выделять главное, сравнивать и обобщать;
- развивать представления о причинно-следственных связях явлений,
познаваемости мира.
Девиз урока: “Единственный путь, ведущий к знанию,– это деятельность”
(Б.Шоу).
Реактивы и оборудование: цинк, магний, медь, железо, вода, соляная
кислота, раствор хлорида меди (II); спиртовка, спички, держатель, штатив с
пробирками.
В данный модуль входят четыре учебных элемента (УЭ):
УЭ-1. Постановочная часть урока;
УЭ-2. Металлы – химические элементы;
УЭ-3. Металлы – простые вещества;
УЭ-4. Резюме. Самостоятельная работа.
УЭ-1.
Постановочная часть урока.
Цели: познакомить учащихся с содержанием модуля, поставить учебные
цели и определить пути их достижения.
На доске написано название модуля – “Общие свойства металлов”.
Начинаем с актуализации знаний учащихся, постановки учебных целей (5 мин).
Знакомим учащихся с содержанием модуля по карте самоконтроля и самооценки по
данной теме и обращаем их внимание на то, что они должны знать и уметь.
Карта самоконтроля и самооценки
по теме “Общие свойства
металлов”
| Содержание | Что нужно знать | Что нужно уметь | Контрольные вопросы и задания | Источник информации |
| Положение химических элементов металлов в периодической системе. Нахождение металлов в природе. |
Положение металлов в периодической системе и особенности строения их атомов. |
Давать сравнительную характеристику металлов по положению в периодической системе. |
1. Какова распространенность металлов в природе?
2. В чем различие в строении атомов металлов и неметаллов? Приведите 3. Как изменяется восстановительная способность металлов в 4. Чем отличаются металлические кристаллические решетки от: |
|
| Металлы – простые вещества. Получение металлов в промышленности, физические свойства металлов. |
Основные физические свойства простых веществ-металлов. Способы получения, важнейшие восстановители металлов. |
Описывать физические свойства металлов и объяснять их. Называть способы получения металлов в промышленности. |
1. В виде каких соединений встречаются в природе хром, свинец? Приведите уравнения реакций получения этих металлов. 2. Чем объясняется сходство физических свойств металлов? |
|
| Металлы – простые вещества. Химические свойства металлов: взаимодействие с неметаллами, солями, кислотами. |
Важнейшие химические свойства металлов. | Составлять уравнения химических реакций металлов с неметаллами, водой, кислотами, солями. Составлять электронный баланс для окислительно-восстановительных реакций. |
1. Допишите уравнения реакций:
Объясните окислительно-восстановительные процессы. 2. При взаимодействии 3,45 г щелочного металла с водой 3.При взаимодействии 12,4 г оксида одновалентного металла с водой |
|
| Металлы – простые вещества. Применение металлов и их сплавов. |
Области применения металлов и их сплавов. | Доказать преимущества применения металлов и их сплавов в различных областях. |
После этого предлагаем вспомнить, что учащиеся уже знают о металлах,
заполняем на доске таблицу ЗХУ – “Знаем, хотим узнать” и ставим учебные цели.
Таблица ЗХУ
Затем следует “загадочная пауза”. Предлагаем учащимся загадки о металлах (3
мин).
- Он в теченье многих лет был причиной многих бед (Au).
- Был металл серебристо-белым, в соединении стал мелом (Ca).
- Красит пламя в желтый цвет, в воду кинь – его уж нет (Na).
- К восьмой группе отнесен, в честь России назван он (Ru).
- “Камнем” прозван он людьми, но попробуй-ка возьми (Li).
- Из него солдатик твой, не болеет он “чумой” (Sn).
На каждой парте лежит незаполненная схема-кластер “Общие свойства металлов”.
Совместно с учащимися заполняем ее на основании таблицы ЗХУ.
Кластер по теме “Общие свойства металлов”
УЭ-2.
Металлы – химические элементы.
Цель: сформировать понятие о металлах как химических элементах.
Учащиеся в течение 10 мин работают с частью I опорного конспекта “Химия
металлов” и делают краткие записи в тетрадях по плану.
- Положение химических элементов – металлов в периодической системе.
- Строение атомов металлов.
- Нахождение металлов в природе (использовать “Распространенность металлов
в земной коре”).
Распространенность металлов в земной коре
После этого организуем обсуждение данных вопросов и сообщаем интересную
информацию: металлы составляют 3% массы человека, например содержание кальция в
организме – 2%, калия – 0,27%, натрия – 0,1%. Роль металлов в организме человека
чрезвычайно велика.
УЭ-3.
Металлы – простые вещества.
Цели: сформировать понятие о металлах как простых веществах, повторить
и закрепить знания о физических и химических свойствах металлов, их нахождении в
природе, основных областях их применения.
На доске записаны слова: “Семь металлов создал свет по числу семи планет” – и
прикреплены карточки знаков семи металлов:
| Au Солнце |
Cu Венера |
Ag Луна |
Fe Марс |
Sn Юпитер |
Сообщаем учащимся краткую историческую справку о металлах (3 мин).
Считается, что в древности и средние века были известны только семь металлов
по числу известных тогда планет. Алхимики считали, что эти металлы рождаются в
недрах Земли под влиянием лучей планет. В настоящее время множество металлов
трудятся вокруг нас и для нас, где бы мы ни находились: дома или в школе, на
улице или в транспорте. А было время, когда человек использовал всего несколько
металлов.
Заранее подготовленные учащиеся делают краткие сообщения (по 3 мин) об
истории использования золота, меди и железа.
Примерно 70 лет назад электрическая лампочка считалась чудом. Это и впрямь
чудо, ведь при изготовлении обыкновенной лампочки используют девять металлов.
Каждый из них обладает своими свойствами. Прежде чем поговорить о свойствах
металлов, делаем “загадочную паузу”.
- Самый распространенный в земной коре металл (Al).
- Металл, обнаруженный в упавших метеоритах (Fe).
- Металл, обладающий бактерицидными свойствами (Ag).
- Металл, широко используемый в электротехнике (Cu).
В течение 7 мин учащиеся изучают самостоятельно физические свойства
металлов по учебнику и опорному конспекту “Химия металлов”.
Опорный конспект “Химия металлов”
В процессе работы они составляют схему – “паучок” по теме “Физические
свойства металлов”, зарисовывают схему металлической кристаллической решетки и
отвечают на вопросы: каков вид химической связи в металлах? Чем обусловлены
общие физические свойства металлов?
Схема – “паучок” по теме “Физические свойства металлов”
На изучение химических свойств металлов отводим 15 мин.
Учащиеся работают с учебником и опорным конспектом “Химия металлов”,
зарисовывают в тетради схему “Химические свойства простых веществ – металлов” из
этого конспекта. Обращаем их внимание на то, что металлы проявляют
восстановительные свойства. Учащиеся сравнивают восстановительные свойства
металлов, используя электрохимический ряд напряжений металлов.
После этого проводим лабораторные опыты “Химические свойства металлов” по
плану, который записан на доске.
- Окисление меди кислородом воздуха.
- Взаимодействие магния с водой.
- Взаимодействие цинка с соляной кислотой.
- Взаимодействие железа с хлоридом меди (II).
Учащиеся фиксируют наблюдения и делают выводы о химических свойствах
металлов.
Следующий этап – изучение способов получения металлов (7 мин). Учащиеся
самостоятельно работают с таблицей “Общие способы получения металлов”, а также
используют материал учебника. Они записывают в тетрадь общие способы получения
металлов и перечисляют основные восстановители металлов.
Общие способы получения металлов
| Способы получения | Конкретные металлы | Химизм процесса |
I. Использование самородных металлов
II. Гидрометаллургия(восстановление из раствора)
| Реакции замещения в водном растворе | Ag, Cu, Zn, Cd, Mo, V | CuO→ CuSO4→ Cu |
III. Пирометаллургия(восстановление при высокой температуре)
| 1. Восстановление более активными металлами (металлотермия) |
Тугоплавкие: Cr, Fe, Mn, W | МеО+Al→Ме+Al2O3+Q Cr2O3+Al→ MnO2+Mg→ |
| 2. Обжиг сульфидных руд | Zn, Fe | ZnS→ZnO→Zn |
IV. Восстановление из оксидов (при нагревании)
| 1. Водородом H2 | Pb, Cu, W, Mn, Fe | МеО+ H2→Ме+H2O-Q ZnO+ H2→ WO3 + H2 → |
| 2. Коксом C или кремнием Si | Чугун, Cu, , Zn, Sr, Pd, V, Co, Ni, Bi | МеО+ C→Ме+CO-Q V2O5 + C → SnO2 +Si→ |
| 3. Оксидом углерода (II) CO | Fe, ферросплавы | МеО+ CO→Ме+CO2-Q Fe2O3+ CO→ |
| 4.Разложением оксидов | Hg, Ag | HgO→ ? + ? – Q |
V. Электрометаллургия (восстановление электрическим током)
| 1. Электролиз расплавов солей и щелочей | Щелочные или щелочноземельные Ме | На катоде: |
| 2. Электролиз растворов солей | Mg-Ag | На катоде: |
Изучая применение металлов (7 мин), учащиеся работают с пособием Р.А.Лидина,
В.А.Молочко “Химия для абитуриентов”, с.157 (М.: Химия, 1993) и составляют
рассказ о применении металлов. На уроке заслушиваем и оцениваем два лучших
рассказа. Затем проводим “химическую паузу” (3 мин), предлагая учащимся
химические “перевертыши”. Прослушав текст “перевертыша”, учащиеся определяют
правильное звучание фразы.
- Разговор – ртуть, крик – платина. (Слово – серебро, молчание – золото.)
- Гладь металл, пока холодно. (Куй железо, пока горячо.)
- Пролежал холод, сушь и оловянные трубы. (Прошел огонь, воду и медные
трубы.) - Не та грязь, что тусклая. (Не то золото, что блестит.)
- Звери живут за неметалл. (Люди гибнут за металл.)
УЭ-4.
Резюме. Самостоятельная работа.
Цели: повторить и обобщить знания о металлах, выявить степень усвоения
учащимися материала модуля “Общие свойства металлов”.
Время работы -10 мин. Данную часть урока можно провести в форме
самостоятельной работы над вопросами и заданиями из карты самоконтроля и
самооценки по теме “Общие свойства металлов”. Работу организуем по трем
вариантам. В случае затруднений учащиеся могут обратиться к рекомендуемым
источникам информации.
После этого организуем обсуждение ответов на данные вопросы и оцениваем
лучшие ответы. Если остается время (10 мин), проводим разноуровневую работу по
четырем вариантам, если времени нет, эта работа переносится на следующий урок.
Задания для самостоятельной работы
Закончите уравнения реакций, объясните один из окислительно-восстановительных
процессов (подчеркнут).
| I. |
|
| II. |
|
| III. |
|
| IV. |
|
В конце урока учащиеся записывают домашнее задание и высказывают свое мнение
о данном уроке.
Литература:
- Журнал “Химия в школе” №2-2002, стр.37.
- Учебник. Габриелян О.С. Химия-9.
- Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия-9.
металлов. Многие металлы обладают пластичностью (например, олово, алюминий), ковкостью. Общие физические свойства: 1) Пластичность — способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду — Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света. 3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду — Ag, Cu, Al, Fe уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа». 4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути. 5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий — литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3). Металлы, имеющие r < 5 г/см3 считаются «легкими металлами». 7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Механические свойства. Прочность. Прочностью металла называют его способность сопротивляться действию внешних сил, не разрушаясь. Твердость. Твердостью называется способность тела противостоять проникновению в него другого, более твердого тела. Упругость. Упругостью металла называется его свойство востонавливать свою форму после прекращения действия внешних сил, вызывавших изменение формы(деформацию.) Вязкость. Вязкость называется способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам. Вязкость – свойство, обратное хрупкости. Пластичность. Пластичностию называется свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил. Пластичность – свойство, обратное упругости. Все металлы являются восстановителями. Для металлов главных подгрупп восстановительная активность (способность отдавать электроны) возрастает сверху вниз и справа налево. Например, Натрий и кальций вытесняют водород из воды уже при обычных условиях: Ca + 2H2O ® Ca(OH)2 + H2 ; 2Na + 2H2O ® 2NaOH + H20 . А магний при повышении температуры: Mg + H2O –t°® MgO + H2. Восстановительная способность и химическая активность элементов побочных подгрупп увеличивается снизу вверх по группе (например, серебро на воздухе окисляется, а золото нет; медь вытесняет серебро из его соли): Cu + 2AgNO3 → 2Ag ↓ + Cu(NO3)2 Cu0 -2 ē → Cu+2 1 О.О.В. Ag+ + ē → Ag0 2 В.В.О.
Высшая положительная степень окисления для металлов главных подгрупп в их соединениях равна номеру группы (например, NaCl, MgCl2, AlCl3, SnCl4), а для металлов побочных подгрупп в их кислородосодержащих соединениях также часто совпадает с номером группы (например, ZnO, TiO2, V2O5, CrO3, KMnO4). Химические свойства:
Восстановительная способность. Щелочные металлы на воздухе сразу окисляются (даже самовоспламеняются), поэтому их хранят под слоем керосина или парафина. При окислении щелочных металлов, как правило, образуются не оксиды, а пероксиды металлов: 2Na + O2 = Na2O2. Другие металлы окисляются медленно при обычной температуре или при нагревании с образованием оксидов: 4Al + 3O2 = 2Al2O3. Серебро, золото и платина не окисляются даже при нагревании. Металлы взаимодействуют при тех или иных условиях с неметаллами: Fe + S = FeS. Взаимодействие с водой. Активные щелочные и щелочно-земельные металлы с водой реагируют очень бурно с выделением водорода и образованием щелочи: 2Na + 2HOH = 2NaOH + H2
-
Виды кластеров и их свойства
Рассмотрим виды
кластеров, а также их свойства. На рис.3
представлена схема различных видов
кластеров.

Рис.3.
Схема различных видов кластеров.
1.2.1. Кластеры металлов
Молекулярные
кластеры металлов. Этот
тип кластеров достаточно хорошо изучен
в структурной и координационной химии.
На рис.4 изображены ядра молекулярных
кластеров, формирующиеся по законам
симметрии для комплексов металлов [19].

Рис. 4.
Изображения кластерных ядер молекулярных
кластеров с различной структурой: а)
простой тетраэдр; б)
10-атомный
тетраэдр; в)
октаэдр; г)
куб; д)
икосаэдр
без включения центрального атома; е)
икосаэдр,
включающий центральный атом; ж)
пентагональный
додекаэдр; з)
Ni34Sе22(РРh3)10,
включающий додекаэдр, сформированный
из ядра Ni20
[4].
В
теории координационных соединений
известно правило 18 электронов, суммарное
число электронов стабильного комплекса
с центральным ионом металла (его
валентными электронами) и электронами
лигандов должно быть равно 18. Для
стабильных кластеров металлов выполняется
правило: 9v
– e,
где v
– число вершин, e
– число ребер [9]. Для подобных кластеров
характерна структурная перестройка
при локализации и делокализации
электронов в вершинах полиэдров на
атомах металла.
В
кластерах переходного металла структурная
перестройка вызывается молекулярными
колебаниями. В результате перестройки
образуются изомеры, образуют флуктуационные
структуры, существующих определенное
время. Такое поведение кластеров
переходных металлов объясняется
нежесткостью кластерных ядер. Подобное
поведение свойственно и для биологически
– активных кластеров. Молекулярные
кластеры благородных металлов (палладий,
платина) синтезируются с плотной
упаковкой атомов. Для 12 – вершинного
многогранника (кубооктаэдр, икосаэдр,
антикубооктаэдр) число атомов определяется
по формуле [20]:
(1.1)
где
n
– число слоев вокруг центрального
атома, минимальная плотность упаковки
ядра – 13 атомов: 12 атомов первого слоя
и 1 атом – центральный. Формула дает
набор магических чисел N:
13, 55, 147, 309 … для стабильных ядер
металлических кластеров.
В
кластерах с малым числом атомов происходит
перестройка электронных уровней металла
и их объединения [21]. Свойства металлических
молекулярных кластеров определяются
тем, что образуются дискретные
энергетические уровни, одноэлектронные
переходы. Температурная зависимость
теплоемкостей таких кластеров отклоняется
от линейной зависимости. Металлические
кластеры представляют собой пример
конечной Ферми – системы и по своим
свойствам аналогичны атомным ядрам.
Металлические кластеры используются
в технике в качестве катализаторов не
только благодаря большой эффективной
площади реакции, но и их собственной
высокой реакционной способности. С
металлическими кластерами, имплантированными
в матрицу, связывают будущее нанотехнологии.
Кластеры оксидов
металлов. Кластеры
на основе оксидов металлов представляют
собой полиэдры типа МОх
(М
– металл высокой степени окисления).
такие
кластеры представляют собой упорядоченную
супрамолекулярную организацию, которые
имеют нанометровые полости, с помощью
них можно изменять супрамолекулярную
структуру. Такие нанометровые системы
можно использовать для моделирования
каталитических свойств.
Другой
тип молекулярных кластеров оксидов
металлов – это высокосимммитричные
кластеры – кеплераты,
которые имеют центральную точку, вокруг
которой слоями формируются атомы
кластера. Свойства кластеров зависят
от размеров.
Кластеры
металлов и оксидов металлов открывают
большие возможности для конструирования
нанокластеров различных функциональных
назначений: сорбенты, катализаторы,
одноэлектронные наноустройства,
наномагниты и т.п.
Кластеры щелочных
металлов и серебра. Кластеры
такого типа имеют s
– электрон в каждом атоме на внешнем
слое, они служат хорошими объектами для
изучения электронных свойств наноструктур
размером 1 – 2 нм; измеряются – энергия
ионизации кластеров, сродство к электрону,
оптическое поглощение, энергия
диссоциации. Диссоциация кластеров
происходит в возбужденном состоянии
на отдельные атомы или атомные фрагменты.
Экспериментальные исследования
объясняются двумя моделями: моделью
металлической капли и квантовой моделью
(оболочечной моделью). Оптические
свойства таких кластеров объясняются
наличием свободных электронов на основе
теории поглощения и рассеяния света с
учетом дискретности электронных уровней
кластеров, которая представлена в [8].
кластеры
переходных металлов. Для
малых металлических кластеров переходных
металлов наблюдается эффект резонанса,
который усиливает поглощение
электромагнитного излучения, объясняющееся
когерентным суммированием возбуждений
электронов и дырок.
Кластеры алюминия.
Алюминиевые
кластеры интересны как модельные атомы,
имеющие хорошую металлическую
проводимость. кластеры
этого типа характеризуются энергией
ионизации, энергией диссоциации,
поляризацией и химической активностью.
Кластеры алюминия взаимодействуют с
водородом и кислородом, причем реакционная
способность увеличивается с уменьшением
размеров.
Кластеры ртути.
Они интересны
с точки зрения перехода вещества от
диэлектрика к проводнику. С увеличением
размеров кластера происходит переход
от вандерваальсовых связей к металлическим.
Важнейшим свойством кластеров такого
типа является энергия ионизации.
Урок
по химии в 9 классе
«Металлы.
Общая характеристика»
Цель: создать условия для
обобщения и углубления знаний учащихся о металлах как простых веществах,
физических свойствах металлов, использование человеком.
Цели урока:
образовательная:
• повторить положение металлов в ПСХЭ
• раскрыть особенности строения атомов
металлов
• охарактеризовать основные физические свойства
металлов
развивающая:
• создать условия для формирования у
учащихся:
— умения работать с текстом
— умения устанавливать причинно-следственные
связи
• развивать эффективное внимание и аналитическое
мышление, познавательную активность учащихся
воспитывающая:
• показать значение металлов в жизни человека
• воспитывать внимательность
• способствовать развитию умения работать в паре
• развивать умение высказывать собственную точку
зрения
Тип урока: комбинированный (изучение нового
материала и первичное закрепление)
Формы организации познавательной деятельности: фронтальная, групповая, индивидуальная
Оборудование:
ü
учебник: Химия 9 класс О.С. Габриелян
ü
презентация
ü
рабочие листы
ü
Периодическая система химических элементов
Д.И.Менделеева
ü
Коллекция «Металлы»
Методические
рекомендации к уроку химии в 9 классе.
«Металлы.
Общая характеристика»
1.
Мотивация.
Приветствие. Проверка готовности к уроку.
Обсуждение эпиграфа к уроку:
«То, что мы знаем, — ограничено,
а то, чего мы не знаем,- бесконечно».
П.Лаплас
И я предлагаю сегодня на уроке пополнить
копилку ваших знаний. Так же сегодня мы будем работать в рабочих листах.
Подпишите их.
2. Актуализация
знаний.
На прошлых уроках мы вспоминали знания,
которые получили из курса химии в 8 классе. Давайте поиграем в змейку. Откройте
таблицу Д.И.Менделеева. Назовите химии элемент расположенный в 3 главной группе
2 периода. (Дети продолжают: кто отвечает, тот и
задает следующие координаты).
Откройте рабочие листы и выполните задание
«Вспоминалочка». Ребята выполняют задание.
Обменяйтесь тетрадями и сверьте ответы со
слайдом.
Молодцы.
3. Постановка
проблемы и поиск противоречия.
Посмотрите на следующий слайд. (К Ва Si Fe Na Al Zn Ca) Что
лишнее?
Обсуждение ответов учащихся.
Все эти разные элементы мы называем
металлами. Значит, у них должно быть, что то, общее, схожее. Таким образом, как
вы думаете, какая будет тема сегодняшнего урока? И что мы должны будем сегодня
узнать? Ответы детей.
Запишите тему и цель урока в рабочие листы.
4. Главный этап
урока – открытие новых знаний.
А что мы уже знаем про такие вещества как
металлы? Ведь в повседневной жизни мы сталкиваемся с ними постоянно. Предлагаю
вам подумать и сказать все, что нам известно про металлы. Посередине на доске записывается слово «Металлы» и учащиеся
дописывают к нему слова. Идет обсуждение.
Перед тем как приступить к изучению
металлов я предлагаю послушать сообщение об их появлении в жизни человека и
заполнить пропуски в рабочих листах. «История человечества – это история
металлов» Ученик рассказывает
заранее подготовленную историю появления металлов. Потом проверяется
правильность заполнения рабочих листов.
Где же находятся
металлы? Вместе с учителем учащиеся вспоминают положение металлов в
периодической системе химических элементов, записывают в рабочие листы названия
групп металлов (щелочные, щелочно-земельные), характерные степени окисления и
изменение свойств по группе и по периоду. Записывают строение атомов натрия,
магния и алюминия.
Металлическими называют
решётки, в узлах которых находятся атомы и ионы металла, между ними свободные
электроны.
Давайте немного отдохнем, отложим ручки,
расслабьтесь и посмотрим на слайды. Это радужная релаксация для коррекции
вашего зрения. Просмотр
слайдов.
Хорошо, а теперь продолжим.
Итак, металл – это вид атомов, способных
легко отдавать при химических реакциях электроны, входить в состав химических
соединений в виде положительно заряженных ионов, а также образовывать простые
вещества с характерными для металлов физическими свойствами.
Учащимся предлагается открыть учебник на странице 25 (§6)
прочитать его и составить кластер на тему «Физические свойства металлов».
Сначала ребята обсуждают все в парах, затем совместно с учителем заполняют
схему в рабочих листах.
Пример беседы:
Рассмотрите
образцы металлов (на столах
пластинки трех металлов – медь, алюминий и цинк)
- в каком агрегатном состоянии находятся металлы?
1. Твердые (исключение ртуть – жидкий металл при комнатной
температуре)
- найдите среди предложенных металлов медь. Считается,
что металлический цвет – это серебристо – белый или серый. Но все ли
металлы такого цвета? Назовите «цветные» металлы.
А
алюминий и цинк можно отличить по цвету? А как отличим?
Пластичность – способность изменять свою форму при ударе,
прокатываться в тонкие листы, вытягиваться в проволоку.
В
чем причина пластичности металлов? В этом нам поможет разобраться следующий
опыт: две стеклянные пластинки смачиваем водой и прижимаем друг к другу. Они
легко скользят друг по другу, но их трудно разъединить. Прослойка воды
имитирует свободные электроны, а значит причина пластичности – также особое
строение кристаллической решетки.
- самый пластичный металл?
Какие
еще свойства присущи металлам? электропроводность, теплопроводность,
металлический блеск, твердость.
Как
можно объяснить наличие общих физических свойств у такого большого числа
разнообразных простых веществ?
Электрическая проводимость металлов объясняется движением свободных
электронов. Почему при нагревании электрическая проводимость металлов
уменьшается? (стр. 30)
- в чем причина электропроводности металлов, какие
металлы самые лучшие проводники тока, что такое сверхпроводимость? – отвечают на вопросы
Чем
обусловлена теплопроводность, и как она изменяется при
нагревании? (стр30).
металлический блеск (из-за отражения света от их поверхности).
- почему не блестит медь, цинк?
Как
блеск может применяться на практике?
Высокая
отражающая способность позволяет использовать металлы при производстве зеркал,
оптических линз, кровельных изделий. Алюминий используется для создания помех в
радиолокации, для производства теплостойкой защитной одежды для пожарных.
Другие
свойства:
плотность:
- лёгкие ρ < 5 г/см3 – Li, K, Ca, Al.
- тяжёлые ρ > 5 г/см3 – Sn, Pb, Hg,
Fe, Os.
Как
это свойство применяется на практике?
Многие
лёгкие металлы используются для производства лёгких сплавов в машиностроении,
авиа – и судостроении. Снижение массы машины даёт преимущества в скорости,
дальности, высоте. Тяжёлые металлы для производства гирь, монет, решёток,
цепей, тяжёлых машин.
температура плавления:
- легкоплавкие t < 350° С – Na, Cs, K.
- тугоплавкие t > 350°С – Fe, Cr, W.
Как
это свойство применяется на практике?
Тугоплавкие
металлы используются для изготовления нитей накаливания электроламп, при
производстве жаропрочных сталей.
Твердость
Твердые
и мягкие
Ковкость, где используется?
Итак,
какими физическими свойствами обладают металлы?
5. Рефлексия.
Предлагаю
ответить на вопросы: Вопросы
выводятся на слайдах.
Итак,
мы с вами приобрели новые знания по теме Металлы. Вспомните, какая была цель
нашего урока? Достигли мы ее? Предлагает проанализировать записи в рабочих
листах и сделать вывод: что нового узнали о металлах?
Домашнее
задание: §5-6. Подготовить презентации на темы: (по выбору)
1.
Металлы нашего организма: качество и количество.
2.
Использование металлов.
Ребята, вам понравился
урок?
Тогда давайте оценим
свою работу. В своих рабочих листах дополните предложение,
высказав своё мнение об уроке:
Сегодня на уроке ….
Я узнал
Я научился
Было сложно
Было легко
Мне понравилось
Меня удивило
Моя отметка на уроке…
Наш
урок подошел к концу. Всем спасибо за работу!
1.Какие
схемы строения атомов соответствуют атомам металлов
а) 2е
1е б) 2е 8е 7е в) 2е 8е
2е г) 2е 8е 14е 2е
2.Атомы
каких металлов представлены?
3.Какая
кристаллическая решетка характерна для металлов? (на выбор несколько
кристаллических решеток), по каким признакам вы это определили.
4.
Проанализируйте рисунок и ответьте на вопрос: Почему металлы используют таким
образом?

?????
Тест «верно – неверно»
Учитель зачитывает
утверждения, ученики под каждым номером ставят «+» или «_»
1. У большинства
металлов мало валентных электронов
2. Есть металлы, у
которых больше трех валентных электронов
3. Радиус атомов
металлов меньше, чем радиус атомов неметаллов
4. Активность
металлов возрастает с ростом радиуса атома
5. Активность
металлов в периоде возрастает слева направо
6. Калий активнее,
чем натрий
7. Металлы первой
группы главной подгруппы называют щелочными
8. У металлов
наиболее ярко выражены окислительные свойства
9. Металлы
способны отдавать валентные электроны
10. Алюминий и
цинк образуют амфотерные оксиды и гидроксиды
11. В
кристаллической решетке металлов есть свободные электроны
12. Все металлы теплопроводны
и электропроводны
13. Самый
тугоплавкий металл – ртуть
14. Металл цезий
плавится от тепла руки человека
15. Все металлы
находятся только в твердом состоянии
Ученики меняются
тетрадями с соседом по парте.
Критерии
оценивания:
• нет и 1
ошибка – оценка «5»
• 2-3
ошибки – оценка «4»
• 4-5
ошибок – оценка «3»
• 6 и
более ошибок – оценка «2»
Подборка по базе: Дидактические материалы по математике для 5 класса. Мерзляк А.Г., Методические материалы 5-7 класс.docx, Учебно-методические материалы Ч. 1.doc, Справыочные материалы по спектрам.doc, Дидактические материалы _Эволюция систем органов_.docx, Автомобильные эксплуатационные материалы — вариант №9 ГОТОВО.doc, Сиз окутулуп жаткан дисциплинанын окуу материалынын маалыматтык , Методические материалы.docx, аттестационные материалы 1 класс.docx, Справочные материалы_Основы биостатистики.pdf
Термин “кластер” происходит от английского “cluster“ – рой, скопление, гроздь, груда и широко используется. В химии и физике это понятие, стало использоваться с 1964 года, когда профессор Коттон предложил называть химические соединения, в которых атомы металла образуют между собой химическую связь, кластерами.
Кластеры подразделяют в зависимости от типа объединяемых частиц:
- Атомные
- Ионные
- Молекулярные
Кластерные соединения металлов подразделяются на малые, средние, большие и гигантские. Малые кластеры обычно содержат до 12 атомов металла, средние и большие до 150, а гигантские – свыше 150, при этом их диаметр достигает 2–10 нм.
Металлические кластеры по своей природе являются неравновесными образованиями и обладают большим запасом внутренней энергии. Это означает, что кластеры – неустойчивые образования, стремящиеся к активному взаимодействию со средой, в которой они находятся. Для стабилизации кластеров их окружают лигандами.
Металлические кластеры делят на:
Кластерные соединения – соединения металлов, молекулы которых содержат окруженный лигандами остов из атомов металлов, находящихся на расстояниях, допускающих прямое взаимодействие металл-металл Характерным признаком кластерных соединений служат короткие (не более 0,35 нм) расстояния металл–металл.
Кластерные материалы – вещества, в составе которых имеются группировки из атомов металлов, находящихся на расстояниях, допускающих взаимодействие металл-металл.
Методы получения
Испарение под лазерным облучением
Лазерный луч высокой интенсивности падает на металлический стержень, вызывая испарение атомов с поверхности металла, которые затем уносятся потоком гелия через сопло. Расширение потока в вакууме приводит к его охлаждению и образованию кластеров атомов металла. Эти кластеры ионизируются УФ-облучением и попадают на масс-спектрометр, измеряющему отношение массы к заряду.
Высокочастотный индукционный нагрев
Металл разогревают в вакууме выше точки испарения высоковольтными радиочастотными катушками. Затем в систему впускают гелий, что приводит к образованию в области катушек высокотемпературной плазмы.
Атомы гелия выступают в качестве зародышей конденсации для атомов металла, и эти комплексы диффундируют к холодному коллектору, где и образуются наночастицы.
Термолиз
Наночастицы могут образоваться в результате разложения при высокой температуре твердых веществ, содержащих катионы металлов, молекулярные анионы. Такой процесс называют термолизом. Например, малые частицы Li можно получить разложением азида лития LiN3. Вещество помещают в кварцевую трубку и нагревают в вакууме до 400С в установке.
При температуре 370С азид разлагается с выделением газообразного азота, что можно определить по увеличению давления в вакуумированном пространстве. Через несколько минут давление падает до первоначального уровня, показывая, что весь азот удален. Оставшиеся атомы лития объединяются в кластеры с размером до 5 нм.
Импульсные лазерные методы
С помощью импульсного лазерного метода получают наночастицы серебра. Сущность метода состоит в воздействии лазерного луча на химический процесс восстановления металла (в частности, серебра) из смеси растворов. Образование кластеров инициируют высокочастотным лазерным лучом, а их рост заторможен концентрационными ограничениями в растворе.
Раствор нитрата серебра и восстановителя протекает через смеситель, который представляет собой диск, вращающийся в растворе. Образующиеся наночастицы серебра в горячих областях, отделяются с помощью центрифуги. Размер частиц зависит от интенсивности лазерного луча и скорости вращения диска.
Свойства металлических кластеров.
В чем отличие металлических кластеров от обычных моноядерных комплексов? Прежде всего в том, кластеры содержат несколько металлических атомов. Эти атомы образуют центральную часть кластера – металлическое ядро. Группировка металлических атомов имеет свою геометрическую структуру. Но главное состоит в том, что эти атомы существуют не обособленно друг от друга; между ними существует сильное взаимодействие, приводящее к образованию химической связи.
Кластеры, как замкнутые структурные образования из атомов одного (гомоядерные) или нескольких (гетероядерные) элементов, относятся к 0D–наноструктурам. Кластеры состоят из различного числа атомов – от единиц до десятков и сотен тысяч, поэтому занимают промежуточную область между отдельными атомами и микроскопическими образованиями и проявляют свойства, отличные от тех и других. Их физические характеристики существенно зависят от вида и числа входящих в них атомов. С уменьшением размеров кластеры теряют металлические свойства, т.е. характер химической связи в кластере зависит от его размера. Кластеры Au, состоящие менее чем из 100 атомов металлическими свойствами не обладают. Металлические свойства начинают проявляться, начиная со 150-500 атомов. В кластерах Na металлические свойства проявляются для числа атомов свыше 10-300 атомов. У кластеров Fe, состоящих из 13 атомов, проявляются неметаллические свойства, а из 35 атомов – металлические.
Установлено, что температура плавления металлов зависит от степени дробления: при уменьшении размеров частиц ниже некоторой величины она уменьшается. Так компактное золото плавится при 1336К, а у частиц радиусом меньше 50 нм она уменьшается.
Ионизационный потенциал уменьшается при увеличении размера кластера
Еще одна особенность кластеров по сравнению с макротелами состоит в том, что в зависимости от параметров и размеров кластера релаксация может как уменьшать, так и увеличивать его объем (релаксация — это изменение расстояния между атомными плоскостями вблизи поверхности по сравнению с объемными значениями). Во многих случаях с уменьшением размера кластера наблюдается сжатие решетки.
При уменьшении радиуса частиц от 2,5 до нескольких нм работа выхода падает от 4 до 2 эВ. На частицах серебра, наоборот, наблюдался рост работы выхода электрона с уменьшением их радиуса.
Применение металлических кластеров.
В конце естественно возникает вопрос имеют ли кластеры только эстетическое значение, или они играют важную роль в жизни, технике и науке: Проведенные исследования показали, что кластеры металлов проявляют каталитическую активность в различных химических реакциях (гидрирования, карбонилирования, изомеризации и др.). В настоящее время на основе кластеров разрабатывается новое поколение каталитических систем. В настоящее время на основе кластеров разрабатывается новое поколение каталитических систем. Речь идет о гетерогенизированных кластерах, о кластерах, которые специальным способом нанесены, привиты, закреплены на поверхности носителя.
В качестве носителя используют оксиды кремния, алюминия, лантана и других металлов. В зависимости от природы носителя, условий и способа закрепления того или иного кластера на поверхности представляется возможным создать активный каталитический центр, избирательно ускоряющий необходимую химическую реакцию. Следует отметить, что в гетерогенизированных каталитических системах значительно упрощается проблема отделения продукта реакции от катализатора.