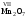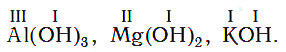Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
«Оксид» |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: «оксид углерода два»);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:

Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:



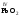
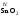
V,
VI,
VII
.являются
кислотными:
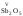


др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.
Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #
В уроке 29 «Понятие об основаниях» из курса «Химия для чайников» познакомимся с новым классом химических веществ — основаниями, а также узнаем о новом типе химических реакций — реакциях обмена.
Как вы уже знаете, при взаимодействии активных металлов и их оксидов с водой образуются основания — соединения, не принадлежащие ни к одному из известных вам до сих пор классов: оксидов, солей или кислот.
Основания как сложные вещества
Испытаем с помощью индикатора раствор, полученный в результате реакции оксида кальция CaO с водой. Для этого прибавим к нему 1—2 капли раствора метилового оранжевого. Окраска раствора изменится с оранжевой на желтую (рис. 111).
Это свидетельствует о том, что в полученном растворе присутствует не кислота, а какое-то новое вещество, изменяющее цвет индикатора. Подобно оксиду кальция, с водой реагируют и некоторые другие оксиды, например оксид натрия Na2O:
В результате взаимодействия оксидов кальция и натрия с водой образуются вещества Са(ОН)2 и NaОН. Они похожи тем, что в их состав входят атомы металлов и группы ОН, называющиеся гидроксогруппами (от греческого слова «hydor», которое означает «вода»). Такие вещества относятся к классу оснований.
Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
Валентность гидроксогруппы равна единице. Зная это, легко составить формулу любого основания: число групп ОН в формуле основания всегда равно валентности атома металла, например:
В то же время по формуле основания можно легко определить валентность атомов содержащегося в нем металла — она равна числу гидроксогрупп в формуле данного основания. Например, в формуле основания Fe(OH)2 две гидроксогруппы, следовательно, валентность атома железа в этом веществе равна II, а в основании Cr(OH)3 валентность атомов хрома равна III.
Как же называются основания? Известно, что продукты соединения воды с веществами называются гидратами. Если с водой соединяются оксиды металлов, то образуются гидраты оксидов металлов, или сокращенно гидроксиды металлов. Поэтому вещества Ca(OH)2 и NaOH, образующиеся при взаимодействии оксидов кальция и натрия с водой, называются «гидроксид кальция» и «гидроксид натрия».
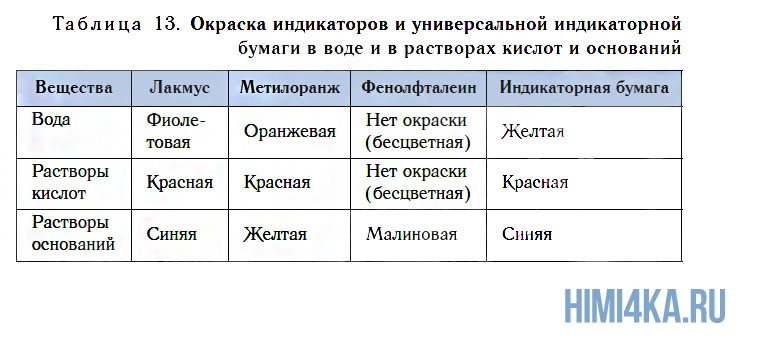
По растворимости в воде основания делятся на растворимые и нерастворимые. Растворимые в воде основания называют щелочами. К их числу относятся KOH, NaOH, Ca(OH)2, Ba(OH)2 и некоторые другие.
Обнаружить присутствие растворимых в воде оснований (щелочей) можно по изменению окраски индикаторов. Кроме известных вам лакмуса и метилоранжа, для этих целей можно использовать еще один индикатор — фенолфталеин. Он не имеет окраски в воде и в растворе кислоты, но в присутствии щелочей этот индикатор окрашивается в малиновый цвет (см. рис. 111, табл. 13).
Реакция нейтрализации
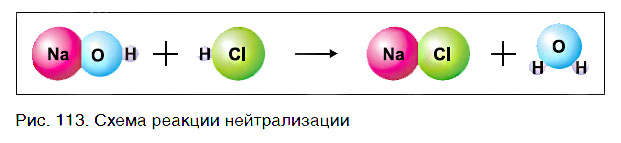
Как было показано, растворимые в воде основания — щёлочи — легко обнаружить с помощью индикаторов. Однако если к раствору гидроксида натрия NaOH прибавить фенолфталеин, а затем хлороводородную кислоту, то появившаяся вначале малиновая окраска после добавления кислоты исчезает (рис. 112).
Это свидетельствует о том, что кислота как бы уничтожила, или нейтрализовала, основание. Реакцию между кислотой и основанием, протекающую в этом случае, называют реакцией нейтрализации:
Реакция нейтрализации — это реакция между основанием и кислотой, в результате которой образуются соль и вода.
Реакция нейтрализации не относится ни к одному из известных вам до сих пор типов реакций (разложения, соединения, замещения). Это реакция нового типа — реакция обмена.
Реакциями обмена называются реакции между сложными веществами, в ходе которых они обмениваются своими составными частями.
Основание состоит из атомов металла и гидроксогрупп, а кислота — из атомов водорода и кислотного остатка. В результате реакции исходные вещества обменялись своими составными частями (рис. 113):
Краткие выводы урока:
- Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
- Реакция между основанием и кислотой, в ходе которой образуются соль и вода, называется реакцией нейтрализации.
- Реакция обмена — реакция между сложными веществами, в результате которой они обмениваются своими составными частями.
Надеюсь урок 29 «Понятие об основаниях» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Основания.
Основания.
Определение Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксильных групп (ОН)
Определение
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксильных групп (ОН).
Общая формула: Ме (ОН)n, где
n – валентность металла.
«Основания»
Классификация оснований ОСНОВАНИЯ
Классификация оснований
ОСНОВАНИЯ
Растворимые в воде Нерастворимые в воде
(ЩЕЛОЧИ)
Классификация оснований Растворимые
Классификация оснований
|
Растворимые |
Нерастворимые |
|
NaOH |
Mg(OH)2 |
|
LiOH |
Cu(OH)2 |
|
KOH |
Fe(OH)3 |
|
Ba(OH)2 |
Al(OH)3 |
|
Ca(OH)2 |
Zn(OH)2 |
|
Образуют только активные металлы |
Образуют все остальные металлы |
Составление химических формул оснований
Составление химических формул оснований
Записывается металл и гидроксильная группа (ОН).
Над металлом записывается валентность. Валентность гидроксильной группы равна I.
Количество гидроксильных групп зависит от валентности металла.
Рядом с гидроксильной группой записывается индекс, равный валентности металла.
Построение формулы и названия основания
Построение формулы и названия основания
III I
Сr(OH)3
Название: гидроксид хрома (III).
Если металл имеет постоянную валентность, то валентность в названии не указывается.
Потренируйся в составлении формул оснований
Потренируйся в составлении формул оснований
Гидроксид меди (II)
Гидроксид железа (III)
Гидроксид кальция
Гидроксид свинца (II)
Гидроксид лития
Физические свойства оснований:
Физические свойства оснований:
Растворимые основания — это твердые белые кристаллические вещества, хорошо растворимые в воде. Растворение как правило сопровождается выделением тепла.
Нерастворимые основания – это твердые вещества, нерастворимые в воде. Имеют разнообразную окраску.
Физические свойства
Физические свойства
Физические свойства оснований Ba(OH)2
Физические свойства оснований
Ba(OH)2
Co(OH)2
NaOH
Ca(OH)2
LiOH
Cu(OH)2
Из перечня: Ca(OH)2, MgO, Na2CO3,
Из перечня:
Ca(OH)2, MgO, Na2CO3, LiOH, CO2, Mg(OH)2 —
выпишите формулы оснований, назовите их и вычислите молярные массы.
Из перечня: Fe(OH)2, Ba(OH)2, NaOH,
Из перечня:
Fe(OH)2, Ba(OH)2, NaOH, H3PO4, N2O5, KOH –
выпишите формулы растворимых в воде оснований и назовите их.
Составьте формулы указанных оснований: а) гидроксида лития б) гидроксида магния в) гидроксида железа (II) г) гидроксида железа (III)
Составьте формулы указанных оснований:
а) гидроксида лития
б) гидроксида магния
в) гидроксида железа (II)
г) гидроксида железа (III)
Растворимые основани я
Растворимые основания
«Основания»
Получение растворимых оснований
Получение растворимых оснований
Химические свойства оснований
Химические свойства оснований
Действие щелочей на индикаторы
лакмус
метилоранж
фенолфталеин
Химические свойства оснований 2
Химические свойства оснований
2. Взаимодействие с кислотными оксидами:
Правило: При взаимодействии растворимых оснований с кислотными оксидами образуются соль и вода.
2KOH + SO2 = K2SO3 + H2O
(При составлении солей, напоминаю, что нужно вспомнить, какая кислота соответствует кислотному оксиду и записать ее кислотный остаток. В нашем случае SO2 соответствует Н2SO3, значит записываем кислотный остаток SO3)
Химические свойства оснований 3
Химические свойства оснований
3. Взаимодействие с кислотами:
Правило: При взаимодействии растворимых оснований с кислотами образуется соль и вода.
HCl + NaOH = NaCl + H2O
Реакция взаимодействия кислоты и основания называется реакцией нейтрализации.
Химические свойства оснований
Химические свойства оснований
Химические свойства оснований 4
Химические свойства оснований
4. Взаимодействие с растворимыми солями:
Правило: При взаимодействии растворимых солей с растворимыми основаниями образуются нерастворимые основания.
CuCl2 + 2KOH = Cu(OH)2↓+ 2KCl
Заметьте, что если в качестве продуктов реакции образуется растворимое основание, то реакция теряет смысл!
Нерастворимые основания
Нерастворимые основания
Получение нерастворимых оснований
Получение нерастворимых оснований
Правило: Чтобы получить нерастворимое основание, необходимо взять растворимую соль, содержащую необходимый металл и растворимое основание.
Итак, получим Fe(OH)3
1. Находим по таблице растворимости растворимую соль железа (III).
«Основания»
Получение нерастворимых оснований
Получение нерастворимых оснований
Это FeCl3, к нему добавляем растворимое основание NaOH:
FeCl3 + 3NaOH = Fe(OH)3 ↓+ 3NaCl
Чтобы посмотреть видео перейдите по ссылке: ….ВидеоГалиев Ильяс 10А Опыты по химииНеорганикаоснов. классы неорг. соединполуч. нераств. оснований.wmv
Химические свойства нерастворимых оснований 1
Химические свойства нерастворимых оснований
1. Взаимодействие с кислотами:
Правило: При взаимодействии нерастворимых оснований с кислотами образуется соль и вода.
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Химические свойства нерастворимых оснований 2
Химические свойства нерастворимых оснований
2. При нагревании разлагаются
Правило: При нагревании нерастворимые основания разлагаются на основной оксид и воду.
II t II
Сu(OH)2 = CuO + H2O
При составлении формулы основного оксида, не забудьте учесть валентность металла. Какова она в основании, такая же валентность металла будет и в оксиде.
Химические свойства нерастворимых оснований
Химические свойства нерастворимых оснований
Чтобы посмотреть видео перейдите по ссылке: ….ВидеоГалиев Ильяс 10А Опыты по химииНеорганикаоснов. классы неорг. соединсвойства нераст. основан..wmv
Установите соответствие
Установите соответствие
BaO P2O5 HCl
BaO P2O5 HCl
H2SO4 NaCl H2O
MgOHCl K2O
NO AgNO3 CaO Al2O3
KOH
Mg(OH)2
LiOH
Fe(OH)3
Ca(OH)2
Ba(OH)2
Al(OH)3
Выберите только основания.
Напишите уравнения реакций Гидроксида калия с:
Напишите уравнения реакций
Гидроксида калия с:
Азотной кислотой;
Оксидом фосфора (V);
Раствором нитрата меди (II) – Cu(NO3)2
Гидроксида магния:
Серной кислотой;
Соляной кислотой;
Разложите при нагревании
Напишите уравнения реакций, с помощью которых можно получить
Напишите уравнения реакций, с помощью которых можно получить
Гидроксид бария;
Гидроксид лития
Гидроксид цинка;
Гидроксид алюминия
Закончите уравнения осуществимых реакций:
Закончите уравнения осуществимых реакций:
Са + H2O =
SO3 + NaOH =
Fe + H2O =
P2O5 + Pb(OH)2 =
KOH + H3PO4 =
Be(OH)2 +H2SO4 =
AlCl3 + NaOH =
Ca(OH)2 + CO2 =
Fe(OH)3 + N2O5 =
Al(OH)3 + H2SO4 =
Ba(OH)2 + HCl =
CuSO4 + LiOH =
Ca(NO3)2 + KOH =
P2O5 + NaOH =
K + H2O =
Sn(OH)2 = … + …
Ba(OH)2 = … + …
H2SiO3 + NaOH =
Осуществите цепочки превращений:
Осуществите цепочки превращений:
Na → NaOH→Na2SO3
↓
Fe(OH)3
2. Zn→ZnO→Zn(NO3)2→Zn(OH)2→ZnO
3. Cu→CuO→CuCl2→Cu(OH)2→CuSO4→Cu(OH)2
↓
CuO