Составьте химические формулы кислот, соответствующих оксидам, формулы которых:
N
2
O
3
,
C
O
2
,
P
2
O
5
,
S
i
O
2
,
S
O
2
. Дайте названия всех веществ.
reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. §21. Вопросы и задания. Номер №3
Решение
| Оксид | Кислота |
|---|---|
|
N 2 + O 3 − оксид азота (III) |
H + N + O 2 − − азотистая кислота |
|
C + O 2 − оксид углерода (IV) |
H 2 + C + O 3 − − угольная кислота |
|
P 2 + O 5 − оксид фосфора (V) |
H 3 + P + O 4 − − фосфорная кислота |
|
S + O 2 − оксид кремния (IV) |
H 2 + S + O 3 − − кремниевая кислота |
|
S + O 2 − оксид серы (IV) |
H 2 + S + O 3 − − сернистая кислота |
-
- 0
-
Составьте формулы кислотных оксидов и соответствующих им кислот: оксид серы(4), оксид серы (6), оксид кремния(4), оксид хрома(6), оксид фосфора(3)
оксид азота(5), оксид марганца(7),оксид хлора(1), оксид брома(3)
Заранее большое спасибо
-
Комментариев (0)
-
- 0
-
-
Комментариев (0)
Кислоты бывают:
-
бескислородные: хлороводородная (соляная) HCl, сероводородная H2S
-
кислородосодержащие: азотная HNO3, серная H2SO4 и т.д.
• По числу атомов водорода: одноосновные (HNO3), двухосновные (H2SO4) трехосновные (H3PO4).
• По растворимости: растворимые, нерстворимые (см. таблицу растворимости)
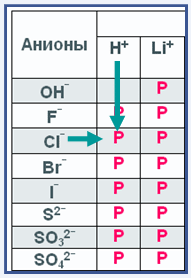
На рисунке слева представлена небольшая часть уже знакомой тебе таблицы растворимости. Под общим названием анионы расположены различные отрицательно заряженные ионы, кроме гидроксид иона ОН— все остальные – это ионы кислотных остатков.
При пересечении, например столбца иона водорода Н+ с ионом хлора Cl— мы видим ячейку в которой находится буква Р (растворяется). Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.
Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
Вопрос: Как составить формулу оксида соответствующего данной кислоте?
Пример: Для серной кислоты составим соответствующий оксид. Для этого:
1. Определим степень окисления элементов в кислоте.
H2SO4 — формула серной кислоты
Степени окисления водорода и кислорода нам известны: водорода +1, кислорода -2. Неизвестна только степень окисления у серы. Обозначим её х. Подставим все степени окисления в формулу серной кислоты.
H2+1SхO4-2 т.к. для химического соединения в сумме все степени окисления равны 0, можно составить уравнение:
+1 • 2 + х + (-2) • 4 = 0
решим его:
2 + х – 8 = 0
Х = +6
все степени окисления известны: H2+1S+6O4-2
2. Степень окисления серы в серной кислоте +6. Составим оксид соответствующий серной кислоте: S+6O3-2 или SO3.
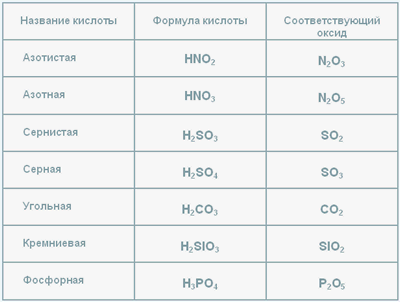
Таблица кислот и оксидов
Табл.1
В таблице представленны формулы кислот, их названия и оксиды, соответствующие данной кислоте.
* * *
.
I. Оксид серы (VI) (серный ангидрид, триокись серы, серный газ)
SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь.
1. Физические свойства
Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе «дымит», сильно поглощает влагу (хранят в запаянных сосудах).
SO3 + H2O → H2SO4
SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
2. Получение
1) 2SO2 + O2 → 2SO3 (катализатор – V2O5, при 450˚С)
2) Fe2(SO4)3 → Fe2O3 + 3SO3 (разложение при нагревании)
3. Химические свойства
Серный ангидрид — кислотный оксид. Его химическая активность достаточно велика.
1) Взаимодействие с водой
При растворении в воде дает сильную двухосновную серную кислоту:
Анимация: “Взаимодействие оксида серы (VI) с водой”
SO3 + H2O → H2SO4
2) Взаимодействие со щелочами
2NaOH + SO3 → Na2SO4 + H2O
NaOH + SO3 (избыток) → NaHSO4
3) Взаимодействие с основными оксидами
Na2O + SO3 → Na2SO4
4) SO3 — сильный окислитель
5SO3 + 2P = P2O5 + 5SO2
3SO3 + H2S = 4SO2 + H2O
2SO3 + 2KI = SO2 + J2 + K2SO4
II. Серная кислота и ее соли
Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом» (как правило это был кристаллогидрат, по консистенции напоминающий масло), очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
1. Физические свойства
Тяжелая маслянистая жидкость («купоросное масло»); r = 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Помните!
Кислоту вливать малыми порциями в воду, а не наоборот!
Видео: «Разбавление серной кислоты водой»
2. Производство серной кислоты
Макет производсва серной кислоты
1-я стадия. Печь для обжига колчедана
4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
Процесс гетерогенный:
- измельчение железного колчедана (пирита)
- метод «кипящего слоя»
- 800°С; отвод лишнего тепла
- увеличение концентрации кислорода в воздухе
2-я стадия. Контактный аппарат
После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V2O5):
2SO2 + O2 → 2SO3
3-я стадия. Поглотительная башня
nSO3 + H2SO4(конц) → (H2SO4 • nSO3) (олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
3. Химические свойства разбавленной серной кислоты
H2SO4 — сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют).
H2SO4 образует два ряда солей — средние (сульфаты) и кислые (гидросульфаты)
1) Диссоциация протекает ступенчато:
H2SO4→ H+ + HSO4— (первая ступень, образуется гидросульфат – ион)
HSO4— → H+ + SO42- (вторая ступень, образуется сульфат – ион)
H2SO4 образует два ряда солей — средние (сульфаты) и кислые (гидросульфаты)
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб) → Zn+2SO4 + H20↑
Zn0 + 2H+ → Zn2+ + H20↑
3) Взаимодействие с основными и амфотерными оксидами:
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
4) Взаимодействие с основаниями:
H2SO4 + 2NaOH → Na2SO4 + 2H2O (реакция нейтрализации)
H+ + OH— → H2O
Если кислота в избытке, то образуется кислая соль:
H2SO4 + NaOH → NaНSO4 + H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2H+ + Cu(OH)2 → Cu2+ + 2H2O
5) Обменные реакции с солями:
образование осадка
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Видео: «Качественная реакция на сульфит- и сульфат-ионы»
образование газа — как сильная нелетучая кислота серная вытесняет из солей другие менее сильные кислоты, например, угольную
MgCO3 + H2SO4 → MgSO4 + H2O + CO2↑
MgCO3 + 2H+ → Mg2+ + H2O + CO2
4. Применение серной кислоты
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавкиE513(эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (получение этанола);
- сульфирования (получение СМС и промежуточные продукты в производстве красителей);
- и др.
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Это интересно
История серной кислоты (материал взят с сайта alhimikov.net)
Вы все, наверное, знакомы с медным купоросом, кристаллогидратом сульфата меди (II). Купоросами называют кристаллогидраты двухвалентных металлов. Купоросы изучались еще с древних времен. Так, в некоторых работах конца-начала новой эры обсуждались свойства купоросов и их происхождение. Они упоминаются в трудах греческого врача Диоскорида, римского исследователя природы Плиния Старшего. Об использовании купоросов в металлургии рассказано в работах древнегреческих алхимиков Зосимы из Панополиса. Древний лекарь Ибн Сина использовал различные вещества-купоросы в медицине.
Самым первым способом получения был процесс нагревания алюмокалиевых квасцов . Сведения об этом способе содержатся в алхимической литературе XIII века. Но алхимики не знали сути процесса и состава квасцов. А целенаправленно химическим синтезом серной кислоты стали заниматься в XV веке. Алхимики обрабатывали смесь сульфида сурьмы(III) Sb2S3 и серы при нагревании с азотной кислотой.
Серную кислоту средневековые европейские алхимики называли «купоросным маслом», в последствии купоросной кислотой. Алхимики получали небольшие количества, которые использовались для проведения экспериментов. В XVII веке Иоганн Глаубер получил серную кислоту в результате горения самородной серы с калийной селитрой( нитратом калия) в присутствии паров воды. Селитра окисляла серу до оксида серы (VI, который впоследствии реагировал с парами воды, в результате чего образовывалась серная кислота. В 30-е годы XVIII века лондонский фармацевт Уорд Джошуа использовал эту реакцию для промышленного производства серной кислоты. Потребности в серной кислоте в средние века исчислялись всего несколькими десятками килограммов. Она использовалась для аптечных нужд и алхимических опытов. Небольшое количество концентрированной серной кислоты шло производство спичек, которые содержали бертолетовую соль. количество концентрированной кислоты шло для производства особых спичек, содержащих бертолетову соль. На Руси купоросная кислота появилась в семнадцатом веке.
В 1746 г. Джон Робак в английском Бирмингеме наладил производство, адаптировав этот способ для производства серной кислоты, используя освинцованные камеры, которые были прочными , дешевыми более крупными чем стеклянные контейнеры.
Джон Робак
Этот способ использовался в промышленности в течение почти двух столетий. В камерах получали кислоту с концентрацией около 65 %, впоследствии усовершенствовав сам процесс (Это сделали французский химик Гей-Люссак и английский Гловер), концентрацию довели до 78%. Однако этих концентраций для некоторых химических процессов, например, при производстве красителей не хватало.
Лишь в 1831 г. британский торговец уксусной кислотой Перегрин Филипс запатентовал экономичный процесс для производства оксида серы (VI) и концентрированной серной кислоты, который известен нам в настоящее время как контактный способ получения серной кислоты.
В 1864 году стали производить суперфосфат. В восьмидесятые годы XIX века производство серной кислоты достигло в Европе 1 млн. тонн. Основными производителями были Англия и Германия, на долю которых приходилось более 72% от мирового объема производства.
5. Применение солей серной кислоты
Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.
Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.
«Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.

Гипс СаSO4•2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
III. Тренажеры
Тренажёр №1 — Сероводород. Оксиды серы
Тренажёр №2 — Свойства разбавленной серной кислоты
IV. Задания для закрепления
№1. Осуществите превращения по схеме:
1) Zn →ZnSO4→Zn(OH)2 →ZnSO4 → BaSO4
2) S →SO2 →SO3→H2SO4 →K2SO4
№2. Закончите уравнения практически осуществимых реакций в полном и кратком ионном виде:
Na2CO3 + H2SO4→
Cu + H2SO4 (раствор) →
Al(OH)3 + H2SO4 →
MgCl2 + H2SO4 →
№3. Запишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием, гидроксидом железа (III), оксидом алюминия, нитратом бария и сульфитом калия в молекулярном, полном и кратком ионном виде.
ЦОРы
Видео: «Разбавление серной кислоты водой»
Макет производсва серной кислоты
Видео:«Качественная реакция на сульфит- и сульфат-ионы»
Оксид серы(VI)
Oксид серы((VI)) образуется при каталитическом окислении сернистого газа:
При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
Эта реакция протекает даже с парами воды. Поэтому оксид серы((VI)) дымит на воздухе.
Особенностью оксида серы((VI)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
Оксид серы((VI)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
Степень окисления серы в этом оксиде — (+6). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота
H2SO4
— важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Рис. (1). Смешивание серной кислоты с водой
Серная кислота очень гигроскопична и используется для осушки разных веществ.
Химические свойства серной кислоты зависят от её концентрации.
Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
;
- с солями, если образуется газ или нерастворимое вещество:
,
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
.
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):
Рис. (2). Обугливание сахара концентрированной серной кислотой
Серная кислота образует два ряда солей. Средние соли называются сульфатами (
Na2SO4,CaSO4
), а кислые — гидросульфатами (
NaHSO4,Ca(HSO4)2
).
Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.
Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.
Соли серной кислоты также находят применение. Медный купорос
CuSO4⋅5H2O
используется для борьбы с заболеваниями растений, гипс
CaSO4⋅2H2O
применяется в строительстве, сульфат бария
BaSO4
— в медицине.
Источники:
Рис. 1. Смешивание серной кислоты с водой © ЯКласс
Рис. 2. Обугливание сахара концентрированной серной кислотой © ЯКласс