Графические формулы оксидов
Графическая
формула – это схематическое изображение
пространственного расположения атомов
в молекуле. Она показывает порядок
соединения атомов и число связей между
ними .
Для
того, чтобы изобразить графическую
формулу оксида , необходимо :
-
Правильно
составить эмпирическую формулу; -
Соединить
атомы, учитывая, что атом кислорода
двухвалентен и каждая валентность,
указывая единицу связи, условно
изображается черточкой . -
Если
в молекулу кислорода входит не один, а
несколько атомов элемента, то нужно
соединить их в молекулу через атом
кислорода.
|
Оксид |
|
Na |
|
Оксид |
|
O |
|
Оксидазота |
|
O |
|
|
|
O |
Свойства оксидов
Общими
химическими свойствами основных,
кислотных и амфотерных оксидов являются
кислотно-основные взаимодействия:
Основные оксиды
Физические
свойства основных оксидов:
|
Оксиды |
Цвет |
Агрегатное |
|
MgO, |
Белый |
тв. |
|
CuO, |
Черный |
тв. |
|
Cu2O |
Красный |
тв. |
|
Ag2O |
Темно-Коричневый |
тв. |
|
Cs2O, |
Оранжевый |
тв. |
|
MnO |
Серо-Зеленый |
тв. |
|
NiO, |
Желтый |
тв. |
|
Li2O, |
Бесцветный |
тв. |
Химические свойства основных оксидов:
-
Взаимодействие с водой
Из
основных оксидов с водой взаимодействуют
только оксиды щелочных и щелочноземельных
металлов:
|
Li2O |
-
Взаимодействие с кислотными оксидами
|
MgO |
K2O |
3. Взаимодействие с кислотами
а)
Основные оксиды взаимодействуют с
кислотами с образованием соли и воды:
|
Na2O |
-
При
взаимодействии основного оксида
(избыток) (II,
III
-валентного металла) с кислотой
образуется основная
соль и вода:
|
BaO |
|
MgO |
-
При
взаимодействии основного оксида с
кислотой (избыток) (II,
III
— основная) образуется кислая соль и
вода:
|
Nа2О+ |
|
CaO |
б)
Двойные оксиды образуют две соли:
|
Fe3O4 |
|
(Fe |
4.
Оксиды щелочных и щелочноземельных
металлов при сплавлении взаимодействуют
с амфотерными гидроксидами, образуя
соли
|
Na2О |
|
K2О |
|
CaO |
5.
Оксиды с солями реагируют редко и
только при сплавлении
|
Fе2Оз |
6.
При высокой температуре более активные
металлы вытесняют (восстанавливают)
менее активные из их оксидов. На этом
основан один из способов
получения металлов, называемый
металлотермией. В качестве
металлов-восстановителей
обычно используют Аl
(алюминотермия), Мg(магнийтермия),
редко Са, К, Мn
и др. металлы
|
3(Mn |
|
UO2 |
7.
При высокой температуре реакции оксидов
с неметалламивозможны, в результате
которых происходит восстановление
металлов
|
FeO |
-
В
результате взаимодействия оксидов
щелочноземельных металлов с
углем
образуются карбиды металлов и оксид
углерода(II):
|
CaO |
-
В
результате взаимодействия оксидов
щелочноземельных металлов с водородом
(при высокой температуре) образуются
гидриды металлов и вода:
|
Са |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Загрузить PDF
Загрузить PDF
Если вам задали домашнее задание, в котором требуется найти эмпирическую формулу соединения, но вы не знаете, с чего начать, не бойтесь! wikiHow придет вам на помощь! Сначала прочтите базовые знания, которые необходимы вам для нахождения эмпирической формулы, а затем просмотрите пример во второй части статьи.
-
1
Узнайте, что такое эмпирическая формула. В химии ЭФ – это самый простой способ описания соединения – по сути это список элементов, образующих соединение с учетом их процентного содержания. Нужно обратить внимание, что эта простейшая формула не описывает порядок атомов в соединении, она просто указывает, из каких элементов оно состоит.[1]
For example:- Соединение, состоящее из 40,92% углерода; 4,58% водорода и 54,5% кислорода, будет иметь эмпирическую формулу C3H4O3 (пример того, как найти ЭФ этого соединения будет рассмотрен во второй части).
-
2
Усвойте термин ‘процентный состав’. ‘Процентным составом’ называется процентное содержание каждого отдельного атома во всем рассматриваемом соединении. Чтобы найти эмпирическую формулу соединения, необходимо знать процентный состав соединения. Если вы находите эмпирическую формулу в качестве домашнего задания, то проценты, скорее всего, будут даны.
- Чтобы найти процентный состав химического соединения в лаборатории, его подвергают некоторым физическим экспериментам, а затем – количественному анализу. Если вы не находитесь в лаборатории, вам не нужно делать эти эксперименты.
-
3
Имейте в виду, что вам придется иметь дело с грамм-атомами. Грамм-атом – это определенное количество вещества, масса которого равна его атомной массе. Чтобы найти грамм-атом, нужно воспользоваться следующим уравнением: Процентное содержание элемента в соединении делится на атомную массу элемента.[2]
- Допустим, к примеру, что у нас есть соединение, содержащее 40,92% углерода. Атомная масса углерода равна 12, поэтому наше уравнение будет иметь 40,92 / 12 = 3,41.
-
4
Знайте, как находить атомное соотношение. Работая с соединением, у вас будет получаться больше одного грамм-атома. После нахождения всех грамм-атомов вашего соединения, посмотрите на них. Для того, чтобы найти атомное соотношение, вам нужно будет выбрать наименьшее значение грамм-атома, которые вы вычислили. Затем нужно будет разделить все грамм-атомы на наименьший грамм-атом. Например:
- Допустим вы работаете с соединением, содержащим три грамм-атома: 1,5; 2 и 2,5. Наименьшее из этих чисел – 1,5. Поэтому, чтобы найти соотношение атомов, вы должны разделить все числа на 1,5 и поставить между ними знак отношения :.
- 1,5 / 1,5 = 1. 2 / 1,5 = 1,33. 2,5 / 1,5 = 1,66. Следовательно, соотношение атомов равно 1 : 1,33 : 1,66.
-
5
Разберитесь, как переводить значения отношений атомов в целые числа. Записывая эмпирическую формулу, вы должны использовать целые числа. Это значит, что вы не можете использовать числа вроде 1,33. После того, как вы найдете отношение атомов, вам нужно перевести дробные числа (вроде 1,33) в целые (например, 3). Для этого вам нужно найти целое число, умножив на которое каждое число атомного соотношения, вы получите целые числа. Например:
- Попробуйте 2. Умножьте числа атомного соотношения (1, 1,33 и 1,66) на 2. Вы получите 2, 2,66 и 3,32. Это не целые числа, поэтому 2 не подходит.
- Попробуйте 3. Если вы умножите 1, 1,33 и 1,66 на 3, у вас получится 3, 4 и 5 соответственно. Следовательно, атомное соотношение целых чисел имеет вид 3 : 4 : 5.
-
6
Разберитесь, что значат эти целые числа для эмпирической формулы. Соотношение целых чисел, которое мы только что нашли, подходит для эмпирической формулы. Эти три числа являются маленькими числами, которые записываются под каждой буквой, представляющей отдельный элемент химического соединения. Например, наша рассчитанная эмпирическая формула будет иметь вид:
- X3Y4Z5
Реклама
-
1
Определите процентный состав соединения. Если вы пытаетесь найти эмпирическую формулу для домашней работы, то вам, вероятнее всего, будет дан процентный состав, вам просто нужно знать, как он выглядит. Например:
- Допустим, в задании просят рассмотреть образец витамина C. В него входят 40,92% углерода, 4,58% водорода 54,5% кислорода — это и есть процентный состав.
- 40,92% витамина C состоит из углерода, а остальная часть состоит из 4,58% водорода и 54,5% кислорода.
-
2
Найдите значения грамм-атомов в соединении. Как было сказано в части 1, уравнение для нахождения количества грамм-атомов имеет вид: Процентное содержание элемента в соединении (%) деленное на атомную массу элемента. В нашем примере есть углерод, атомная масса которого 12, водород, с атомной массой 1, и кислород, с атомной массой 16.
- Количество грамм-атомов углерода = 40,92 / 12 = 3,41
- Количество грамм-атомов водорода = 04,58 / 01 = 4,58
- Количество грамм-атомов кислорода = 54,50 / 16 = 3,41
-
3
Выясните атомное соотношение. Найдите наименьший грамм-атом из всех вычисленных. В нашем примере – это 3,41 (углерод или кислород – у них одинаковое значение). Затем вы должны разделить все значения грамм-атомов на это число. Соотношение будет выглядеть следующим образом: значение для углерода : значение для водорода : значение для кислорода.
- Углерод: 3,41 / 3,41 = 1
- Водород: 4,58 / 3,41 = 1,34
- Кислород: 3,41 / 3,41 = 1
- Атомное соотношение – 1 : 1.34 : 1.
-
4
Переведите соотношение в целые числа. Если ваше атомное соотношение состоит из целых чисел, то вы можете пропустить этот шаг. В нашем примере, однако, нам нужно превратить 1,34 в целое число. Наименьшее число, которое можно умножить числа в атомном соотношении – это 3.
- 1 x 3 = 3 (подходит, так как 3 – целое число).
- 1,34 x 3 = 4 (4 – также целое число).
- 1 x 3 = 3 (и снова, 3 – это целое число).
- Следовательно, полученное соотношение целых чисел имеет вид углерод (C) : водород (H) : кислород (O) = 3 : 4 : 3
-
5
Запишите эмпирическую формулу. Для этого, все что вам нужно – это записать букву каждого компонента, в нашем случае – C для углерода, H для водорода и O для кислорода, с сопутствующими им числами в виде нижних индексов. В нашем примере эмпирическая формула имеет вид:
- C3H4O3
Реклама
Советы
- Молекулярная формула отражает общее количество присутствующих атомов, тогда как эмпирическая отражает наименьшее соотношение между отдельными атомами.
- Если вам нужно найти процентное соотношение в лаборатории, то вы должны будете провести над образцом соединения спектрометрические эксперименты.
Реклама
Об этой статье
Эту страницу просматривали 22 057 раз.
Была ли эта статья полезной?
.
Порядок составления формул оксидов
Формулы
оксидов можно составлять по правилу креста:

Рис.1

формул первым ставят
элемент степень окисления. которого со знаком +, а
вторым элемент с отрицательной степенью окисления. Для оксидов это
всегда кислород.
Далее
необходимо:
1. расставить степени
окисления
(с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2
(минус два).
2. Для того чтобы
правильно
определить степень окисления. второго элемента необходимо познакомится
с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
|
Элемент |
Возможные степени окисления |
| N (азот) | -3, 0, +1, +2, +3, +4,+5. |
| P (фосфор) | -3, 0, +3, +5. |
| S (сера) | -2, 0, +4, +6. |
| C (углерод) | -4, 0, +2, +4. |
Степень окисления «0» —
ноль имеют:
1. Простые вещества: Н2,
Са, О2 …
2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0)
Степень окисления со знаком +
характерна для элементов которые отдают свои электроны в соединениях
другим атомам или от которых оттянуты общие электронные пары, т.е.атомы
менее электроотрицательных элементов. например металлы
всегда имеют положительную степени окисления.
Подсказка: Узнать степени окисления для металлов
можно в таблице «растворимости…«.
В ней представлены заряды ионов металлов они обычно совпадают со
степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее
электроотрицательный, чем сам кислород см. таблицу
электроотрицательности.
рис.2

окисления.
элементов в бинарных соединениях равны по модулю, то индексы в формуле
не ставятся: Сa+2О-2.
Составим формулу
оксида натрия:
По
таблице растворимости заряд иона натрия +,
соответственно степень окисления натрия имеет значение +1 (Na+1),
с.о. кислорода в оксидах всегда -2.
Натрий
имеет положительный заряд, значит, его ставим первым, а вторым
ставим кислород и по правилу креста получим: Na2+1O-2
или Na2O.
Правило
наименьшего общего кратного
это способ наиболее универсальный для составления формул. Как им
пользоваться рассмотрим на примере.
Составить формулу
оксида серы (VI).
1.
У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а
первым элементом будет сера ее с.о. указана в названии оксида VI, т. е
+6. S+6O-2.
2.
Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
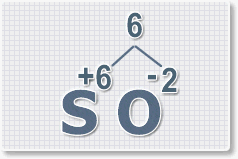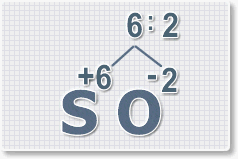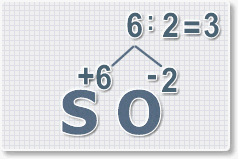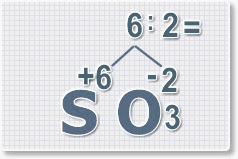
3.
Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
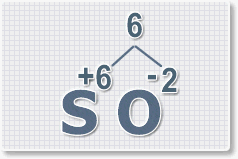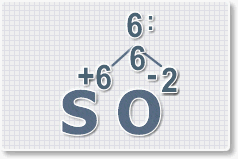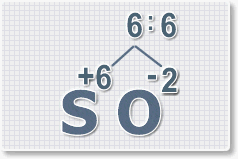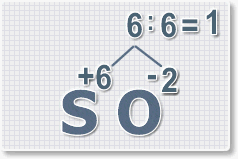
6 : 6 = 1 это индекс для серы.
Индексы со значением 1 в формулах не ставятся.
Рис.3
6 : 2 = 3
это индекс для кислорода
Рис.4
В результате получим
формулу оксида серы (VI):
* * *








 N
N