Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора KOH. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько л газа (н.у.) выделилось при этом на катоде?
Решение:
KOH ↔ K+ + OH–
H2O ↔ H + + OH–
|
На катоде: |
На аноде: |
|||
|
K++ ê = К0 |
Е(K+/К0) = -2,924 В |
4OH– – 4ê =О2 +2 H2O |
||
|
2 H + +2 ê = Н2 |
Е(Н+/Н0) = 0,00 В |
Поэтому на катоде:
2 H + +2 ê = Н2
Суммарно:
2H2O ↔ 2 Н2 + О2
|
m = |
Э*I*t |
→ I = |
m * F |
= |
6,4 г* 96500 А*с |
=17,08 А |
|
F |
Э * t |
8 г * 4520 с |
По закону Фарадея:
t = 1 ч 15 мин 20 с = 3600 + 900 +20 = 4520 с
Эквивалентный объем 11,2 л
V = (Э V * I*t)/ F
Объем водорода на катоде:
V (Н2) = (11,2 л *17,08 А * 4520 с)/ 96500 А*с = 8,96 л
Правила составления окислительно-восстановительных реакций
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H2 0 + 2OH – .
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F – ), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl – – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH – и H + не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H2), а на аноде протекают только процессы окисления.
4OH – – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO – – 2e → R-R + 2CO2.
Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na + + Cl –
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2Cl – – 2e → Cl2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl – + 2H2O → H2 0 + 2Na + + 2OH – + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H2 0 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na + + SO4 2–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H2 0 + 2OH –
А: 2H2O – 4e → O2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H2 0 + 4OH –
А: 2H2O – 4e → O2 0 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H2 0 + 4OH – + 4H + + O2 0 .
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H2 0 + 4H2O + O2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H2 0 + O2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu 2+ + 2Cl –
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu 2+ + 2e → Cu 0
A: 2Cl – – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu 0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu 2+ + SO4 2–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu 2+ + 2e → Cu 0
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO4 2– 1:1.
К: 2Cu 2+ + 4e → 2Cu 0
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO4 2– + 2H2O → 2Cu 0 + O2 + 4H + + 2SO4 2– .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu 0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni 2+ + 2Cl –
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: 2Cl – – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 4Cl – – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl – + 2H2O → Ni 0 + H2 0 + 2OH – + Ni 2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni 0 + H2 0 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni 2+ + SO4 2–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO4 2– + 2H2O + 2H2O → Ni 0 + Ni 2+ + 2OH – + H2 0 + O2 0 + 2SO4 2– + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni 0 + Ni(OH)2 + H2 0 + O2 0 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH – с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO4 2– + 2H2O + 2H2O → Ni 0 + 2OH – + H2 0 + O2 0 + SO4 2– + 4H + .
Ni 2+ + SO4 2– + 4H2O → Ni 0 + H2 0 + O2 0 + SO4 2– + 2H + + 2H2O.
NiSO4 + 2H2O → Ni 0 + H2 0 + O2 0 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO – + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2CH3COO – – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH3COO – + 2H2O → 2Na + + 2OH – + H2 0 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H2 0 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H + + SO4 2–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H + +2e → H2
A: 2H2O – 4e → O2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H + +4e → 2H2
A: 2H2O – 4e → O2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H2O → 2H2 + O2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH –
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 4OH – – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na + (в растворе)
4H2O + 4e → 2H2 0 + 4OH –
А: 4OH – – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH – → 2H2 0 + 4OH – + O2 0 + 2H2O
Сокращая 2H2O и ионы OH – , получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
По таблице 11.1 находим значение стандартных электродных потенциалов железа и цинка:


Так как 
2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде (H2SO4)
Составляем схему коррозионного ГЭ:
А (-) Zn │ H + │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На К(+) 2H + + 2ē = H2 1
Zn + 2H + = Zn 2+ + H2 — суммарное ионно-молекулярное уравнение процесса коррозии;
Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода (HCl+O2).
Составляем схему коррозионного ГЭ:
А (-) Zn │ HCl + O2 │ Fe (+) K
А (-) Zn │ H + + O2 │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На A (-) Zn – 2ē = Zn 2+ 2

2Zn + 4H + + O2 = 2Zn 2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии
2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии.
Во всех случаях коррозионному разрушению будет подвергаться более активный металл – цинк.
УРОВЕНЬ В
1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 1·10 -3 М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.

|
РЕШЕНИЕ: Для составления схемы ГЭ необхо-димо знать величины электродных потенциалов металлов – цинка и хрома. По таблице 11.1 определяем стан-дартные электродные потенциалы металлов: |
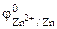
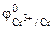
Хлорид цинка диссоциирует по уравнению:

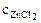

α = 1 (ZnCl2 – сильный электролит), 

Хлорид хрома (III) диссоциирует по уравнению:
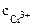
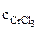
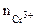
α = 1 (CrCl3 – сильный электролит), 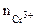
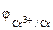
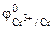
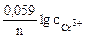

Так как 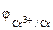
Составляем уравнения электродных процессов и суммарной токообразующей реакции:


На A(-)Cr – 3ē = Cr 3+ 2
На К(+)Zn 2+ + 2ē = Zn 3
2Cr + 3Zn 2+ = 2Cr 3+ + 3Zn — суммарное ионно-молекулярное уравнение токообразующей реакции
2Cr + 3ZnCl2 = 2CrCl3 + 3Zn — суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
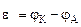


2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni 2+ = Fe 2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆fG 0 (298К, Me n + ) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
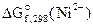



На К(+)Ni 2+ + 2ē = Ni 1 — восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель.
Составляем схему ГЭ:
А(-) Fe │ Fe 2+ ║ Ni 2+ │ Ni(+)K
Рассчитываем стандартное напряжение ГЭ:
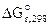
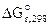

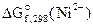
= -84,94-(-64,4) = -20,54 кДж,
ε 0 =
z = 2, F = 96500 Кл/моль.
Рассчитываем константу равновесия токообразующей реакции (Кc).
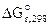
lgKс =
Ответ: ε 0 = 0,106В, Kс = 3981.
3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см 2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см 3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3,7∙10 -3 г. Плотность железа равна 7,9 г/см3 .
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:

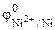
Так как 
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A Fe – 2ē = Fe 2+

Fe + 2H + = Fe 2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии.

Дано: τ = 40 мин V(газа) = 0,5 см 3 S = 20 см 2 KV -? Km — ? |
Рассчитываем объемный показатель коррозии KV по формуле: KV =  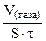 , см 3 /м 2 ∙час. При расчете KV принимаем: S – [м 2 ], τ — [час], V(газа) – [см 3 ]. , см 3 /м 2 ∙час. При расчете KV принимаем: S – [м 2 ], τ — [час], V(газа) – [см 3 ]. |
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, V(газа) = 
Тогда, KV = 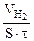
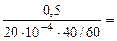
10 -4 – коэффициент пересчета, см 2 в м 2 .
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 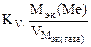
В процессе коррозии разрушению подвергается железо и выделяется водород.
Мэк(Ме) = Мэк(Fe) = 
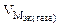

Km = 
Ответ: KV = 375 см 3 /м 2 ∙час, Km = 0,94 г/м 2 ∙час.
При расчете Km принимаем: 
Тогда: Km = 


Рассчитываем глубинный показатель коррозии по формуле:
П = 

Ответ: Km = 0,925 г/м 2 ∙час, П = 1,03 мм/год.
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Таблица 11.1. Процессы протекающие на катоде при электролизе водных растворов
 В В |
Катио-ны в вод- ном рас- творе | Зоны | Процессы на катоде |
| -3,02 -2,99 -2,93 -2,92 -2,90 -2,89 -2,87 -2,71 -2,34 -1,67 | Li + , Rb + , Cs + K + , Ba 2+ , Sr 2+ , Ca 2+ , Na + , Mg 2+ , Al 3+ | I | Катионы этих металлов на катоде не восстанавли-ваются, а концентри-руются в околокатодном пространстве (католите). На катоде восстанавливаются только молекулы воды: 2Н2О + 2ē = 2ОН — + Н2 |
| -1,05 -0,76 -0,74 -0,44 -0,40 -0,28 -0,26 -0,14 -0,13 | Mn 2+ , Zn 2+ , Cr 3+ , Fe 2+ , Cd 2+ , Co 2+ , Ni 2+ , Sn 2+ , Pb 2+ | II | 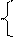 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 |
| 0,00 | Н + | При электролизе кислоты 2Н + + 2ē = Н2 | |
| +0,20 +0,23 +0,34 +0,80 +0,83 +0,85 +1,20 | Sb 3+ , Bi 3+ , Cu 2+ , Ag + , Pd 2+ , Hg 2+ , Pt 2+ | III | Восстанавливаются только ионы этих металлов Ме n + + nē = Me |
Таблица 11.2. Последовательность окисления анионов на инертном аноде в водном растворе.
Примечание. Если анод изготовлен из металлов II или III зоны (растворимый анод), то при электролизе протекает только процесс его растворения Мe 0 – nē = Me n +
УРОВЕНЬ А
1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов (анод инертный): а) хлорида меди (II), б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
|
Дано: а)CuCl2, б) NaОН. Анод инертный 1. Схема электролиза-? 2. Продукты электролиза-? |
РЕШЕНИЕ а) CuCl2 = Cu 2+ + 2Cl — , Схему электролиза составляем в соответствии с таблицами 11.1 и 11.2: K(-) A(+) инертный Cu 2+ + 2ē = Cu 2Cl — — 2ē = Cl2 H2O H2O |
На катоде выделяется Cu, на аноде выделяется Cl2.
б) NaОН = Na + + ОН —
Na + 4ОН 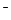
На катоде выделяется Н2, на аноде выделяется О2.
2.Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II) , если: а) анод инертный, б) анод никелевый. Какие продукты выделяются на катоде и аноде?

Дано: NiSO4 а) анод инертный б) анод никелевый 1. Схема электролиза-? 2. Продукты электролиза-? |
РЕШЕНИЕ а) анод – инертный NiSO4 = Ni 2+ +  Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: |
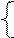
На катоде выделяется Ni и H2 , на аноде выделяется О2.
б) анод – никелевый:
NiSO4 = Ni 2+ +
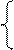

2H2O+2ē = H2+2OH — Ni — 2ē = Ni 2+
На катоде выделяется Ni и H2, на аноде растворяется Ni.
3.При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить какое вещество и в каком количестве выделилось на катоде? Анод инертный.
В соответствии со схемой электролиза:
nэк (О2)(анод) = nэк (Н2)(катод) или 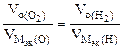


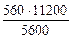
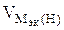
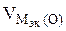
На катоде выделилось 1120 см 3 водорода.
Ответ: 1120 см 3 водорода.
б) AgNO3 = Ag + +
Ag + + ē = Ag
На катоде выделяется Ag, на аноде выделяется О2.
По закону эквивалентов: nэк(Ag)(катод) = nэк(О2)(анод) или 
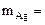


где
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
УРОВЕНЬ В
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.


где 
F = 96500 Кл/моль, если τ – cек,
F = 26,8 А∙ч/моль, если τ – час.
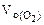

где 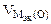

Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:

откуда: 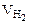

Объем кислорода при заданных условиях:

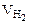
Ответ: 3,73 л водорода, 1,865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см 2 , необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0,15 мм. Плотность меди – 8,9 г/см 3 .
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна:
mCu(факт) = 
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S∙h∙ρ (г), где S – см 2 , h – см, ρ – г/см 3 .
S∙h∙ρCu = 
откуда
τ = 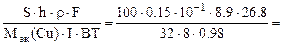
где Mэк(Cu) = 
10 -1 – коэффициент пересчета мм в см.
3.Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см 3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
Молярная концентрация эквивалента раствора AgNO3:

nэк(Ag) = 
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току.
mAg = 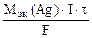

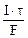
Молярная концентрация эквивалента раствора AgNO3:


где τ – c, F – 96500 Кл/моль, Vр-ра – л.
60 – коэффициент пересчета мин. в сек.
10 -3 – коэффициент пересчета см 3 в л.
Ответ: 
Электролиз
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
http://lektsii.org/9-43917.html
Составление электронных уравнений процессов, происходящих на электродах при электролизе солей
Задание 271.
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора AgNO3. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4 г. Определите расход электричества при этом. Ответ: 4830 Кл.
Решение:
Процессы, происходящие на угольных электродах при электролизе нитрата серебра:
Стандартный электродный потенциал системы Ag+ + = Ag0 (+0,80 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае на катоде будет происходить электрохимическое восстановление меди Ag+:
Ag+ + 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 2
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал, характеризующий систему из кислородной кислоты. Ионы NO3—, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Расход электричества, необходимый для проведения электролиза находим из уравнения Фарадея, имея в виду, что МЭ(Ag) = 107,868 г/моль, m(Ag) = 5,4 г; Q = I . t, получим:
m(B) = МЭ(B) . I . t/F
Q = I . t = m(B) . F/ МЭ(B). = 5,4 . 96500/107,868 = 4830 Кл;
Здесь m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: Q = 4830 Кл.
Задание 272.
Электролиз раствора СuSO4 проводили в течение 15 мин при силе тока 2,5 А. Выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анодов. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Ответ: 97,3%.
Решение:
а) Электролиз медного купороса на угольных электродах:
Стандартный электродный потенциал системы Cu2+ + 2 = Cu0 (+0,34 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае при электролизе соли на угольных электродах, на катоде будет происходить электрохимическое восстановление меди Cu2+:
Cu2+ + 2 = Cu0
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 = О2↑ + 4Н+,
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO42- — 2 = 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
б) Электролиз медного купороса в случае медного анода:
При электролизе медного купороса на медном аноде на катоде будет электрохимическое восстановление меди Cu2+. На аноде будет происходить электрохимическое окисление меди, приводящее к выделению в анодное пространство ионов Cu2+, поскольку отвечающий этой системе стандартный электродный потенциал (+0,34 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О — 4 = О2↑ + 4Н+
т. е. в данном случае при электролизе будет происходить растворение медного анода и отложение меди на катоде. Электрохимические процессы при данном типе электролиза:
Катод: Cu2+ + 2 = Cu0;
Анод: Cu0 — 2 = Cu2+
в) Вычисление выхода меди по току.
Массу теоретического выхода меди вычислим из уравнения Фарадея, имея в виду, что 15 мин = 900 с и МЭ(Cu) = 31,77 г/моль, I = 2,5 A, получим:
m(Cu) = МЭ(В) . I . t/F = 31,77 . 2,5 . 900/96500 = 0,74 г.
Здесь m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Выход по току (отношение массы выделившегося вещества к теоретически возможной) равен:
m% = (0.72 . 100)/0,74 = 97,3%
Ответ: m% = 97,3%.
Задание 273.
Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплавов и водных растворов NaCl и КОН. Сколько литров (н.у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30 мин при силе тока 0,5 А? Ответ: 0,052 л.
Решение:
а) При электролизе расплава соли NaCl происходит диссоциация: NaCl ⇔ Na+ + Cl—. Ионы натрия движутся к катоду, где окисляются до металлического натрия:
Na+ + = Na0
Ионы хлора движутся к аноду, где восстанавливаются до газообразного хлора:
2Сl— — 2 = Cl20
Таким образом, при электролизе расплава NaCl на катоде выделяется металлический натрий, а на аноде – газообразный хлор.
При электролизе раствора соли хлорида натрия в электрохимических процессах кроме ионов натрия и хлора участвует и вода. Стандартный электродный потенциал системы Na+ + = Na0 (-2,71 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
2Н2О + 2 = Н2↑ + 2ОН—
На аноде будет происходить электрохимическое окисление ионов Cl-, приводящее к выделению хлора:
2Сl— — 2 = Сl20
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему
2Н2О — 4 = О2↑ + 4Н+
б) КОН — сильный электролит, который диссоциирует по схеме:
КОН ⇔ К+ + ОН—
При электролизе расплава КОН ионы калия движутся к катоду, где окисляются до свободного калия:
К+ + = К0
Гидроксид-ионы движутся к аноду, где восстанавливаются с образованием газообразного кислорода и воды:
4OH— — 4 = O2↑ + 2H2O
Таким образом, при электролизе расплава КОН продуктами электролиза являются металлический калий (у катода) и кислород и вода (у анода).
При электролизе раствора КОН в электрохимических процессах кроме ионов калия и гидроксид-ионов участвует и вода. Стандартный электродный потенциал системы К+ + = К0 (-2,92 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы К+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство), образуется гидроксид калия:
2Н2О + 2 = Н2↑ + 2ОН—
На аноде будет происходить электрохимическое окисление ионов ОН-, приводящее к выделению кислорода:
4ОН— — 4 = О2↑ + 2Н2О,
поскольку отвечающий этой системе стандартный электродный потенциал (+0,54 В) значительно ниже, чем стандартный электродный потенциал (+1,23 В), характеризующий систему 2Н2О — 4 = О2↑ + 4Н+.
Таким образом, продуктами электролиза раствора КОН являются газообразные водород и кислород, а в растворе – гидроксид калия КОН.
в) Объём выделившегося газа на аноде находим из уравнения Фарадея, которое представим в следующем виде:
V = VЭ . I. t/F
Здесь V – объём выделившегося газа, л; m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; I – сила тока равна 0,5 А; t – время равно 1800 с; F – число Фарадея, 96500 Кл/моль.
Поскольку при нормальных условиях эквивалентный объём кислорода равен 5,6 л/моль, получим:
V(О2) = (5,6 . 0,5 . 1800)/96500 = 0,652 л
Ответ: V(О2) = 0,052 л.
Вид работы: Лабораторная работа
Предмет: Физика
Тема: Электролиз
Кемеровский технологический институт пищевой промышленности.
Кафедра общей и неорганической химии.
Лабораторная работа №4.
Цель работы: Исследование электролиза водных растворов солей.
1. Электролиз водного раствора иодида калия.
- 2KJ+2H2O электролиз J2+2H2+2KOH
Процесс на аноде.
- А(+): 2J—2e-→J2
Процесс на катоде.
- К(-): 2H2O+2e-→H2+2OH-
В результате электролиза наблюдаем:
При добавлении фенолфталеина в околокатодное пространство раствор становится малинового цвета, так как при восстановлении молекул воды образуются ионы ОН-, которые создают щелочную среду.
При добавлении раствора крахмала в околоанодное простанство наблюдаем появление синего окрашивания, которое является качественной реакцией на молекулярный йод, который образуется при окислении ионов J-.
2. Электролиз водного раствора сульфата натрия.
- Na2SO4+2H2O электролиз Na2SO4+2H2+O2↑
- 2H2O электролиз 2H2+O2↑
Процесс на аноде.
- А(+): H2O-4e-→O2+4H+
Процесс на катоде.
- К(-): 2H2O+2e-→H2+2OH-
При добавлении раствора универсального индикатора в околокатодное пространство наблюдаем синее окрашивание, так как при восстановлении молекул воды образуются ОН- ионы, которые дают щелочную среду.
При добавлении раствора универсального индикатора в околоанодное пространство наблюдаем красное окрашивание, так как при окислении молекул воды образуются H+ ионы, кторые дают кислую среду.
Сульфат натрия не принимает участия в электролизе. Протекает только электролиз воды.
3. Электролиз водного раствора сульфата меди (II).
- 2CuSO4+2H2Oэлектролиз 2Cu+O2+2H2SO4
Процесс на аноде.
- А(+): H2O-4e-→O2+4H+
Процесс на катоде.
- К(-): Cu2++2е-→Сu0
При электролизе раствора сульфата меди (II) на катоде наблюдаем выделение осадка красной меди.
В околоанодном пространстве выделяются пузырьки кислорода.
Вывод по проведенной работе:
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
Катодные процессы в водных растворах при электролизе зависят от природы катиона.
Процессы, происходящие на катоде зависят от окислительной способности катиона металла:
- Li, K, Ca, Na, Mg, Al Mn, Zn, Fe, Ni, Sn, Pb H Cu, Hg, Ag, Pt, Au
- Меn⁺не восстанавливается (остаётся в растворе)
- 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ Меn⁺ + nē = Me°
- 2 H₂O + 2ē = H₂↑ + 2 OH⁻ Men⁺ + nē = Me°
Анодные процессы в водных растворах зависят от материала анода и природы аниона.
Процессы, происходящие на аноде
Безкислородные кислотные остатки
Кислородсодержащие кислотные остатки
- J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻)
- Аm⁻ – m ē = A° OH⁻, SO₄²⁻, NO₃⁻, F⁻
В щелочной среде:
- 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О
- в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺
(Влияние материала анода не рассматриваем, так как в лабораторной работе влияние материала анода на протекание электролиза не рассматривается).
8. Приведите формулировку законов Фарадея? Каковы их математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4.
Ответ:
Течение первичных анодных и катодных реакций во время протекания электролиза подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
- m = kQ, но Q =It (1)
- где I – сила тока, А; t – время пропускание тока, с.
- m = kIt (2)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (2), получим формулу, объединяющую оба закона Фарадея.
(3)
Соотношение (3) используют в расчетах процессов при электролизе.
Электролиз водного раствора хлорида кадмия (II):
- CdCl2↔Cd2++2Cl-
- K(-):Cd2+, H2O А(+): Cl-, H2O
- Cd2++2e-→Cd 2Cl—2e-→Cl2
Суммарное уравнение электролиза:
- CdCl2→Сd+Cl2
Электролиз водного раствора сульфата кадмия (II):
- CdSO4→ Cd2++SO42-
- K(-):Cd2+, H2O А(+):SO42-, H2O
- Cd2++2e-→Cd 2H2O-4e-→O2+4H+
Суммарное уравнение электролиза:
- 2CdSO4+2 H2O→2Cd+O2+2H2SO4


Прикрепленные файлы:
laboratornaya_po_elektrolizu
laboratornaya_po_elektrolizu
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn2+ +2e → Zn0.
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H20 + 2OH–.
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H+ +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F–), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl– – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H+ написать не можем, так как OH– и H+ не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H+ +2e → H2), а на аноде протекают только процессы окисления.
4OH– – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H+.
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO– – 2e → R-R + 2CO2.
Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na+ + Cl–
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2Cl– – 2e → Cl2
Коэффициент 2 перед Na+ появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na+ + 2Cl– + 2H2O → H20 + 2Na+ + 2OH– + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H20 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na+ + SO42–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H20 + 2OH–
А: 2H2O – 4e → O20 + 4H+.
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H20 + 4OH–
А: 2H2O – 4e → O20 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H20 + 4OH– + 4H+ + O20.
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H20 + 4H2O + O20.
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H20 + O20.
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu2+ + 2Cl–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu2+ + 2e → Cu0
A: 2Cl– – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu2+ + SO42–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu2+ + 2e → Cu0
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu2+ и SO42– 1:1.
К: 2Cu2+ + 4e → 2Cu0
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Записываем суммарное уравнение:
2Cu2+ + 2SO42– + 2H2O → 2Cu0 + O2 + 4H+ + 2SO42–.
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni2+ + 2Cl–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: 2Cl– – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 4Cl– – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 4Cl– + 2H2O → Ni0 + H20 + 2OH– + Ni2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni0 + H20 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni2+ + SO42–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni2+. Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 2SO42– + 2H2O + 2H2O → Ni0 + Ni2+ + 2OH– + H20 + O20 + 2SO42– + 4H+.
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni0 + Ni(OH)2 + H20 + O20 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H+ и OH– с образованием двух молекул воды. Оставшиеся 2H+ расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni2+ + SO42– + 2H2O + 2H2O → Ni0 + 2OH– + H20 + O20 + SO42– + 4H+.
Ni2+ + SO42– + 4H2O → Ni0 + H20 + O20 + SO42– + 2H+ + 2H2O.
Итоговое уравнение:
NiSO4 + 2H2O → Ni0 + H20 + O20 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO– + Na+
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2CH3COO– – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na+ + 2CH3COO– + 2H2O → 2Na+ + 2OH– + H20 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H20 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H+ + SO42–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H+ +2e → H2
A: 2H2O – 4e → O2 + 4H+
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H+ +4e → 2H2
A: 2H2O – 4e → O2 + 4H+
Суммируем левые и правые части уравнений:
4H+ + 2H2O → 2H2 + O2 + 4H+
Катионы H+ находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na+ + OH–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 4OH– – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na+ (в растворе)
4H2O + 4e → 2H20 + 4OH–
А: 4OH– – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH– → 2H20 + 4OH– + O20 + 2H2O
Сокращая 2H2O и ионы OH–, получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.









