C (углерод) — элемент с прядковым номером 6 в периодической системе.
Находится во II периоде. Температура плавления: 3550 ℃. Плотность: 3.51 г/см3.
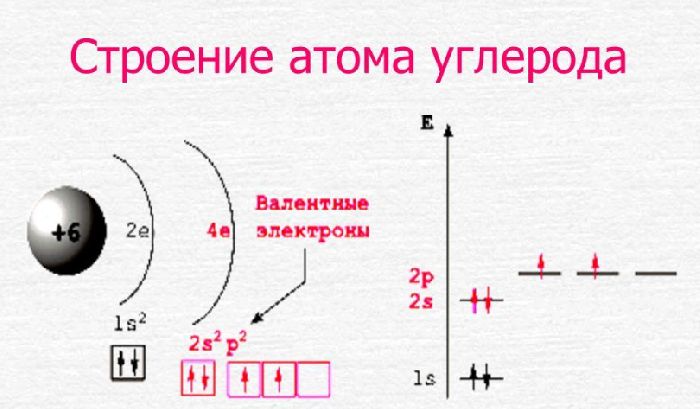
Электронная формула атома углерода:
1s2 2s2 2p2
Сокращенная электронная конфигурация C:
[He] 2s2 2p2
Ниже приведена электронно-графическая схема атома углерода
Распределение электронов по энергетическим уровням в атоме C
1-й уровень (K): 2
2-й уровень (L): 4
Валентные электроны углерода
Количество валентных электронов в атоме углерода — 4.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 2 | 0 | 0 | +1/2 |
| s | 2 | 0 | 0 | -1/2 |
| p | 2 | 1 | -1 | +1/2 |
| p | 2 | 1 | 0 | +1/2 |
Степени окисления, которые может проявлять углерод: -4, -3, -2, -1, +1, +2, +3, +4
Углерод в таблице менделеева занимает 6 место, в 2 периоде.
| Символ | C |
| Номер | 6 |
| Атомный вес | 12.0096000 |
| Латинское название | Carboneum |
| Русское название | Углерод |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема углерода
C: 1s2 2s2 2p2
Короткая запись:
C: [He]2s2 2p2
Одинаковую электронную конфигурацию имеют
атом углерода и
N+1, O+2
Порядок заполнения оболочек атома углерода (C) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Углерод имеет 6 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
2 электрона на 2p-подуровне
Степень окисления углерода
Атомы углерода в соединениях имеют степени окисления 4, 3, 2, 1, -1, -2, -4.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы углерода
Валентность C
Атомы углерода в соединениях проявляют валентность IV, III, II, I.
Валентность углерода характеризует способность атома C к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа C
Квантовые числа определяются последним электроном в конфигурации,
для атома C эти числа имеют значение N = 2, L = 1, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации C:
Eo = 1086 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где C в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Электронное строение атома углерода
Электронное строение нейтрального атома углерода в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме углерода.
C
+6
2
4
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме углерода.
| 2 | ↑↓ | ↑ | ↑ | |||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома углерода выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома углерода.
6C 1s2 2s2 2p2
Сокращённая электронная конфигурация атома углерода.
6C [He] 2s2 2p2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома углерода.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 2s | 2 | 0 | 0 | +½ |
| -½ | ||||
| 2p | 2 | 1 | -1 | +½ |
| 1 | +½ |
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,666 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,992 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Строение атома углерода

4.1
Средняя оценка: 4.1
Всего получено оценок: 561.
4.1
Средняя оценка: 4.1
Всего получено оценок: 561.
Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.
Атом углерода
Положение углерода в периодической таблице Менделеева:
- шестой порядковый номер;
- четвёртая группа;
- второй период.
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
Физические свойства
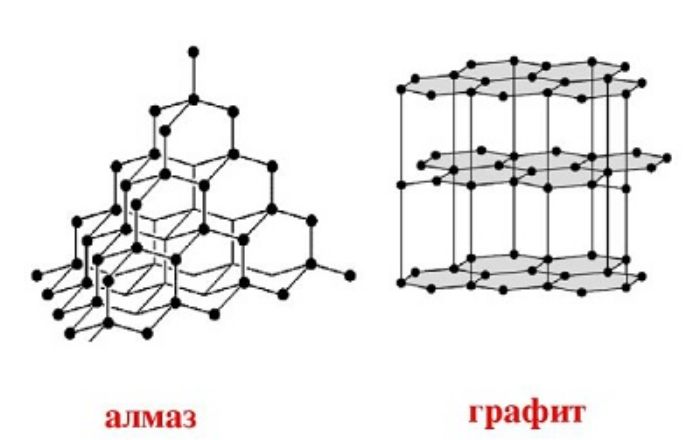
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С + 2Н2 → СН4.
С кислородом углерод образует углекислый газ и угарный газ:
- С + О2 → СО2;
- 2С + О2 → 2СО.
Угарный газ также образуется при взаимодействии с водой:
C + H2O → CO + H2.
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
- 2H2SO4 + C → CO2 + 2SO2 + 2H2O;
- 4HNO3 + C → CO2 + 4NO2 + 2H2O.
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Natasha Zolotareva
5/5
-
Даниил Шкарин
5/5
Оценка доклада
4.1
Средняя оценка: 4.1
Всего получено оценок: 561.
А какая ваша оценка?