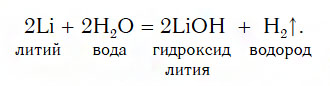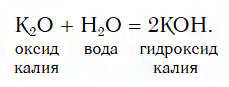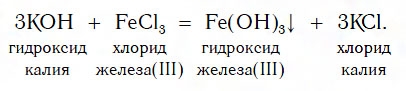bontam976
Вопрос по химии:
Как образуются нерастворимые в воде основания???!!! составьте соответствующие уравнения!
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
xcocle20
Нерастворимые в воде основания получают косвенным путем: реакцией растворимых оснований с солями.
CuSO₄ + 2KOH = Cu(OH)₂ + K₂SO₄
FeCl₃ + 3NaOH = Fe(OH)₃ + 3NaCl
Al(NO₃)₃ + 3KOH =Al(OH)₃ + 3KNO₃
younge
CuSO₄ + 2KOH = Cu(OH)₂ + K₂SO₄
FeCl₃ + 3NaOH = Fe(OH)₃ + 3NaCl
Al(NO₃)₃ + 3KOH =Al(OH)₃ + 3KNO₃
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
В уроке 38 «Получение и применение оснований» из курса «Химия для чайников» рассмотрим способы получения щелочей и нерастворимых оснований, а ещё узнаем где в каких отраслях они применяются.
Поскольку растворимые и нерастворимые основания отличаются по свойствам, эти вещества получают разными способами.
Содержание
- Получение щелочей
- Взаимодействие активных металлов (Li, Na, К, Ca, Ba) с водой
- Взаимодействие оксидов активных металлов с водой
- Получение нерастворимых оснований
- Применение оснований
Получение щелочей
Для получения щелочей можно использовать следующие реакции.
Взаимодействие активных металлов (Li, Na, К, Ca, Ba) с водой
Например:
Поскольку эти реакции протекают очень бурно (рис. 121), на практике их используют редко.
Взаимодействие оксидов активных металлов с водой
Например:
Некоторые щелочи (NaOH, KOH) получают, пропуская электрический ток через водные растворы солей NaCl или KCl. При этом наряду со щелочами образуются и другие ценные вещества — водород H2 и хлор Сl2.
Получение нерастворимых оснований
Нерастворимые основания получают взаимодействием растворимых оснований (щелочей) с солями. Образующиеся нерастворимые основания выделяются из растворов в виде осадков.
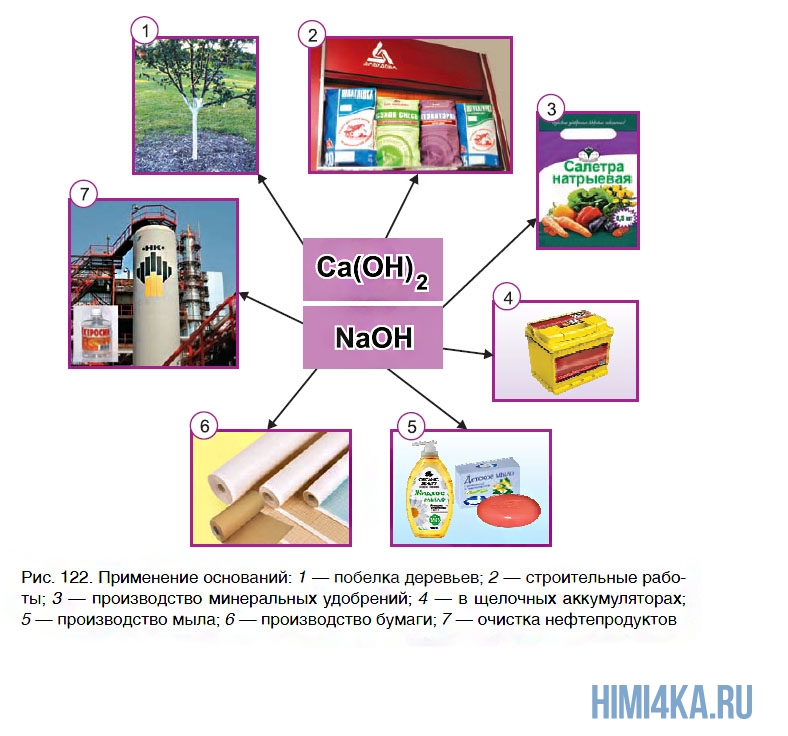
Применение оснований
Из всех оснований наиболее широкое применение находят щелочи. Раствор одной из них вы наверняка сможете найти дома. Эту жидкость под названием «Крот» используют в быту для промывания труб, идущих от кухонных раковин. Дело в том, что эти трубы постепенно засоряются остатками жира, которые мешают стоку воды. А щелочи обладают способностью растворять жиры. Поэтому достаточно в засоренную трубу влить небольшое количество «Крота», и через некоторое время проблема будет решена.
В последнее время в быту получили широкое распространение щелочные гели — густые жидкости, содержащие гидроксид натрия. Они предназначены для быстрого удаления остатков пригоревшего жира с поверхности кухонных плит и СВЧ- печей.
Большое количество гидроксида кальция используется в производстве сахара из сахарной свеклы. Некоторые области применения оснований показаны на рисунке 122.
Из нерастворимых оснований применение находят гидроксиды алюминия Al(OH)3 и магния Mg(OH)2. Они входят в состав медицинского препарата «Алмагель», который используют при заболеваниях пищеварительной системы.
Поскольку щелочи оказывают разрушающее действие на кожу, при их практическом использовании следует соблюдать правила безопасности.
Краткие выводы урока:
- Щелочи образуются при взаимодействии некоторых металлов и их оксидов с водой.
- Нерастворимые основания получаются в результате взаимодействия щелочей с солями.
Надеюсь урок 38 «Получение и применение оснований» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Ca(oh)2 + фенолфталеин = малиновый цвет
H2So4 + лакмус = Красный
Найдем для начала молярную массу:
M(SO3) = 32,065 + 16*3 = 80 (г/моль)
M(S)/M(<span>SO3) = 32/80 = 2/5 = 0,4 = 40%
40% серы
Ответ: формула SO3.
</span>
Молекулярная масса(Mr(CO)) считается по формуле: Mr = m(молекулы)/u(униту)
Собственно мы получаем: m(молекулы) = Mr(CO) * u
И получаем: m(молекулы) = 28 * 1,66*10<span>−24(степени)</span> =
= 46*10-24(степени)
Ряд, в котором все вещества — соли 1)КNO3, CuCl2, Ba(OH)2. 2)Na2SiO3,Fe2(SO4)3, KBr, 3)HCl,Al2O3,Mg(OH)2, 4) CaO, LiOH, BaSO
Gary1970
Это второй ряд
Na2SiO3,Fe2(SO4),<span>KBr</span>
1.2)Фосфор
2.1)Верно только А
3.А-3,Б-4,В-6,Г-2
4.?
5.2)Магний
6.А-5,Б-1,В-3,Г-2
7.1)номеру группы
8.3)3
9.?
10.2)Mg и Ba
Свойства и способы получения нерастворимых в воде оснований
Среди
нерастворимых в воде оснований следует
выделить особую группу веществ –
амфотерные гидроксиды. Их свойства
будут рассмотрены ниже. Способы получения
амфотерных оснований такие же, как
и нерастворимых оснований.
Нерастворимые
основания получают, действуя на раствор
соли, в состав которой входит нужный
атом металла, раствором щелочи:
CuSO4
+ 2NaOH = Cu(OH)2
+ Na2SO4.
Попробуем
определить, какие вещества нужно взять
для того, чтобы получить гидроксид
марганца(II). До реакции составные
части нерастворимого основания Mn(OH)2
находились в составе растворимых веществ
– соли марганца (например, MnCl2) и
щелочи (например, KOH):
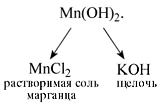
Уравнение
реакции:
MnCl2
+ 2KOH = Mn(OH)2 + 2KCl.
Задание
2.24. Напишите уравнения реакций, при
помощи которых можно получить:
а)
гидроксид железа(III); б) гидроксид
железа(II).
Свойства
нерастворимых в воде оснований во
многом отличаются от свойств щелочей.
Нерастворимые в воде основания не
реагируют с растворами солей, а также
с амфотерными и некоторыми кислотными
оксидами.
• Нерастворимые
основания реагируют с кислотами. При
этом происходит растворение исходного
нерастворимого вещества (осадка).
Например:
Таким
образом, подобные реакции возможны,
если образуется растворимая соль.
• Нерастворимые
основания разлагаются при нагревании.
При этом чем меньше активность металла
(см. ряд напряжений), тем легче разлагается
основание на оксид и воду:
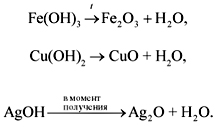
Свойства амфотерных гидроксидов
Амфотерные
гидроксиды соответствуют амфотерным
оксидам. Это означает, что в состав
амфотерного гидроксида входит тот же
атом металла и с той же валентностью,
что и в состав амфотерного оксида:
Амфотерные
вещества проявляют двойственные
свойства, они реагируют и с кислотами,
и с щелочами (при этом амфотерные
гидроксиды растворяются):
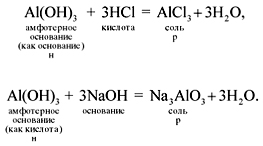
Если
эта реакция происходит с растворами
щелочей, то вместо вещества состава
Na3AlO3 (или NaAlO2)*
образуется сложное комплексное
соединение: Na3[Al(OH)6] или
Na[Al(OH)4].
Задание
2.25. Составьте уравнения реакций с
кислотой и со щелочью следующих амфотерных
гидроксидов: а) гидроксида цинка; б)
гидроксида хрома(III).
Выводы
по главе 2.3. Молекулы неорганических
оснований содержат гидроксигруппы ОН.
Все
неорганические основания, кроме NH4OH,
содержат атомы металлов.
Основания
делят на растворимые в воде (щелочи) и
нерастворимые.
Растворы
щелочей реагируют с кислотами (реакция
нейтрализации), с кислотными и амфотерными
оксидами, с растворами солей. Щелочи
обнаруживаются индикаторами в щелочной
(«синей») области. Нерастворимые в воде
основания не изменяют окраску индикатора,
могут реагировать с некоторыми кислотами
и кислотными оксидами. Термически
неустойчивы.
2.4. Соли
Соль
– это продукт реакции между кислотой
и основанием.
В
состав любой соли входит остаток
основания (атом металла или группа NH4)
и остаток кислоты (кислотный остаток).
Например:
NH4NO3,
K2CO3, CaHPO4, CuOHCl.
Задание
2.26. Для каждой из этих солей (см.
выше) определите, где в ее молекуле
остаток кислоты, а где – остаток
основания. Определите валентности
составных частей.
В
состав некоторых солей входят атомы
водорода или группы ОН. Такое различие
подсказывает, что соли могут быть разных
типов. Рассмотрим три вида солей.
Средние
соли получаются, если кислота
и основание полностью прореагировали:
Кислые
соли получаются, если не все атомы
водорода кислоты были замещены на атомы
металла:
Кислотные
остатки таких солей содержат атом
водорода. Кислые соли могут проявлять
некоторые свойства кислот. Например,
они могут реагировать со щелочами:
Осно’вные
соли образуются, если не все
группы ОН основания замещаются на
кислотный остаток:
Такие
соли содержат гидроксигруппу ОН.
Осно’вные соли могут проявлять некоторые
свойства оснований. Например, они
реагируют с кислотами:
Во
многих примерах, которые иллюстрировали
свойства оксидов, кислот и оснований,
продуктами реакции были соли. Попробуем
обобщить эти сведения и выяснить, в
результате каких процессов можно
получить соль заданного состава.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #