- Главная
- Пациентам
- Статьи
- Определение плотности кости в стоматологии
Определение плотности кости в стоматологии

Качество дентальной имплантации и последующего протезирования зависит от разных факторов. Перед выбором имплантов врач проводит обследование. Его обязательный этап – определение плотности костной ткани. В зависимости от этого параметра имплантолог определяет возможность установки искусственного корня, его длину, способ прокола и т.д.
Характеристики кости влияют и на первоначальную стабилизацию имплантата, период, необходимый для полного приживления. Для успешной имплантации важны количество, качество, биотип костной ткани, ее структура, строение челюстей. Все эти параметры врач изучает во время предварительного обследования.
Измерение плотности костной ткани
Плотность кости определяют разными методами:
- Эхоостеометрия. Диагностика строится на характеристиках прохождения ультразвука по костной ткани. Врач оценивает скорость прохождения и рассчитывает плотность. Особенность этого метода заключается в том, что для оценки характеристик нужен прямолинейный участок не менее 4 см, поэтому применяют его только на нижней челюсти.
- Рентгенография. Применяют на верхней челюсти, где невозможно использовать более точные ультразвуковые методы. Недостаток его применения – неточные результаты.
Существуют ситуации, когда точно определить плотность кости невозможно. Врач ориентируется на данные с низкой достоверностью, и только во время препарирования кости понимает, что ее плотности недостаточно. Опытный врач может успешно вживить имплантат в рыхлую кость. Для этого можно сделать ложе меньшего диаметра и конденсировать кость. Это помогает обеспечить первичную стабильность, а прием препаратов кальция во время реабилитационного периода – хорошую приживляемость.
Как определить толщину кости
Когда кость имеет недостаточную толщину, имплантат устанавливать нельзя. В этом случае имплантолог может порекомендовать сначала пройти процедуру остеопластики. Параметр определяют с помощью компьютерной томографии. Этот метод позволяет точно определять толщину даже тонких костей. Это позволяет избежать риска установить имплантат в костную ткань, не способную справиться с нагрузкой.
Как определить ширину кости
С помощью компьютерной томографии изучают еще один важный для имплантации параметр – ширину кости. Для нормальной приживаемости имплантата необходимо, чтобы ширина окружающей его костной ткани составляла 6-7 мм. При недостаточной ширине имплантация невозможна. В этом случае врач порекомендует остеопластику или другой вид протезирования.
Как определить тип костной ткани
Это еще один важный параметр, оцениваемый имплантологом. Раньше в стоматологии выделяли всего 4 типа костной ткани. Затем было добавлено еще две. Они являются результатом атрофии кости, что происходит в тех случаях, когда пациент затягивает с протезированием после утери зубов.
По своим свойствам кость отличается от других тканей организма. Во-первых, она способна к регенерации, но в месте сращивания не образует шрам. Во-вторых, кость обладает очень высокой нагрузочной способностью, так как при изменении нагрузки может меняться ее структура.
Особенности кости объясняются ее трехслойным строением. Слои отличаются по своей структуре, а их соотношение определяет свойства кости и ее тип.
- Кортикальный слой состоит из минеральных пластинок, плотно прилегающих друг к другу. Поэтому он не менее, чем в 10 раз плотнее губчатого.
- Губчатый слой мягкий, и 70% ткани приходится на костный мозг, кровеносные сосуды. Минеральные перегородки составляют только 30% от всего объема кости. Они образуют ячеистую структуру, напоминающую губку.
- Надкостница. Эта часть ткани отвечает за ее питание. По сути, она является разновидностью соединительной ткани.
Лучше всего для имплантации подходит кортикальная компактная костная ткань.
Сочетание слоев не одинаково для обеих челюстей. Нижняя челюсть плотная, так как в ней преобладает кортикальный слой. Верхняя челюсть отличается не только наличием гайморовых пазух, что сокращает высоту кости. Кортикальный слой верхней челюсти тонкий, а основная часть состоит из губчатого вещества разной плотности.
Не одинаковым является и соотношение кортикального и губчатого вещества, по этому параметру на основе результатов компьютерной томографии определяют тип кости. Самой плотной, состоящей практически из одного компактного вещества, является ткань I типа.
II и III типы характеризуются соотношением слоев 1:1 и 1:2, и достаточно большой толщиной кортикального слоя. Они являются оптимальным вариантом для вживления импланта. IV тип рыхлый, поэтому хуже всего подходит для вживления имплантата, есть риск, что он будет долго стабилизироваться. Атрофические типы не подходят для установки имплантов.
Если у вас возникла проблема, похожая на описанную в данной статье, обязательно обратитесь к нашим специалистам. Не ставьте диагноз самостоятельно!
Почему стоит позвонить нам сейчас:
- Ответим на все ваши вопросы за 3 минуты
- Бесплатная консультация
- Средний стаж работы врачей – 12 лет
- Удобство расположения клиник
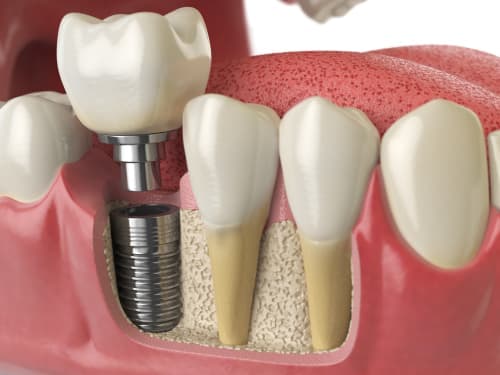
Реставрации с опорой на дентальные имплантаты являются общепринятым и хорошо задокументированным методом успешной стоматологической реабилитации. Основной принцип имплантации базируется на установке титановых опор в область достаточного костного предложения в вертикальной, горизонтальной и сагиттальной плоскостях. При этом в практической стоматологии продолжаются дискуссии относительно того, какая же толщина костной ткани с вестибулярной стороны имплантата является минимально необходимой для успешного функционирования титановых опор в долгосрочной перспективе.
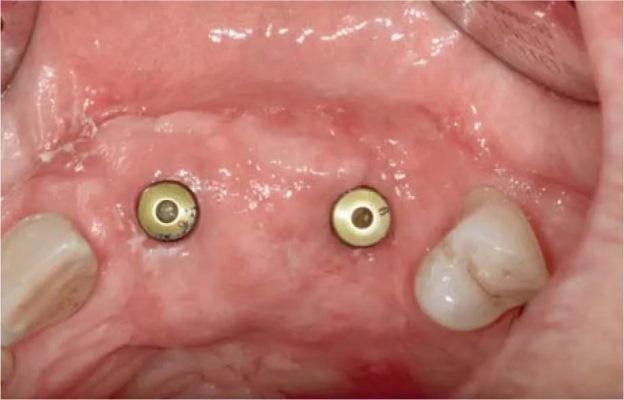
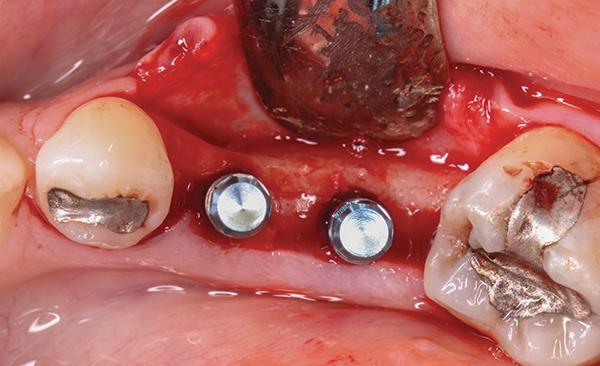
На фото 1-3 изображены различные примеры толщины вестибулярной щечной пластинки. Некоторые клиницисты предполагают, что наличие, как минимум 1-2 мм толщины кости вестибулярно по отношению к установленному имплантату достаточного для позитивного прогноза его функционирования (фото 3). При этом параметр толщины вестибулярной костной пластинки может влиять и на аспекты эстетики в периимплантатной области, и на риск развития рецессии мягких тканей, и на паттерн вертикальной и горизонтальной резорбции, и даже на уровень выживания имплантатов. Верификация минимально допустимой толщины костной ткани с вестибулярной стороны перед установкой внутрикостной опоры способствует определению потребности в проведении процедур направленной костной регенерации для оптимизации параметров резидуального костного гребня. Интересно, что в литературе практически отсутствуют исследования относительно влияния толщины язычной костной пластинки на прогноз функционирования имплантатов. Такая особенность может быть обусловлена тем, что, как правило, толщина костной ткани с язычной стороны превышает аналогичный параметр с вестибулярной, и она подлежит менее выраженной резорбции после процедуры экстракции.
Фото 1. Пример тонкой костной пластинки (менее 1 мм), находящейся вестибулярно по отношению к установленному дентальному имплантату, в проекции 19 зуба (окклюзионный вид).

Фото 2. Пример толстой костной пластинки (более 2 мм), находящейся вестибулярно по отношению к установленному дентальному имплантату, в проекции 4 зуба (окклюзионный вид).
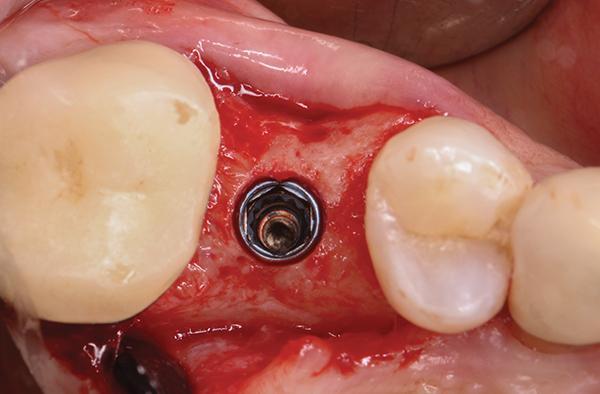
Фото 3. Пример костной пластинки, находящейся вестибулярно по отношению к установленным дентальным имплантатам, толщиной в диапазоне 1-2 мм в проекции 19 и 20 зубов (окклюзионный вид).
В данной статье будет проанализировано влияние толщины вестибулярной костной пластинки на прогноз функционирования дентальных имплантатов при их установке в заживший резидуальный гребень челюсти с учетом основных физиологических аспектов ремоделирования кости, имеющих значение после выполнения процедуры экстракции.
Типы костной ткани и их функции
Кость представляет собой динамическую ткань, основной функцией которой является обеспечение механической поддержки человеческого тела. По сути, костная ткань – это высокодифференцированная форма соединительной ткани, состоящая из органической и неорганической фаз. Органический матрикс кости усилен кальцием с преобладанием в структуре коллагена 1 типа, в то время как неорганический матрикс состоит в основном из гидроксиапатита. Известны два основные морфологические типы кости: кортикальная и губчатая. Их структура отличается, учитывая, что они обеспечивают две разные функции. Кортикальная кость обеспечивает поддержку тела, защиту органов, депонирует в своей структуре химические элементы по типу кальция, которые при потребности могут выделяться в кровь. Губчатая кость характеризуется высоковаскуляризированной структурой и содержит костный мозг, в котором проходят процессы гемопоэза и формирования клеток крови. Дентальные имплантаты в основном контактируют с губчатой костью, что крайне важно для заживления костной ткани вокруг установленной титановой опоры. Кортикальная же кость, в свою очередь, в большей степени отвечает за стабильность имплантата. После выполнения процедуры экстракции и кортикальная, и губчатая кость характеризуются развитием резорбтивных процессов.
Васкуляризация вестибулярной костной ткани
Васкуляризация вестибулярной костной ткани на верхней челюсти обеспечивается за счет передней, средней и задней ветвей верхней альвеолярной артерии и щечной артерии. В проекции нижней челюсти вестибулярная костная ткань кровеснабжается щечной артерией. При этом непосредственное кровоснабжение обеспечивается тремя сосудистыми источниками: пародонтальной связкой (ПЗ), надкостницей и сосудами эндоста. Нарушение кровоснабжения кости могут спровоцировать развитие процессов резорбции. Например, после экстракции зуба нарушается кровоснабжение из области пародонтальной связки. Если же удаление зуба сопровождалось сепарацией лоскута, то нарушается кровоснабжение как из области пародонтальной связки, так и из области надкостницы. Следовательно, в таком случае кровоснабжение обеспечивается только за счет сосудов костномозгового пространства до момента, пока полностью не восстановиться сосудистая структура пародонта. Костная пластинка, находящаяся вестибулярно по отношению к установленному дентальному имплантату, характеризуется преобладанием преимущественно компактной кортикальной ткани, а следовательно – и более низким уровнем исходного кровоснабжения. В структуре язычной/небной костной пластинки резидуального гребня, наоборот, преобладает губчатая кость, следовательно, ее структура характеризуется более густой сеткой кровеносных сосудов, и менее ассоциирована с риском развития резорбции.
Изменение размеров лунки после удаления зуба
После экстракции зуба происходят пространственные изменения костной ткани, которые касаются как высоты, так и ширины резидуального гребня. Выраженность постэкстракционной резорбции зависит от многих факторов: исходной толщины вестибулярной костной пластинки, использованной методики удаления (травматической, атравматической, лоскутной, безлоскутной), степени воспалительной реакции, влияния системных факторов, топографического расположения зуба, состояния лунки, наличия смежных патологий, анатомических вариаций, кровоснабжения и генетических составляющих.
Shropp и коллеги сообщили, что через 3 месяца после удаления премоляров и моляров с сепарацией лоскута наблюдалось уменьшение ширины костного гребня до 50%. Большая часть резорбции отмечалась в первые 3 месяца после экстракции, но продолжалась и через 9 месяцев после хирургического вмешательства. Систематический обзор Tan и коллег позволил систематизировать данные о величине горизонтальной и вертикальной резорбции через 1 год после удаления зуба с сепараций лоскута во время проведения операции. Авторы сообщили, что средняя горизонтальная потеря костной ткани составляет около 3,79 мм, в то время как вертикальная – 1,24 мм. Безлоскутная процедура экстракции характеризовалась средними показателями горизонтальной и вертикальной резорбции в диапазоне до 1 мм. Таким образом, процедура экстракции без сепарации лоскута позволяет в большей степени минимизировать горизонтальную, нежели вертикальную убыль костной ткани. Аналогичные уровни вертикальной резорбции, отмеченные с и без сепарации лоскута, очевидно, связаны с нарушением объема кровоснабжения из области пародонтальной связки. Уменьшение убыли костной ткани при реализации безлоскутного подхода к удалению может быть ассоциировано с сохранением целостности надкостницы как источника кровоснабжения.
Толщина костной пластины: вестибулярная против язычной
Толщина щечной костной пластинки на верхней и нижней челюсти была исследована на естественных зубах с помощью конусно-лучевой компьютерной томографии (КЛКТ). Januário и коллеги определяли тонкий тип вестибулярной костной пластинки при ширине таковой <1 мм, а толстый — при ≥1 мм. При анализе клинических случаев на верхней челюсти авторы сообщили, что в большинстве из них толщина вестибулярной костной пластинки составляет менее 1 мм, а в 50% случаев даже меньше 0,5 мм. Fuentes и коллеги отметили, что в передних отделах верхней челюсти ширина костной пластинки, превышающая 2 мм, была отмечена менее чем в 10% клинических случаев. По данным других исследований, большая толщина внешней костной пластинки была идентифицирована в области дистальных зубов. Результаты Zekry и коллег свидетельствуют о том, что средняя толщина вестибулярной костной пластинки в передних отделах обеих челюстей составляла около 0,9 мм, в то время как в дистальных участках она варьировала в диапазоне от 1,23 до 2,46 мм.
Толщина вестибулярной костной пластинки и ее связь с успешностью имплантатов
По данным многих исследований резорбция вестибулярной костной пластинки после установки имплантата в значительной степени может варьировать: по данным Spray, средний показатель составляет 0,7±1,7 мм, по данным Cardaropoli – 0,4 мм, по данным Merhed – 0,85±0,71 мм, по данным Kaminaka – 0,18±0,22 мм, по данным Vara – 0,54 мм, по данным Takuma – 0,3 мм; при этом исходная толщина вестибулярной костной пластинки до имплантации находилась в диапазоне 0,5-1,83 мм. Несмотря на вышеупомянутые вариации показателей, уровень выживаемости установленных имплантатов достигал 97-100% через 6 месяцев – 1 год мониторинга. Таким образом, исходя из этих данных краткосрочного наблюдения можно резюмировать, что взаимосвязь между успешностью дентальных имплантатов и толщиной вестибулярной костной пластинки является клинически незначимой. Однако, необходимо уточнить, что в проанализированных исследованиях измерение ширины вестибулярной костной пластинки проходило относительно разных исходных ориентиров.
Влияние толщины костной пластинки, находящейся вестибулярно относительно имплантата, на горизонтальную потерю костной ткани
В нескольких исследованиях оценивали взаимосвязь между начальной толщиной костной пластинки, находящейся вестибулярно относительно установленного имплантата, и степенью горизонтальной резорбции кости, которая происходит после процедуры имплантации. В большом проспективном многоцентровом исследовании Spray и коллег авторы сообщили, что исходная толщина вестибулярной костной пластинки до имплантации влияет на изменения толщины таковой после имплантации. При этом исходные параметры толщины в 1,8-2,0 мм являются достаточными для дальнейшего позитивного прогноза изменений костной ткани. В другом исследовании было установлено, что исходные параметры толщины вестибулярной костной пластинки в 1,2 мм, 1,25 мм, и 0,5 мм после имплантации были ассоциированы с горизонтальной резорбцией вестибулярной кости на уровне 0,4 мм, 0,54 мм, и 0,3 мм соответственно. По данным этих исследований, параметры ширины костной пластинки, находящейся вестибулярно по отношению к имплантату, в диапазоне от 0,5 мм до 1,25 мм после установки интраоссальной опоры провоцирует уменьшение ширины таковой до <1 мм в ходе постоперационного мониторинга. Тем не менее, в другом исследовании констатировали отсутствие статистически значимой разницы относительно горизонтальной потери костной ткани при исходно тонкой (<1 мм) и толстой (≥1 мм) вестибулярной костной пластинке.
В исследовании Kaminaka и коллег не удалось установить связи между паттерном потери ширины вестибулярной костной пластинки вокруг имплантата (0,08–0,18 мм) и ее исходными параметрами при установке внутрикостных опор с разными типами соединений: внешним, внутренним и коническим. Результаты Omori продемонстрировали, что горизонтальная резорбция костной ткани через 3 месяца после имплантации составляла 0,3 мм, если исходная толщина таковой была около 1 мм, и 1 мм, если исходная толщина таковой была 2 мм. Таким образом, можно резюмировать, что ширина вестибулярной костной пластинки уменьшается через несколько месяцев после имплантации, но диапазон изменений составляет около 1 мм. Spray и коллеги, изучая корреляции между исходной шириной костной пластинки, находящейся вестибулярно относительно установленного имплантата, и изменениями таковой в процессе дальнейшего мониторинга пришли к выводу, что изначальная толщина вестибулярной пластинки от 1,8 мм до 2 мм, позволяет минимизировать объем потери горизонтальных параметров таковой в будущем. Однако данное исследование характеризуется рядом недостатков. Во-первых, авторы не уточнили топографию установленных имплантатов. Во-вторых, также не было указано, проводилась ли установка внутрикостных опор на уровне костного гребня, или субкрестально. Также авторы не идентифицировали специфики соединений, дизайна и текстуры поверхности используемых имплантатов. Именно поэтому требуется проведение дополнительных проспективных исследований, посвященных вопросу влияния исходной толщины вестибулярной костной пластинки на изменения горизонтальных параметров таковой в процессе функционирования дентальных имплантатов.
Влияние толщины костной пластинки, находящейся вестибулярно относительно имплантата, на вертикальную потерю костной ткани
Только пять из семи исследований, включенных в этот обзор, предоставляли данные о взаимосвязи исходной толщины костной пластинки, находящейся вестибулярно относительно имплантата, на вертикальную потерю костной ткани. Spray и коллеги сообщили, что если толщина вестибулярной костной пластинки после установки имплантата превышала 1,8 мм, то потери вертикального уровня костной ткани вообще не наблюдалось. В противном случае, если толщина вестибулярной кости была менее 1,8 мм, то вертикальная резорбция ткани составляла около 0,7 мм. Эти данные были получены после 6-месячного мониторинга. По сути, большие исходные параметры толщины костной пластинки были ассоциированы с меньшими показателями ее вертикальной резорбции. В других исследованиях авторы сообщали, что вертикальная потеря костной ткани, находящейся вестибулярно по отношению к имплантату, все же наблюдалась, однако было сложно идентифицировать связь между уровнями таковой и исходной толщиной кости. Так, по данным Cardaropoli и коллег, исходная толщина вестибулярной костной ткани в 1,2 мм была ассоциирована с вертикальной потерей в 0,7 мм, по данным Vera и коллег, исходная толщина в 1,25 мм – с вертикальной потерей 0,49 мм, по данным Takuma и коллег, исходная толщина в 0,5 мм – с вертикальной потерей в 1 мм.
Некоторые исследователи представили иную точку зрения. Omori и коллеги, проводя анализ 32 участков через 3 месяца после установки имплантатов, установили, что исходная толщина вестибулярной костной пластинки в 1 мм после имплантации провоцировала потерю высоты таковой до 0,9 мм, а исходная толщина в 2 мм – потерю высоты таковой в 0,8 мм. Kaminaka и коллеги отмечали среднюю вертикальную потерю костной массы, связанную с тремя типами соединения имплантатов (внешним, внутренним и коническим) на уровне 1,85 мм, 1 мм и 0,21 мм соответственно. При этом средние исходные параметры толщины вестибулярной костной ткани составляли 0,18 мм, 0,87 мм и 0,53 мм. То есть очевидно, что более тонкая вестибулярная щечная пластинка была связана с более значительной вертикальной резорбцией костной ткани.
Подводя итог, можно резюмировать, что вертикальная резорбция кости является достаточно частым явлением после выполнения процедуры дентальной имплантации. При этом диапазон прогнозированной вертикальной потери кости составляет около 0,4-1 мм. Данный паттерн редукции может быть связан с формированием биологической ширины после присоединения абатментов. Кроме того, различия в величине вертикальной резорбции могут быть связаны с такими факторами, как дизайн соединения имплантата и абатмента, положение имплантата относительного альвеолярного гребня, объема хирургической травмы, исходной шириной вестибулярной костной пластинки после установки внутрикостной опоры. Ни одно исследование, за исключением проведенного Spray и коллегами, не продемонстрировало наличие корреляции между начальной толщиной костной пластинки, находящейся вестибулярно по отношению к имплантату, и последующей вертикальной потерей костной ткани в периимплантатной области. Следует отметить, что исследование Spray и коллег проводилось на имплантатах, установленных в полностью заживший костный гребень, и его результаты не могут быть интерпретированы на внутрикостные опоры, установленные непосредственно сразу после имплантации.
Влияние толщины костной пластинки, находящейся вестибулярно относительно имплантата, на риск развития рецессии
Ни в одном из проанализированных исследований не было проведено целевой оценки влияния толщины костной пластинки, находящейся вестибулярно по отношению к установленному имплантату, на эстетический результат реабилитации после фиксации окончательной супраконструкции. При этом в трех исследованиях было идентифицировано развитие рецессий после ортопедической нагрузки имплантатов. Cardaropoli зарегистрировал рецессии глубиной в 0,6 мм, а Takuma – в 0,4 мм через 1 год мониторинга. Kaminaka установил средний уровень рецессии в 0,35 мм вокруг имплантатов с тремя разными дизайнами соединений. Возможно, в проанализированных трех исследованиях рецессии десен могли быть ассоциированы с редукцией вертикальных и горизонтальных параметров костной ткани после проведения процедуры имплантации. Таким образом, целесообразно ожидать развитие рецессии до 0,5 мм через 1 год после установки интраоссальной опоры. Однако при этом на развитие рецессии могут влиять и другие факторы, среди которых контур коронки, положение имплантата в щечно-лингвальном направлении, тип соединения с абатментом. Исходя из данных литературы, невозможно установить необходимой исходной толщины вестибулярной пластики, которая могла бы полностью предупредить развитие рецессии.
Оценка толщины вестибулярной костной пластинки
В большинстве проанализированных исследований для оценки толщины вестибулярной костной пластинки использовали штангенциркуль и метод КЛКТ сразу же после установки имплантата. В 60% исследований, включенных в данный обзор, использовали цифровой инструмент (цифровой штангенциркуль) для верификации толщины костной ткани с вестибулярной стороны, а в 40% исследований – результаты КЛКТ-сканирования.
Недостатки рентгенологического исследования
Использование рентгеновских снимков, включая КЛКТ и периапикальные рентгенограммы, помогает оценить состояние костной ткани до проведения процедуры имплантации. При этом рентгенограмма является лишь двухмерным изображением и не предоставляет информации о ширине альвеолярного гребня. Последний параметр можно оценить лишь по полученным КЛКТ-сканам, хотя и данный метод является не абсолютно точным. Vanderstuyft и коллеги сообщили, что наличие металлических предметов в структуре костной ткани приводит к развитию разного рода артефактов, что, в свою очередь, компрометирует возможности для объективного состояния кортикальной пластинки. Peterson, проводя анализ точности метода КЛКТ для верификации высоты вестибулярной костной пластинки и идентификации дефектов по типу дегисценций и фенестраций, установил, что КЛКТ характеризуется эффектом недооценки исходной высоты вестибулярной костной пластинки и эффектом переоценки относительно наличия вышеупомянутых типов дефектов. Эти данные указывают на потребность интерпретации данных КЛКТ с большою осторожностью и учетом влияния смежных факторов.
Выводы
Имеющие данные литературы характеризуются определенным дефицитом доказательств в отношении определения критически важных параметров толщины вестибулярной костной пластинки, которые позволили бы нивелировать последующую вертикальную и горизонтальную потерю костной ткани. Лишь в исследовании Spray и коллег было указано конкретное значение исходной толщины вестибулярной костной пластинки, наличие которой позволяет предупредить дальнейшее развитие горизонтальной и вертикальной резорбции. Конечно же, успешных результатов имплантации можно добиться и при меньших параметрах толщины костной ткани, находящейся вестибулярно по отношению к установленной внутрикостной опоре, однако подобные результаты были зарегистрированы лишь в краткосрочной перспективе. Большинство исследований, в которых определенные показатели толщины вестибулярной костной пластинки были интерпретированы, как таковые непосредственно влияющие на успех, по уровню своей доказательности являются лишь экспертными мнениями. На основании представленных в обзоре данных авторы могут сделать следующие выводы:
— имплантаты, устанавливаемые на расстоянии от 0,5 мм до 1,83 мм от вестибулярного края костной ткани, характеризуются высокими показателями выживаемости (от 97% до 100%), однако данных, которые могли бы подтвердить данное предположение для долгосрочного прогноза, пока что не получено;
— исходная толщина вестибулярной костной пластинки, отмеченная сразу после установки имплантата, потенциально может влиять на дальнейший объем горизонтальной и вертикальной резорбции, однако пока что не определены те пороговые значения толщины, которые позволили бы нивелировать дальнейший паттерн резорбции;
— развитие рецессии мягких тканей на глубину до 0,5 мм является типичным после проведения процедуры имплантации, при этом пока что не определены те пороговые значения толщины вестибулярной костной пластинки, исходя из которых можно было бы сделать вывод о риске развития специфической глубины рецессии;
— при интерпретации данных КЛКТ в отношении параметров костной ткани в периимплантатной области следует проявлять особую осторожность, учитывая ограниченные возможности данного метода относительно регистрации толщины вестибулярной костной пластинки;
— верификация минимально-необходимого параметра толщины вестибулярной костной пластинки после процедуры дентальной имплантации потенциально может позволить оптимизировать результаты успешности имплантации, следовательно, для коррекции таковой в отдельных случаях необходимо рассматривать потребность проведения дополнительных манипуляций;
— для уточнения роли исходной толщины вестибулярной костной пластинки на прогноз изменений костной ткани периимплантатной области в вертикальной и горизонтальной плоскостях, необходимо проведение дополнительных проспективных исследований.
Авторы:
Sultan Albeshri, BDS, MS
Gary Greenstein, DDS, MS
Цель
работы: Изучение упругих и прочностных
свойств тканей организма. Используя
универсальную установку определить
модуль упругости образца по деформации
изгиба.
Вопросы
теории (исходный уровень):
1.
Упругие, вязкие и вязкоупругие среды.
2.
Механические характеристики и модели
упругих, вязких и вязкоупругих сред.
3.
Механические свойства:
—
костной ткани,
—
мышц,
—
сухожилий,
—
сосудов.
Содержание
занятия:
1.
Выполнить работу по указаниям в
руководстве к данной работе.
2.
Оформить отчет.
3.
Защитить работу с оценкой.
4.
Решить задачи.
Задачи
Какая
сила необходима для разрушения при
сжатии бедренной кости диаметром 30 мм
с толщиной стенок 3 мм,
если предел прочности кости 1,4 · 108
н/м2?
Определить
толщину стенки большой берцовой кости
диаметром 28 мм,
если ее разрыв произошел при нагрузке
23,1· 103
н.
Предел прочности кости принять равным
9,8 · 107
н/м2.
Определить
абсолютное удлинение сухожилия длиной
4 см
и диаметром 6 мм
под действием силы 31,4 н.
Модуль упругости сухожилия принять
равным 109
н/м2.
Мышца
длиной 10 см
и диаметром 1 см
под действием груза 49 н
удлинилась на 7 мм.
Определить модуль упругости мышечной
ткани.
Модуль
упругости протоплазменных нитей,
получившихся вытягиванием протоплазмы
у некоторых типов клеток с помощью
микроигл, оказывается равным 9 · 103
н/м2
при комнатной температуре. Определить
напряжение, действующее на нить при
растяжениях, не превышающих 20% ее
первоначальной длины.
Какая
работа совершается при растяжении на
1 мм
мышцы длиной 5 см
и диаметром
4 мм?
Модуль Юнга для мышечной ткани принять
равным 9,8· 107
н/м2.
Найти
потенциальную энергию, приходящуюся
на единицу объема кости, если кость
растянута так, что напряжение в ней
составляет 3 · 109
н/м2.
Модуль упругости кости принять равным
22,5 109
н/м2.
Лабораторная работа № 1 « определение модуля упругости кости по изгибу»
Приборы и
принадлежности:
1) индикатор длин; 2) штангенциркуль;
3)
миллиметровая линейка длиной 30 см; 4)
две опоры со стальными призмами,
5)
пластина, вырезанная из бедренной кости;
6) кусок бедренной или плечевой кости
длиной 20—25 см; 7) пластина органического
стекла; 
трубки длиной 30 см; 9) набор грузов по 50
и 100 г (всего 5 кг).
Изучение упругих
и прочностных свойств тканей организма
имеет большой практический интерес.
Например, знание упругих характеристик
костей необходимо в хирургической
практике (подбор нагрузок при вытяжениях).
Прочность костей — показатель, без
которого не может обойтись судебно-медицинская
экспертиза. Для диагностики заболеваний
сердечно-сосудистой системы используется
определение модуля упругости стенок
кровеносных сосудов. Ознакомление с
элементами учения о сопротивлении
материалов представляет особый интерес
для студентов стоматологического
факультета, так как зубной протез — это
конструкция, прочность и надежность
которой обеспечивается учетом законов
деформаций.
Деформациями
называют изменения формы и объема тел
под действием различных сил. В зависимости
от действующих сил различают следующие
виды деформации: растяжение, сжатие,
сдвиг, кручение и изгиб. Всем твердым
телам присущи два вида деформаций:
упругая, когда после прекращения действия
сил деформация полностью исчезает, и
остаточная (пластическая), когда после
прекращения действия сил деформация
полностью не исчезает. Деформация
сохраняет характер упругой только для
малых нагрузок до предельного ее
значения, называемого пределом упругости,
после чего она переходит в пластическую.
Исследуя упругие деформации тел,
английский физик Гук установил следующий
закон: удлинение l
тела прямо пропорционально приложенной
к нему силе Р,
его первоначальной длине l
и обратно пропорционально площади
поперечного сечения S,
т. е.
(1)
где
Е —
модуль упругости, или модуль Юнга.
Равенство (1) можно представить в виде
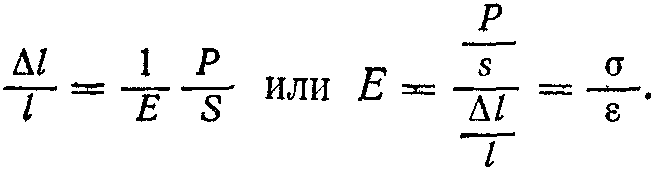
Отношение
называется напряжением,
— относительным
удлинением.
При l
= l
получим
,
т. е. модуль Юнга представляет напряжение,
при котором длина образца удваивается
(l
+ l
= 2l
). Фактическое удвоение длины можно
получить у резины и ряда полимерных
материалов. Для других материалов
нарушение прочности происходит раньше,
чем длина образца удвоится. Упругие
константы иногда удобнее определять
не по деформации растяжения, а по изгибу
образца. В деформации изгиба сжатия в
одной части образца комбинируются с
растяжениями в другой его части. В
отличие от продольных напряжений
растянутых (или сжатых) образцов
напряжения при изгибе будут поперечными,
т. е. перпендикулярными к их длине. Мерой
деформации в этом случае служит стрела
прогиба, т. е. наибольшее отклонение
одной из точек образца от первоначального
положения.
Графическое
изображение распределения значений
каких-нибудь величин по длине образца
называется эпюрой.
На рис. 8, а,
б, в показаны
(сверху вниз): эпюры деформаций, поперечных
напряжений и изгибающих моментов
образца, свободно лежащего на опорах,
под действием нагрузки, приложенной к
его середине.
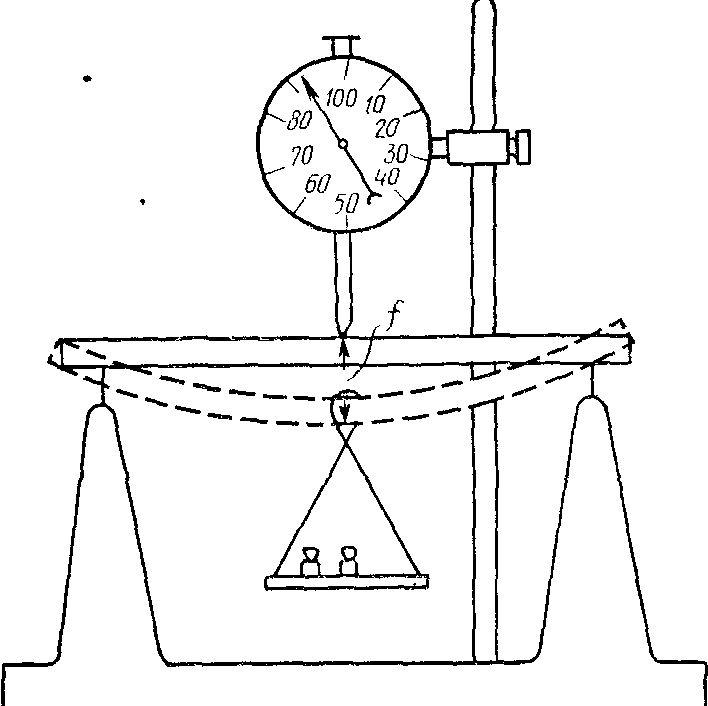
Рис.
8 Рис. 9
Установка для
определения модуля упругости по
деформации изгиба показана на рис. 9.
Образец свободно укладывается на две
стальные призмы, которыми заканчиваются
опоры. Посредине образца подвешивается
чашка для грузов. Прогиб измеряется с
помощью индикатора длин. Для модуля
упругости образца в виде пластины
(пластины кости, органического стекла)
теория дает следующее выражение:
(2)
где
Р
—нагрузка; l
— длина образца (расстояние между
опорами); f
—стрела
прогиба; b
— ширина образца; h
— высота (направление нагрузки). Для
образца в форме трубки теория дает
выражение:
(3)
где
R
— внешний; r
— внутренний
диаметр трубки.
Расстояние между
опорами измеряют миллиметровой линейкой,
линейные размеры — штангенциркулем.
Измерения делают в нескольких местах
вдоль образца и берут их средние значения.
Все размеры выражают в метрах, нагрузку
Р
— в ньютонах.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Кость представляет собой сложную материю, это сложный анизотропный неравномерный жизненный материал, обладающий упругими и вязкими свойствами, а также хорошей адаптивной функцией. Все превосходные свойства костей составляют неразрывное единство с их функциями.
Функции костей главным образом имеет две стороны: одна из них – это образование скелетной системы, используемой для поддержания тела человека и сохранения его нормальной формы, а также для защиты его внутренних органов. Скелет является частью тела, к которой крепятся мышцы и которая обеспечивает условия для их сокращения и движения тела. Скелет сам по себе выполняет адаптивную функцию путем последовательного изменения своей формы и структуры. Вторая сторона функции костей состоит в том, чтобы путем регулирования концентрации Ca2+ , H+ , HPO4+ в электролите крови поддерживать баланс минеральных веществ в теле человека, то есть функцию кроветворения, а также сохранения и обмена кальция и фосфора.
Форма и структура костей являются различными в зависимости от выполняемых ими функций. Разные части одной и той же кости вследствие своих функциональных различий имеют разную форму и структуру, например, диафиз бедренной кости и головка бедренной кости. Поэтому полное описание свойств, структуры и функций костного материала является важной и сложной задачей.
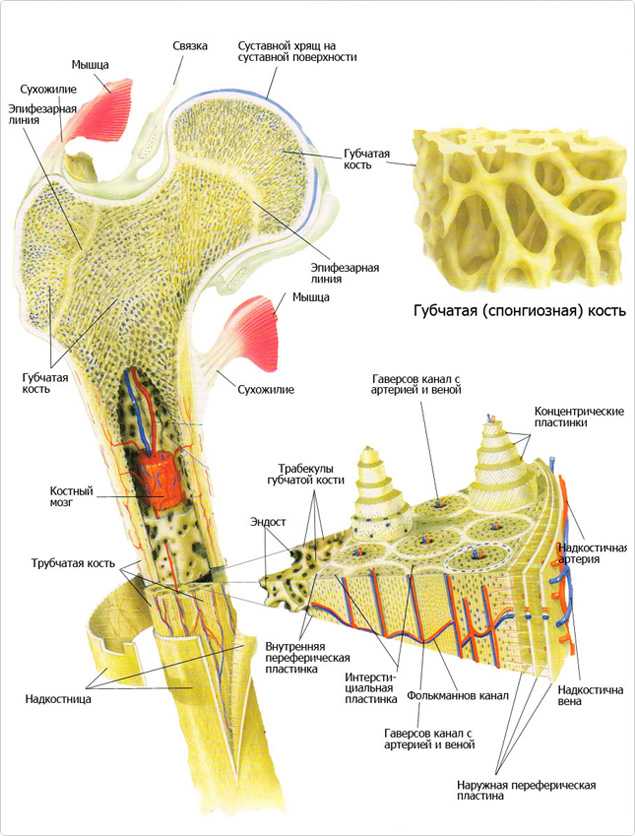
Структура костной ткани
«Ткань» представляет собой комбинированное образование, состоящее из особых однородных клеток и выполняющих определенную функцию. В костных тканях содержатся три компонента: клетки, волокна и костный матрикс. Ниже представлены характеристики каждого из них:
Клетки: В костных тканях существуют три вида клеток, это остеоциты, остеобласт и остеокласт. Эти три вида клеток взаимно превращаются и взаимно сочетаются друг с другом, поглощая старые кости и порождая новые кости.
Костные клетки находятся внутри костного матрикса, это основные клетки костей в нормальном состоянии, они имеют форму сплющенного эллипсоида. В костных тканях они обеспечивают обмен веществ для поддержания нормального состояния костей, а в особых условиях они могут превращаться в два других вида клеток.
Остеобласт имеет форму куба или карликового столбика, они представляют собой маленькие клеточные выступы, расположенные в довольно правильном порядке и имеют большое и круглое клеточное ядро. Они расположены в одном конце тела клетки, протоплазма имеет щелочные свойства, они могут образовывать межклеточное вещество из волокон и мукополисахаридных белков, а также из щелочной цитоплазмы. Это приводит к осаждению солей кальция в идее игловидных кристаллов, расположенных среди межклеточного вещества, которое затем окружается клетками остеобласта и постепенно превращается в остеобласт.
Остеокласт представляет собой многоядерные гигантские клетки, диаметр может достигать 30 – 100 µm, они чаще всего расположены на поверхности абсорбируемой костной ткани. Их цитоплазма имеет кислотный характер, внутри ее содержится кислотная фосфотаза, способная растворять костные неорганические соли и органические вещества, перенося или выбрасывая их в другие места, тем самым ослабляя или убирая костные ткани в данном месте.
Костный матрикс также называется межклеточным веществом, он содержит неорганические соли и органические вещества. Неорганические соли также называются неорганическими составными частями костей, их главным компонентом являются кристаллы гидроксильного апатита длиной около 20-40 nm и шириной около 3-6 nm. Они главным образом состоят из кальция, фосфорнокислых радикалов и гидроксильных групп, образующих [Ca10 (PO4) (OH)2], на поверхности которых находятся ионы Na+ , K+, Mg2+ и др. Неорганические соли составляют примерно65% от всего костного матрикса. Органические вещества в основном представлены мукополисахаридными белками, образующими коллагеновое волокно в кости. Кристаллы гидроксильного апатита располагаются рядами вдоль оси коллагеновых волокон. Коллагеновые волокна расположены неодинаково, в зависимости от неоднородного характера кости. В переплетающихся ретикулярных волокнах костей коллагеновые волокна связаны вместе, а в костях других типов они обычно расположены стройными рядами. Гидроксильный апатит соединяется вместе с коллагеновыми волокнами, что придает кости высокую прочность на сжатие.
Костные волокна в основном состоит из коллагенового волокна, поэтому оно называется костным коллагеновым волокном, пучки которого расположены послойно правильными рядами. Это волокно плотно соединено с неорганическими составными частями кости, образуя доскообразную структуру, поэтому оно называется костной пластинкой или ламеллярной костью. В одной и той же костной пластинке большая часть волокон расположена параллельно друг другу, а слои волокон в двух соседних пластинках переплетаются в одном направлении, и костные клетки зажаты между пластинками. Вследствие того, что костные пластинки расположены в разных направлениях, то костное вещество обладает довольно высокой прочностью и пластичностью, оно способно рационально воспринимать сжатие со всех направлений.
У взрослых людей костная ткань почти вся представлена в виде ламеллярной кости, и в зависимости от формы расположения костных пластинок и их пространственной структуры эта ткань подразделяется на плотную кость и губчатую кость. Плотная кость располагается на поверхностном слое ненормальной плоской кости и на диафизе длинной кости. Ее костное вещество плотное и прочное, а костные пластинки расположены в довольно правильном порядке и тесно соединены друг с другом, оставляя лишь небольшое пространство в некоторых местах для кровеносных сосудов и нервных каналов. Губчатая кость располагается в глубинной ее части, где пересекается множество трабекул, образуя сетку в виде пчелиных сот с разной величиной отверстий. Отверстия сот заполнены костным мозгом, кровеносными сосудами и нервами, а расположение трабекул совпадает с направлением силовых линий, поэтому хотя кость и рыхлая, но она в состоянии выдерживать довольно большую нагрузку. Кроме того, губчатая кость имеет огромную поверхностную площадь, поэтому она также называется Костю, имеющей форму морской губки. В качестве примера можно привести таз человека, средний объем которого составляет 40 см3 , а поверхность плотной кости в среднем составляет 80 см2 , тогда как поверхностная площадь губчатой кости достигает 1600 см2 .
Морфология кости
С точки зрения морфологии, размеры костей неодинаковы, их можно подразделить на длинные, короткие, плоские кости и кости неправильной формы. Длинные кости имеют форму трубки, средняя часть которых представляет собой диафиз, а оба конца – эпифиз. Эпифиз сравнительно толстый, имеет суставную поверхность, образованную вместе с соседними костями. Длинные кости главным образом располагаются на конечностях. Короткие кости имеют почти кубическую форму, чаще всего находятся в частях тела, испытывающих довольно значительное давление, и в то же время они должны быть подвижными, например, это кости запястья рук и кости предплюсны ног. Плоские кости имеют форму пластинок, они образуют стенки костных полостей и выполняют защитную роль для органов, находящихся внутри этих полостей, например, как кости черепа.
Кость состоит из костного вещества, костного мозга и надкостницы, а также имеет разветвленную сеть кровеносных сосудов и нервов, как показано на рисунке. Длинная бедренная кость состоит из диафиза и двух выпуклых эпифизарных концов. Поверхность каждого эпифизарного конца покрыта хрящом и образует гладкую суставную поверхность. Коэффициент трения в пространстве между хрящами в месте соединения сустава очень мал, он может быть ниже 0.0026. Это самый низкий известный показатель силы трения между твердыми телами, что позволяет хрящу и соседним костным тканям создать высокоэффективный сустав. Эпифизарная пластинка образована из кальцинированного хряща, соединенного с хрящом. Диафиз представляет собой полую кость, стенки которой образованы из плотной кости, которая является довольно толстой по всей ее длине и постепенно утончающейся к краям.
Костный мозг заполняет костномозговую полость и губчатую кость. У плода и у детей в костномозговой полости находится красный костный мозг, это важный орган кроветворения в человеческом организме. В зрелом возрасте мозг в костномозговой полости постепенно замещается жирами и образуется желтый костный мозг, который утрачивает способность к кроветворению, но в костном мозге по-прежнему имеется красный костный мозг, выполняющий эту функцию.
Надкостница представляет собой уплотненную соединительную ткань, тесно прилегающую к поверхности кости. Она содержит кровеносные сосуды и нервы, выполняющие питательную функцию. Внутри надкостницы находится большое количество остеобласта, обладающего высокой активностью, который в период роста и развития человека способен создавать кость и постепенно делать ее толще. Когда кость повреждается, остеобласт, находящийся в состоянии покоя внутри надкостницы, начинает активизироваться и превращается в костные клетки, что имеет важное значение для регенерации и восстановления кости.
Микроструктура кости
Костное вещество в диафизе большей частью представляет собой плотную кость, и лишь возле костномозговой полости имеется небольшое количество губчатой кости. В зависимости от расположения костных пластинок, плотная кость делится на три зоны, как показано на рисунке: кольцевидные пластинки, гаверсовы (Haversion) костные пластинки и межкостные пластинки.
Кольцевидные пластинки представляют собой пластинки, расположенные по окружности на внутренней и внешней стороне диафиза, и они подразделяются на внешние и внутренние кольцевидные пластинки. Внешние кольцевидные пластинки имеют от нескольких до более десятка слоев, они располагаются стройными рядами на внешней стороне диафиза, их поверхность покрыта надкостницей. Мелкие кровеносные сосуды в надкостнице пронизывают внешние кольцевидные пластинки и проникают вглубь костного вещества. Каналы для кровеносных сосудов, проходящие через внешние кольцевидные пластинки, называются фолькмановскими каналами (Volkmann’s Canal). Внутренние кольцевидные пластинки располагаются на поверхности костномозговой полости диафиза, они имеют небольшое количество слоев. Внутренние кольцевидные пластинки покрыты внутренней надкостницей, и через эти пластинки также проходят фолькмановские каналы, соединяющие мелкие кровеносные сосуды с сосудами костного мозга. Костные пластинки, концентрично расположенные между внутренними и внешними кольцевидными пластинками, называются гаверсовыми пластинками. Они имеют от нескольких до более десятка слоев, расположенных параллельно оси кости. В гаверсовых пластинках имеется один продольный маленький канал, называемый гаверсовым каналом, в котором находятся кровеносные сосуды, а также нервы и небольшое количество рыхлой соединительной ткани. Гаверсовы пластинки и гаверсовы каналы образуют гаверсову систему. Вследствие того, что в диафизе имеется большое число гаверсовых систем, эти системы называются остеонами (Osteon). Остеоны имеют цилиндрическую форму, их поверхность покрыта слоем цементина, в котором содержится большое количество неорганических составных частей кости, костного коллагенового волокна и крайне незначительное количество костного матрикса.
Межкостные пластинки представляют собой пластинки неправильной формы, расположенные между остеонами, в них нет гаверсовых каналов и кровеносных сосудов, они состоят из остаточных гаверсовых пластинок.
Внутрикостное кровообращение
В кости имеется система кровообращения, например, на рисунке показа модель кровообращения в плотной длинной кости. В диафизе есть главная питающая артерия и вены. В надкостнице нижней части кости имеется маленькое отверстие, через которое внутрь кости проходит питающая артерия. В костном мозге эта артерия разделяется на верхнюю и нижнюю ветви, каждая из которых в дальнейшем расходится на множество ответвлений, образующих на конечном участке капилляры, питающие ткани мозга и снабжающие питательными веществами плотную кость.
Кровеносные сосуды в конечной части эпифиза соединяются с питающей артерией, входящей в костномозговую полость эпифиза. Кровь в сосудах надкостницы поступает из нее наружу, средняя часть эпифиза в основном снабжается кровью из питающей артерии и лишь небольшое количество крови поступает в эпифиз из сосудов надкостницы. Если питающая артерия повреждается или перерезается при операции, то, возможно, что снабжение кровью эпифиза будет заменяться на питание из надкостницы, поскольку эти кровеносные сосуды взаимно связываются друг с другом при развитии плода.
Кровеносные сосуды в эпифизе проходят в него из боковых частей эпифизарной пластинки, развиваясь, превращаются в эпифизарные артерии, снабжающие кровью мозг эпифиза. Есть также большое количество ответвлений, снабжающих кровью хрящи вокруг эпифиза и его боковые части.
Верхняя часть кости представляет собой суставный хрящ, под которым находится эпифизарная артерия, а еще ниже ростовой хрящ, после чего имеются три вида кости: внутрихрящевая кость, костные пластинки и надкостница. Направление кровотока в этих трех видах кости неодинаково: во внутрихрящевой кости движение крови происходит вверх и наружу, в средней части диафиза сосуды имеют поперечное направление, а в нижней части диафиза сосуды направлены вниз и наружу. Поэтому кровеносные сосуды во всей плотной кости расположены в форме зонтика и расходятся лучеобразно.
Поскольку кровеносные сосуды в кости очень тонкие, и их невозможно наблюдать непосредственно, поэтому изучение динамики кровотока в них довольно затруднительно. В настоящее время с помощью радиоизотопов, внедряемых в кровеносные сосуды кости, судя по количеству их остатков и количеству выделяемого ими тепла в сопоставлении с пропорцией кровотока, можно измерить распределение температур в кости, чтобы определить состояние кровообращения.
В процессе лечения дегенеративно-дистрофических заболеваний суставов безоперационным методом в головке бедренной кости создается внутренняя электрохимическая среда, которая способствует восстановлению нарушенной микроциркуляции и активному удалению продуктов обмена разрушенных заболеванием тканей, стимулирует деление и дифференциацию костных клеток, постепенно замещающих дефект кости.
Методы измерения плотности костей
С возрастом структура кости становится хрупкой и ломкой, происходит деминерализация скелета, то есть с годами тихо и незаметно подкрадывается остеопороз. Низкая плотность костей признана важным фактором риска, который ассоциируется с остеопорозом также как кровяное давление или уровень холестерина считаются признанными стимуляторами возникновения кардиоваскулярных заболеваний.
Ещё несколько лет назад постановка диагноза «остеопороз» основывалась на истории болезни, на рентгеновских снимках и на клинических симптомах (особенно большую роль в подтверждении диагноза играли переломы в анамнезе), то есть диагноз ставился, когда болезнь была уже в продвинутой стадии. Сегодня с появлением современных методик ситуация изменилась, диагноз остеопороза можно поставить на самой ранней стадии, когда симптомы еще отсутствуют и можно особенно эффективно бороться с патологией.
Сознательные пациенты уже давно понимают клиническое значение этих измерений. Методы остеоденситометрии доступны по цене, проводятся быстро и имеют надежные результаты. Они существенно упрощают постановку диагноза и оценку хода развития заболевания.
На первое место в диагностике остеопороза выходит измерение плотности костей – DXA (двухэнергетическая рентгеновская денситометрия). Почему это исследование столь актуально? Вот некоторые его плюсы:
- ранняя диагностика;
- возможность избежать переломов в перспективе;
- возможность следить за результатами лечения в динамике, ведь благодаря современным методам лечения можно увеличивать костную массу.
Показания к остеоденситометрии
В соответствии с основными направлениями Национального фонда остеопороза (НОФ, США) проведение измерений рекомендуется:
- всем женщинам в возрасте 65 + (независимо от других факторов риска);
- всем женщинам в период постменопаузы, у которых были переломы;
- всем женщинам, которые решили начать лечение остеопороза и их окончательное решение зависит от результата остеоденситометрии;
- всем женщинам, которые проходили долгое время гормональную терапию.
Кроме того, остеоденситометрия назначается:
- при уменьшении размеров тела, связанного с возрастом;
- при боли в спине неизвестного происхождения;
- худым курильщикам и курильщицам;
- лицам с исходными переломами;
- пациентам с проблемами суставов с ограниченной подвижностью;
- при долгосрочном применении терапии (более 6 месяцев) с использованием медикаментов, опасных для костей, таких как: кортикостероиды, маркумар или противоэпилептические средства;
- при гипертиреозе и гиперпаратиреоидизме (или гиперфункция щитовидной железы, или гиперфункция околощитовидной железы);
- пациентам с трансплантацией;
- при хронических заболеваниях ЖКТ и операции в гастроэнтерологической области;
- при нервной анорексии (истощение);
- при хронической почечной недостаточности.
Измерение плотности костей при помощи метода DXA − это единственный надежный метод для документирования эффекта от терапии остеопороза. Ежегодное измерение показывает положительную или отрицательную динамику течения болезни. Эта быстрая методика определяет начало развития остеопороза, когда с помощью целенаправленных мероприятий ещё можно предотвратить прогрессирование тяжёлого заболевания.
DXA — двойная энергетическая рентгеновская абсорбциометрия
DXA — это наиболее применяемый и распространенный метод измерения и прогноза. Остеоденситометрия позволяет определить диагноз до того, как произойдёт перелом костей. Метод DXA рекомендует для применения ВОЗ, он считается мировым стандартом для измерения плотности костей. Он позволяет сделать вывод о минеральном состоянии костей и о сравнительных показателях плотности разных областей скелета. Минеральное содержание определяет прочность и плотность костей. Метод DXA наиболее распространенный метод, так как воздействие рентгеновского излучения невысокое. Само исследование длится всего несколько минут.
Почему нужно измерять плотность костей?
Единственная возможность поставить ранний диагноз остеопороза, то есть до начала переломов и другой клиники, это количественное измерение плотности костей. Измерение плотности костей BMD позволяет анализировать плотность костей в различных областях скелета и сделать оценку риска возможных переломов. Эффективность метода доказана результатами многих исследований. Уменьшение плотности костной массы всего на 10% увеличивает вдвое риск возникновения переломов в области позвоночного столба, в три раза в области шейки бедра. Если переломы уже происходили, то это измерение проводится для подтверждения диагноза остеопороза и определения степени износа костей в аксиальном скелете.
Измерение плотности костей позволяет получить следующую информацию:
- остеопороз или остеопению можно определить ещё до появления переломов;
- результат позволяет предсказать риск позднего манифестного остеопороза;
- результат показывает скорость потери костей («прогрессия»).
- документирует действенность лечения.
Соотношение между BMD и риском возникновения переломов хорошо поддаётся документированию. Связь между плотностью костей (измеряется у тазового сустава и в пояснично-крестцовом отделе позвоночника) и переломами шейки бедра в три раза очевиднее, чем связь между уровнем холестерина в крови и инфарктом.
Методы измерения
Надёжность и точность метода зависит от:
- типа приборов;
- регулярного (ежедневно) калибрования по фантому;
- сотрудничества с исследуемым (важно спокойное положение пациента во время измерения)
- точной и воспроизводимой настройки прибора исследователем,
- стадии остеопороза (чем меньше плотность костей, тем меньше точность измерения).
Для выявления болезни применяют следующие методы:
- рентген;
- ультразвук;
- ККТ (количественная компьютерная томография);
- ДХА;
- МРТ
Коротко остановимся на каждом из них.
Рентген
Рентгеновские снимки выявляют манифестный остеопороз, то есть когда потеряна уже треть костной массы. Поэтому сегодня эта методика не актуальна.
ККТ
Методика применяется в том случае, если ДХА проводить нецелесообразно. Достоинством исследования является точность измерения и возможность получить объемный снимок. Но лучевое облучение при этом столь высокое, что назначается редко.
Костная денситометрия периферическая.
Местом исследования является запястье и пяточная кость. В местах наиболее уязвимых для переломов плотность измерить нельзя. Небольшое устройство может находиться в кабинете доктора, радиационное облучение минимальное. Оно обычно применяется как скрининг для раннего выявления болезни.
Ультразвук
Эта методика оценивает риск перелома, выявляя участки пониженной плотности периферического скелета с помощью ультразвуковых лучей. Объектом исследования обычно становятся пяточная кость, пальцы, надколенник. Но поставить диагноз на основании данного исследования нельзя.
DXA
DXA – двухэнергетическая рентгеновская абсорбциометрия, называется ещё DEXA, DXA, реже QDR, DPX, DER – в этом случае речь идёт о самом популярном и самом совершенном методе измерения, о «золотом стандарте» во всём мире и во всех международных исследованиях. Метод DAX появился в 80-е годы в Японии, его глобальное применение началось в 1988 году. Два луча энергии с разной интенсивностью направляют через скелет. По количеству излучения, которое проникает через кости, можно сделать расчёты плотности костей. На основании измерений при помощи двух лучей с разной величиной энергии можно высчитать количество абсорбции, обусловленное плотностью костей и исключить его. Во время исследования проводятся измерения поясничного отдела позвоночника и тазобедренного сустава (справа и /или слева). Новым многообещающим методом является технология измерений DXA с лазерной поддержкой, измерения проводятся на пятке. Между тем, сейчас возможен общий анализ костной массы («сканнер тела DXA»). Внутри автоматически определяемых площадей производятся расчёты минерального содержания на площади (гр/см2). Эти измерения охватывают не только тело позвонков, но и их дуг, и остистых отростков, которые содержат значительное количество плотного вещества кости. Международное общество клинической денситометрии (ISCD) рекомендует проводить измерения минимум двух областей скелета, при этом диагноз определяется по низшему Т-критерию. В области позвоночного столба измерение проводится от L1 доL4.
Метод DXA обладает следующими преимуществами:
- метод неинвазивный;
- исследование при помощи современных приборов проводится очень быстро (5-10 минут), а благодаря новой технологии лазерного импульса измерение длится всего 1-2 секунды;
- исследование доступно по цене;
- не создаёт лучевую нагрузку на пациента — лучевое воздействие очень незначительно. 13m Rem (миллибэр) соответственно, только 1/10–1/100 от нормальной дозы рентгеновского излучения. Доза облучения новой технологии лазерного импульса составляет <10μSV (микрозиверт) (1 mRem/ (миллибэр) на площадь;
- измерение остеопороза происходит в самых чувствительных ареалах скелета, в которых чаще всего происходят переломы (пояснично-крестцовый отдел позвоночного столба и тазобедренный сустав). Измерения очень точные и просто идеальные для проведения контрольных измерений (верность 2-6%, точность 1-3%);
- метод признан и рекомендуется DVO (Главный союз по остеологии) и ВОЗ, как стандартное обследование для выявления остеопороза;
- метод применяется во всех больших терапевтических исследованиях как самый надежный при измерении плотности костей.
Внимание!
Параметры плотности костей для поясничных позвонков 1-4 распечатываются отдельно и в комбинации, для исключения при расчетах отдельных позвонков с дефектами. Большой перечень факторов, который сопровождается изменениями позвоночного столба или же изменениями в соседних мягких частях, может искажать измерения, эти факторы должны учитываться при оценивании. При сильно выраженных дегенеративных изменениях или при тяжёлых сколиозах необходимо полностью отказаться от измерений, следует учитывать только результаты измерений в области таза. Также и в проксимальной области бедренной кости могут существовать большие различия в плотности кости, поэтому при контрольных измерениях необходимо сравнивать одинаковые области. Единственным недостатком метода DAX является интегральное измерение исследуемого ареала скелета.
Иногда трудно точно определить, входят ли в результаты измерения скоплений кальция (например, кальций аорты, заизвесткованные лимфатические узлы, части мышц или спондилофиты), или же другие абсорбирующие вещества (металлические застёжки, контрастные средства, доступные для измерения рентгеном, таблетки кальция). Этих ловушек можно избежать при помощи предварительных рентгеновских снимков пояснично-крестцового отдела позвоночника. Новые приборы позволяют проводить измерения и с боковой проекции, и благодаря высокой разрешающей способности могут представить детальное изображение структуры позвонков и таза.
Т-критерий и Z-критерий
Эти два понятия в рамках проведения оценки измерений DAX имеют клиническое значение:
- Z- критерий (Z-показатель): сравнение плотности костей пациента с «показателями пациента того же пола и равного возраста» («контроль по возрасту и полу»)
- Т-критерий (Т-показатель): сравнительная величина показателей плотности костей пациента, с показателями нормального взрослого человека (в возрасте 20-30 лет) (сравнение по «максимальной плотностью костей»).
Так как показатель минеральной плотности ткани МПК (BMD) с возрастом уменьшается во всех областях скелета, то у всех пациентов, которые старше 30 лет, Т-критерий ниже, чем Z-критерий, при этом, с возрастом разница увеличивается. Согласно определению, диагноз остеопороза основывается на показателе Т-критерия < -2,5 SD.
МРТ
Возможности МРТ безграничны, структура костей на снимке видна ясно. Но из-за высокой стоимости эта технология для определения плотности применяется редко.
Вывод
Сегодня используются разнообразные методики определения плотности кости. На основании одних исследований можно поставить диагноз остеопороза, на основании других можно выявить риск переломов и своевременно заняться профилактикой коварной болезни. Надо понимать, что выявленные параметры плотности кости могут быть разными, поэтому выбор участка обследования чрезвычайно важен!
Помните, что остеопороз на ранней стадии можно остановить – достаточно сделать первый шаг по определению костной массы!