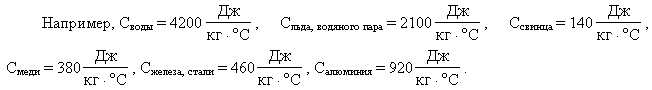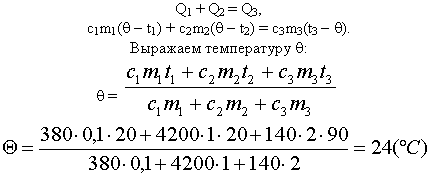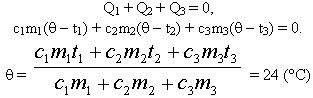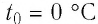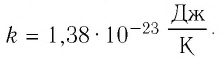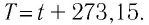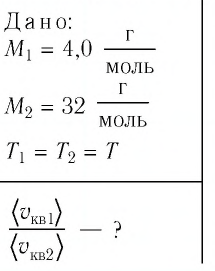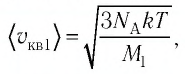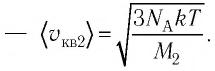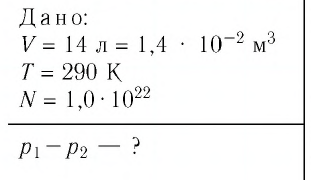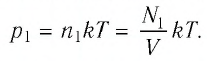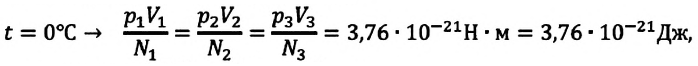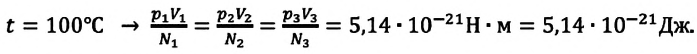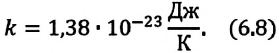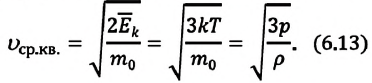Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
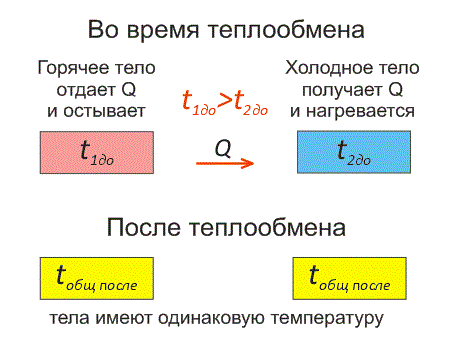
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
Рис.1. Два тела во время теплообмена и после
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Рис. 2. Полученное количество теплоты имеет знак «+», а отданное Q – знак «-»
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
[large boxed{ Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 }]
(large Q_{text{остывания горяч}} left( text{Дж} right) ) – это количество теплоты горячее тело теряет.
(large Q_{text{нагревания холод}} left( text{Дж} right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_{1} + Q_{2} = 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed{ Q_{1} + Q_{2} + Q_{3} + ldots + Q_{n} = 0 } ]
При этом:
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
[large Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 ]
2). Теперь запишем формулу для каждого количества теплоты:
[large Q_{text{остывания горяч}} = c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) ]
[large Q_{text{нагревания холодн}} = c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) ]
Примечания:
- (large c_{text{воды}} ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_{text{общ}} — t_{text{горяч}} ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_{text{общ}} — t_{text{холодн}} ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
[large c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) + c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) = 0 ]
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_{text{общ}} — 80 ) + 4200 cdot 0,1 cdot (t_{text{общ}} — 15 ) = 0 ]
Проведем упрощение:
[large 840 cdot (t_{text{общ}} — 80 ) + 420 cdot (t_{text{общ}} — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
[large t_{text{общ}} = 58,33 ]
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_{1} ) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_{2} ) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_{3} ) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Выводы
- Если тела имеют различную температуру, то между ними возможен обмен тепловой энергией, т. е. теплообмен;
- Когда тела будут иметь равную температуру, теплообмен прекратится;
- Тело с высокой температурой, отдает тепловую энергию (теплоту) и остывает. Отданное количество теплоты Q имеет знак «минус»;
- А тело с низкой температурой получает тепловую энергию и нагревается. Полученное количество теплоты Q имеет знак «плюс»;
- Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом. Это – закон сохранения тепловой энергии;
- Сохранение тепловой энергии можно записать в виде уравнения теплового баланса;
- В левой части уравнения складываем количества теплоты (всех тел, участвующих в теплообмене);
- В правой части уравнения записываем ноль, когда теплообмен с окружающей средой отсутствует.
Тепловое равновесие и уравнение теплового баланса
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
(large Q_<text<остывания горяч>> left( text <Дж>right) ) – это количество теплоты горячее тело теряет.
(large Q_<text<нагревания холод>> left( text <Дж>right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_ <1>+ Q_ <2>= 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed < Q_<1>+ Q_ <2>+ Q_ <3>+ ldots + Q_ = 0 > ]
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
2). Теперь запишем формулу для каждого количества теплоты:
Примечания:
- (large c_<text<воды>> ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_<text<общ>> — t_<text<горяч>> ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_<text<общ>> — t_<text<холодн>> ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_<text<общ>> — 80 ) + 4200 cdot 0,1 cdot (t_<text<общ>> — 15 ) = 0 ]
[large 840 cdot (t_<text<общ>> — 80 ) + 420 cdot (t_<text<общ>> — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_ <1>) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_ <2>) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_ <3>) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Уравнения баланса энергии и теплоты
Ключевые слова конспекта: количество теплоты, уравнение теплового баланса, закон сохранения энергии в тепловых процессах.
Для механических явлений при определённых условиях выполняется закон сохранения механической энергии: полная механическая энергия системы тел сохраняется, если они взаимодействуют силами тяготения или упругости. Если действуют силы трения, то полная механическая энергия тел не сохраняется, часть её (или вся) превращается в их внутреннюю энергию.
При изменении состояния тела (системы) меняется его внутренняя энергия. Состояние тела и соответственно его внутреннюю энергию можно изменить двумя способами: в процессе теплопередачи или путём совершения внешними силами работы над телом (работа, например, силы трения). Мерой изменения внутренней энергии тела в процессе теплообмена выступает количество теплоты (Q).
Уравнение теплового баланса
В изолированной системе при смешивании горячей и холодной воды, количество теплоты Q1, отданное горячей водой, равно количеству теплоты Q2, полученному холодной водой, т.е.: |Q1|= |Q2| . Q1 (выделенное) 0.
Qотданное + Qполученное = 0
Записанное равенство называется уравнением теплового баланса (эта формула и уравнение, используемое в 8 классе!). Определение: суммарное количества теплоты, которое выделяется в теплоизолированной системе равно суммарному количеству теплоты, которое в этой системе поглощается.
Уравнение теплового баланса связывает количество теплоты, полученное одним телом, и количество теплоты, отданное другим телом при теплообмене. При этом в теплообмене могут участвовать не два тела, а три и более: Q1 + Q2 + Q3 + … = 0
Уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах. Оно даёт возможность определить те или иные величины. В частности, значения удельной теплоёмкости веществ определяют из уравнения теплового баланса.
◊◊◊ Обратите внимание! В более старших классах используется следующее определение «уравнения теплового баланса»: Если в изолированной системе тел не происходит никаких превращений энергии кроме теплообмена, то количество теплоты, отданное телами, внутренняя энергия которых уменьшается, равно количеству теплоты, полученному телами, внутренняя энергия которых увеличивается. При этом суммарная энергия системы не изменяется«. А также используется другая формула уравнения (с учетом интегральной формы Первого начала термодинамики):
Закон сохранения энергии в тепловых процессах
Закон сохранения энергии в тепловых процессах выполняется при нагревании тел за счёт энергии, выделяющейся при сгорании топлива. Топливо — это природный газ, дрова, уголь, нефть. При его сгорании происходит химическая реакция окисления — атомы углерода соединяются с атомами кислорода, содержащимися в воздухе, и образуется молекула оксида углерода (углекислого газа) С02. При этом выделяется энергия.
При сгорании различного топлива одинаковой массы выделяется разное количество теплоты. Например, хорошо известно, что природный газ является энергетически более выгодным топливом, чем дрова. Это значит, что для получения одного и того же количества теплоты, масса дров, которые нужно сжечь, должна быть существенно больше массы природного газа. Следовательно, различные виды топлива с энергетической точки зрения характеризуются величиной, называемой удельной теплотой сгорания топлива.
Конспект урока «Уравнение теплового баланса».
Уравнение теплового баланса — формула, суть и примеры решений
Общие сведения
Баланс в переводе на русский язык означает равновесие. Когда теплоизолированная система приходит в состояние теплового равновесия, то температура всех тел, образующих эту совокупность, становится одинаковой. Такую ситуацию называют законом теплового равновесия или нулевым уравнением термодинамики.
Впервые с уравнением теплового баланса знакомят в средней школе на уроке физики. Ученикам в седьмом классе предлагается решить несколько простых заданий, используя равенство. Формула и определение даётся без доказательства, так как для понимания процесса нужно знать понятия, которые разбираются в выпускных классах школы. Например, то, что теплоёмкость не является характеристикой вещества, при этом она может быть разной в зависимости от проходящих процессов.
Закон теплового баланса позволяет утверждать, что когда в изолированной системе физических тел происходит только теплообмен, то часть тепла, переданного телами, внутреннее состояние энергии которых уменьшается, численно равняется теплу, полученному объектами с возрастающей внутренней энергии. Математически уравнение записывается в виде следующей формулы: Q 1 + Q 2 + Q 3 + …+ Qn = 0, где:
- n — число тел, находящихся в теплоизолированной системе;
- Q — полученное количество теплоты.
Если предположить, что имеется совокупность, состоящая из двух тел, из которых одно отдаёт тепло, а другое принимает его, то справедливо будет записать: Q1 = Q2. Таким образом, теплоотдача всегда равняется теплоприёму. Поэтому этот закон и называют правилом сохранения энергии в тепловых процессах.
Когда тела два, то понять, какое из них отдаёт тепло, а какое получает, несложно. То, что имеет большее нагревание, — будет отдавать. Если же объектов три и более, и некоторые из них имеют промежуточную температуру, определить, какие из них принимают тепло, довольно сложно. Вот тут на помощь и приходит уравнение термодинамики.
Изменение внутренней энергии объясняется теплопередачей, то есть случаем, когда работа не совершается. Поэтому в физике уравнение теплового баланса используется при анализе процессов теплопередачи, нахождении КПД. Это равенство можно применять как при рассмотрении твёрдых тел, так и жидкости.
Суть уравнения
Следует рассмотреть процесс установления теплового равновесия в теплоизолированной системе. Это такая совокупность, в которой объекты взаимодействуют только друг с другом. Простейшая система будет состоять из двух тел. Например, в термос налит сок и в него вброшен лёд. В этом случае термос является изолятором от внешнего воздействия. Пусть первое тело имеет температуру t1, а второе t2. Допустим, что t1 больше t2. Это допущение не является принципиальным, поэтому его можно использовать.
В начальный момент времени тела находятся далеко друг от друга и теплообмен между ними не происходит. Как только, они соприкоснутся — начнётся взаимодействие. Так как температура первого тела больше, то оно начнёт остывать, а второе нагреваться. Происходит теплопередача. В какой-то момент времени она прекратится и наступит тепловое равновесие. То есть температура двух тел станет одинаковой: t1 = t2.
Получившаяся температура называется равновесной. Обозначается она греческой буквой тета — θ. Так как раньше первое тело имело большую температуру, то получается, что в процессе взаимодействия оно отдало тепло. Записать это можно как Q1 — — количество теплоты, отданное первым телом. Второй же объект в процессе подогрелся — увеличил температуру. Обозначить это можно как +Q2 — количество теплоты, полученное вторым телом.
Получить тепло второй объект мог только от первого тела, так как рассматриваемая система изолированная. Соответственно, и отдать определённое количество теплоты первое тело могло только второму. Отсюда можно сделать вывод, что если система теплоизолированная, то эти два количества теплоты одинаковы: Q1 — = +Q2. Фактически это есть уравнение баланса.
Такая запись даётся в школьных учебниках. Но профессиональные физики записывают его в другой форме. Для термодинамики неважно, какой объект отдаёт, а какой получает тепло. Наука изучает только количество теплоты, полученное в процессе. Взяв простую аналогию с весом, когда о похудевшем человеке на два килограмма можно сказать, что он поправился на минус два кило, будет верным записать: Q1 — = -Q1 или -Q1 = Q2.
Если собрать два слагаемых таким образом, чтобы они находились с одной стороны знака равенства, то можно записать: Q1 + Q2 = 0.
Суммарное количество теплоты, образуемое при теплообмене тел в теплоизолированной системе, равно нулю. При этом это правило будет справедливо и для энного количества объектов.
Доказательство закона
Пусть имеется теплоизолированная система, состоящая из нескольких помещённых в неё объектов. Сами тела могут обмениваться теплом только друг с другом. Первый закон термодинамики для системы в целом можно записать как Q = А’ + Δ U. То есть количество теплоты, полученное всей системой, равняется суммарной работе, совершённой всеми телами в совокупности над внешним миром, складывающейся с изменением энергии всех тел внутри системы.
По условию задачи внутренняя энергия меняется не за счёт совершения работы. Поэтому А’ = 0. С другой же стороны, теплоизоляция обозначает, что Q = 0. Иными словами, количество энергии, поступающее из окружения Земли, равняется нулю. Следовательно, изменение внутренней энергии всех тел в системе будет нулевым: Δ U = 0.
Энергия системы состоит из внутренних энергий каждого из входящих в неё тел: U = U1 + U2 +…+ Un. Изменение же её Δ U = Δ U 1 + Δ U 2 + … + Δ Un. Отсюда следует, что если внутренняя энергия остаётся неизменной, то сумма Δ U будет нулевой: Δ U 1 + Δ U 2 + … + Δ Un = 0.
Первый закон термодинамики персонально для каждого из тел входящих в систему можно записать как следующую систему:
Все уравнения, входящие в неё, можно сложить почленно. При этом распределив слагаемые для удобства дальнейшего анализирования: Q1 + Q2 +…+ Q n = (А n1′ + А n2′ + … + А n’) + (Δ U1 + Δ U2 + … + Δ Un). Из полученного выражения можно сделать вывод, что сумма дельт второго члена в правой части равняется нулю. В первом же члене с правой стороны каждое слагаемое также равняется нулю. Поэтому можно записать: Q1 + Q2 +…+ Q n = 0. Что и следовало доказать.
Для решения задач полезно вспомнить, на что может идти полученное тепло. К таким частным случаям относят:
- Процессы, при которых нет фазовых переходов. В таком случае полученное количество идёт на увеличение теплоты потенциальной и кинетической энергии: Q = c * m * ΔT (изохорная теплоёмкость).
- Плавление. Например, есть тающий лёд, к которому подводят тепло, при этом кинетическая энергия остаётся постоянной. Значит, изменяется только потенциальная мощность. В этом случае происходит превращение льда в воду. Это действие называют плавлением — переход кристаллического вещества из твёрдого состояния в жидкое: Q = λ * m.
- Парообразование. Выделение из жидкости пара: Q = L * m.
Типовое задание
Явление теплового баланса используется как в изучении процессов при переходе из одного агрегатного состояния в другое, так и для твёрдых или жидких тел, не изменяющих решётку. Существуют типовые задания, входящие в школьную программу. Ученик, решая их, научится находить удельные параметры и сможет понять всю важность выражения теплового баланса.
В латунный котёл массой 128 граммов, содержащий 240 граммов воды, при 8,4 градусах опущено металлическое тело массой 192 грамма, нагретое до 120 градусов Цельсия. Окончательная установившаяся температура составила 21,5 градус. Определить удельную теплоёмкость рассматриваемого тела. Для решения задачи необходимо из справочника взять значение энергетической теплоёмкости латуни. Она составляет 400 Дж/ кг *С 0 . При этом нужно учитывать, что котёл теплоизолирован.
Температуру, которая установилась через время, обозначают буквой θ. Решение подобных задач начинают с установления количества тел, участвующих в теплообмене. В этом примере их три: вода, котёл, испытываемое тело. Количество тепла, полученное всеми тремя объектами, согласно закону, будет равняться нулю: Qв + Qк +Qт = 0. Теперь следует каждое слагаемое расписать отдельно:
- Qв = mв * cв * Св (θ — Tв).
- Qк = mк * cл * (θ — Tв).
- Qт = mт * cт * (θ — Tк).
Полученные формулы нужно подставить в исходное уравнение. При этом следует обратить внимание, что при подстановке образуется общий множитель (θ — T в), который можно вынести за скобки: (m в * c в + m к * c л) * (θ — T в) + m т * c т * (θ — T к) = 0.
Из условия задачи известно, что у тела температура 100 градусов, а равновесная температура меньше. Поэтому последняя скобка будет отрицательной. Значит, есть смысл перенести это слагаемое вправо, поменяв местами вычитаемое и уменьшаемое: (m в * c в + m к * c л) * (θ — T в) = m т * c т * (T к — θ). Отсюда можно выразить удельную теплоёмкость массы тела. Она будет равняться: C т = (m в * c в + m к * c л) * (θ — T в) / m т * (T к — θ) .
Все данные, используемые в формуле, известны. Остаётся только провести расчёты, подставив значения: Cт = (0,24 кг * 4,2 кДж/кг*С + 0,128 кг * 0,4 кДж/кг*С *(21,5 — 8,4) С) / 0,192 кг * (100 — 21,5)С = 0,921 кДж/ кг *С 0 . Полученное вещество является алюминием.
Примеры высокого уровня
Эти задачи рассчитаны на подготовленных учащихся, понимающих суть процессов и знающих уравнение баланса. Например, электрическая установка с мощностью P = 350 Вт не может нагреть воду массой 0,6 кг до кипения. Убедившись в этом, её выключают. Нужно определить, каким останется конечный нагрев воды через 15 секунд.
Из условия можно утверждать, что мощность теплопотерь равняется мощности нагревателя: Pпот = P. По сути, мощность теплопотерь это количество тепла, отдаваемое телом в единицу времени. То есть: P пот = Q — / ΔT. С другой стороны, отданное тепло находится из формулы: Q — = c * m * (-ΔT). Отсюда можно записать: P = — c * m * ΔT / Δt. Из последнего выражения легко выразить искомый параметр: ΔT = -(P * Δt) / (c * m). Все необходимые данные есть в условии и их необходимо просто подставить: ΔT = — 350 Вт * 15 с / 4200 Дж * 0,6 кг = — 2,1 С 0 . Минус в ответе показывает, что температура понижается. Задача решена.
Вот ещё одна задача, для решения которой необходимо вначале исследовать ситуацию. В ёмкость поместили смесь, состоящую из пяти килограммов воды и трёх килограммов льда. Затем туда пустили 0,2 кг водяного пара при температуре 100 0 С. Нужно определить, что произойдёт.
По условию задачи даны три массы mв, mл, mп. Можно предположить, что при смешении в момент запуска пара температура в системе была нулевой. Это исходит из того, что в ёмкости одновременно находится лёд и вода. Поступающий пар конденсирует, и из него образуется вода. Через время она остывает до нуля. Поэтому в начальный момент выделившаяся энергия идёт только на таяние льда. Cуществует три варианта развития события:
- Лёд не растает ( θ =0 0 С).
- Лёд полностью растает (0 0 С).
- Вода начнёт кипеть ( θ = 100 0 С) .
Для того чтобы выяснить, какой вариант верный, нужно найти выделившуюся энергию: Qпл = λ * m = 330 * 3 = 990 кДж. Получается, чтобы растопить лёд, нужно 990 кДж теплоты. Пар, вступая в реакцию, отдаёт: Q- = L* m + cв * mв (Tпар – Tпл) = 2300 + 0,2 + 4,2 * 0,2 * 100 = 544 кДж. Учитывая два полученных результата, можно утверждать, что при конденсации основного пара выделившейся теплоты будет недостаточно для расплавления льда. Следовательно θ = 0 0 С.
Пособие рекомендовано учащимся, желающим
получить практические навыки в решении задач на
теплообмен, и может быть полезным для учителей и
абитуриентов.
При соприкосновении тел, имеющих разные
температуры, между этими телами происходит
теплообмен. С точки зрения
молекулярно-кинетической теории, это
объясняется так: молекулы более нагретого тела
имеют большую кинетическую энергию, чем молекулы
тела, менее нагретого. При “столкновениях”
молекул соприкасающихся тел происходит процесс
выравнивания их средних кинетических энергий.
Молекулы более нагретого тела теряют часть своей
кинетической энергии, при этом нагретое тело
будет остывать. Кинетическая энергия молекул
холодного тела возрастает, поэтому температура
этого тела будет увеличиваться. В конечном итоге
кинетические энергии молекул обоих тел
сравняются, и температуры тел станут
одинаковыми. На этом теплообмен прекращается.
Энергию, которую тело получает или отдаёт в
процессе теплообмена, называют количеством
теплоты (Q).
Количество теплоты, как и все другие виды
энергии, измеряется в системе СИ в Джоулях: [Q] = Дж.
(Здесь и в дальнейшем единицы измеряются в
системе СИ.)
Нагревание или охлаждение
При нагревании или охлаждении тела количество
теплоты, поглощаемое или выделяемое им,
рассчитывается по формуле:
Q = сm(t2 – t1), (1)
где m – масса тела, кг;
(t2 – t1) – разность температур
тела,° С (или К);
с – удельная теплоёмкость вещества, из
которого состоит тело,
Удельная теплоёмкость вещества – это
количество теплоты, которое нужно сообщить
одному килограмму данного вещества, чтобы
увеличить его температуру на 1° С (или это
количество теплоты, которое выделяет один
килограмм данного вещества, остывая на 1° С).
Значения удельных теплоемкостей других
веществ можно найти в справочниках, а также в
школьном учебнике или задачнике.
При нагревании тела его внутренняя энергия
увеличивается. Это требует притока энергии к
телу от других тел. Значит, оно поглощает
некоторое количество теплоты, принимая его от
других тел, участвующих в теплообмене.
При охлаждении тела его внутренняя энергия
уменьшается. Поэтому остывающее тело отдаёт
кому-либо некоторое количество теплоты.
Обычно конечную температуру, установившуюся в
результате теплообмена, обозначают греческой
буквой (тэта).
В формуле (1) произведение cm для каждого
конкретного тела есть величина постоянная. Её
называют теплоёмкостью тела и обозначают С:
C = c m.(2)
Размерность теплоемкости: Теплоемкость тела показывает,
сколько энергии нужно подвести к данному телу,
чтобы нагреть его на 1° С (или сколько энергии
выделяет это тело, остывая на 1° С).
Теплообмен между телами, имеющими одинаковые
температуры, не происходит, даже если
контактируют вещества, находящиеся в разных
агрегатных состояниях. Например, при температуре
плавления (0° С) лёд и вода могут находиться
бесконечно долго, при этом количество льда и
количество воды останутся неизменными.
Аналогично ведут себя пар и жидкость,
находящиеся при температуре кипения. Теплообмен
между ними не происходит.
Плавление или кристаллизация
Если при нагревании тела его температура
достигнет температуры плавления, то начинает
происходить процесс перехода этого вещества из
твердого состояния в жидкое. При этом идут
изменения в расположении и характере
взаимодействия молекул. Температура при
плавлении не изменяется. Это означает, что
средние кинетические энергии молекул жидкости и
твердого тела при температуре плавления
одинаковы. Однако внутренняя энергия тела при
плавлении возрастает за счет увеличения энергии
взаимодействия молекул. Количество теплоты,
поглощаемое телом при плавлении, рассчитывается
по формуле
(3)
где m – масса тела, кг;
–
удельная теплота плавления,
При кристаллизации, наоборот, внутренняя
энергия тела уменьшается на величину и эта теплота данным
телом выделяется. Она поглощается другими
телами, участвующими в теплообмене.
Удельная теплота плавления показывает,
сколько энергии нужно сообщить одному
килограмму данного вещества, взятого при
температуре плавления, чтобы полностью
превратить его при этой температуре в жидкость
(или сколько энергии выделяет 1 кг жидкости,
взятой при температуре кристаллизации, если вся
она при этой температуре полностью превратится в
твёрдое тело).
Удельную теплоту плавления любого вещества
можно найти в справочниках. Для льда же
Температура плавления у каждого вещества своя.
Её также можно найти в справочниках. Важно
подчеркнуть, что температура плавления вещества
равна температуре кристаллизации этого же
вещества. У льда tпл = 0° С.
Кипение или конденсация
При достижении жидкостью температуры кипения
начинает происходить другой фазовый переход –
кипение, при котором расстояния между молекулами
значительно увеличиваются, а силы
взаимодействия молекул уменьшаются. Вся
подводимая к жидкости теплота идет на разрыв
связей между молекулами. При конденсации пара в
жидкость, наоборот, расстояния между молекулами
значительно сокращаются, а силы взаимодействия
молекул увеличиваются. Для кипения жидкости
энергию к жидкости нужно подводить, при
конденсации пара энергия выделяется. Количество
теплоты, поглощаемое при кипении или выделяемое
при конденсации, рассчитывается по формуле:
где m – масса тела, кг; L – удельная
теплота парообразования,
Удельная теплота парообразования
показывает, сколько энергии нужно сообщить
одному килограмму жидкости, взятой при
температуре кипения, чтобы при этой температуре
полностью превратить её в пар (для конденсации:
сколько энергии выделяет один килограмм пара,
взятого при температуре конденсации, полностью
превращаясь в жидкость).
При одинаковом давлении температура кипения и
температура конденсации одного и того же
вещества одинаковы.
Температуры кипения и удельные теплоты
парообразования также можно найти в
справочниках. Для воды же они соответственно
равны: рис. 9 (при нормальном атмосферном
давлении).
Уравнение теплового баланса
Тела, участвующие в теплообмене, представляют
собой термодинамическую систему.
Термодинамическая система называется теплоизолированной,
если она не получает энергию извне и не отдаёт её;
теплообмен происходит только между телами,
входящими в эту систему. Для любой
теплоизолированной системы тел справедливо
следующее утверждение: количество теплоты,
отданное одними телами, равно количеству
теплоты, принимаемому другими телами.
Qотд. = Qполуч. (5)
Это утверждение описывает частный случай
закона сохранения и превращения энергии в
применении к процессу теплообмена. А формула (5)
является одним из видов уравнения теплового
баланса.
При решении задач с помощью данного вида
уравнения теплового баланса в формуле (1) в
качестве t2 следует брать большую
температуру, а в качестве t1 – меньшую.
Тогда разность (t2 – t1) будет
положительна и всё произведение cm(t2–t1)
также будет положительным. Все теплоты, отданные
и полученные, будут положительными.
Уравнение теплового баланса можно записать и в
таком виде:
Q1+ Q2+…+ Qn= 0, (6)
где n – количество тел системы.
Алгебраическая сумма всех количеств теплоты
(поглощенных и выделенных) в теплоизолированной
системе равна нулю.
Q1, Q2, …, Qn – это теплоты,
поглощаемые или выделяемые участниками
теплообмена. Очевидно, что в этом случае какие-то
теплоты должны быть положительны, а какие-то –
отрицательны. При записи уравнения теплового
баланса в виде (6) всегда t2 – конечная
температура, а t1 – начальная.
Если тело нагревается, то разность (t2 – t1)
положительна и все произведение cm(t2 – t1)
положительно. То есть Q > 0 тогда, когда теплота к
данному телу подводится.
А если t2 < t1 (тело остывает), то
разность (t2 – t1) отрицательна, то есть
Q < 0. В этом случае тело энергию выделяет.
Если при фазовом переходе энергия к телу
подводится (плавление, кипение), то Q > 0; если
тело выделяет энергию (кристаллизация,
конденсация), то Q < 0.
В принципе уравнения (5) и (6) равносильны.
Результат решения задачи не зависит от того,
каким видом уравнения пользуемся. Выбор способа
решения – за читателем.
Применим уравнение теплового баланса для
решения ряда задач (здесь приводим лишь одну
задачу, остальные материалы можно найти по
адресу http:// kirov-festival.nm.ru).
Задача 1
В медном калориметре массой 100 г находится 1 кг
воды при температуре 20° С. В воду опускают
свинцовую деталь массой 2 кг, имеющую температуру
90° С. До какой температуры нагреется вода? (В этой
и последующих задачах потерями теплоты в
калориметре пренебречь.)
Решение
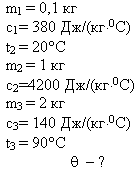 |
Проведём анализ:
Вода и калориметр При опускании в воду с температурой 20° С |
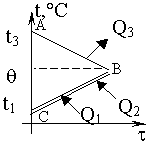 |
Изменение температур тел с течением времени удобно изображать на графике зависимости t(t ). Отрезок АВ соответствует |
| Два параллельных отрезка СВ соответствуют графикам изменения температур калориметра и воды. Стрелки, идущие к ним, показывают, что для нагревания калориметра и воды требуется энергия Q1 и Q2, которую они поглощают. |
|
| Решим задачу с использованием уравнения теплового баланса в виде (5): |
Решим задачу с использованием уравнения
теплового баланса в виде (6):
Ответ: Вода нагреется до 24° С.
Предлагаю читателю самостоятельно сделать
проверку размерности.
Напомним, остальной материал (полноценную
версию пособия) можно найти по адресу http:// kirov-festival.nm.ru.
Содержание:
Тепловое равновесие:
Температура — мера средней кинетической энергии теплового движения частиц вещества
В повседневной жизни под температурой мы понимаем степень нагретости тела (холодное, тёплое, горячее). Такой подход является довольно субъективным, он зависит не только от состояния рассматриваемого тела, но и от наших ощущений. Чтобы избежать субъективной неопределённости, необходимо установить способ измерения температуры.
Тепловое равновесие
Если привести в соприкосновение два тела, то молекулы этих тел, взаимодействуя между собой, будут обмениваться энергией. При этом молекулы с большей кинетической энергией передают часть энергии молекулам с меньшей кинетической энергией. В результате средняя кинетическая энергия теплового движения молекул одного тела увеличивается, а другого — уменьшается. Отдающее энергию тело называют более нагретым, а тело, к которому энергия переходит, — менее нагретым. Как показывает опыт, такой переход энергии продолжается до тех пор, пока не установится некоторое состояние, в котором тела могут находиться сколь угодно долго. В этом состоянии степень нагретости тел становится и остаётся одинаковой, следовательно, у тел одинаковая температура. Это учитывают при измерении температуры тела. Термометр приводят в соприкосновение с телом, но отсчёт его показаний выполняют не сразу, а через некоторый промежуток времени. Это необходимо для того, чтобы между термометром и телом установилось тепловое равновесие.
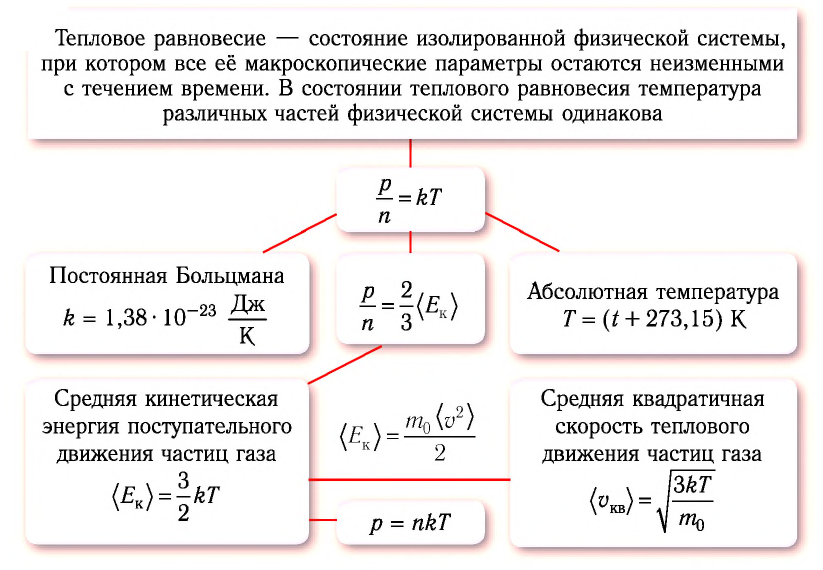
Тепловое равновесие — состояние изолированной физической системы, при котором все её макроскопические параметры остаются неизменными с течением времени.
Под изолированной, или замкнутой, системой понимают систему тел, которая не обменивается энергией с окружающими телами.
Отметим, что у тел, входящих в физическую систему, находящуюся в состоянии теплового равновесия, могут быть различные значения плотности, концентрации, давления и объёма. Однако температура всех тел, входящих в такую систему, всегда одинакова.
Интересно знать:
Понятия «градус» и «температура» появились задолго до изобретения термометра. Знаменитый древнеримский врач Гален (II в.) считал, что все лекарства следует различать по «градусам» (от лат. gradus — ступень) теплоты, холода, сухости и влажности. Гален учил, что одни лекарства оказывают охлаждающее действие, а другие — согревающее. При необходимости следовало смешивать лекарства, чтобы умерить излишнее тепло влажностью, а холод — сухостью. От латинского слова temperature (смешение) возник термин «температура».
Температура и средняя кинетическая энергия поступательного движения молекул газа
Определение температуры должно основываться на такой физической величине, которая характеризует состояние тел и является одинаковой для любых тел, находящихся в состоянии теплового равновесия. Необходимым свойством обладает средняя кинетическая энергия теплового движения частиц вещества. Тепловое движение частиц вещества существенно изменяется при изменении его агрегатного состояния. Максимально простым оно оказывается у одноатомного газа, атомы которого совершают только поступательное движение.
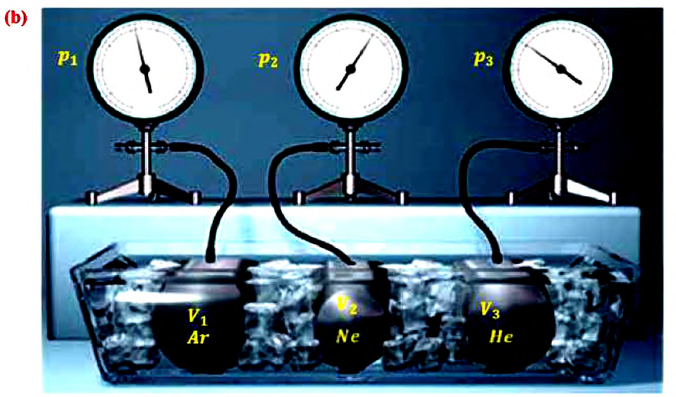
Возьмём несколько сосудов разной вместимости, снабжённых манометрами для измерения давления (рис. 16). Заполнив их различными газами, например аргоном, неоном и гелием, поместим сначала в сосуд с тающим льдом (
Опытным путём установлено, что в состоянии теплового равновесия, несмотря на различные значения давления 
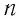
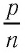
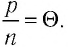
Здесь 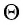
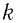
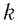
Если для измерения температуры использовать абсолютную температурную шкалу, то при определении числового значения температуры по этой шкале полагают:
Абсолютную (термодинамическую) шкалу температур предложил в 1848 г. выдающийся английский физик Уильям Томсон (1824—1907), удостоенный за работы в области физики в 1892 г. титула лорда Кельвина. Поэтому эту шкалу обычно называют шкалой Кельвина.
Шкала Кельвина совершенно не зависит от физических свойств каких бы то ни было веществ, поэтому её можно считать абсолютной и универсальной.
Нулевая точка по шкале Кельвина соответствует самой низкой теоретически возможной температуре (абсолютный нуль температуры). Температура тающего льда по этой шкале 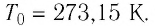
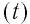
* Единица измерения температуры джоуль неудобна. Например, температура кипения воды, выраженная в джоулях: 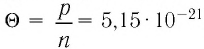
Единица температуры по абсолютной шкале один кельвин (1 К) является основной единицей температуры в СИ и совпадает с одним градусом (1 °С) по шкале Цельсия. Поэтому разность температур по шкале Кельвина и по шкале Цельсия одинакова, т. е. 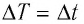
От теории к практике:
Выразите по шкале Кельвина температуру тела здорового человека.
Из основного уравнения молекулярно-кинетической теории идеального газа (3.2) следует: 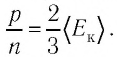
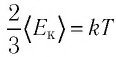
Соотношение (4.2) устанавливает связь между абсолютной температурой Т идеального газа и средней кинетической энергией 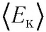
Средняя кинетическая энергия поступательного движения молекул газов, находящихся в состоянии теплового равновесия, одинакова для разных газов и не зависит от массы молекулы газа.
Этот вывод, основанный на экспериментах с разреженными газами, справедлив для жидкостей и твёрдых тел.
Уравнение (4.2) можно записать следующим образом: 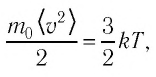
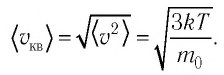
С учётом формулы (4.1) основное уравнение молекулярно-кинетической теории идеального газа может быть записано в виде:
Из уравнения (4.3) следует, что при одинаковых значениях абсолютной температуры Т и концентрации 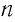
Пример №1
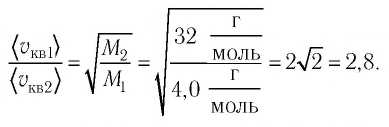
Сравните средние квадратичные скорости атомов гелия и молекул кислорода, если газы находятся в состоянии теплового равновесия.
Решение. Средняя квадратичная скорость теплового движения частиц газа 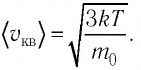
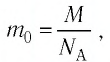
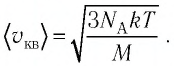
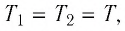
молекул кислорода
Тогда:
Ответ: в состоянии теплового равновесия средняя квадратичная скорость атомов гелия в 2,8 раза больше средней квадратичной скорости молекул кислорода.
Пример №2
В баллоне вместимостью 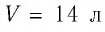
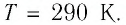
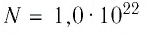
Решение. Начальное давление газа
После того как израсходовали часть газа, а его температура увеличилась до первоначального значения Т, давление газа стало
Тогда убыль давления газа:
Ответ:
Тепловое равновесие, температура
Понятие температуры занимает важное место в повседневной жизни. Так, говоря температура, мы обычно подразумеваем степень нагретости (горячее, теплое, холодное) тела. Такое рассмотрение в достаточной степени субъективно, потому что температура зависит не только от состояния рассматриваемого тела, но и от нашей чувствительности.
Тепловое равновесие:
Известно, что при соприкосновении двух тел с разными температурами между ними происходит теплообмен: тепло переходит от тела с высокой температурой к телу с более низкой температурой. Этот процесс продолжается до тех пор, пока температуры обоих тел не сравняются. Этот факт учитывается при измерении температуры тел — термометр приводится в соприкосновение с телом, но его показания снимаются не сразу, а через определенный промежуток времени, в течение которого между телом и термометром устанавливается тепловое, или так называемое термодинамическое равновесие. При термодинамическом равновесии макроскопические параметры системы остаются постоянными, то есть изменение агрегатного состояния вещества не происходит.
Тепловое или термодинамическое равновесие — это состояние системы, когда ее макроскопические параметры длительное время остаются неизменными.
Состояние теплового равновесия системы характеризуется температурой.
Температура — физическая величина, характеризующая состояние теплового равновесия макроскопической системы: в состоянии теплового равновесия температура всех частей системы одинакова.
Качественное и количественное определение температуры должно основываться на определении физической величины, которая, во-первых, должна характеризовать состояние тела, во-вторых, должна быть одинакова для всех тел, находящихся в тепловом равновесии. Такой величиной является средняя кинетическая энергия поступательного движения молекул вещества. Можно легко определить ее значения для поступательно движущихся молекул одноатомного идеального газа.
С этой целью был поставлен следующий интересный эксперимент: три баллона разного объема, снабженные манометрами (прибор для измерения давления), заполнены различными газами, например, аргоном, неоном и гелием. Баллоны помещаются сначала в тающий лед 
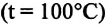
Произведенные вычисления показывают, что в обоих случаях (и при температуре 0°С, и при температуре 100°С) при достижении теплового равновесия, отношение 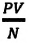
при
при
Если принять во внимание, что 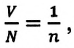
Здесь 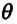
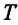
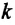
Постоянная Больцмана связывает температуру 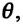
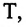
Выражение (6.9) может быть использовано для определения абсолютной температуры в Кельвинах:
Формула (6.10) дает возможность создания новой температурной шкалы. Такая температурная шкала, называемая шкалой абсолютных температур, была предложена в 1848 году английским физиком Уильямом Томсоном (1824-1907). За вклад в области физики в 1892 году он был награжден титулом лорда Кельвина.
Поэтому предложенная им шкала температур называется шкалой Кельвина. Нулевая точка шкалы Кельвина, то есть температура абсолютного нуля, это самая низкая температура, какая возможна теоретически и практически. Согласно этой шкале температура плавления льда равна 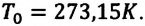
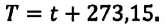
Единица измерения абсолютной температуры, являющейся основной в СИ — Кельвин 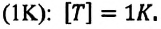
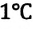
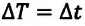
Температура — мера средней кинетической энергии молекул. На самом деле из сравнения выражений (6.4) и (6.9) получаем, что абсолютная температура, являющаяся макроскопическим параметром идеального газа (или разреженного газа), связана со средней кинетической энергией молекул, являющейся ее микроскопическим параметром:
• Средняя кинетическая энергия поступательного движения молекул газа прямо пропорциональна его абсолютной температуре:
Из формулы (6.12) ясно виден физический смысл температуры:
Температура — это мера средней кинетической энергии поступательного движения молекул тела. Это утверждение так же верно для жидкостей и твердых тел. Из формулы видно, что среднее значение кинетической энергии поступательного движения, а значит, и средняя квадратичная скорость молекул при абсолютном нуле равна нулю.
Средняя квадратичная скорость молекул
Из формул (6.1), (6.3) и (6.5) можно вычислить среднюю квадратичную скорость молекул:
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Строение и свойства жидкостей в физике
- Испарение и конденсация в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
- Температура в физике
- Парообразование и конденсация
В этой статье тема «найти тепловое равновесие» будет кратко изложена. В состоянии теплового равновесия передача тепла между двумя веществами, находящимися в контакте, отсутствует.
Из нулевого закона термодинамики мы получаем ясное представление о тепловом равновесии. Тепловое равновесие — это состояние между двумя объектами, при котором тепло не передается и объекты контактируют друг с другом. Температура для двух объектов остается одинаковой для условия теплового равновесия.
Очень интересной концепцией, связанной с температурой, является термин тепловое равновесие. Два вещества находятся в состоянии теплового равновесия, если в замкнутой системе температура объектов повышается или снижается до тех пор, пока они не достигнут состояния равновесия, несмотря на то, что между двумя веществами не происходит передачи энергии. Так же, как и когда вещества не находятся в контакте, они также находятся в состоянии теплового равновесия, если, находясь в контакте, тем не менее обмен энергией между двумя веществами не происходит.
Кредит изображения — Википедия
Примеры теплового равновесия:
Некоторые примеры теплового равновесия обсуждаются ниже.
- Измерение температуры тела человека термометром хороший пример теплового равновесия. При исследовании температуры с помощью термометра температура набирается термометром и через определенное время, когда температура тела и термометра становится одинаковой, теплопередача между телом и термометром прекращается, что означает, что состояние достигает равновесного состояния.
- Внезапно сунуть руку в кубик льда — еще один хороший пример теплового равновесия. Когда рука помещается в кубик льда, в это время температура между кубиком и рукой начинает снижаться. передавать тепло и когда температура между рукой и кубиком льда станет одинаковой, теплопередача будет остановлена, что означает, что состояние достигает состояния равновесия.
- Плавление кубика масла также является примером теплового равновесия. Когда кубик масла помещается в естественную в это время температуру между кубиком и атмосферой, попытайтесь достичь той же температуры, таким образом, начнется передача тепла, и когда температура между атмосферой и кубиком масла станет одинаковой, теплопередача прекратится. , означает, что состояние достигает состояния равновесия.
Как найти тепловое равновесие?
Тепловое равновесие – это состояние, при котором теплообмен двух веществ прекращается, когда их температуры достигают одной и той же точки. Тепловое равновесие определяется по этой формуле
Где,
Q = полная энергия удельной материи тела, выраженная в джоулях.
m = масса конкретного вещества тела, выраженная в граммах.
Ce = Удельная теплоемкость удельной материи тела, которая выражается в джоулях на кельвин на килограмм
Δt = температура конкретного вещества тела, выраженная в градусах Кельвина.
Если заданы значения массы вещества и удельной теплоемкости, температуры, то легко подставляя значения в …уравнение (1), мы можем определить величину теплового равновесия.
Теперь с помощью численной задачи обсуждается тепловое равновесие,
Проблема:
Чтобы 40 граммов воды нагрелись до 45 градусов по Цельсию. Теперь определите значение энергии, при котором вода остается в состоянии теплового равновесия.
Решение:-
В задаче приведены данные,
Масса воды (м) = 40 грамм
Удельная теплоемкость воды Ce = 4.17 Дж на грамм-градус Цельсия
Температура Δt = 45 градусов по Цельсию
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х Δt
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce= Удельная теплоемкость удельного вещества тела
Δt = температура конкретного вещества тела
Теперь мы помещаем значения в уравнение,
Q = 40 х 4.17 х 45
Q = 7506 Дж.
Чтобы 40 граммов воды нагрелись до 45 градусов по Цельсию. Значение энергии, при котором вода остается на тепловое равновесие состояние 7506 Дж.
Когда найти тепловое равновесие?
Когда два тела соприкасаются, тепло (энергия) передается от одного к другому, пока они не достигнут одинаковой температуры (находятся в тепловом равновесии). Когда объекты имеют одинаковую температуру, теплопередача отсутствует.
Формула для расчета теплового равновесия:
Тепло – это поток энергии от более высокой температуры к более низкой температуре. Когда эти температуры уравновешиваются, тепло перестает течь, тогда говорят, что система (или набор систем) находится в тепловом равновесии.
Формула теплового равновесия:
Q = м х Сe х Δt
Где,
Q = полная энергия удельной материи тела, выраженная в джоулях.
m = масса конкретного вещества тела, выраженная в граммах.
Ce= удельная теплоемкость удельного вещества тела, выраженная в джоулях на кельвин на килограмм.
Δt = температура конкретного вещества тела, выраженная в градусах Кельвина.
Как найти конечную температуру в тепловом равновесии?
С помощью числовых значений конечная температура в тепловом равновесии описана ниже,
Кусок железа массой 220 грамм. Температура куска железа составляет 310 градусов по Цельсию. Предположим, что кусок железа опущен на сосуд, наполненный водой. Вес воды 1.2 кг, температура 22 градуса по Цельсию.
Определить конечную температуру теплового равновесия воды.
Решение:-
Пусть конечная температура в тепловом равновесии для воды = Т градусов по Цельсию.
Теперь изменение температуры,
Δт = Токончательный — Тначальный
Изменение тепла,
Q = м х Сe х Δt
Итак, изменение теплоты куска железа равно
ΔQжелезо = 220/1000 х 450 х (Т – 310) Дж
ΔQжелезо = 99 (Т – 310) Дж
Итак, изменение теплоты воды равно
ΔQводы = 1.20 х 4200 х (Т — 22) Дж
ΔQводы = 5040 (Т – 22) Дж
Используя закон сохранения энергии, мы можем написать,
ΔQжелезо+ ΔQводы = 0
Помещая полученные значения,
99 (Т – 310) + 5040 (Т – 22) = 0
99 Тл – 30690 + 5040Т – 110880 = 0
5138 Т = 141570
Т = 141570/5138
Т = 27.5 градусов по Цельсию.
Кусок железа массой 220 грамм. Температура куска железа составляет 310 градусов по Цельсию. Предположим, что кусок железа опущен на сосуд, наполненный водой. Вес воды 1.2 кг, температура 22 градуса по Цельсию.
Конечная температура в тепловом равновесии для воды составляет 27.5 градусов по Цельсию.
Проблема: 1
Сколько энергии потребуется для повышения температуры 55 граммов воды на 40 градусов по Цельсию?
Решение:-
Данные данные,
Масса воды (м) = 40 грамм
Удельная теплоемкость воды Ce = 4.17 Дж на грамм-градус Цельсия
Температура ΔT = 55 градусов по Цельсию
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce = Удельная теплоемкость удельного вещества тела
Delta; t = Температура конкретного вещества тела
Q = 40 х 4.17 х 55
Q = 9174 Дж.
Для повышения температуры 9174 граммов воды на 55 градусов по Цельсию требуется энергия 40 Дж.
Проблема: 2
Рамеш, друг Ратана, увлекается коллекционированием камней. Пока Рамеш собирает камни, он всегда бросает их в контейнер. Контейнер изготовлен из металлического алюминия. Вес контейнера 15.2 грамма. Естественно, температура контейнера составляет около 36 градусов по Цельсию. Теперь Рамешу в алюминиевую тару наливают холодную воду. Температура воды будет 22 градуса по Цельсию, а вес воды 32 грамма.
Определите точную температуру, при которой температура алюминиевого сосуда и температура холодной воды будут одинаковыми.
Решение: —
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce = Удельная теплоемкость удельного вещества тела
Delta; t = (Конечная температура – Начальная температура) удельного вещества тела
Для алюминия,
QA = мA * СeA * ΔtA ………….. уравнение (1)
Данные данные,
mA = 15.2 грамма
CeA = 0.215 калории на грамм-градус Цельсия
ΔtA = (Тf — ТiA) градус Цельсия = (Tf – 36) градусов по Цельсию
Для воды,
QW = мW * СeW * ΔtW ………….. уравнение (1)
Данные данные,
mW = 32 грамм
CeW = 1 калории на грамм-градус Цельсия
ΔtW = (Тf — ТiW) градус Цельсия = (Tf – 22) градусов по Цельсию
Теперь из ………….. уравнения (1) и ………….. уравнения (2) мы можем написать,
QA = мA * СeA * ΔtA знак равно QW = (-) мW * СeW * ΔtW
Подставляя значение из уравнения (1) и уравнения (2),
15.2 х (0.215) х (Тf – 36) = (-) 32 х 1 х (Тf — 22)
(Поместите значение для CeW = 1 калории на грамм-градус Цельсия
3.268 х (Тf – 36) = -32 (Тf — 22)
3.268 Tf – 117.648 = -32 Тлf + 704
3.268 Tf + 32 тf = 704 + 117.648
Tf = 704 + 117.648/35.268
Tf = 23.2 градуса по Цельсию
Рамеш, друг Ратана, увлекается коллекционированием камней. Пока Рамеш собирает камни, он всегда бросает их в контейнер. Контейнер изготовлен из металлического алюминия. Вес контейнера 15.2 грамма. Естественно, температура контейнера составляет около 36 градусов по Цельсию. Теперь Рамешу в алюминиевую тару наливают холодную воду. Температура воды будет 22 градуса по Цельсию, а вес воды 32 грамма.
Точная температура, при которой температура алюминиевого контейнера и температура холодной воды будут одинаковыми, составляет 23.2 градуса по Цельсию.
Проблема: 3
Неустановленный металл хранится в лаборатории. Вес неуказанного металла 6 грамм. Теперь к неуказанному металлу добавлена энергия 248.2 Дж. Температура неуказанного металла повышается до 116 градусов по Цельсию.
Теперь определите количество удельной теплоемкости для неуказанного металла.
Решение:-
Данные данные,
Масса неуказанного металла (м) = 6 грамм
Нужно рассчитать,
Удельная теплоемкость для неуказанного металла Ce знак равно Джоуль на грамм-градус Цельсия
Температура Delta; t = 116 градуса по Цельсию
Общая энергия неуказанного металла (Q) = 248.2 Дж.
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Ce = Q/мDelta; t
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce= Удельная теплоемкость удельного вещества тела
Delta; t = Температура конкретного вещества тела
Ce = 248.2 / 6Delta; t
Ce= 248.2/6 х 116
Ce = 0.356 Дж на грамм-градус Цельсия.
Неустановленный металл хранится в лаборатории. Вес неуказанного металла 6 грамм. Теперь к неуказанному металлу добавлена энергия 248.2 Дж. Температура неуказанного металла повышается до 116 градусов по Цельсию. Количество удельной теплоты для неуказанного металла составляет 0.356 Дж на грамм-градус Цельсия.
Вывод:
Две физические системы находятся в тепловом равновесии, если между ними нет чистого потока тепловой энергии, когда они соединены путем, проницаемым для тепла.