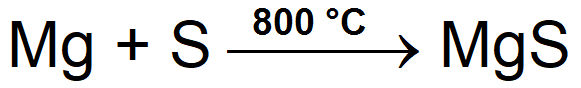| Сульфид магния | |
|---|---|
| Систематическое наименование |
Сульфид магния |
| Традиционные названия | Сернистый магний |
| Хим. формула | MgS |
| Состояние | Белые кристаллы |
| Молярная масса | 56,37 г/моль |
| Плотность | 2,86 г/см³ |
| Температура | |
| • плавления | разл. при 2000 °C |
| Мол. теплоёмк. | 45,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | -348 кДж/моль |
| Рег. номер CAS | 12032-36-9 |
| PubChem | 82824 |
| Рег. номер EINECS | 234-771-1 |
| SMILES |
[Mg+2].[S-2] |
| InChI |
1S/Mg.S SMDQFHZIWNYSMR-UHFFFAOYSA-N, QENHCSSJTJWZAL-UHFFFAOYSA-N |
| ChemSpider | 8305407 |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид магния — бинарное неорганическое соединение магния и серы с формулой MgS, бесцветные кристаллы.
Получение
- Непосредственно из элементов:
-
- Mg + S →800oC MgS
Физические свойства
Сульфид магния образует бесцветные (или розовато-красные из-за примесей) кристаллы, кубическая сингония, пространственная группа F m3m, параметры ячейки a = 0,51913 нм, Z = 4, упаковка типа NaCl.
Химические свойства
- Реагирует с водой, медленно с холодной:
-
- 3 MgS + 2 H2O → Mg(HS)2 + 2 MgO + H2S
- быстрее с горячей:
-
- MgS + H2O → MgO + H2S
- Реагирует с кислотами:
-
- MgS + 2 HCl → MgCl2 + H2S
- Окисляется кислородом:
-
- MgS + 2 O2 → MgSO4
Соединения магния
- Магний (Mg)
- Азид магния (Mg(N3)2) Тринитрид магний
- Алюминат магния (Mg(AlO2)2) Метаалюминат магния
- Амид магния (Mg(NH2)2)
- Антимонид магния (Mg3Sb2) Магний сурмянистый
- Арсенат магния (Mg3(AsO4)2) Магний мышьяковокислый
- Арсенид магния (Mg3As2) Магний мышьяковистый
- Аурат магния (Mg[AuO2]2)
- Ацетат магния (Mg(C2H3O2)2) Магний уксуснокислый
- Бензоат магния (Mg(C6H5COO)2) Магний бензойнокислый
- Борид магния (MgB2) Магний бористый
- Бромат магния (Mg(BrO3)2) Магний бромноватокислый
- Бромид магния (MgBr2) Магний бромистый
- Ванадат магния (Mg2V2O7) Магний ванадиевокислый
- Висмутид магния (Mg3Bi2)
- Вольфрамат магния (MgWO4) Магний вольфрамовокислый
- Гексаборид магния (MgB6) Бористый магний
- Гексафторогерманат магния (Mg[GeF6])
- Гексафторосиликат магния (MgSiF6)
- Гексацианоферрат II магния (Mg2[Fe(CN)6])
- Гептагидрат сульфата магния (MgSO4·7H2O) Английская соль
- Германид магния (Mg2Ge)
- Гидрид магния (MgH2) Магний водородистый
- Гидроарсенат магния (MgHAsO4)
- Гидрокарбонат магния (Mg(HCO3)2) Бикарбонат магния, Магний двууглекислый
- Гидрокарбонат магния-калия (MgKH(CO3)2)
- Гидроксид магния (Mg(OH)2) Гидроокись магний
- Гидроортофосфат магния (MgHPO4)
- Гипофосфит магния (Mg(PH2O2)2) Магний фосфорноватистокислый (Фосфинат магния)
- Глицерофосфат магния (MgC3H7O6P)
- Дигидроортофосфат магния (Mg(H2PO4)2)
- Дителлурид магния (MgTe2)
- Дифенилмагний (Mg(C6H5)2)
- Диэтилмагний (Mg(C2H5)2)
- Додекаборид магния (MgB12)
- Йодат магния (Mg(IO3)2) Магний йодноватокислый
- Йодид магния (MgI2) Магний йодистый
- Карбид магния (MgC2) Ацетиленид магния
- Карбонат магния (MgCO3) Магний углекислый
- Карбонат магния лекарственное средство
- Каустический магнезит
- Магнезит
- Метаборат магния (Mg(BO2)2) Магний борнокислый мета
- Метагерманат магния (MgGeO3) Магний германиевокислый
- Метасиликат магния (MgSiO3) Магний кремнекислый магний
- Метатитанат магния (MgTiO3) Магний титановокислый мета
- Молибдат магния (MgMoO4) Магний молибденовокислый
- Нитрат магния (Mg(NO3)2) Магний азотнокислый
- Нитрид магния (Mg3N2) Магний азотистый
- Нитрит магния (Mg(NO2)2) Магний азотистокислый
- Оксид магния (MgO) Магний окись (магнезия жженая)
- Оксалат магния (MgC2O4) Магний щавелевокислый
- Олеат магния (Mg(C18H33O2)2) Магний олеиновокислый
- Ортоарсенат магния (Mg3(AsO4)2)
- Ортоборат магния (Mg3(BO3)2)
- Ортосиликат магния (Mg2SiO4)
- Ортотитанат магния (Mg2TiO4)
- Перманганат магния (Mg(MnO4)2) Магний марганцовокислый
- Пероксид магния (MgO2) Перекись магния
- Перхлорат магния (Mg(ClO4)2) Магний хлорнокислый (Ангидрон)
- Пирофосфат магния (Mg2P2O7)
- Рицинолеат магния (Mg(C18H33O3)2) Магний рицинолевокислый
- Селенат магния (MgSeO4) Магний селеновокислый
- Селенид магния (MgSe) Магний селенистый
- Селенит магния (MgSeO3) Магний селенистокислый
- Силицид магния (Mg2Si) Магний кремнистый
- Станнид димагния (Mg2Sn)
- Стеарат магния (MgC36H70O4) Магний стеариновокислый
- Стекломагниевый лист
- Сульфат магния (MgSO4) Магний сернокислый
- Сульфид магния (MgS) Магний сернистый
- Сульфит магния (MgSO3) Магний сернистокислый
- Тартрат магния (MgC4H4O6) Магний виннокислый
- Теллурид магния (MgTe) Магний теллуристый
- Тиосульфат магния (MgS2O3) Гипосульфит магния
- Тиоцианат магния (Mg(SCN)2) Магний роданистый
- Трикарбид димагния (Mg2C3)
- Формиат магния (Mg(HCOO)2) Магний муравьинокислый
- Фосфат магния (Mg3(PO4)2) Магний Фосфорнокислый (Фосфат магния)
- Фосфид магния (Mg3P2) Магний фосфористый
- Фторид магния (MgF2) Магний фтористый
- Хлорат магния (Mg(ClO3)2) Магний хлорноватокислый
- Хлорид магния (MgCl2) Магний хлористый
- Хлорофилл
- Хлорофилл с1
- Хлорофилл с2
- Хлорофилл с3
- Хромат магния (MgCrO4) Магний хромовокислый
- Хромит магния (MgCr2O4) Магний хромистокислый
- Цирконат магния (MgZrO3) Магний циркониевокислый
- Цитрат магния (MgC6H6O7) Магний лимоннокислый
Сульфид магния это неорганическое вещество, кристаллы его бесцветны, но примеси дают слегка розоватый оттенок.
Сульфид магния это соединение магния с серой имеет формулу MgS, можно получить реакцией магния с серой.
Что такое сульфид магния
Сульфид магния представляет собой простое неорганическое соединение, состоящее из магния и сульфида. Формула сульфида магния или формула для сульфида магния дана как MgS.
Это химическая формула сульфида магния, и одним из лучших способов понять его физическую важность является определение молекулярной массы соединения.
Молекулярная масса соединения, определенная формулой сульфида магния или формулой для сульфида магния, составляет 56,38 г/моль.
Еще одним интересным свойством, которое можно понять, посмотрев на формулу сульфида магния, является электронный обмен между двумя элементами.
Из формулы магния сульфида ясно, что магний и сера образуют соединение в соотношении 1:1, поэтому два электрона, пожертвованные магнием, поглощаются атомами серы при поддержании нейтрального заряда.
Общие свойства сульфида магния
Как правило, магния сульфид, имеющий MgS в качестве химической формулы сульфида магния, получают в виде шлака из процесса выплавки стали.
Он встречается как редкий минерал в некоторых метеоритах в виде минерального нинингерита. Он также находится в некоторых оболочках, включающих некоторые из определенных углеродных звезд.
Сульфид магния или сульфид, представленный в виде MgS (молекулярная формула сульфида магния), представляет собой белое кристаллическое твердое вещество.
Обычно магния сульфид находится в нечистой форме, которая представляет собой коричневый и некристаллический порошок.
Он обычно производится промышленными предприятиями при производстве металлического железа. Кристаллическая структура или комбинация атомов, как показано на рисунке выше.
Физические свойства
Сульфид магния образует бесцветные (или розовато-красные из-за примесей) кристаллы, кубическая сингония, пространственная группа F m3m, параметры ячейки a = 0,51913 нм, Z = 4, упаковка типа NaCl.
Химические свойства
Реагирует с водой, медленно с холодной:
3MgS + 2H2O → Mg(HS)2 +2MgO + H2S↑
Реакция идет быстрее с горячей водой:
3MgS + 2H2O → MgO + H2S↑
Реагирует с кислотами:
MgS + 2HCl → MgCl2 + H2S↑
Полученный MgCl2 используют в получении магния.
Окисляется кислородом:
MgS + 2O2 → MgSO4
Получение сульфида магния
Поскольку формула сульфида магния или формула для сульфида магния показывает, что он состоит из сульфида магния, следовательно, он образуется в результате реакции серы или сероводорода с магнием.
Кристаллы сульфида магния имеют структуру каменной соли, потому что это самая стабильная фаза, которую может принять кристалл хлорида магния.
Тем не менее, кристалл хлорида магния может принимать структуру цинк-обманки и структуру вюрцита в процессе молекулярно-лучевой эпитаксии.
Химические свойства этого соединения, MgS химическая формула сульфида магния или химическая формула сульфида магния, связаны с другими сульфидами, такими как сульфиды натрия, бария или кальция.
Когда сульфид магния реагирует с кислородом, он образует соответствующий сульфат, известный как сульфат магния.
MgS дополнительно может реагировать с водой с образованием сероводорода и гидроксида магния. Он может произвести сероводород по мере того как он делает контакт с влагой.
Применение сульфида магния
Ниже приведены некоторые из примеров, которые показывают применение сульфида магния:
- Он используется в процессе производства стали BOS, т. е. В основном процессе производства кислородной стали. В процессе сера является первым компонентом, который необходимо удалить. Для удаления серы используется много килограммов магния, и таким образом сера удаляется в виде сульфида магния и легко удаляется, так как она продолжает плавать на расплавленном железе.
- Он используется в качестве полупроводника. MgS (формула сульфида магния)-это прямой полупроводник с широкой запрещенной зоной. Он производит сине-зеленый излучатель. Благодаря этому свойству широкой запрещенной зоны сульфид магния можно использовать в качестве фотодетектора для короткой длины волны ультрафиолетового света.
Часто задаваемые вопросы ответы об сульфиде магния?
Вреден ли сульфид магния для человека?
Сульфид магния-это неорганическое соединение, состоящее из магния и серы. Известно, что он вызывает раздражение глаз или коррозию. Воздействие сульфида магния может вызвать серьезное повреждение глаз из-за раздражения.
Растворяется ли сульфид магния в воде?
Как правило, большинство сульфидов, образующихся из металлов, нерастворимы в воде. Существуют некоторые исключения из этих случаев, такие как сульфиды бария, кальция, магния, натрия, калия и аммония.
Сульфиды бария, кальция и магния слабо растворимы в воде. Таким образом, сульфид магния экономно растворяется в воде.
Следовательно, ионное соединение сульфида магния будет диссоциировать на Mg2+ и S2 — при экономном растворении в воде.
Является ли сульфид магния смесью или чистым веществом?
Сульфид магния является чистым веществом. Когда магний и сульфид вступают в реакцию друг с другом, образуется сульфид магния.
После образования сульфида магния молекула сама по себе является чистым веществом и, следовательно, не является смесью. Но если наполнители магния и серы находятся вместе, не вступая в реакцию, то она образует смесь.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| Other names
Niningerite |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.031.597 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgS |
| Molar mass | 56.38 g/mol |
| Appearance | white to reddish brown powder |
| Density | 2.84 g/cm3 |
| Melting point | 2,000 °C (3,630 °F; 2,270 K) approx. |
|
Solubility in water |
decomposes |
| Structure | |
|
Crystal structure |
Halite (cubic), cF8 |
|
Space group |
Fm3m, No. 225 |
|
Coordination geometry |
cubic |
| Thermochemistry | |
|
Heat capacity (C) |
45.6 J/mol K |
|
Std molar |
50.3 J/mol K |
|
Std enthalpy of |
-347 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Source of H2S |
| Related compounds | |
|
Other anions |
Magnesium oxide |
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium sulfide is an inorganic compound with the formula MgS. It is a white crystalline material but often is encountered in an impure form that is brown and non-crystalline powder. It is generated industrially in the production of metallic iron.
Preparation and general properties[edit]
MgS is formed by the reaction of sulfur or hydrogen sulfide with magnesium. It crystallizes in the rock salt structure as its most stable phase, its zinc blende[1] and wurtzite[2] structures can be prepared by molecular beam epitaxy. The chemical properties of MgS resemble those of related ionic sulfides such as those of sodium, barium, or calcium. It reacts with oxygen to form the corresponding sulfate, magnesium sulfate. MgS reacts with water to give hydrogen sulfide and magnesium hydroxide.[3]
Applications[edit]
In the BOS steelmaking process, sulfur is the first element to be removed. Sulfur is removed from the impure blast furnace iron by the addition of several hundred kilograms of magnesium powder by a lance. Magnesium sulfide is formed, which then floats on the molten iron and is removed.[4]
MgS is a wide band-gap direct semiconductor of interest as a blue-green emitter, a property that has been known since the early 1900s.[5] The wide-band gap property also allows the use of MgS as photo-detector for short wavelength ultraviolet light.[6]
Occurrence[edit]
Aside from being a component of some slags, MgS is a rare nonterrestrial mineral niningerite detected in some meteorites. MgS is also found in the circumstellar envelopes of certain evolved carbon stars, i. e., those with C/O > 1.[7]
Safety[edit]
MgS evolves hydrogen sulfide upon contact with moisture.
References[edit]
- ^ Bradford, C.; O’Donnell, C. B.; Urbaszek, B.; Balocchi, A.; Morhain, C.; Prior, K. A.; Cavenett, B. C. (2000). «Growth of zinc blende MgS/ZnSe single quantum wells by molecular-beam epitaxy using ZnS as a sulphur source». Appl. Phys. Lett. 76: 3929. Bibcode:2000ApPhL..76.3929B. doi:10.1063/1.126824.
- ^ Lai, Y. H.; He, Q. L.; Cheung, W. Y.; Lok, S. K.; Wong, K. S.; Ho, S. K.; Tam, K. W.; Sou, I. K. (2013). «Molecular beam epitaxy-grown wurtzite MgS thin films for solar-blind ultra-violet detection». Applied Physics Letters. 102: 171104. Bibcode:2013ApPhL.102q1104L. doi:10.1063/1.4803000.
- ^ Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Irons, G. A.; Guthrie, R. I. L. «Kinetic aspects of magnesium desulfurization of blast furnace iron» Ironmaking and Steelmaking (1981), volume 8, pp.114-21.
- ^ Tiede, E. «Reindarstellung von Magnesiumsulfid und seine Phosphorescenz. I (Preparation of pure magnesium sulfide and its phosphorescence. I)» Berichte der Deutschen Chemischen Gesellschaft (1916), volume 49, pages 1745-9.
- ^ Hoi Lai, Ying; Cheung, Wai-Yip; Lok, Shu-Kin; Wong, George K.L.; Ho, Sut-Kam; Tam, Kam-Weng; Sou, Iam-Keong (2012). «Rocksalt MgS solar blind ultra-violet detectors». AIP Advances. 2: 012149. Bibcode:2012AIPA….2a2149L. doi:10.1063/1.3690124.
- ^ Goebel, J. H.; Moseley, S. H. (1985). «MgS Grain Component in Circumstellar Shells». Astrophysical Journal Letters. 290: L35. Bibcode:1985ApJ…290L..35G. doi:10.1086/184437.
| Сульфид магния | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфид магния |
| Традиционные названия | Сернистый магний |
| Химическая формула | MgS |
| Физические свойства | |
| Состояние (ст. усл.) | Белые кристаллы |
| Молярная масса | 56,37 г/моль |
| Плотность | 2,86 г/см³ |
| Термические свойства | |
| Температура плавления | разл. при 2000 °C |
| Молярная теплоёмкость (ст. усл.) | 45,6 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -348 кДж/моль |
| Классификация | |
| Рег. номер CAS | 12032-36-9 |
Сульфид магния — бинарное неорганическое соединение магния и серы с формулой MgS, бесцветные кристаллы.
Получение
- Непосредственно из элементов:
Физические свойства
Сульфид магния образует бесцветные (или розовато-красные из-за примесей) кристаллы, кубическая сингония, пространственная группа F m3m, параметры ячейки a = 0,51913 нм, Z = 4, упаковка типа NaCl.
Химические свойства
- Реагирует с водой, медленно с холодной:
- быстрее с горячей:
- Реагирует с кислотами:
- Окисляется кислородом:
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5
|
Соединения магния |
|---|
|
Борид магния (MgB2) • Бромид магния (MgBr2) • Гидрид магния (MgH2) • Гидрокарбонат магния (Mg(HCO3)2) • Гидроксид магния (Mg(OH)2) • Гидроортофосфат магния (MgHPO4) • Дигидроортофосфат магния (Mg(H2PO4)2) • Иодид магния (MgI2) • Карбид магния (MgC2) • Карбонат магния (MgCO3) • Нитрат магния (Mg(NO3)2) • Нитрид магния (Mg3N2) • Оксид магния (MgO) • Ортоарсенат аммония-магния (NH4MgAsO4) • Ортоарсенат магния (Mg3(AsO4)2) • Ортофосфат аммония-магния (NH4MgPO4) • Пероксид магния (MgO2) • Перхлорат магния (Mg(ClO4)2) • Силицид магния (Mg2Si) • Сульфат магния (MgSO4) • Сульфид магния (MgS) • Сульфит магния (MgSO3) • Фосфат магния (Mg3(PO4)2) • Фосфид магния (Mg3P2) • Фторид магния (MgF2) • Хлорид магния (MgCl2) • Цитрат магния (MgC6H6O7) |