Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Теоретическое введение
Примеры обратимого гидролиза
Случаи необратимого гидролиза
Константа и степень гидролиза
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
Гидролиз – обменная реакция взаимодействия растворенного вещества (например, соли) с водой. Гидролиз происходит в тех случаях, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.
Примеры обратимого гидролиза
Соли, образованные сильным основанием и слабой кислотой, например, CH3COONa, Na2CO3, Na2S, KCN гидролизуются по аниону:
СН3СООNa + НОН ↔ СН3СООН + NaОН (рН > 7)
Гидролиз солей многоосновных кислот протекает ступенчато. 1 ступень:
CO32– + HOH ↔ HCO3– + OH–,
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH.
2 ступень:
НCO3– + HOH ↔ Н2CO3 + OH—,
или в молекулярной форме:
NaНCO3 + HOH ↔ H2CO3 + NaOH.
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
Соли, образованные слабым основанием и сильной кислотой, например, NH4Cl, FeCl3, Al2(SO4)3, гидролизуются по катиону:
NH4+ + HOH ↔ NH3·H2О + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2О + HCl (рН < 7).
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. 1 ступень:
Fe3+ + HOH ↔ FeOH2+ + H+;
FeCl3 + HOH ↔ FeOHCl2 + HCl
2 ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+;
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl.
3 ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+;
Fe(OH)2Cl + HOH ↔ Fe(OH)3+ HCl.
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Соли, образованные слабым основанием и слабой кислотой, например, CH3COONH4, (NH4)2CO3, HCOONH4, гидролизуются и по катиону, и по аниону:
СH3COO– + NH4+ + HOH ↔ СH3COOH + NH3·H2О.
СH3COONH4 + HOH ↔ СH3COOH + NH3·H2О.
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. Поскольку в рассматриваемом примере константы диссоциации СH3COOH и NH3·H2О при 25оС примерно равны (Кд(СH3COOH) = 1,75·10–5, Кд(NH3·H2О) = 1,76·10–5), то раствор соли будет нейтральным.
При гидролизе HCOONH4 реакция раствора будет слабокислой, поскольку константа диссоциации муравьиной кислоты (Кд(HCOOН) = 1,77·10–4) больше константы диссоциации уксусной кислоты.
Соли, образованные сильным основанием и сильной кислотой (например, NaNO3, KCl, Na2SO4), при растворении в воде гидролизу не подвергаются.
Случаи необратимого гидролиза
Гидролиз некоторых солей, образованных слабыми основаниями и слабыми кислотами, протекает необратимо. Необратимо гидролизуется, например, сульфид алюминия:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Следует отметить, что при смешении растворов солей гидролизующихся по аниону и катиону:
Mg2+ + HOH ↔ MgOH+ + H+,
CO32– + HOH ↔ HCO3– + OH–
Продукты гидролиза первой соли усиливают гидролиз второй соли и наоборот. В результате при смешении водных растворов сульфата магния и карбоната натрия образуется основной карбонат магния:
2MgSO4 + 2Na2CO3 + H2O → Mg2(OH)2CO3↓ + CO2↑ + 2Na2SO4
Основные карбонаты выпадают в осадок также при смешивании растворов карбонатов щелочных металлов и солей Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.
При сливании растворов соды и солей Fe2+, Ca2+, Sr2+, Ba2+ реакции протекают следующим образом:
МеCl2 + Na2CO3 = МеCO3↓ + 2NaCl
(Ме – Fe, Ca, Sr, Ba)
При взаимодействии солей Аl3+, Сr3+ и Fe3+ в растворе с сульфидами, карбонатами и сульфитами в результате гидролиза в осадок выпадают не сульфиды, карбонаты и сульфиты этих катионов, а их гидроксиды:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3↓ + 3СO2↑ + 6KCl,
2Fe(NO3)3 + 3Na2SO3 + 3H2O = 2Fe(ОН)3↓ + 3SO2↑ + 6NaNO3.
Следует отметить, что катион Fe3+ производит окисляющее действие на анион S2-. В результате протекает реакция:
2Fe3+ + S2- = 2Fe2+ + Sо.
Например, хлорид железа (III) реагирует с сульфидом калия:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Некоторые соли в результате гидролиза в воде образуют малорастворимые оксосоединения:
Bi(NO3)3 + H2O → BiONO3↓ + 2 HNO3,
SbCl3 + H2O → SbOCl↓ + 2HCl.
Необратимо гидролизуются в водных растворах галогенангидриды:
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2 HCl,
PCl5 + 4 H2O = H3PO4 + 5 HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl.
Константа и степень гидролиза
Константа Кг и α г степень гидролиза для растворов электролитов связаны между собой уравнением, по форме совпадающим с уравнением Оствальда:

Константа гидролиза Кг может быть рассчитана на основе значений ионного произведения воды Кw и константы диссоциации Кд образующихся в результате гидролиза слабой кислоты или слабого основания:

Примеры решения задач
Задача 1. Вычислите Кг, α г и рН 0,01 М раствора NH4Cl при температуре 298 К, если при указанной температуре Кд(NH3·H2O) = 1,76× 10-5.
Решение.
NH4+ + H2O ↔ NH3·H2O + H+

Кг ≈ Cисх(NH4Cl)·αг2.
αг2 = √(Kг / Cисх(NH4Cl))
или 2,4× 10-2 %.
[Н+] = 2,4·10–4× 0,01 = 2,4× 10–6М.
рН = — lg 2,4× 10–6 = 5,6.
Задача 2. Определите константу гидролиза, степень гидролиза и рН 0,02 М раствора НСООNa при 298 К, если при указанной температуре Кд(НСООН) = 1,77× 10–4.
Решение. Формиат натрия гидролизуется в соответствии с уравнением:
НСОО— + Н2О ↔ НСООН + ОН—.
Поскольку [НСООН] = [ОН–] и [НСОО–]·Сисх(НСООNa), то константу гидролиза можно записать следующим образом:

или 5,3·10-3%.
[Н+] = 10–14÷1,06× 10–6 = 9,4·10–9 М
рН = — lg 9,4× 10–9 = 8
Задача 3. Определите рН 0,006М раствора NaNO2, если α г = 7·10–3%.
Решение.
NO2– + H2O ↔ HNO2 + OH–.
[ОН–] = 0,006× 7× 10–5 = 4,2× 10–7 М.
[Н+] = 10–14:4,2× 10–7 = 2,4× 10–8 М.
рН = — lg 2,4× 10–8 = 7,6.
Задача 5. Определите рН 0,1 М раствора Na3PO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны: Кд.1 = 7,11× 10— 3, Kд.2 = 6,34× 10— 8, Kд.3 = 4,40× 10— 13.
Решение. Na3PO4 диссоциирует в растворе и подвергается ступенчатому гидролизу:
Na3PO4 → 3Na+ + PO43-
PO43- + H2O ↔ HPO42- + OH—
.
Следует обратить внимание на выбор “нужной” величины Кд.
HPO42- + H2O ↔ H2PO4- + OH—
H2PO4— + H2O H3PO4 + OH—
.
H2PO4— HPO42- + H+
Kдисс.2 = 6,34·10— 8
Поскольку Кг,3 < < Kд,2, то гидролиз по третьей ступени практически не идет и в растворе NaH2PO4 преобладает процесс диссоциации ионов H2PO4— .
Так как Кг,1 > > Кг,2, то можно считать, что соль подвергается гидролизу только по первой ступени.
Значит:

поскольку [HPO42- ] = [OH—].
Можно принять, что Сисх(Na3PO4) ≈ [PO43- ], тогда
рОН = –lg 4,76× 10— 2 = 1,32 и рН = 14 – 1,32 = 12,68.
Задачи для самостоятельного решения
1. Гидролиз соли Na2SO3 усилится при добавлении в раствор веществ:
| а) Н2O | б) Na2CO3 | в) NaOH |
| г) H2SO4 | д) Na2S | е) Na2SO4 |
2. Напишите уравнение реакции NiCl2 + Na2CO3 + H2O → .
3. Напишите уравнение реакции Fe2(SO4)3 + Na2CO3 + H2O→
4. Напишите уравнение реакции KCr(SO4)2 + K2S + 6H2O → .
5. Напишите уравнение реакции гидролизa BiCl3.
6. Напишите уравнение реакции гидролизa Al2(SO4)3.
7. Напишите уравнение реакции гидролизa SO2Cl2.
8. Определите рН 0,01 М раствора Na2 НPO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны:
К1 = 7,11× 10— 3, K2 = 6,34× 10— 8, K3 = 4,4× 10— 13.
9. При 298 К рН 0,049 М раствора KCN равен 11. Определите константу диссоциации синильной кислоты при указанной температуре.
10. Рассчитать константу гидролиза, степень гидролиза NH4NO3 в 0,18 М растворе, если рН 0,18 М раствора нитрата аммония равен 5.
Уравнения для расчета константы, степени гидролиза и рН растворов и гидролизующихся солей:
|
Типы |
Кг |
h |
рН |
|
Соль |
|
|
7- |
|
Соль |
|
|
7+ |
|
Соль |
|
|
7- |
Гидролиз
солей – это взаимодействие ионов соли
с водой, приводящее к образованию слабого
электролита.
Различают
3 типа гидролиза солей:
а) гидролиз по
аниону. Соль образована сильным основанием
и слабой кислотой. Например, CH3COONa.
Диссоциация соли
(сильный электролит):
CH3COONa
CH3COO—
+ Na+. (1)
Диссоциация воды
(слабый электролит):
Н2О
Н+ +
ОН—. (2)
Ацетат-ионы
связывают ионы Н+
с образованием молекулы слабого
электролита – уксусной кислоты:
CH3COO—
+ Н+
CH3COOH. (3)
Суммируя уравнения
(2), (3), получаем уравнение гидролиза соли
в ионном виде:
CH3COO—
+ Н2О
CH3COOH
+ ОН—. (4)
Уравнение (4)
показывает, что идет накопление
гидроксид-ионов, а потому раствор
приобретает щелочную реакцию.
В молекулярном
виде гидролиз CH3COONa
записывается так:
CH3COONa
+ Н2О
CH3COOH
+ NaOH.
Количественно
реакция гидролиза характеризуется:
1) степенью гидролиза
(h) – отношением числа гидролизовавшихся
молекул соли к исходному числу молекул
соли;
2) константой
гидролиза (Кг).
В соответствии с
законом действующих масс константа
равновесия для реакции (4):
или
Поскольку
[Н2О]const,
то К[Н2О]const=Кг;
где Кг
– константа гидролиза.
Учитывая, что
,
получаем:
Константа диссоциации
СН3СООН
(Кк):
CH3COOНCH3COO—+Н+
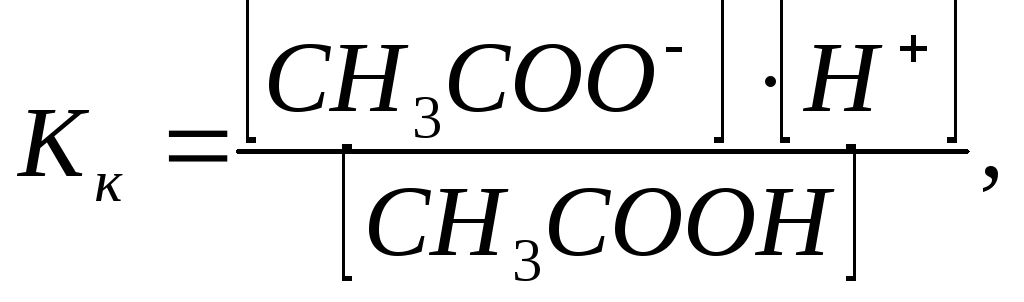
тогда.
Чем больше Кг,
тем сильнее соль гидролизуется.
Обозначим
концентрацию соли CH3COONa
через С. Тогда [CH3COONa]=[CH3COO—]=C.
Степень гидролиза, согласно определению,
можно записать для уравнения (4) следующим
образом: h =
.
Поскольку [СН3СООН]=
[ОН—],
то
.
Для уравнения (4)
концентрация негидролизовавшихся ионов
[CH3COO—]
= C — Ch.
Таким образом,
.
Так как для многих солей величина h –
величина очень малая, то 1-h
1 и Ch2
Кв/Кк.
Откуда ;
б) гидролиз по
катиону. Соль образована сильной кислотой
и слабым основанием. Например, NH4Cl:
NH4Cl
NH4+
+ Cl—
Н2О
Н+ +
ОН—
NH4+
+ ОН—
NH4OH
т. е. NH4+
+ Н2О
NH4OH
+ Н+
В молекулярном
виде:
NH4Cl
+ Н2О
NH4OH
+ HCl.
В этом случае
реакция раствора кислая, т. к. происходит
накопление ионов Н+.
По аналогии с вышерассмотренным примером
можно получить константу и степень
гидролиза для такого типа гидролиза.
Для двух типов
гидролиза степень гидролиза тем больше:
1) чем больше Кв,
т. е. чем больше температура (т. к. Кв
возрастает с температурой);
2) чем меньше Кк
и Косн,
т. е. чем слабее кислота или основание,
которые образуются в результате гидролиза
соли;
3) чем меньше
концентрация, т. е. чем больше разбавлен
раствор.
Таким
образом, чтобы усилить гидролиз солей,
образованных слабым основанием и сильной
кислотой или сильным основанием и слабой
кислотой, необходимо разбавить раствор
соли и нагреть его;
в) гидролиз по
катиону и аниону. Соль образована слабой
кислотой и слабым основанием. Например,
CH3COONH4:
CH3COONH4
CH3COO—
+ NH4+
Н2О
Н+ +
ОН—
CH3COO—
+ Н+
CH3COOH
NH4+
+ OН—
NH4OH
т. е. CH3COONH4
+ Н2О
CH3COOН
+ NH4ОН.
Степень гидролиза
солей, образованных слабой кислотой и
слабым основанием, от разбавления не
зависит. В этом случае рН водных растворов
солей может быть больше, равен или меньше
7: реакция раствора кислая, если Кк
Косн;
щелочная – Кк
Косн
; нейтральная – Кк
Косн.
Гидролиз солей
многоосновных кислот и многокислотных
оснований протекает ступенчато в
соответствии со ступенчатой диссоциацией.
Например, для Na2CO3:
CO3-2
+ H2O
HCO3—
+ OH—
HCO3—
+ H2O
H2CO3
+ OH—
Пример
1. Составьте
ионно-молекулярные и молекулярные
уравнения гидролиза солей: a) NaCN; б) К2СО3;
в) ZnSO4.
Определите реакцию среды растворов
этих солей.
Решение. а) цианид натрия NaCN – соль
слабой одноосновной кислоты HCN и сильного
основания NaOH. При растворении в воде
молекулы NaCN полностью диссоциируют на
катионы Na+и анионы CN—. Катионы
натрия Na+не могут связывать анионы
воды ОН—, так как NaOH – сильный
электролит. А анионы CN—связывают
катионы воды Н+, образуя молекулы
слабого электролита. Соль гидролизуется
по аниону.Ионно-молекулярное уравнение
гидролиза имеет вид:
CN— + Н2ООН— + HCN или в молекулярной форме:CN
+ Н2ОКОН +
HCN. В результате гидролиза появляется
избыток гидроксид-ионов ОН—,
поэтому раствор имеет щелочную реакцию
среды
(рН > 7);
б) карбонат калия
–
соль слабой многоосновной кислоты и
сильного основания. В этом случае анионы
соли СО32-,
связывая водородные ионы воды Н+,
образуют анионы кислой соли НСО3
—,
а не молекулы Н2СО3,
так как ионы НСО3—
диссоциируют гораздо труднее, чем
молекулы Н2СО3.
В обычных условиях гидролиз идет по
первой ступени. Соль гидролизуется по
аниону. Ионно-молекулярное уравнение
имеет вид:
СO3— + H2OОН—+ НСO3—
или в молекулярной форме:К2СО3+ Н2ОКОН +
NaHCО3.В растворе появляется избыток
ионов ОН—, поэтому раствор К2СO3имеет щелочную реакцию (рН > 7);
в) сульфат цинка ZnSО4– соль слабого
многокислотного основания Zn(OH)2и сильной кислоты H2SO4. В этом
случае катионы Zn2+связывают
гидроксильные ионы воды ОН—,
образуя катионы основной соли ZnOH+.
Образование молекул Zn(OH)2не
происходит, так как ионы ZnОН+диссоциируют гораздо труднее, чем
молекулы Zn(OH)2. В обычных условиях
гидролиз идет по первой ступени. Соль
гидролизуется по катиону.
Ионно-молекулярное уравнение гидролиза
имеет вид:
Zn2++ Н2ОН++ ZnОН+или в молекулярной
форме:
2ZnSО4+ 2Н2О(ZnOH)2SО4
+H2SO4.
В растворе появляется избыток ионов
водорода Н+, поэтому раствор ZnSО4имеет кислую реакцию (рН < 7).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
hгидр = (nгидр/nобщ)·100 %
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
K = [HA]·[MOH]/[MA]·[H2O]
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
K·[H2O]= Kг,
тогда соотношение для константы гидролиза соли Kгбудет иметь такой вид:
Kг = [HA]·[MOH]/[MA]
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Kг = С·h2/(1- h), моль/л
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Kг = С·h2
Зная, константу гидролиза, можно определить pH среды:
Kг = [HA]·[MOH]/[MA]
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH—]2/[MA]
Используя это выражение можно вычислить pH раствора
[OH—] = (Kг·[MA])1/2 моль/л
[H+] = 10-14/[OH—] моль/л
pH = -lg[H+]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
Na+ + HOH ↔ реакция практически не протекает
Cl— + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4+ + Cl—
NH4+ + HOH ↔ NH4OH + H+
Cl—+ HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Kг = KH2O/Kосн
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe2+ + 2Cl—
| I ступень | Fe2++ HOH ↔ (FeOH)+ + H+ FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH)+ + HOH ↔ Fe(OH)2 + H+ (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Kг1 = KH2O/Kосн2
Kг2 = KH2O/Kосн1
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Kг1 > Kг2
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kгнамного больше Kосн, то среда сильнокислая, при Kгнамного меньшей Kосн — среда слабокислая, а если Kги Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na+ + CN—
CN— + HOH ↔ HCN + OH—
Na+ + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Kг = KH2O/Kк-ты
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
Na2SO3 ↔ 2Na+ + SO32-
| I ступень | SO32- + HOH ↔ HSO3— + OH— Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3— + HOH ↔ H2SO3 + OH— NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Kг1 = KH2O/Kк-ты2
Kг2 = KH2O/Kк-ты1
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kгнамного больше Kк-ты, то среда сильнощелочная, при Kгнамного меньшей Kк-ты — среда слабощелочная, а если Kги Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Al2S3 + 6HOH ↔ 2Al(OH)3↓+ 3H2S↑
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Kг = KH2O/(Kк-ты·Kосн)
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al3+ + 3Cl—
Al3+ + 3HOH ↔ Al(OH)3 + 3H+
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na+ + S2-
S2- + 2HOH ↔ H2S + 2OH—
Суммарная реакция гидролиза:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Термин, используемый для описания электрохимического процесса, протекающего в расстворах, а также для обозначения подобного биологического процесса.
Обычно гидролиз представляет собой химический процесс, при котором молекула воды присоединяется к определенному веществу. Иногда это присоединение заставляет молекулу вещества и воды диссоциировать на части. В таких реакциях один фрагмент молекулы-мишени (или родительской молекулы) получает ион водорода. Он разрушает химическую связь в соединении.
Гидролиз солей
Растворимые в воде соли практически полностью диссоциируют на ионы. В некоторых солях катионы более реакционноспособны по сравнению с анионами, и они реагируют с водой с образованием ионов H+. Таким образом, раствор приобретает кислую среду:
M++H2O→MOH+H+M^+ + H_2O → MOH + H^+
В других солях анионы могут быть более реакционноспособными по сравнению с катионами, и они реагируют с водой с образованием ионов ОН—. Таким образом, раствор становится щелочным:
A−+H2O→HA+OH−A^-+ H_2O → HA + OH^-
Процесс гидролиза соли фактически является обратной нейтрализацией:
соль + вода → кислота + основание
Поскольку природа катиона или аниона соли определяет, будет ли ее раствор кислым или щелочным, целесообразно рассмотреть все четыре возможные комбинации.
Соли сильных кислот и слабых оснований
Раствор такой соли является кислым. Катион соли, пришедший из слабого основания, является реакционноспособным. Он реагирует с водой с образованием слабого основания и ионов H+.
B++H2O→BOH+H+B^+ + H_2O → BOH + H^+
Пример 1
Рассмотрим, например, NH4ClNH_4Cl. Он полностью ионизован в воде на ионы NH4+NH_4^+ и Cl−Cl^-. Ионы реагируют с водой с образованием слабого основания (NH4OH)(NH_4OH) и ионов H+H^+.
NH4++H2O→NH4OH+H+NH^+_4 + H_2O → NH_4OH + H^+
Таким образом, концентрация ионов водорода возрастает, и раствор становится кислым.
Соли слабых кислот и сильных оснований
Раствор такой соли является щелочным. Анион соли реагирует с водой с образованием слабых ионов кислоты и OH—ионов.
A−+H2O→HA+OH−A^- + H_2O → HA + OH^-
Пример 2
Рассмотрим, например, соль CH3COONaCH_3COONa. Он полностью ионизирует в воде, чтобы дать ионы CH3COO−CH_3COO^- и Na+Na^+. CH3COO−CH_3COO^- ионы реагируют с водой с образованием слабых кислот, ионов CH3COOHCH_3COOH и OH−OH^- ионов.
CH3COO−+H2O→CH3COOH+OH−CH_3COO^- + H_2O → CH_3COOH + OH^-
Таким образом, концентрация ионов OH—ионов возрастает, раствор становится щелочным.
Соли слабых кислот и слабых оснований
В случае соли такого типа гидролиз происходит максимально, так как катион и анион являются реакционноспособными и реагируют с водой с образованием ионов H+ и OH—. Образованный раствор, как правило, остается нейтральным, но он может быть либо слабо кислым, либо слабощелочным, если обе реакции происходят с разными скоростями.
Пример 3
Рассмотрим, например, соль CH3COONH4CH_3COONH_4. Она диссоциирует на ионы ионы CH3COO−CH_3COO^- и ионы NH4+NH_4^+, которые реагируют с водой:
CH3COO−+H2O→CH3COOH+OH−CH_3COO^- + H_2O → CH_3COOH + OH^-
NH4++H2O→NH4OH+H+NH^+_4 + H_2O → NH_4OH + H^+
Среда раствора соли, образованной слабой кислотой и слабым основанием будет определяться из соотношения pK ее катиона и аниона.
Когда pKa = pKb, pH = 7, то есть раствор соли будет нейтральным.
Когда pKa > pKb. Раствор будет щелочным, так как кислота будет немного слабее, чем основание, а значение pH будет больше 7.
В случае pKa < pKb раствор будет кислым, так как кислота относительно сильнее основания, а pH будет меньше 7.
Соли сильных кислоты и сильных оснований
Такая соль, например NaClNaCl, не подвергается гидролизу, так как ионы не реагируют. Таким образом, раствор будет нейтральным.
Константа и степень гидролиза
Количественно гидролиз оценивают по степени и константе гидролиза.
Количественный показатель характеризующий процесс гидролиза, выражается как степень гидролиза и определяется как доля одного моля соли, которая гидролизуется когда достигнуто равновесие. Он обычно выражается как h или x:
h = (количество гидролизованой соли) / (общее количество соли)
Степень гидролиза зависит от природы соли, ее концентрации и температуры раствора. С разбавлением и повышением температуры раствора степень гидролиза соли растет.
Полнее характеризует гидролиз константа гидролиза (Кг). которая является константой равновесия относительно реакции гидролиза.
Пример 4
Например, для CH3COONaCH_3COONa, гидролиз которого происходит по уравнению:
CH3COO−+H2O→CH3COOH+OH−,CH_3COO^- + H_2O → CH_3COOH + OH^-,
согласно закону действующих масс. Можно записать константу гидролиза Кг в таком виде:
Кг=OH−[CH3COOH][CH3COO−]Кг=frac{OH^-[CH_3COOH]}{[CH_3COO^-]}
Помножим числитель и знаменатель уравнения на [Н+], тогда с учетом того, что [Н+] [ОН—] = Kw, уравнение будет иметь вид
Кг=H+OH−[CH3COOH]H+[CH3COO−]=КwКд(CH3COOH)Кг=frac{H^+OH^-[CH_3COOH]}{H^+[CH_3COO^-]}=frac{Кw}{Кд(CH_3COOH)}
Тест по теме «Гидролиз солей. Константа и степень гидролиза»
План урока:
Гидролиз
Электролиз
Виды электродов
Значение электролиза
Гидролиз
Гидролиз – процесс распада молекул под действием молекул воды. Гидролизу подвергаются соли. Во время этого процесса образуются исходные вещества – кислота и основание. Если исходные компоненты растворимы в воде, процесс гидролиза обратим и продукты зафиксировать сложно, поэтому, гидролиз возможен только для тех солей, один из исходных компонентов которой – слабое соединение. В этом случае образуется продукт – осадок, газ или вода, выпадающий из общей реакции.
Процесс диссоциации хлорида натрия
Кроме гидролиза существует процесс диссоциации. По сути, это первая стадия гидролиза – разрушение молекулы водой. Если после этого происходит образование новых химических соединений, происходит гидролиз. Эти процессы могут идти одновременно и конкурировать между собой или будет преобладать только один из вариантов.
Константа гидролиза солей
Хоть гидролиз и является общим свойством селей, многие соли подвергаются ему в разной степени. Это зависит не только от наличия сильного и слабого иона, но и от растворимости самой соли.
Степень гидролиза определенной соли называют константой гидролиза солей и обозначают Kr. Это табличные данные, но в эксперименте их можно посчитать по формуле: К = [К+][А–]/[КА]. То есть, чтобы определить этот параметр, нужно концентрацию катионов и анионов разделить на концентрацию недиссоциированных молекул. Максимальное значение константы = 1. Чем ближе к этой цифре, тем выше степень гидролиза молекулы.
Константа зависит от ряда параметров:
- Температура раствора;
- Природа соли (ее растворимость);
- Длительность процесса.
Но, не зависит от концентрации соли и объема реакционной среды.
Одно и то же вещество может иметь разные значения константы гидролиза. Это характерно для таких молекул, у которых несколько атомов катиона или аниона. Например, Na3PO4 распадается постепенно, отщепляя по одному атому Na:
- Na3PO4↔ Na+ + Na2PO4—
- Na2PO42- ↔ Na+ + NaPO42-
- NaPO42-↔ Na+ + PO43-
- Суммарно: Na3PO4↔3Na+ + PO43-
Активнее всего процесс будет идти по первой ступени, ниже по второй. Третий этап, практически, не осуществим.
Обратимый гидролиз
Если в растворе идет как распад исходной молекулы с образованием новых продуктов, так и образование молекул этого же вещества, это обратимый гидролиз. В качестве примера рассмотрим этот процесс для фосфата натрия Na3PO4 по первой ступени: в растворе образуются ионы, соединяющиеся в продукты NaOH и Na2HPO4. Оба вещества растворимы в воде, а значит, тоже могут распадаться на ионы. В результате устанавливается равновесие между двумя процессами – прямой и обратный гидролиз:
Na3PO4 + H2O ↔ Na2HPO4 + NaOH
3Na+ + PO43- + HOH ↔2Na+ + HPO42- + Na ++ OH—
Для того чтобы реакция шла только в одном направлении можно удалять нужный продукт или формировать подходящую кислотность.
Гидролиз растворов может протекать по аниону или катиону. Анион – ион, заряженный отрицательно, а катион – положительно. Условием этого процесса является наличие одного или дух слабых ионов. При их распаде образуется необратимый продукт, позволяющий зафиксировать процесс.
К слабым кислотам (анион) относятся:
- все органические кислоты;
- бескислородные кислоты, кроме HBr, HCl, HI;
- кислоты, проявляющие переменную степень окисления (H2SO3, HNO2);
- кислоты, которые быстро распадаются (H2CO3, H2SiO3, H3PO4).
Слабость основания (катиона) можно определить по таблице растворимости. К слабым основаниям относятся все малорастворимые и нерастворимые вещества. Например, Al(OH)3 и Zn(OH)2 – слабые основания.
Возможно 4 варианта гидролиза в зависимости от состава соли.
Щелочь + слабая кислота (гидролиз по аниону)
Гидролиз по аниону проходит, если соль имеет кислотный остаток слабой кислоты. В финальном растворе останутся гидроксид-ионы, за счет чего сформируется щелочная среда (pH>7).
Пример: Na3PO4 + H2O ↔ Na2HPO4 + NaOH
Реакцию можно рассмотреть с точки зрения последовательного образования анионов и катионов.
- Na3PO4 ↔ 3 Na3+ + PO43-
- 3 Na3+ + PO43- + H2O ↔ 3 Na+ + HPO42- + OH—
Растворимое слабое основание + сильная кислота (гидролиз по катиону)
Если в соли слабо основание, будет происходить его распад. В этом случае в растворе останется больше катионов водорода и среда сформируется кислая (pH<7).
Пример: AlCl3 + H2O ↔ AlOHCl + HCl
Гидролиз веществ проходит в две стадии.
- AlCl3 ↔ Al3+ + 3 Cl—
- Al3+ +3 Cl—+ H2O ↔ AlOH2+Cl + H+ + Cl—
Слабое основание + слабая кислота (гидролиз по катиону и аниону)
Если обе части соли слабые, гидролиз будет идти по обеим частям. Так как образуются и катионы водорода, и гидроксид-ионы в равном количестве, среда будет нейтральная(рН = 7).
Пример: (NH4)2S + 2 H2O → 2 NH4OH + H2S
- (NH4)2S → 2 NH4+ + S—
- NH4+ + H2O ↔ NH4OH + H+
S— + H2O ↔ HS— + OH—
Щелочь + сильная кислота
Сильные молекулы называются так из-за очень высокой реакционной способности ионов, в таком случае, даже если происходит их распад на катионы и анионы, они сразу соединяются обратно. Молекулы воды не успевают оттащить их достаточно далеко, чтобы образовались новые продукты реакции.
Электролиз
Электролиз – разложение веществ под действием электрического тока. Он представляет собой окислительно-восстановительную реакцию.
Под действием электрического тока ионы начинают двигаться направленно – положительно заряженные катионы к отрицательному катоду, а отрицательно заряженные анионы к положительному аноду. На катоде катионы принимают электроны и восстанавливаются, а на аноде анионы отбирают электроны и окисляются. Электролиз протекает в расплаве или в растворе.
Виды электродов
Электрод – один из основных компонентов электролиза. Именно на нем происходит процесс объединение ионов и формирования продуктов реакции. Существует несколько видов электродов, на каждом из которых есть особенности процессов.
В химических лабораториях используют несколько видов электродов:
- платиновый,
- инертный,
- угольный,
- стандартный водородный.
Электроды отличаются стандартным электродным потенциалом. Это значит, на разных электродах скорость ОВР будет различна. Для каждого электрода приведены стандартные значения его потенциала, что может быть использовано в решении задач для определения степени электролиза.
Электролиз расплавов
При электролизе расплавов солей вода не участвует в процессе реакции. Этот способ применяется в том случае, если продукты электролиза вступают в реакцию с водой, например, при получении щелочных и щелочно-земельных металлов. В этом случае вместо металла образуется щелочь.
2NaCl(расплав) электролиз 2Na + Cl2↑
Катод( ): Na+ + ē =Na
Анод(+): 2Cl—— 2ē = 2Cl = Cl2↑
Электролиз растворов
Электролиз растворов протекает в присутствии воды.
Продукты реакции на катоде и аноду зависят от характеристик соответствующих катионов и анионов.
Процесс на катоде
На катоде происходит восстановление металлов и водорода, в зависимости от активности металла. Можно выделить три варианта продуктов реакции на катоде, в зависимости от положения металла в электрохимическом ряду напряжений.
- Активный металл (металлы в ряду напряжений стоят до алюминия включительно)
В процессе реакции восстанавливается водород, т.к.активные металлы не могут долго существовать в чистом виде и быстро образуют новые соединения в растворе.
2 Н2О + 2 ē → Н2 + 2 ОН—
- Металл со средней активностью (металл находится между алюминием и водородом)
В процессе электролиза одновременно восстанавливаются вода и металл.
Меn+ + n ē → Me0
2 H2O + 2 ē → Н2 + 2 ОН—
- Неактивный металл (металлы в ряду располагаются после водорода)
В процессе электролиза восстанавливается только металл, так как его реакционная активность низкая.
Меn+ + n ē → Me0
Процессы на аноде
К положительно заряженному аноду подходят анионы. Анионы играют роль окислителя, а кислотные остатки или вода – восстановителей. Здесь, так же, возможно образования различных продуктов в зависимости от аниона.
- Бескислородный кислотный остаток (I—, Br—, Cl—) восстанавливается до соответствующего неметалла:
неМеn-— n ē → неМе0
- Кислородсодержащий кислотный остаток сильной кислоты (SO42-, NO3—) и фторид-ион (F—) не окисляются. Вместо них происходит окисление воды с образованием кислорода:
2 Н2О-2 – 4 ē → О20 + 4 Н+
- Гидроксид-ион (OH—) окисляется с образованием кислорода:
4 ОН— — 4 ē → О2 + 2 Н2О
Суммарные процессы электролиза
В суммарном уравнении электролиза записывают те продукты, которые образовались н электродах. Например, процесс электролиза раствора сульфата меди выглядит следующим образом:
2 Cu2+SO4 + 2 H2O → 2 Cu0 + 2 H2SO4 + O2
К (-): Сu2+ + 2 ē → Сu0
А (+): 2 H2O — 4 ē → О20 + 4 Н+
Электролиз раствора хлорида натрия выглядит следующим образом:
2 NaCl— + 2 H2O → H2 + 2 NaOH + Cl20
K (-):2 H2O + 2 ē → Н2 + 2 ОН—
А (+): 2 Cl— — 2 ē → Cl20
Значение электролиза
Электролиз – важный химический процесс. Основная область его применения – получение неустойчивых элементов, которые нельзя синтезировать в процессе стандартной реакции. Например, так получают щелочные металлы.
Другой вариант – покрытие металлических изделий антикоррозионными элементами. В этом случае, нахождение металлического объекта (например, корабля) в соленой воде приравнивается к процессу электролиза, что приводит к коррозии. Чтобы предотвратить этот процесс, к конструкции прикрепляется элемент с большим потенциалом. Тогда он будет вступать в этот процесс вместо основной конструкции.
В городах электролиз применяют для очистки сточных вод.




















