Примеры решения задач
Задача
1 Смесь
азота и гелия при температуре 27 0С
находится под давлением р=1,3102
Па. Масса азота составляет 70 % от общей
массы смеси. Найти концентрацию
молекул каждого из газов.
|
T
p
M1 |
Решение При р=nkT, откуда n=p/kT. С
M1=c1M, |
|
n1
n2 |
M2=c2M,
где
M
— масса смеси;
с1
и с2
– процентное содержание азота и гелия.
С
другой стороны, масса каждого из газов:

где
V
– объем газа;
— молярная масса газа;
i/NА
– масса молекулы.
Приравнивая
правые части уравнений (1) и (2), получим:
c1M=;
c2M=;
откуда
n1/n2==1/3.
Так как n1+n2=n,
то
n1==0,81022
м-3, n2==2,41022
м-3.
Ответ:
n1==0,81022
м-3, n2==2,41022
м-3.
Задача
2 Найти
среднюю квадратичную скорость, среднюю
кинетическую энергию поступательного
движения и среднюю полную кинетическую
энергию молекул азота и гелия при
температуре 27 0С.
Определить полную энергию всех молекул
100 г каждого из газов.
|
T
M1
Не
N2 |
Решение Средняя <Е>=
<E>=6,210-21 Средняя |
|
<кв>
E W |
<кв>=. (1)
Для расчета средней квадратичной скорости выражение (1) удобно преобразовать, умножив числитель и знаменатель на na.
<кв>=;
<кв>=13,7102
м/с – для гелия;
<кв>=5,17102
м/с – для азота.
Средняя
полная энергия молекулы зависит от
числа степеней свободы молекулы:
<E0>=.
Полная
кинетическая энергия всех молекул,
равная для идеального газа его внутренней
энергии, может быть найдена как
произведение Е0
на число всех молекул:
Е=U=Е0N;
N=.
Гелий
– одноатомный газ
i=3,
тогда <E0>=6,210-21
Дж.
Азот
– двухатомный газ
i=5,
тогда <E0>=10,410-21
Дж.
Полная
энергия всех молекул
Е=.
Для
гелия W=93,5103
Дж; для азота W=22,3103
Дж.
Ответ:
для гелия W=93,5103
Дж; для азота W=22,3103
Дж
Задача
3 Рассчитать
среднюю длину свободного пробега молекул
азота, коэффициент диффузии и вязкость
при давлении р=105
Па и температуре 17 0С.
Как изменятся найденные величины в
результате двукратного увеличения
объема газа: 1) при постоянном давлении;
2) при постоянной температуре? Эффективный
диаметр молекул азота d=3,710-8см.
|
p
T
V2
d |
Решение Средняя
где n <>
m0 |
|
—
D
— |
Концентрацию
молекул можно определить из уравнения p=nkT:
n=p/kT
подставим в уравнение (1):
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Нахождение среднего значения энергии, среднего квадрата энергии и дисперсии (среднеквадратичной флуктуации) энергии частицы
Согласно Максвелловскому закону распределения скоростей
<e> = 1/Z (интеграл) e exp(-альфа e) dГ,
где альфа = 1/kT, dГ — элементы объёма пространства скоростей, а Z определяется условием нормировки
Z = (интеграл) exp(-альфа e)dГ
Дифференцируя это соотношение по параметру альфа, получим
dZ/d альфа = -e (интеграл) exp(-альфа e) dГ
Получим
<e> = -1/Z dZ/d альфа
Отсюда
d<e>/d альфа = -1/Z d^2Z/d альфа^2 + 1/Z^2(dZ/d альфа)^2 = -1/Z d^2Z/d альфа^2 + e^2
Аналогично,
<e^2> = 1/Z (интеграл) e^2 exp(-альфа e)dГ = 1/Z d^2 Z/d альфа^2
<delta e^2> = <e^2> — <e>^2 = -d<e>/d альфа
Подставим альфа = 1/kT
<delta e^2> = kT^2 d<e>/dT
В случае идеального одноатомного газа:
<e> = 1/n (интеграл от нуля до бесконечности) e n 2/sqrt(pi (kT)^3) exp(-e/kT) sqrt(e) de = 3/2 kT
<delta e^2> = 3/2 (kT)^2
<e^2> = 15/4 (kT)^2
2017-05-27
Найти среднюю квадратичную скорость, среднюю кинетическую энергию поступательного движения и среднюю полную кинетическую энергию молекул гелия и азота при температуре $t = 27^{ circ} С$. Определить полную энергию всех молекул 100 г каждого из газов.
Решение:
Средняя кинетическая энергия поступательного движения одной молекулы любого газа однозначно определяется его термодинамической температурой:
$langle W_{0п} rangle = frac{3}{2} kT$, (1)
где $k = 1,38 cdot 10^{-23} Дж/К$ — постоянная Больцмана.
Однако средняя квадратичная скорость молекул газа зависит от массы его молекул:
$v_{кв} = sqrt{3kT/m_{0}}$, (2)
где $m_{0}$ — масса одной молекулы.
Средняя-полная энергия молекулы зависит не только от температуры, но и от структуры молекул — от числа £ степеней свободы:
$langle W_{0} rangle = ikT/2$. (3)
Полная кинетическая энергия всех молекул, равная для идеального газа его внутренней энергии, может быть найдена как произведение $langle W_{0} rangle$ на число $N$ всех молекул:
$W = U = langle W_{0} rangle N$. (4)
Очевидно,
$N = N_{A} m / mu$, (5)
где $m$ — масса всего газа, отношение т/ц определяет число молей, а $N_{A}$ — постоянная Авогадро. Выражение (4) с учетом уравнения Клапейрона — Менделеева позволит рассчитать полную энергию всех молекул газа.
Согласно равенству (1), $langle W_{0п} rangle = 6,2 cdot 10^{-21} Дж$, причем средние энергии поступательного движения одной молекулы и гелия, и азота одинаковы.
Для расчета средней квадратичной скорости выражение (2) удобно несколько преобразовать, умножив числитель и знаменатель на $N_{A}$.
Тогда
$v_{кв} = sqrt{3RT/ mu}$,
где $R = 8,31 Дж/(моль cdot К)$. Для гелия $v_{кв} = 13,7 cdot 10^{2} м/с$, для азота $v_{кв} = 5,17 cdot 10^{2} м/с$.
Для расчета средней полной энергии молекулы [см. (3)] надо знать число степеней свободы молекулы.
Гелий — одноатомный газ, следовательно, $i = 3$, тогда
$langle W_{0п} rangle = langle W_{0} rangle = 6,2 cdot 10^{-21} Дж$.
Азот — двухатомный газ, следовательно, $i = 5$ и
$langle W_{0} rangle = frac{5}{2} kT = 10,4 cdot 10^{-21} Дж$.
Полная энергия всех молекул после подстановки выражений (3) и (5) в (4) равна
$W = frac{i}{2} kT frac{m}{ mu} N_{0} = frac{i}{2} frac{m}{ mu} RT$.
Для гелия $W = 93,5 кДж$; для азота $W = 22,3 кДж$.
Молекулярно-кинетическая теория позволяет, анализируя микроскопическое поведение системы и используя методы статистической механики, получить важные макроскопические характеристики термодинамической системы. Одной из микроскопических характеристик, которая связана с температурой системы, является средняя квадратичная скорость молекул газа. Формулу для нее приведем и рассмотрим в статье.
Газ идеальный
Сразу отметим, что формула квадратичной средней скорости молекул газа будет приведена именно для газа идеального. Под ним в физике полагают такую многочастичную систему, в которой частицы (атомы, молекулы) не взаимодействуют друг с другом (их кинетическая энергия на несколько порядков превышает потенциальную энергию взаимодействия) и не имеют размеров, то есть являются точками с конечной массой (расстояние между частицами на несколько порядков превышает их размеры линейные).
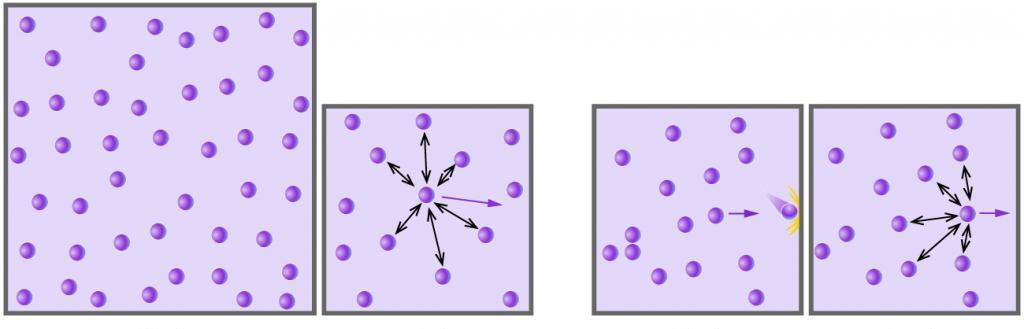
Любой газ, который состоит из химически нейтральных молекул или атомов, и что находится под небольшим давлением и имеет высокую температуру, может считаться идеальным. Например, воздух — это идеальный газ, а водяной пар таковым уже не является (между молекулами воды действуют сильные водородные связи).
Теория молекулярно-кинетическая (МКТ)

Изучая идеальный газ в рамках МКТ, следует обратить внимание на два важных процесса:
Несмотря на то, что индивидуальные скорости газовых частиц сильно отличаются друг от друга, среднее значение этой величины сохраняется постоянным во времени, если отсутствуют внешние воздействия на систему. Формулу средней квадратичной скорости молекул газа можно получить, если рассмотреть связь между кинетической энергией и температурой. Займемся этим вопросом в следующем пункте статьи.
Вывод формулы квадратичной средней скорости молекул газа идеального
Каждый школьник знает из общего курса физики, что кинетическая энергия поступательного движения тела массой m рассчитывается так:
Ek = m*v2/2
Где v — линейная скорость. С другой стороны, кинетическую энергию частицы также можно определить через абсолютную температуру T, используя переводной множитель kB (постоянная Больцмана). Поскольку наше пространство является трехмерным, то Ek рассчитывается так:
Ek = 3/2*kB*T.
Приравнивая оба равенства и выражая из них v, получим формулу средней скорости квадратичной газа идеального:
m*v2/2 = 3/2*kB*T =>
v = √(3*kB*T/m).
В этой формуле m — является массой газовой частицы. Ее значение неудобно использовать в практических расчетах, поскольку оно невелико (≈ 10-27 кг). Чтобы избежать этого неудобство вспомним об универсальной газовой постоянной R и молярной массе M. Постоянная R с kB связана равенством:
kB = R/NA.
Величина M определяется так:
M = m*NA.
Принимая во внимание оба равенства, получаем следующее выражение для средней квадратичной скорости молекул:
v = √(3*R*T/M).
Таким образом, средняя квадратичная скорость газовых частиц оказывается прямо пропорциональной квадратному корню из абсолютной температуры и обратно пропорциональна корню квадратному из молярной массы.
Пример решения задачи
Каждый знает, что воздух, которым мы дышим, на 99% состоит из азота и кислорода. Необходимо определить разницы в средних скоростях молекул N2 и O2 при температуре 15 oC.

Эту задачу будет решать последовательно. Сначала переведем температуру в абсолютные единицы, имеем:
T = 273,15 + 15 = 288,15 К.
Теперь выпишем молярные массы для каждой рассматриваемой молекулы:
MN2 = 0,028 кг/моль;
MO2 = 0,032 кг/моль.
Поскольку значения молярных масс отличаются между собой незначительно, то средние их скорости при одинаковой температуре тоже должны быть близки. Пользуясь формулой для v, получаем следующие значения для молекул азота и кислорода:
v (N2) = √(3*8,314*288,15/0,028) = 506,6 м/с;
v (O2) = √(3*8,314*288,15/0,032) = 473,9 м/с.
Поскольку молекулы азота немного легче, чем молекулы кислорода, то движутся они быстрее. Разница средних скоростей составляет:
v (N2) — v (O2) = 506,6 — 473,9 = 32,7 м/с.
Полученное значение составляет всего 6,5 % от средней скорости молекул азота. Обращаем внимание на большие значения скоростей молекул в газах даже при невысоких температурах.
Автор:
16-01-2019 19:51
Жду ваши вопросы и мнения в комментариях
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.