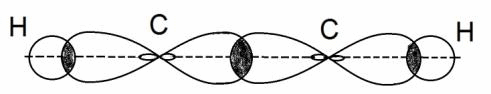
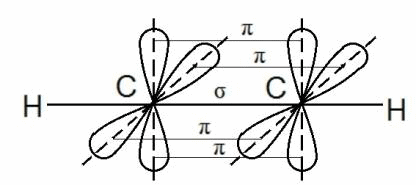
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
Так, например, при смешении одной s- и трех p-орбиталей образуются четыре sp3-гибридных орбитали:
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp3, либо в состоянии sp2, либо в состоянии sp-гибридизации:
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp3 | CH4 – метан |
| 3 атома | sp2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
- Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp-гибридизации.
- Второй атом углерода связан с двумя атомами – sp-гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp3-гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp2-гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
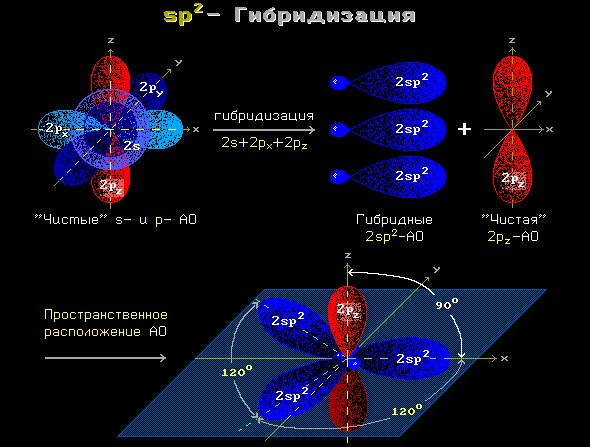
sp2-Гибридизация (плоскостно-тригональная)
Одна s— и две p-орбитали смешиваются, и образуются три равноценные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° (выделены синим цветом). Они могут образовывать три σ-связи. Третья р-орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей. Эта р-АО участвует в образовании π-связи.
VRML-модель (2 камеры, 109,3 Кб).
Для элементов 2-го периода процесс sp2-гибридизации происходит по схеме:
2s + 2px + 2py = 3 (2sp2)
2pz-АО в гибридизации не участвует.
Для изображения пространственного строения атомов в sp2-состоянии используются те же приемы, что и в случае sp3-атомов:
Переход от орбитальной модели sp2-атома (а) к пространственной формуле (б).
Иллюстрация
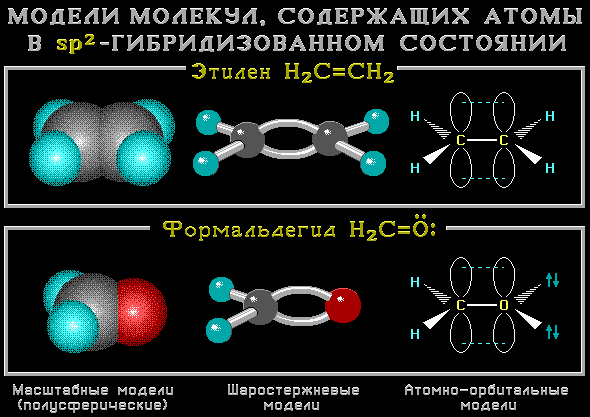
Строение молекул с sp2-атомами отражают их модели:
sp2-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных
пар равна 3 (примеры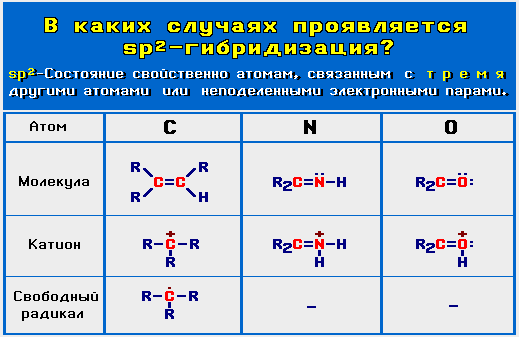
- Кроме того, sp2-состояние оказывается выгодным и для атомов с неподеленными парами электронов, если такой атом связан с другим sp2— или sp-атомом. При этом значение суммы может быть равно 4.
Например, sp2-атом кислорода в
феноле C6H5OH
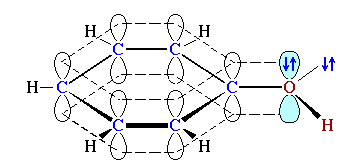 , связанный с sp2-атомом углерода бензольного кольца.
, связанный с sp2-атомом углерода бензольного кольца.Атомы углерода в sp2-гибридном состоянии образуют такие аллотропныеАллотропия — явление существования химических элементов в виде двух и более простых веществ. Может быть обусловлена образованием молекул с различным числом атомов (например, кислород O2 и озон O3), либо кристаллов различных модификаций (пример: алмаз, графит, карбин, графен, фуллерены и другие наноструктуры, состоящие из атомов углерода). В последнем примере аллотропия является частным случаем полиморфизма. формы как
графит
(VRML-модель), графен, фуллерены (например, фуллерен C60
Фуллерен C60, VRML-модель) и другие наноструктуры.
sp2-Гибридизация характерна для атомов С, N, O и др. с двойной связью (sp2-атомы выделены красным цветом):
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
Виды σ-связей
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь
С–С, С–Н, С–О |
Двойная связь
С=С, С=О |
Тройная связь
С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s22s22p2
+6С 1s 2s
2p
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С* 1s22s12p3
+6С* 1s2 2s1
2p3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp3, sp2 и sp-гибридизация.
sp3-Гибридизация
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:
Изображение с портала orgchem.ru
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
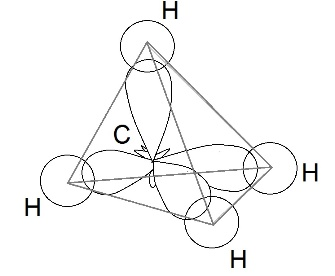
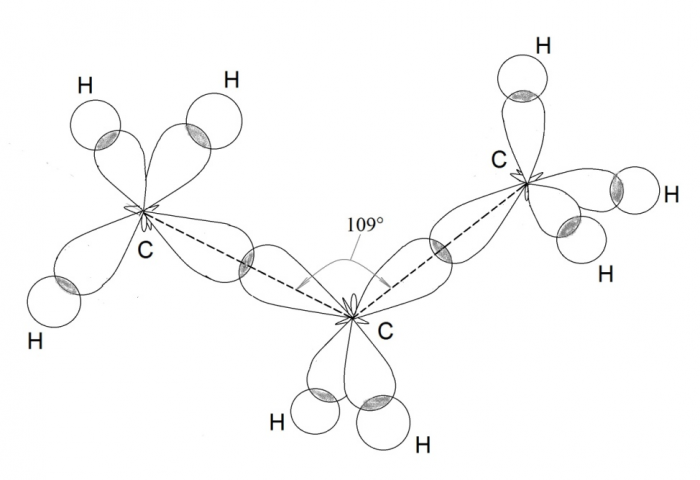
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Например, пространственное строение н-бутана
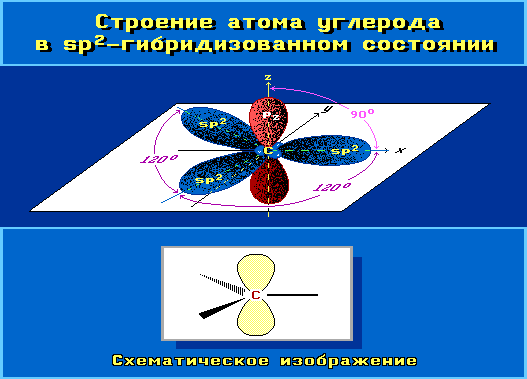
sp2-Гибридизация
В sp2-гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
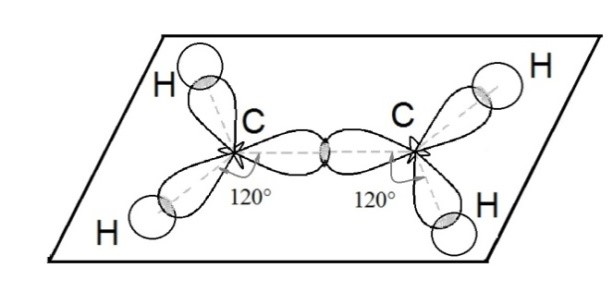
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три sp2-гибридные орбитали атома углерода направлены в пространстве под углом 120о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp2— орбитали.
Изображение с портала orgchem.ru
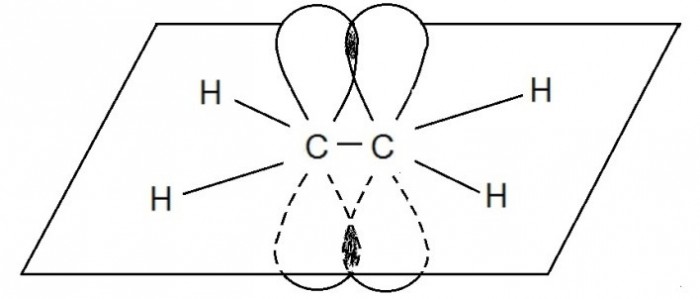
Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp2-гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей.
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180о друг к другу, что соответствует линейному строению.
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
Например, молекула ацетилена имеет линейное строение.
Гибридизация sp3, sp2 и sp в органической химии с практическими примерами.
Введение
Зачем нам теория гибридизации?
Вот один ответ на это. Экспериментально подтверждено, что атом углерода в метане (CH4) и других алканах имеет тетраэдрическую структуру.
- Напомним, что в тетраэдрической геометрии все углы имеют 109,5°, а связи имеют одинаковую длину.
- Помните также, что ковалентные связи образуются в результате перекрывания орбиталей и совместного использования двух электронов между атомами.
Итак, чтобы предсказать валентность и геометрию атома углерода, мы рассмотрим его электронную конфигурацию и орбитали.
C – 1s 2 2s 2 2p 2
Валентные электроны — те, которые находятся на 2s и 2p орбиталях, и те, которые участвуют в связывании и химических реакциях.

Из конфигурации электронов видно, что невозможно создать четыре одинаковые по длине, энергии и всем остальным параметрам связи, потому что одна из орбиталей является сферической s, а остальные три — p — орбиталями.
- И именно здесь мы нуждаемся в теории, которая может помочь нам объяснить известную геометрию и валентность атома углерода во многих органических молекулах.
Гибридизация — это теория, которая используется для объяснения определенных молекулярных геометрий, которые в противном случае были бы невозможны.
Гибридизация sp3
Теперь давайте посмотрим, как это происходит, используя метан в качестве примера.
На первом этапе один электрон перепрыгивает с 2s на 2p орбиталь. Это приводит к возбужденному состоянию углерода:

Обратите внимание, что электрон движется вперед, так как p — оболочка выше по энергии, чем s — оболочка, и это не является энергетически выгодным, но мы увидим, как это компенсируется на следующем этапе, когда орбитали смешаны (гибридизованы).
- Таким образом, на следующем этапе s и p — орбитали углерода в возбужденном состоянии гибридизуются с образованием четырех одинаковых по размеру, форме и энергии орбиталей.

Количество гибридных орбиталей всегда совпадает с количеством смешанных орбиталей.
Итак, четыре орбитали (одна 2s + три 2p) смешаны, и в результате получается четыре sp3 орбитали. Это гибридные орбитали, которые похожи на s и p — орбитали.
- Таким образом, мы называем их sp3, потому что они образованы из одной s орбитали и трех p орбиталей.
Образование этих вырожденных гибридных орбиталей компенсирует энергию подъема s — p — перехода, поскольку они имеют меньшую энергию, чем p — орбитали.
Четыре sp3 — гибридизованные орбитали располагаются в тетраэдрической геометрии и образуют связи, перекрывая s — орбитали четырех водородов: это объясняет симметричную геометрию метана (CH4), где все связи имеют одинаковую длину и угол связи.

Все четыре связи C — H в метане являются одинарными связями, которые образуются путем лобового (или конечного) перекрытия sp3 — орбиталей углерода и s — орбитали каждого водорода.
Связи, которые образуются путем встречного перекрытия орбиталей, называются σ (сигма) связями, потому что электронная плотность сосредоточена на оси, соединяющей атомы C и H.
Этан — CH3-CH3 и другие алканы
Если вместо одного водорода мы подключим другой sp3 — гибридизированный углерод, мы получим этан:

И, следовательно, во всех алканах существует сигма — связь между атомами углерода и атомами углерод — водород, и атомы углерода sp3 гибридизуются с тетраэдрической геометрией:

Чтобы обобщить это, любой атом с четырьмя группами (или атом или одинокая пара) является sp3 гибридизированным.
- И если посмотреть на это, то, чтобы четыре группы были как можно дальше друг от друга, как мы знаем из теории отталкивания электронных пар, группы должны находиться на одинаковых четырех орбиталях, что возможно только в гибридизации sp3.
Например, какая гибридизация кислорода в следующей молекуле?

Кислород связан с двумя атомами и имеет две неподеленные пары. Всего — четыре группы, и именно поэтому он sp3 гибридизован.
Гибридизация sp2
Когда атом углерода находится в возбужденном состоянии, sp3 — гибридизация не является единственным вариантом смешивания орбиталей.
Гибридизация sp2 происходит, когда s — орбиталь смешивается только с двумя p — орбиталями, в отличие от трех p — орбиталей в гибридизации sp3.
- Итак, три орбитали смешаны, и в результате получаются три гибридные орбитали, которые называются sp2 — гибридными орбиталями.

Получающиеся 3 sp2 — орбитали затем располагаются в тригональной плоской геометрии (120°).
Важным отличием здесь по сравнению с гибридизацией sp3 является неучтенная (негибридизированная) p — орбиталь, которая не участвовала в гибридизации. Эта орбиталь расположена под углом 90° к плоскости тригонального расположения трех орбиталей sp2:

Гибридизация углерода в этилене — C2H4
Два sp2 — гибридизированных атома углерода могут образовывать сигма — связь, перекрывая одну из трех sp2 — орбиталей и связываясь с двумя атомами водорода каждый, и два атома водорода образуют сигма — связь с каждым углеродом, перекрывая их s — орбитали с двумя другими sp2 — орбиталями.

Это создает три связи для каждого углерода и одну орбиталь слева.
- Помните, стандартная валентность углерода равна четырем, и ей положено иметь четыре связи.
Эта четвертая связь образована параллельным перекрытием двух 2p — орбиталей на каждом атоме углерода. Этот тип связи путем параллельного перекрытия орбиталей называется π-связью.
Итак, два атома углерода в этилене, который является первым членом семейства алкенов, имеют двойную связь.
- В каждой двойной связи есть одна сигма и одна π-связь.

Вот некоторые ключевые параметры гибридизации sp2 и двойных связей, которые вам необходимо знать:
* Все атомы на двойной связи находятся в одной плоскости;
* Угол между атомами составляет 120°;
* Угол между плоскостью и p — орбиталями составляет 90°.
Гибридизация sp
При sp — гибридизации s — орбиталь углерода в возбужденном состоянии смешивается только с одной из трех 2p — орбиталей.
Это называется sp — гибридизацией, потому что две орбитали (одна s и одна p) смешаны:

Получающиеся две sp — гибридные орбитали затем располагаются в линейной геометрии (180°), а две негибридизованные 2p — орбитали располагаются под углом 90°:

Давайте посмотрим, как это происходит в ацетилене — C2H2. Два атома углерода образуют сигма — связь, перекрывая sp — орбитали.

Один водород связывается с каждым атомом углерода, перекрывая его орбиталь с другой орбиталью.
Две p — орбитали каждого углерода перекрываются, образуя две π-связи.
Основные параметры sp гибридизации и тройной связи:
* Все атомы имеют линейную структуру;
* Угол между атомами составляет 180°;
* В тройной связи есть одна σ (сигма) и две π (пи) связи.
Гибридизация других элементов
В заключение, все, что мы обсуждали выше, относится не только к углероду.
Теория гибридизации работает с тем же принципом для всех других важных элементов в органической химии, таких как кислород, азот, галогены и многие другие.
7. Гибридизация орбиталей
Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях. Казалось бы, и связи в молекуле по прочности должны быть неравноценными. Однако опыт показывает, что они равнозначны. Это явление объясняется представлением о гибридизации атомных орбиталей, введённым американским химиком Л. Полингом.
Рассмотрим образование молекулы метана. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя р-электронами – 1s22s12p3. Экспериментальные данные показали, что все четыре связи С-Н в молекуле метана СН4 одинаковы и направлены к вершинам тетраэдра (угол между ними составляет 109о28′).
Одинаковая прочность связей объясняется гибридизацией валентных (внешних) орбиталей, то есть смешением их и выравниванием по форме и энергии. При этом число гибридных орбиталей равно числу исходных.
Четыре совершенно одинаковые sp3 –гибридные орбитали атома углерода расположены под углом 109о28′ друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода. На рисунке видно, что гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра.
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями других атомов по сравнению с перекрыванием «обычных» s- и р-орбиталей и приводит к образованию более прочных связей.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры атомов, называется σ (сигма) – связью.
Так как гибридные электронные орбитали направлены к вершинам тетраэдра, то при образовании молекулы пропана С3Н8 направление химической связи между вторым и третьим атомами углерода не может совпадать с направлением связи между первым и вторым атомами углерода. Образуется угол 109о28′. Такие же углы существуют между четвертым, пятым и другими атомами углерода. Углеродная цепь принимает зигзагообразную форму:
Ещё один вид гибридизации осуществляется в соединениях углерода ряда этилена. В этом случае происходит гибридизация одной s- и двух р-орбиталей углерода (sp2 –гибридизация). При этом образуются три одинаковые sp2 –гибридные орбитали, расположенные под углом 120о друг к другу. Таким образом каждый атом углерода имеет по три гибридных электронных облака и по одному негибридному р-облаку. Гибридные электронные облака взаимно перекрываются и образуют между атомами углерода σ –связь:
Остальные гибридные электронные облака атомов углерода перекрываются с s-облаками атомов водорода и также образуют σ -связи. Негибридные p-орбитали взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости σ-связей:
Ковалентная связь, возникающая при перекрывании орбиталей по обе стороны линии, связывающей центры атомов, называется π (пи) – связью.
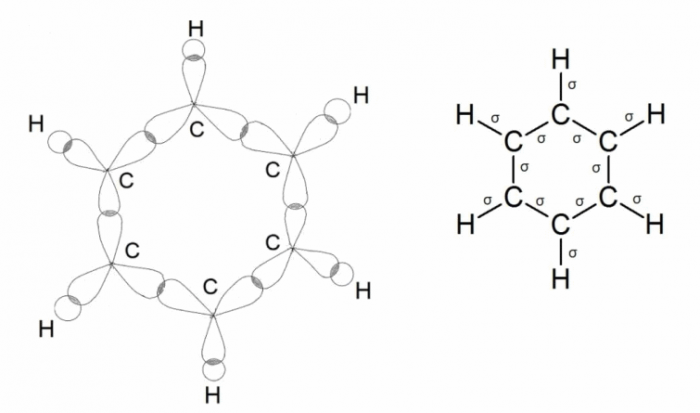
Ещё одним примером, где происходит sp2 –гибридизации углерода, является молекула бензола. Три атомные орбитали (одна s и две р) каждого углерода в молекуле бензола гибридизируются и образуют три σ -связи. Гибридные орбитали перекрываются друг с другом. Перекрывание всех электронных облаков на одном рисунке показать трудно, поэтому рассмотрим последовательно два рисунка. Ниже приведены схема образования σ -связей в молекуле бензола:
Негибридные р-электронные орбитали атомов углерода расположены перпендикулярно плоскости направления σ-связей, они также перекрываются друг с другом, образуя единую систему π-связей:
В молекуле ацетилена С2Н2 каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180о друг к другу. Они, как уже упоминалось выше, называются σ — связями.
Но в молекуле ацетилена в каждом из атомов углерода содержится ещё по два p-электрона, которые не принимают участие в образование σ – связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов выступают из плоскости в перпендикулярном к ней направлении. При этом происходит некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ – связей. В итоге в молекуле ацетилена образуются ещё две ковалентные углерод-углеродные π-связи:
Под воздействием реагентов π-связь легко разрывается, она значительно слабее, чем σ–связь. π –связь образуется не только между атомами углерода, но и в случае образования двойных и тройных связей между углеродом и кислородом, углеродом и азотом.