Строение атома кислорода

4.5
Средняя оценка: 4.5
Всего получено оценок: 336.
4.5
Средняя оценка: 4.5
Всего получено оценок: 336.
Кислород (O) – жизненно важный газ, необходимый для дыхания, поддержания горения, окисления. Относится к группе халькогенов. Самый распространённый на Земле элемент. Строение атома кислорода позволяет ему соединяться с металлами и неметаллами, образуя оксиды.
Строение
По положению в периодической таблице Менделеева можно определить строение атома элемента кислорода. Это восьмой элемент, расположенный в VI группе, втором периоде. Относительная атомная масса – 16. Существует три изотопа элемента:
- 16O;
- 17O;
- 18O.
Наиболее распространён 16O.
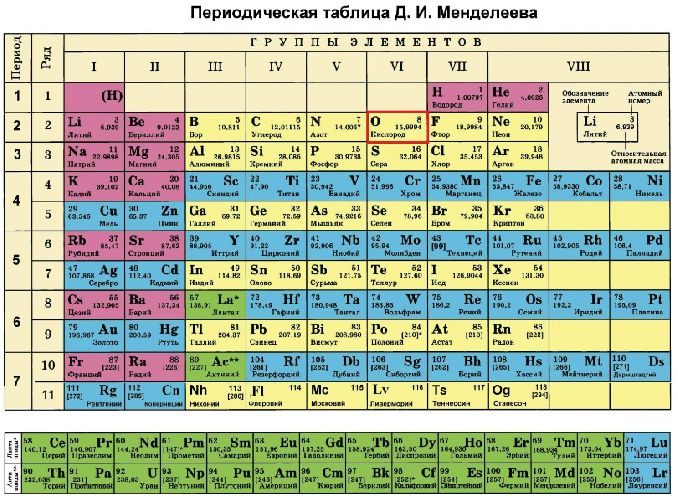
Электронная конфигурация атома кислорода – 1s22s22p4. Ядро атома кислорода имеет заряд +8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали. На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.
Молекула кислорода имеет два атома – О2. При присоединении ещё одного атома образуется озон – О3.
Физические свойства
Кислород – бесцветный и безвкусный газ, плохо растворимый в воде и спирте. Хорошо растворим в жидком серебре. В сжиженном виде приобретает светло-голубой цвет, в твёрдом – синий. Занимает 21 % атмосферного воздуха.
Кислород поддерживает горение, поэтому его легко обнаружить с помощью тлеющей лучины (вспыхивает).
Химические свойства
Благодаря электронному строению обладает высокой степенью окисления. Однако большую активность проявляет при нагревании из-за прочных двойных связей между атомами. При комнатной температуре быстро реагирует с наиболее активными элементами – щелочными и щелочноземельными металлами, некоторыми неметаллами.
Соединяясь с элементами, образует оксиды. Окисляет органические вещества. Примеры реакций с простыми веществами:
- K + O2 → KO2;
- 3Fe + 2O2 → Fe3O4;
- S + O2 → SO2.
С фосфором, серой, углеродом (графитом), водородом кислород реагирует при нагревании:
- 4Р + 5О2 → 2Р2О5;
- S + O2 → SO2;
- С + О2 → СО2;
- 2Н2 + О2 → 2Н2О.
Быстро пропуская фтор через щёлочь, получают реакцию кислорода с фтором:
2F2 + 2NaOH → 2NaF + H2O + OF2.
Кислород с фтором непосредственно взаимодействует при электрическом разряде. В этом случае кислород играет роль восстановителя:
O2 + F2 → F2O2.
Кислород реагирует со сложными веществами, образуя оксиды:
- 2CuS + 3O2 → 2CuO + 2SO2;
- 2H2S + 3O2 → 2SO2 + 2H2O;
- 2C6H6 + 15O2 → 12CO2 + 6H2O;
- CH4 + 2O2 → CO2 + 2H2O.
Кислород не реагирует с золотом и инертными газами. Взаимодействие с галогенами происходит в условиях ультрафиолета или электрического тока.
Что мы узнали?
Кислород – распространённый в природе бесцветный газ. Схема строения атома – +8 О)2)6. Кислород всегда проявляет валентность II за счёт двух неспаренных электронов. Кислород – сильный окислитель, проявляющий в некоторых реакциях свойства восстановителя. Взаимодействует с металлами и неметаллами, сложными неорганическими и органическими веществами. Наибольшую активность проявляет при нагревании. Не реагирует с благородными газами и золотом.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
-
Мила Кондратьева
5/5
-
Семён Гольдфарб
5/5
-
Александр Котков
5/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 336.
А какая ваша оценка?
Строение
По положению в периодической таблице Менделеева можно определить строение атома элемента кислорода. Это восьмой элемент, расположенный в VI группе, втором периоде. Относительная атомная масса – 16. Существует три изотопа элемента:
- 16O;
- 17O;
- 18O.
Наиболее распространён 16O.
Электронная конфигурация атома кислорода – 1s22s22p4. Ядро атома кислорода имеет заряд +8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали. На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.
Молекула кислорода имеет два атома – О2. При присоединении ещё одного атома образуется озон – О3.
Видео
Физические свойства
Кислород – бесцветный и безвкусный газ, плохо растворимый в воде и спирте. Хорошо растворим в жидком серебре. В сжиженном виде приобретает светло-голубой цвет, в твёрдом – синий. Занимает 21 % атмосферного воздуха.
Рис. 3. Твёрдый кислород.
Кислород поддерживает горение, поэтому его легко обнаружить с помощью тлеющей лучины (вспыхивает).
Электронное строение атома кислорода
Атом кислорода имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –VI (халькогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 6 валентных электронов. Обладает высокой окислительной способностью (выше только у фтора).
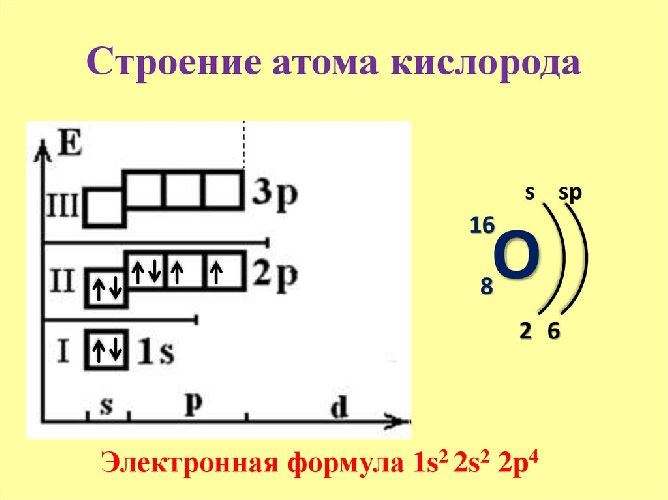
Рис. 1. Схематичное изображение строения атома кислорода.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p4.
Кислород – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
У кислорода есть 2 пары спаренных электронов и два неспаренных электрона. Во всех своих соединениях кислород проявляет валентность II.
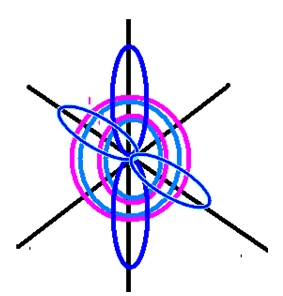
Рис. 2. Пространственное изображение строения атома кислорода.
Получение и применение
Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого удаляют примеси, CO2, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород. В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
Строение атома
Также по теме:
Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть равно 8, 9 или 10. Наиболее распространенный из трех изотопов кислорода (99,76%) – это 168O (8 протонов и 8 нейтронов). Содержание другого изотопа, 188O (8 протонов и 10 нейтронов), составляет всего 0,2%. Этот изотоп используется как метка или для идентификации некоторых молекул, а также для проведения биохимических и медико-химических исследований (метод изучения нерадиоактивных следов). Третий нерадиоактивный изотоп кислорода 178O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 126C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 168O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044 (см. также АТОМНАЯ МАССА).
В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд (см. также АТОМА СТРОЕНИЕ).
Атомы кислорода в соединениях проявляют валентность II, I.
Валентность кислорода характеризует способность атома O к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н2О → 2Н2 + О2
2. В лаборатории кислород получают: 1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4 и др.)
2. Термическим разложением перманганата калия KMnO4: 2KMnO4 = K2MnO4 + MnO2 + O2↑,
Бертолетовой соли KClO3: 2KClO3 = 2KCl + 3O2↑ (катализатор MnO2)
Оксида марганца (+4) MnO2: 4MnO2 = 2Mn2O3 + O2↑ (700 oC),
3MnO2 = 2Mn3O4 + O2↑ (1000 oC),
Пероксид бария BaO2 : 2BaO2 = 2BaO + O2↑
3. Разложением пероксида водорода: 2H2O2 = H2O + O2↑ (катализатор MnO2)
4. Разложение нитратов: 2KNO3 → 2KNO2 + O2
На космических кораблях и подводных лодках кислород получают из смеси K2O2 и K2O4: 2K2O4 + 2H2O = 4KOH +3O2↑ 4KOH + 2CO2 = 2K2CO3 + 2H2O
Суммарно: 2K2O4 + 2CO2 = 2K2CO3 + 3О2 ↑
Когда используют K2O2, то суммарная реакция выглядит так: 2K2O2 + 2CO2 = 2K2CO3 + O2 ↑
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Что мы узнали?
Кислород – распространённый в природе бесцветный газ. Схема строения атома – +8 О)2)6. Кислород всегда проявляет валентность II за счёт двух неспаренных электронов. Кислород – сильный окислитель, проявляющий в некоторых реакциях свойства восстановителя. Взаимодействует с металлами и неметаллами, сложными неорганическими и органическими веществами. Наибольшую активность проявляет при нагревании. Не реагирует с благородными газами и золотом.
Теги
Строение атома кислорода
Общие сведения о строении атома кислорода
Порядковый номер равен 8. Заряд ядра равен +8. Атомный вес – 15,999а.е.м. В природе встречаются три изотопа кислорода: 16O,17O и 18O, из которых наиболее распространенным является 16O (99,762 %).
Электронное строение атома кислорода
Атом кислорода имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –VI (халькогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 6 валентных электронов. Обладает высокой окислительной способностью (выше только у фтора).
Рис. 1. Схематичное изображение строения атома кислорода.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p4.
Кислород – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
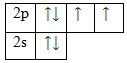
У кислорода есть 2 пары спаренных электронов и два неспаренных электрона. Во всех своих соединениях кислород проявляет валентность II.
Рис. 2. Пространственное изображение строения атома кислорода.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Электронное строение атома кислорода
Электронное строение нейтрального атома кислорода в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме кислорода.
O
+8
2
6
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме кислорода.
| 2 | ↑↓ | ↑↓ | ↑ | ↑ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома кислорода выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома кислорода.
8O 1s2 2s2 2p4
Сокращённая электронная конфигурация атома кислорода.
8O [He] 2s2 2p4
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома кислорода.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 2s | 2 | 0 | 0 | +½ |
| -½ | ||||
| 2p | 2 | 1 | -1 | +½ |
| -½ | ||||
| 1 | +½ | |||
| 2 | +½ |
Кислород, свойства атома, химические и физические свойства.
О 8 Кислород
15,99903-15,99977* 1s2 2s2 2p4
Кислород — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 8. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), втором периоде периодической системы.
Атом и молекула кислорода. Формула кислорода. Строение кислорода
Изотопы и модификации кислорода
Свойства кислорода (таблица): температура, плотность, давление и пр.
Физические свойства кислорода
Химические свойства кислорода. Взаимодействие кислорода. Реакции с кислородом
Получение кислорода
Применение кислорода
Таблица химических элементов Д.И. Менделеева
Атом и молекула кислорода. Формула кислорода. Строение кислорода:
Кислород – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением О и атомным номером 8. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), втором периоде периодической системы.
Кислород самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы халькогенов.
Кислород – химически активный неметалл.
Кислород обозначается символом О.
Как простое вещество кислород (химическая формула O2) при нормальных условиях представляет собой двухатомный газ без цвета, вкуса и запаха. В жидком состоянии кислород имеет светло-голубой цвет, а в твёрдом – представляет собой кристаллы светло-синего цвета.
Молекула кислорода двухатомна. Также встречается аллотропная модификация кислорода – озон, молекула которого состоит из трёх атомов кислорода.
Химическая формула кислорода O2 (или O3 – озон).
Электронная конфигурация атома кислорода 1s2 2s2 2p4. Потенциал ионизации (первый электрон) атома кислорода равен 1313,94 кДж/моль (13,618055(7) эВ).
Строение атома кислорода. Атом кислорода (наиболее распространенный из трех изотопов кислорода (99,757 %) – 168О) состоит из положительно заряженного ядра (+8), вокруг которого по атомным оболочкам движутся восемь электронов. При этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку кислород расположен во втором периоде, оболочки всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s- и р-орбиталями. Два спаренных электрона находится на 1s-орбитали, вторая пара электронов – на 2s-орбитали. На 2р-орбитали находится два спаренных и два неспаренных электрона. Поэтому во всех своих соединениях кислород проявляет валентность II. В свою очередь ядро атома кислорода состоит из восьми протонов и восьми нейтронов. Кислород относится к элементам p-семейства.
Радиус атома кислорода (вычисленный) составляет 48 пм.
Атомная масса атома кислорода составляет 15,99903-15,99977 а. е. м.
Кислород – самый распространённый химический элемент на Земле. В земной коре на его долю в составе различных соединений приходится около 46 % массы. Морские и пресные воды содержат по массе 86 % кислорода (если быть точнее – 85,82 %). В человеке его содержание составляет по массе 61 %. В атмосфере содержание свободного кислорода составляет 20,9476 % по объёму и 23,15 % по массе. На Солнце – 0,9 %, а во Вселенной – 1 %.
При высокой температуре молекула кислорода О2 обратимо диссоциирует на атомарный кислород. При 2000 °C на атомарный кислород диссоциирует 0,03 % молекулярного кислорода, при 2600 °C – 1 %, при +4000 °C – 59 %, при 6000 °C — 99,5 %.
Изотопы и модификации кислорода:
Свойства кислорода (таблица): температура, плотность, давление и пр.
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения* | |
| 101 | Название | Кислород |
| 102 | Прежнее название | |
| 103 | Латинское название | Oxygenium |
| 104 | Английское название | Oxygen |
| 105 | Символ | О |
| 106 | Атомный номер (номер в таблице) | 8 |
| 107 | Тип | Неметалл |
| 108 | Группа | |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1771 г., Джозеф Пристли, Великобритания, 1 августа 1774 г. |
| 110 | Год открытия | 1771 г. |
| 111 | Внешний вид и пр. | Газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 4 аллотропные модификации, обусловленные различным составом молекул:
– кислород (O2), – озон (O3), – ε-кислород (O4 или O8) с простой моноклинной кристаллической решёткой, – ζ-кислород, металлическая фаза кислорода (On). 4 аллотропные модификации кислорода (O2), отличающихся строением кристаллической решётки: – α-кислород (α-O2) с простой моноклинной кристаллической решёткой, – β-кислород (β-O2) с ромбоэдрической (тригональной) кристаллической решёткой, – γ-кислород (γ-O2) с простой кубической кристаллической решёткой, – δ-кислород (δ-O2) |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 23,15 % |
| 119 | Содержание в земной коре (по массе) | 46 % |
| 120 | Содержание в морях и океанах (по массе) | 86 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1 % |
| 122 | Содержание в Солнце (по массе) | 0,9 % |
| 123 | Содержание в метеоритах (по массе) | 40 % |
| 124 | Содержание в организме человека (по массе) | 61 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 15,99903-15,99977 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p4 |
| 203 | Электронная оболочка | K2 L6 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 48 пм |
| 205 | Эмпирический радиус атома | 60 пм |
| 206 | Ковалентный радиус* | 73 пм |
| 207 | Радиус иона (кристаллический) | O2-
124 (4) пм, 126 (6) пм, 128 (8) (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 152 пм |
| 209 | Электроны, Протоны, Нейтроны | 8 электронов, 8 протонов, 8 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 16-ая группа (по старой классификации – главная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, -1, -0,5, 0, +1, +2 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 3,44 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1313,94 кДж/моль (13,618055(7) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | 140,9760(2) кДж/моль (1,4611136(9) эВ) – кислород 16O,
140,9755(3) кДж/моль (1,461108(4) эВ) –кислород 17O, 140,9752(3) кДж/моль (1,461105(3) эВ) –кислород 18O |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,001429 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – газ),
0,00142897 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,141 г/см³ (при -183 °C и иных стандартных условиях, состояние вещества – жидкость), 1,27 г/см3 (при -219 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -218,79 °C (54,36 K, -361,82 °F) |
| 403 | Температура кипения* | -182,962 °C (90,188 K, -297,332 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,444 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,82 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,911 Дж/г·K (при 15 °C), 0,9125 Дж/г·K (при 100 °C), 0,915 Дж/г·K (при 200 °C), 0,926 Дж/г·K (при 400 °C), 0,938 Дж/г·K (при 600 °C) |
| 410 | Молярная теплоёмкость* | 29,378 Дж/(K·моль) |
| 411 | Молярный объём | 11,196 см³/моль |
| 412 | Теплопроводность | 0,02658 Вт/(м·К) (при стандартных условиях),
0,027 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-кислород (α-O2) |
| 512 | Структура решётки | Простая моноклинная
|
| 513 | Параметры решётки | a = 5,403 Å, b = 3,429 Å, c = 5,086 Å, β = 135,53° |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 155 К |
| 516 | Название пространственной группы симметрии | C12/m1 |
| 517 | Номер пространственной группы симметрии | 12 |
| 521 | Кристаллическая решётка #2 | β-кислород (β-O2) |
| 522 | Структура решётки | Ромбоэдрическая (тригональная)
|
| 523 | Параметры решётки | a = 4,21 Å, α = 46,25° |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | |
| 527 | Номер пространственной группы симметрии | |
| 531 | Кристаллическая решётка #3 | γ-кислород (γ-O2) |
| 532 | Структура решётки | Простая кубическая
|
| 533 | Параметры решётки | a = 6,83 Å |
| 534 | Отношение c/a | |
| 535 | Температура Дебая | |
| 536 | Название пространственной группы симметрии | |
| 537 | Номер пространственной группы симметрии | |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7782-44-7 |
Примечание:
100* Данные в таблице приводятся применительно к кислороду (O2).
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
206* Ковалентный радиус кислорода согласно [1] составляет 66±2 пм.
401* Плотность кислорода согласно [1] составляет 0,001429 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ).
402* Температура плавления кислорода согласно [3] составляет -218,35 °C (54,8 K, -361,03 °F).
403* Температура кипения кислорода согласно [3] составляет -182,96 °C (90,19 K, -297,33 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) кислорода согласно [4] составляет 0,446 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) кислорода согласно [3] и [4] составляет 3,4099 кДж/моль и 6,828 кДж/моль соответственно.
410* Молярная теплоемкость кислорода согласно [3] составляет 29,4 Дж/(K·моль).
Физические свойства кислорода:
Химические свойства кислорода. Взаимодействие кислорода. Реакции с кислородом:
Получение кислорода:
Применение кислорода:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Oxygen
- https://de.wikipedia.org/wiki/Sauerstoff
- https://ru.wikipedia.org/wiki/Кислород
- http://chemister.ru/Database/properties.php?dbid=1&id=218
- https://chemicalstudy.ru/kislorod-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
кислород атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле кислорода
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
3 496