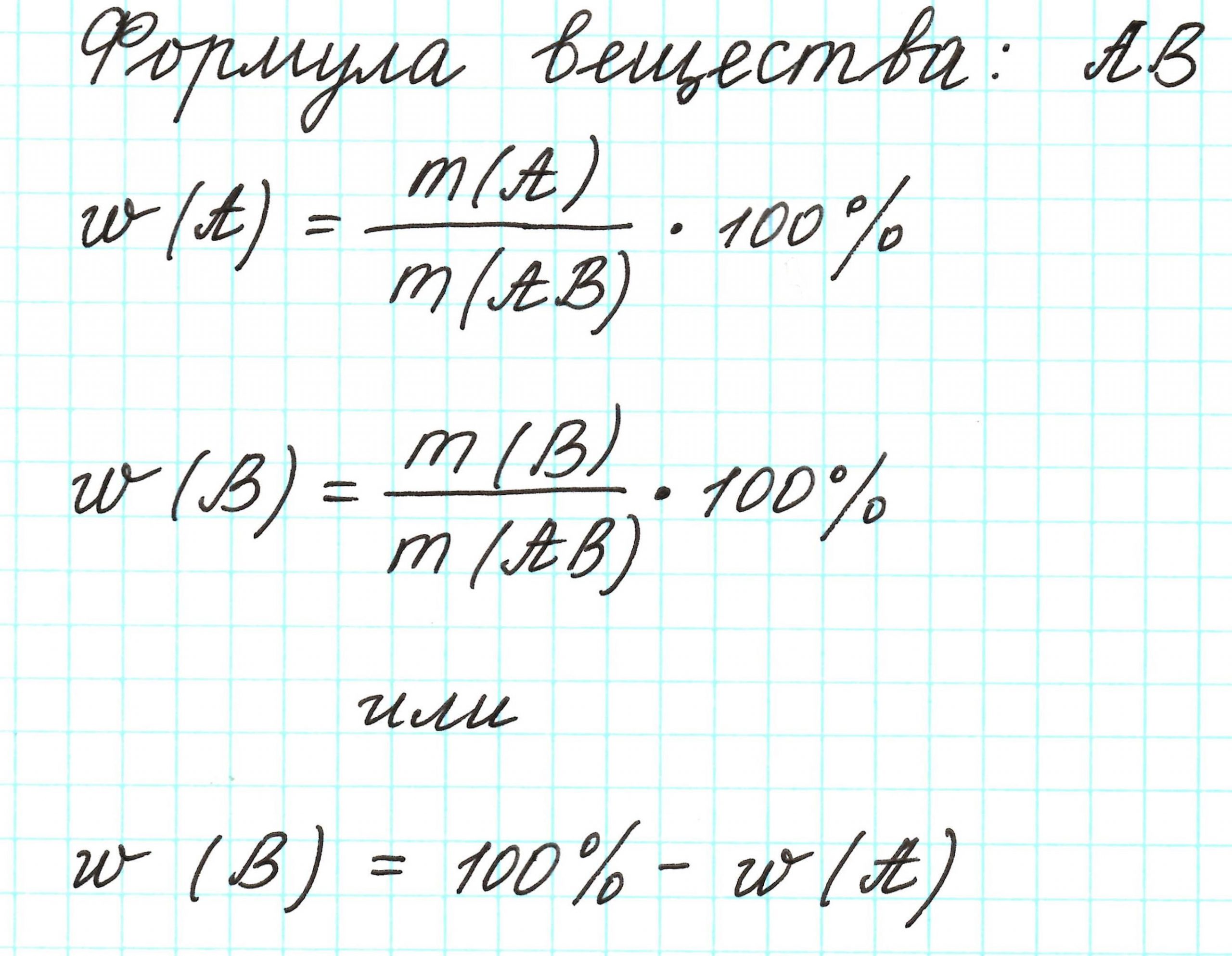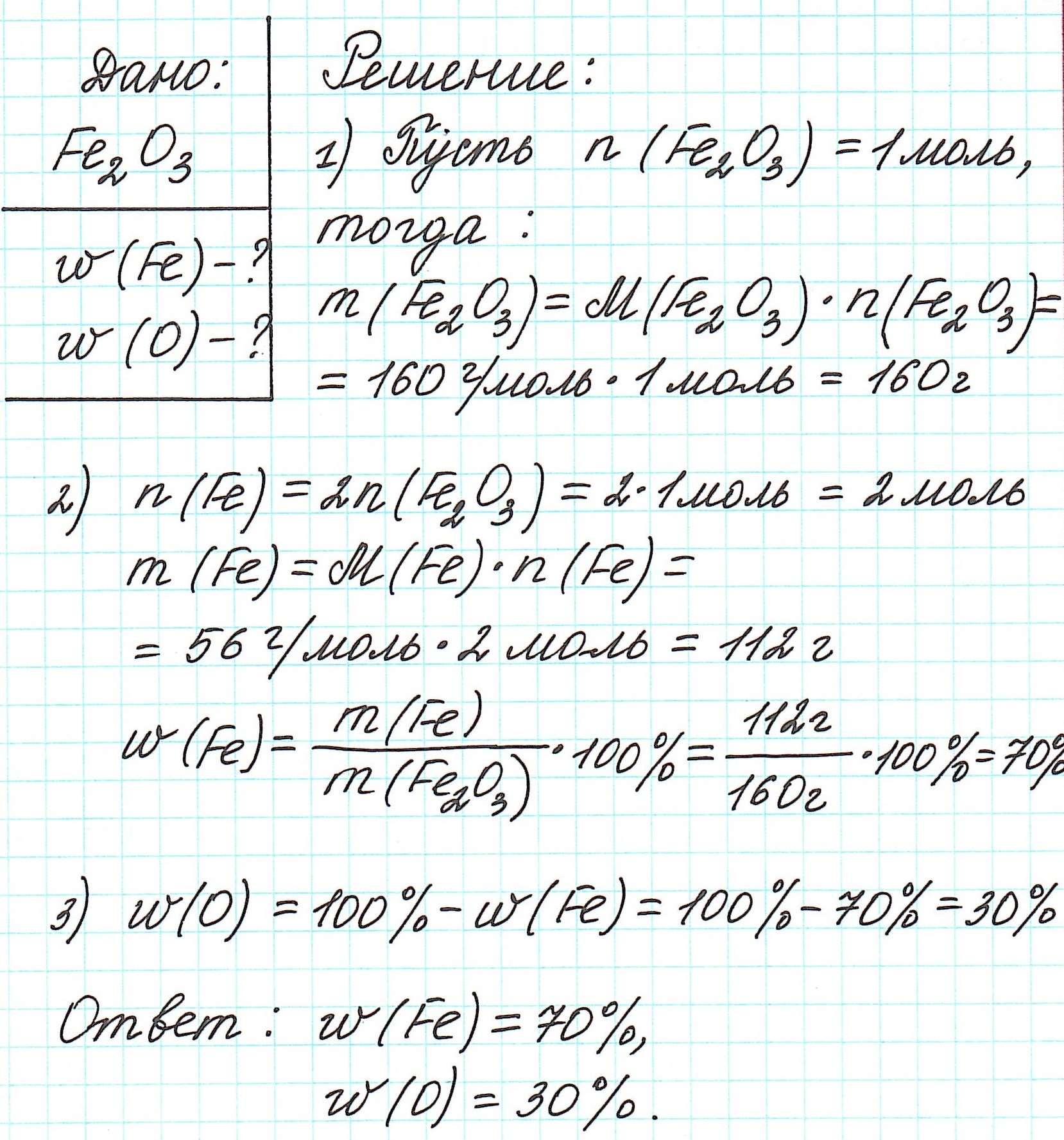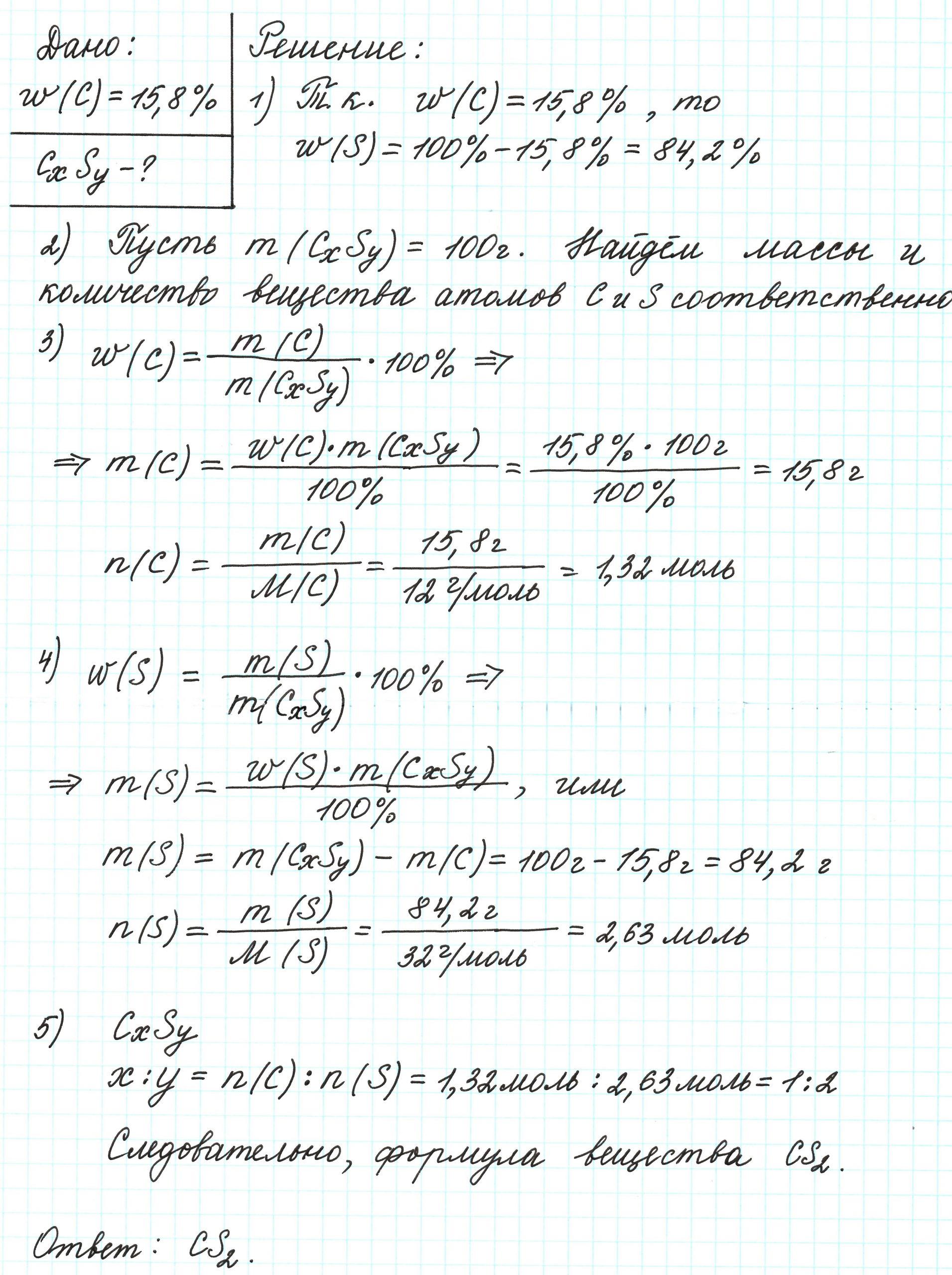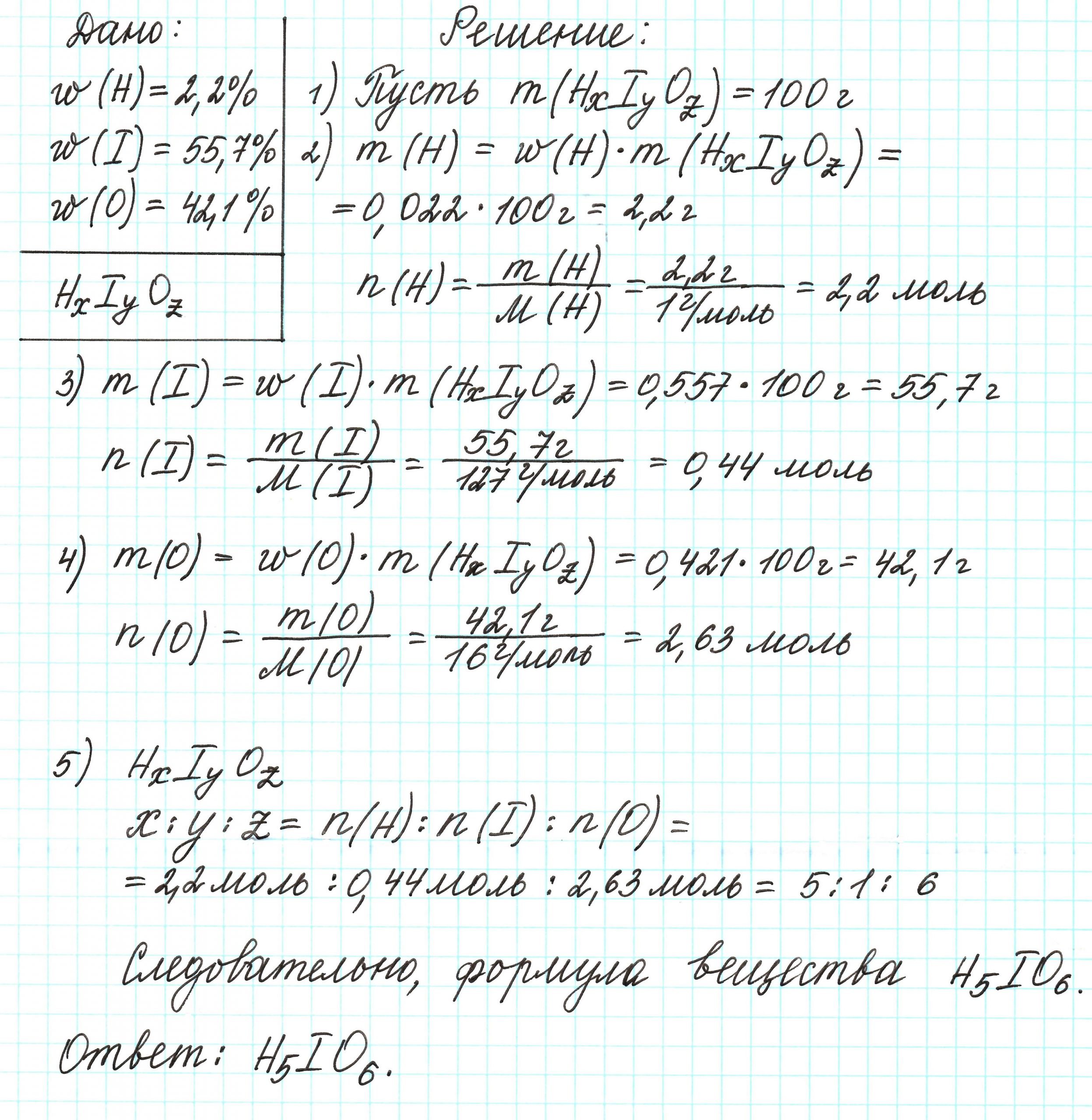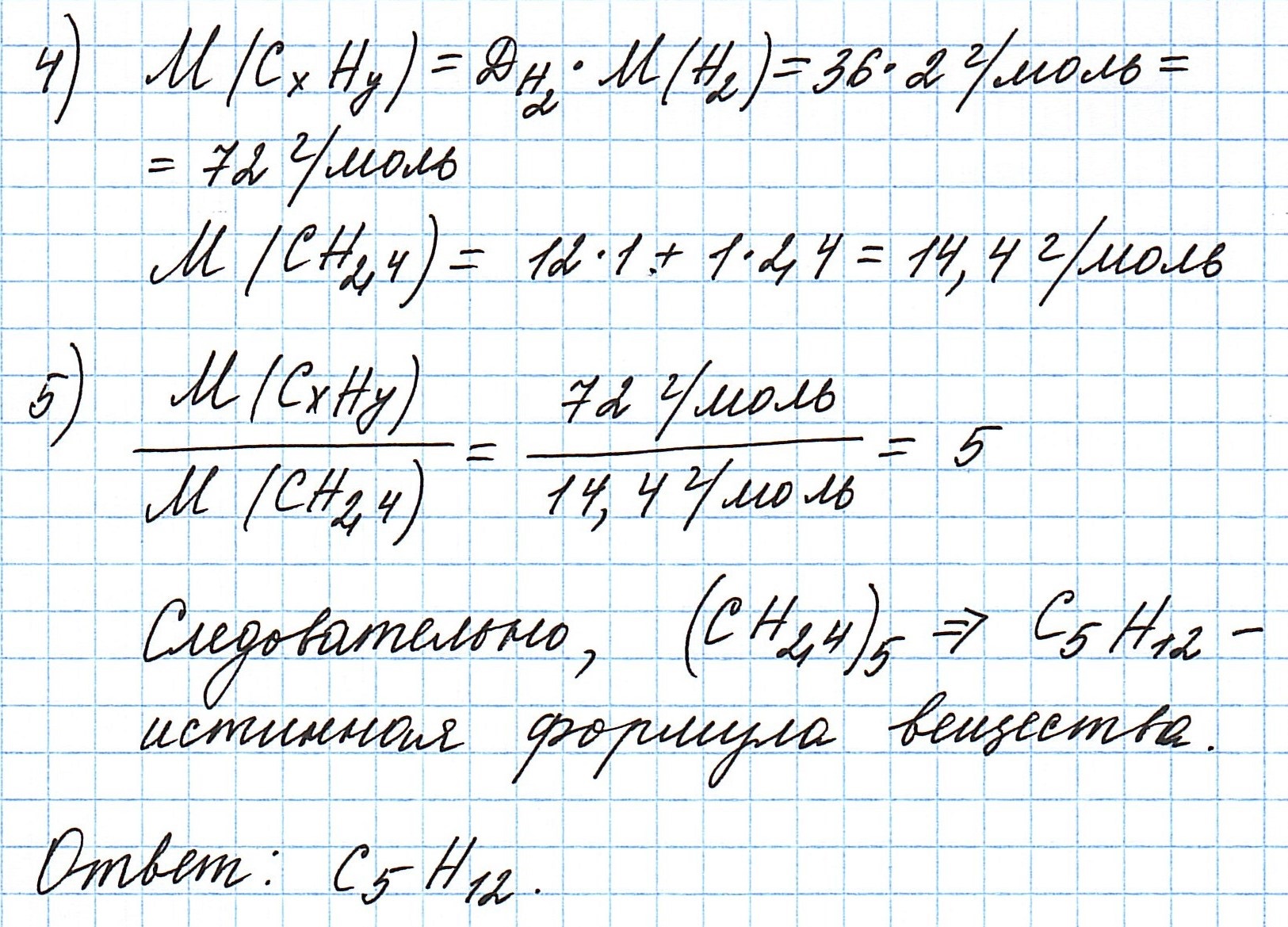найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
Enter the mass of the element (g/mol) and the mass of the compound (g/mol) into the Mass Ratio Calculator. The calculator will evaluate and display the Mass Ratio.
- All Ratio Calculators
- Triglyceride to Hdl Ratio Calculator
- Fluid Ratio Calculator
- Net Mass Calculator
Mass Ratio Formula
The following formula is used to calculate the Mass Ratio.
- Where MAR is the Mass Ratio (%)
- ME is the mass of the element (g/mol)
- MC is the mass of the compound (g/mol)
To calculate a mass ratio, divide the mass of the specific element by the mass of the compound, then multiply by 100.
How to Calculate Mass Ratio?
The following example problems outline how to calculate Mass Ratio.
Example Problem #1:
- First, determine the mass of the element (g/mol).
- The mass of the element (g/mol) is given as: 3.25.
- Next, determine the mass of the compound (g/mol).
- The mass of the compound (g/mol) is provided as: 4.00.
- Finally, calculate the Mass Ratio using the equation above:
MAR = ME / MC *100
The values given above are inserted into the equation below and the solution is calculated:
MAR = 3.25 / 4 *100 = 81.25 (%)
Example Problem #2:
For this problem, the variables required are provided below:
mass of the element (g/mol) = 6
mass of the compound (g/mol) = 7
Test your knowledge using the equation and check your answer with the calculator above.
MAR = ME / MC *100 = ?
Загрузить PDF
Загрузить PDF
Массовый процент задает процентное соотношение элементов в химическом соединении.[1]
Для нахождения массового процента необходимо знать молярную массу (в граммах на моль) входящих в соединение элементов или количество граммов каждого компонента, необходимое для того, чтобы получить заданный раствор.[2]
Массовый процент вычисляется довольно просто: достаточно поделить массу элемента (или компонента) на массу всего соединения (или раствора).
-
1
Выберите уравнение для определения массового процента химического соединения. Массовый процент находится по следующей формуле: массовый процент = (масса компонента/общая масса соединения) x 100. Для получения процентов результат деления умножается на 100.[3]
- В начале решения задачи запишите равенство: массовый процент = (масса компонента/общая масса соединения) x 100.
- Масса интересующего вас компонента должна быть в условии задачи. Если масса не дана, перейдите к следующему разделу, в котором рассказано о том, как определять массовый процент при неизвестной массе.
- Общая масса химического соединения находится путем сложения масс всех элементов (компонентов), которые входят в состав этого соединения (или раствора).
-
2
Вычислите общую массу соединения. Если вы знаете массы всех составляющих соединение компонентов, просто сложите их, и таким образом вы найдете общую массу получившегося соединения или раствора. Эту массу вы используете в качестве знаменателя в уравнении для массового процента.[4]
- Пример 1: Чему равен массовый процент 5 граммов гидроксида натрия, растворенного в 100 граммах воды?
- Общая масса раствора равна сумме количества гидроксида натрия и воды: 100 г + 5 г дают 105 г.
- Пример 2: Сколько хлорида натрия и воды необходимо для получения 175 граммов 15-процентного раствора?
- В этом примере даны общая масса и необходимый процент, и требуется найти количество вещества, которое необходимо добавить в раствор. При этом общая масса составляет 175 граммов.
- Пример 1: Чему равен массовый процент 5 граммов гидроксида натрия, растворенного в 100 граммах воды?
-
3
Определите массу заданного компонента. Если вас просят вычислить «массовый процент», следует найти, сколько процентов от общей массы вещества составляет масса определенного компонента. Запишите массу заданного компонента. Это будет числитель в формуле для массового процента.[5]
- Пример 1: масса заданного компонента — гидрохлорида натрия — составляет 5 граммов.
- Пример 2: в этом примере масса заданного компонента неизвестна, и ее следует найти.
-
4
Подставьте значения в уравнение для массового процента. После того как вы определите все необходимые величины, подставьте их в формулу.
- Пример 1: массовый процент = (масса компонента/общая масса соединения) x 100 = (5 г/105 г) x 100.
- Пример 2: необходимо преобразовать формулу для массового процента так, чтобы можно было найти неизвестную массу химического компонента: масса компонента = (массовый процент*общая масса соединения)/100 = (15*175)/100.
-
5
Вычислите массовый процент. После подстановки всех значений в формулу для массового процента произведите необходимые вычисления. Поделите массу компонента на общую массу химического соединения или раствора и умножьте на 100. В результате у вас получится массовый процент данного компонента.
- Пример 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Таким образом, массовый процент 5 граммов гидрохлорида натрия, растворенного в 100 граммах воды, составляет 4,761%.
- Пример 2: переписанное выражение для массового процента компонента имеет вид (массовый процент*общая масса вещества)/100, откуда находим: (15*175)/100 = (2625)/100 = 26,25 граммов хлорида натрия.
- Необходимое количество воды находим путем вычитания массы компонента из общей массы раствора: 175 – 26,25 = 148,75 граммов воды.
Реклама
-
1
Выберите формулу для массового процента химического соединения. Основное уравнение для нахождения массового процента выглядит следующим образом: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100. Молярная масса вещества — это масса одного моля данного вещества, в то время как молекулярная масса представляет собой массу одного моля всего химического соединения.[6]
Чтобы получить проценты, результат деления умножается на 100.[7]
- В начале решения задачи запишите равенство: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100.
- Обе величины измеряются в граммах на моль (г/моль).
- Если вам не даны массы, массовый процент какого-либо элемента в заданном веществе можно найти, используя молярную массу.
- Пример 1: Найти массовый процент водорода в молекуле воды.
- Пример 2: Найти массовый процент углерода в молекуле глюкозы.
-
2
Запишите химическую формулу. Если в примере не даны химические формулы заданных веществ, следует записать их самостоятельно. Если же в задании даны необходимые формулы химических веществ, данный шаг можно пропустить и перейти сразу к следующему шагу (найти массу каждого элемента).
- Пример 1: запишите химическую формулу воды, H2O.
- Пример 2: запишите химическую формулу глюкозы, C6H12O6.
-
3
Найдите массу каждого элемента, входящего в соединение. Определите молярный вес каждого элемента в химической формуле по таблице Менделеева. Как правило, масса элемента указывается под его химическим символом. Выпишите молярные массы всех элементов, которые входят в рассматриваемое соединение.[8]
- Пример 1: найдите молярные массы кислорода (15,9994) и водорода (1,0079).[9]
- Пример 2: найдите молярные массы углерода (12,0107), кислорода (15,9994) и водорода (1,0079).
- Пример 1: найдите молярные массы кислорода (15,9994) и водорода (1,0079).[9]
-
4
Умножьте молярную массу каждого элемента на его мольную долю. Определите, сколько молей каждого элемента содержится в данном химическом веществе, то есть мольные доли элементов. Мольные доли даются числами, стоящими в формуле внизу символов элементов. Умножьте молярную массу каждого элемента на его молярную долю.[10]
- Пример 1: под символом водорода стоит 2, а под символом кислорода 1 (эквивалентно отсутствию числа). Таким образом, молярную массу водорода следует умножить на 2: 1,00794 X 2 = 2,01588; молярную массу кислорода оставляем прежней, 15,9994 (то есть умножаем на 1).
- Пример 2: под символом углерода стоит 6, под водородом 12 и под кислородом 6. Умножая молярные массы элементов на эти числа, находим:
- углерод: (12,0107*6) = 72,0642
- водород: (1,00794*12) = 12,09528
- кислород: (15,9994*6) = 95,9964
-
5
Вычислите общую массу соединения. Сложите найденные массы всех элементов, входящих в данное соединение. Сумма молярных масс элементов, помноженных на мольные доли, даст вам общую массу химического соединения. Это число является делителем в формуле для массового процента.[11]
- Пример 1: прибавьте к 2,01588 г/моль (масса двух молей атомов водорода) 15,9994 г/моль (масса одного моля атомов кислорода), в результате у вас получится 18,01528 г/моль.
- Пример 2: сложите найденные молярные массы: углерод + водород + кислород = 72,0642 + 12,09528 + 95,9964 = 180,156 г/моль.
-
6
Определите массу интересующего вас элемента. Если вас просят найти «массовый процент», значит, следует вычислить массу определенного элемента, входящего в состав соединения, как процентную долю от общей массы всех элементов. Найдите массу заданного элемента и запишите ее. Для этого необходимо умножить молярную массу элемента на его мольную долю. В результате у вас получится величина, стоящая в числителе формулы для массового процента.[12]
- Пример 1: масса водорода в соединении составляет 2,01588 г/моль (масса двух молей атомов водорода).
- Пример 2: масса углерода в соединении составляет 72,0642 г/моль (масса шести молей атомов углерода).
-
7
Подставьте в уравнение для массового процента численные значения. После того, как вы определите значения всех величин, подставьте их в формулу, которая была приведена на первом шаге: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100.
- Пример 1: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (2,01588/18,01528) x 100.
- Пример 2: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (72,0642/180,156) x 100.
-
8
Вычислите массовый процент. После подстановки численных значений выполните необходимые арифметические действия. Поделите массу элемента на общую массу соединения и умножьте на 100. В результате у вас получится массовый процент элемента.
- Пример 1: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (2,01588/18,01528) x 100 = 0,11189 x 100 = 11,18%. Таким образом, массовый процент атомов водорода в молекуле воды равен 11,18%.
- Пример 2: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (72,0642/180,156) x 100 = 0,4000 x 100 = 40,00%. Таким образом, массовый процент атомов углерода в молекуле глюкозы составляет 40,00%.
Реклама
Об этой статье
Эту страницу просматривали 60 746 раз.
Была ли эта статья полезной?
Содержание
- КАК ВЫЧИСЛИТЬ ФОРМУЛУ ВЕЩЕСТВА
- 1.Понятие простейшей и истинной формулы вещества
- 2.Массовая доля химического элемента: что означает и как высчитывается
- 3.Как определить формулу вещества по массовым долям элементов
- 4.Как определить формулу органического соединения
- 4.1. Как определить формулу органического соединения
- по общей молекулярной формуле вещества
- 4.2. Как определить формулу органического соединения
- по продуктам его сгорания
- 5. Как определить формулу вещества: комбинированные задачи
- Что значит соотношение масс элементов
КАК ВЫЧИСЛИТЬ ФОРМУЛУ ВЕЩЕСТВА
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая , или иными словами, эмпирическая формула , указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула , или иначе молекулярная , отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω . И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров . Эта величина в сегда требуется для нахождения молярной (относительной молекулярной) массы вещества . Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
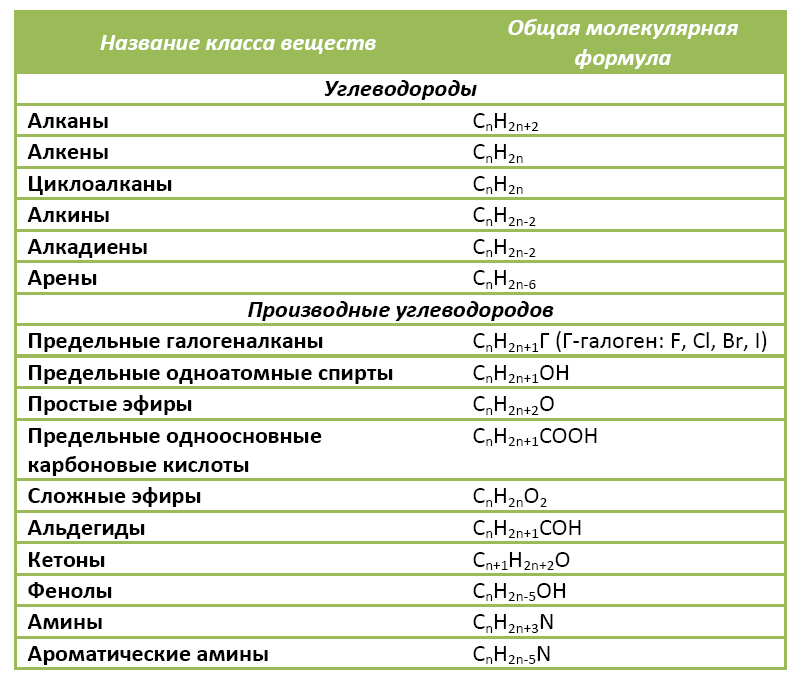
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
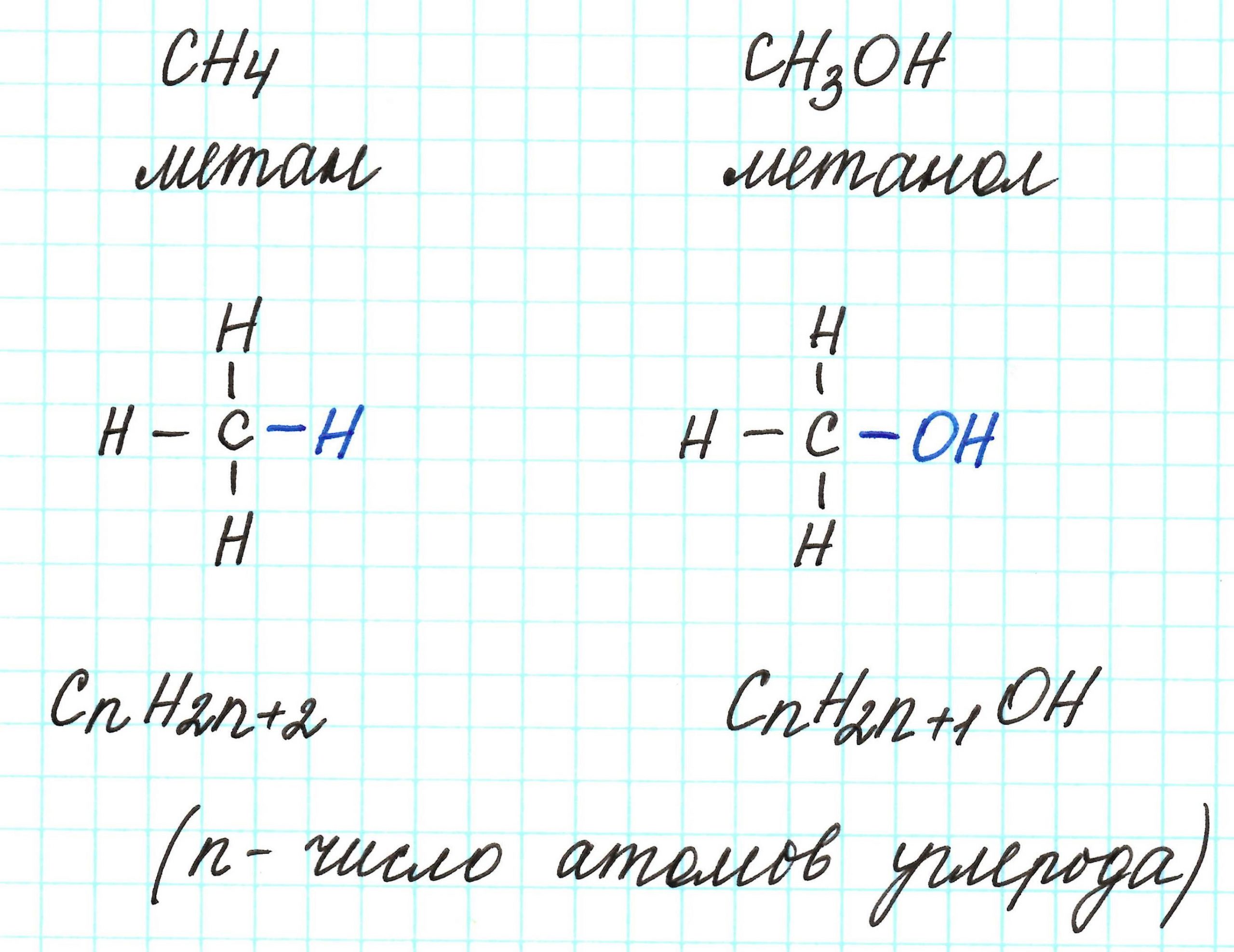
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь в нашу группу ВКонтакте.
Пожалуйста, оцените публикацию 
Источник
Что значит соотношение масс элементов
В химии массовое отношение, часто называемое «процентным составом по массе», представляет собой долю конкретной молекулы, которая состоит из составляющих ее элементов. Например, вода состоит из 11,1 процента водорода (Н) и 88,9 процента кислорода (О), что означает, что 1000-граммовый образец воды (равный 1 литру по объему) состоит из 111 г Н (0,111 × 1000 = 111) и 889 г О (0,889 × 1000).
Этот принцип порождает закон постоянного состава, выдвинутый Джозефом Прустом в 1800 году: данное соединение всегда имеет одинаковую пропорцию по массе составляющих его элементов. Например, вода всегда имеет ровно 8 грамм кислорода на каждый грамм водорода. Углекислый газ всегда содержит 2,67 г кислорода на каждый грамм углерода.
Рассчитать массовые отношения достаточно просто, если у вас есть доступ к периодической таблице (см. Ресурсы) и средства для выполнения базовой алгебры.
Допустим, вы хотите рассчитать массовое соотношение серной кислоты H2SO4.
Определить молярную массу каждого присутствующего элемента
H2SO4 содержит водород (H), серу (S) и кислород (S). Из таблицы Менделеева вы можете видеть, что молярные массы этих элементов:
O = 16,00
Шаг 2: Определите массу каждого отдельного присутствующего элемента
На этом шаге вы умножаете количество атомов в одной молекуле соединения на молярную массу, собранную на шаге 1. Количество атомов — это просто нижний индекс после сокращения элемента в молекулярной формуле с пропуском нижнего индекса, означающего «1.»
Есть два атома Н, один атом S и четыре атома О, поэтому у вас есть:
S = (1) (32,06 г) = 32,06 г
O = (4) (16,00 г) = 64 г
Шаг 3: Определить молярную массу соединения.
Сложите цифры, которые вы рассчитали на шаге 2:
2 + 32,06 + 64 = 98,06 г
Шаг 4: разделить массу каждого присутствующего элемента на молярную массу
Это означает разделение отдельных масс из шага 2 по результату шага 3.
Для Н, у вас есть 2 ÷ 98,06 = 0,0204 = 2,04 процента водорода
Для S у вас есть 32,06 ÷ 98,06 = 0,3269 = 32,69% серы
Для O, у вас есть 64 ÷ 98,06 = 0,6527 = 65,27 процента кислорода
Совет
Чтобы проверить свою работу, убедитесь, что ваши проценты в сумме равны 100, учитывая незначительные различия в результате округления:
Источник
Меню сайта
Категории каталога
| 9 класс [16] |
| 11 класс [5] |
| Лаборатория [7] |
| Переменка [6] |
| Решение задач [9] |
| Учебные пособия [5] |
Форма входа
Приветствую Вас Гость!
Поиск
Друзья сайта
Наш опрос
Статистика
Как вам известно, чтобы написать формулу вещества используют знаки химических элементов и цифры – индексы, которые показывают количество каждого из элементов в 1 моле вещества. Значит, чтобы вывести формулу вещества, необходимо установить, какие элементы входят в его состав и в каком количестве. Поэтому, при установлении формулы находят количество каждого из элементов с помощью данных задачи и определяют их соотношение.
Решим задачу: 10 г кальция сожгли в кислороде. После реакции получился оксид кальция массой 14 г. Рассчитайте формулу оксида.
Исходя из условия, определяем массу кислорода в оксиде:
m (О) = m ( CaO ) — m ( Ca ) = 14г — 10г = 4г
Определяем количества кальция и кислорода, используя формулу для нахождения количества вещества через массу.
n ( Ca ) = 10г/ 40 г/моль = 0,25моль
n ( O ) = 4г / 16 г/моль = 0,25 моль
Следовательно, отношение количества кальция и кислорода в оксиде кальция составляет n ( Ca ): n ( O ) = 0,25 : 0,25, или, в целых числах, 1:1. Значит, химическая формула оксида кальция — СаО.
Ответ: формула оксида кальция СаО.
1. Определите химическую формулу оксида серы, если известно, что в этом оксиде на 8г серы приходится 8г кислорода.
2. Известно, что азот образует несколько оксидов. В лаборатории было получено два оксида азота. Опытным путем установили, что в первом оксиде на 7г азота приходится 4г кислорода, во втором – на ту же массу азота – 16 г. Установите формулы оксидов.
3. Химик провел анализ некоего вещества и установил, что в исследуемом образце содержится 5,4 г алюминия и 21,3 г хлора. Какова химическая формула этого вещества? Дайте ему название.
4. В быту часто употребляют растворитель ацетон, жидкость с характерным запахом. В ацетоне на 9 г углерода приходится 1,5 г водорода и 4 г кислорода. Какова химическая формула ацетона?
Для расчета количества вещества необходимо знать массу. Чтобы перейти от массовых долей к граммам, примем массу образца за 100 г, тогда числовые значения доли в % совпадут с числовым значением массы элемента в образце. Затем решаем задачу по массовому соотношению элементов.
Решим задачу: Карбонат натрия (сода) содержит 11,3% углерода, 43,4 % натрия и 45,3% кислорода. Определите формулу карбоната натрия.
Wm (С)=11,3% Wm ( Na )=43 ,4%
Примем массу образца карбоната натрия за 100г. Исходя из условия, определяем массы элементов в образце:
Определяем количества вещества каждого химического элемента по формуле n = m / M
n ( Na ) = 43,4 г / 23 г/моль = 1,89 моль
n ( C ) = 11,3 г / 12 г/моль = 0,94 моль
n (О) = 45,3 г/ 16 г/моль = 2,83 моль
Следовательно, отношение количества натрия, углерода и кислорода в карбонате натрия составляет n ( Na ): n ( C ): n ( O ) = 1,89 : 0,94: 2,83, Чтобы выразить соотношение в целых числах, разделим каждое число на наименьшее ( на 0,94).
Значит, химическая формула карбоната натрия — Na 2 CO 3.
В состав перманганата калия (в быту называемого марганцовкой) входит 24,7% калия, 34,8% марганца, 40,5% кислорода. Определите формулу перманганата калия.
Главная > Решение
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
Типы расчетных задач
I. Вывод химических формул.
I. Нахождение химической формулы вещества по массовым долям элементов
Задача. Элементный состав вещества следующий: массовая доля элемента железа 0.7241 (или 72,41%), массовая доля кислорода 0,2759 (или 27,59%). Выведите химическую формулу.
Решение. 1) Находим отношение числа атомов:
Fe: О =72,41/56 ==27,59/16 1,29:1,72
2) Меньшее число принимаем за единицу и находим следующее отношение:
3) Так как должно быть целое число атомов, то это отношение приводим к целым числам:
Ответ. Химическая формула данного вещества Fе з О 4 .
2. Нахождение химической формулы по отношение масс элементов,
входящих в состав данного вещества.
Задача. Найдите химическую формулу вещества, в состав которого входит 9 мае. ч. алюминия и 8 мае. ч. кислорода.
Решение. Находим отношение числа атомов:
Аl: О = 9/27:8/16 = 0,33:0.5 = 0,99:1,5 2:3
Ответ. Химическая формула данного вещества Аl 2 Оз.
3. Нахождение химической формулы вещества по массовым долям элементов, если указана плотность или относительная плотность данного вещества в газообразном состоянии.
Задача 1. Экспериментально установлено, это элементный состав газообразного вещества следующий: массовая доля углерода 0,8571 (или 85,71%), массовая доля водорода 0,1429 (или 14,29%). Масса 1 л этого газа при нормальных условиях составляет 1,25 г. Найдите химическую формулу данного вещества.
Решение. 1) Находим отношение числа атомов элементов:
С : Н = 85,71/12:14,29/1 = 7,14:14,29 1:2
Следовательно, простейшая формула этого газа СН 2 .
2) Находим молярную массу по простейшей формуле
М (СН 2 ) = 12 + 2 = 14 г/ моль.
Однако отношению чисел атомов 1:2 соответствуют много формул, например С 2 Н 4 , Сз Н 6 и т. д.
3) Чтобы выяснить, какая из этих формул соответствует данному газу находим молярную массу по плотности:
M = V·р =22,4-1,25= 28;
Так как близкая по численному значению молярная масса, равная 28 г, соответствует лишь формуле С 2 Н 4 . то она является истинной формулой этого вещества.
Ответ. Химическая формула исследуемого вещества С 2 Н 4 ( этилен).
Задача 2. При сгорании 2,3 г вещества образуется 4,4 г оксида углерода (IV) и 2,7 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определите молекулярную формулу данного вещества.
Решение. Так как при сгорании данного вещества образуются оксид углерода (IV) и вода. то из этого следует, что в состав данного вещества входят углерод и водород.
1) Находим массу углерода:
: М (С0 2 )=44 г/моль; :
44 г СО 2 содержат 12 г С
44:4,4=12:х 1 ; х 1 = 
2)Находим массу водорода:
М(Н 2 О)= 18 г/моль;
18 г Н 2 О содержат 2г H
2,7 г Н 2 О » х 2
18:2,7 ==2:Х 2 ; X 2 =
3) Если в исследуемом веществе содержится кислород, то его находят по разности массы вещества и суммы масс углерода и водорода:
m (С) + m (Н) =1,2 г + 0,3 г = 1,5 г;
m(0)= 2,3 г — 1,5 г = 0,8 г
4) Находим отношение числа атомов элементов:
С:Н:0 = 1,2/12:0,3/1:0,8/16 = 0,1:0,3:0,05 = 2:6:1
Следовательно, простейшая формула этого вещества С 2 Н 6 О.
5) Находим молярную массу исследуемого вещества по простейшей формуле и по относительной плотности его паров по воздуху:
М(С 2 Н 6 О)=46 г/моль;
М=29·D возд. = 29-1,59= 46,11; М=46,11 г/моль
В данном случае простейшая формула С 2 Н 6 О является истинной.
Ответ. Химическая формула вещества С 2 Н 6 О.
II. Расчеты по химическим формулам.
1. Нахождение отношения масс элементов по химической формуле сложного вещества .
Задача. Найдите отношение масс элементов в гидроксиде кальция.
Решение. 1) Находим молярную массу гидроксида кальция:
М(Са(ОН) 2 )= 40+(16 +1)·2=74; М =74 г/моль
2) Находим отношение масс кальция, кислорода и водорода:
Ответ: отношение масс кальция, кислорода и водорода в гидроксиде кальция равно 20:16:1.
2. Нахождение содержания массовых долей элементов в сложном веществе.
Задача. Вычислите массовые доли элементов в гидроксиде натрия. Решение. 1) Находим молярную массу гидроксида натрия:
M(NaOH)=23+16+l=40; М(NaOH)=40 г/моль
2) Вычисляем массовую долю натрия:
w (Na) = 23/40 =0,575 маc. д., или 57.5%
3) Вычисляем массовую долю кислорода:
w (О) =16/40=0.4 маc. д., или 40%
4) Вычисляем массовую долю водорода:
w (Н)= 1/40=0,025 маc. д, или 2,5%
5) Проверяем правильность вычисления:
0,575+0,4+0,025=1,00 (в мас. д.);
Ответ. Элементный состав NaOH следующий: массовая доля натрия 0,575 (или 57,5%), массовая доля кислорода 0,4 (или 40%) и массовая доля водорода 0,025 (или 2,5%).
Примечание. Содержание водорода можно также вычислить по разности:
w (Na) + w (О) = 0,575 + 0,4 = 0.975;
w (H) = 1,0 — 0,975 = 0,025;
w% (Na) + w% (О) = 57,5 + 40 = 97,5;
w% (H) = 100 — 97,5 = 2,5
3. Нахождение массы элемента по известной массе сложного вещества Задача. Вычислите, сколько алюминия содержат 408 т оксида алюминия.
Решение. 1) Находим молярную массу оксида алюминия:
А1(А1 2 0з)=27,2+16-3=102; М (А1 2 0з)=102 г/моль;
2) вычисляем массу алюминия, содержащуюся и 408 т оксида алюминия:
102 т Аl 2 Оз содержат 54 т А1
408 т Аl 2 Oз >> x
102:408=54:x. x=
(Здесь и далее вычисление ведется и тex единицах массы, которые указаны в условиях задач.)
Вычисление можно производить и так :
m(Al)=m(Al 2 O 3 )

Ответ: 408 т Al 2 O 3 содержат 216 т Al/
Примечание. Если в условии задачи дано вещество с примесью, тогда предварительно вычисляют массу чистого ветества, содержащуюся в смеси. Затем поступают, как указано выше.
4. Нахождение массы сложного вещества но заданной массе элемента.
Задача. В какой массе оксида меди (II) содержится 3,2 т меди?
Р е ш e н и е, I) Находим молярную массу оксида меди (II):
М (CиО)= 64+ 16 =8О, М(CиO)=80 гмоль
2) Вычисляем массу оксида меди (II):
64 т Си содержится в 8О т СиO
64:3,2 =80: х; х=
Ответ. 3,2 т Си содержится в 4 т CuO.
III. Расчеты с использованием понятия «моль».
I. Вычисление количества вещества, соответствующего определенной массе вещества.
Задача I. Дано 32 г меди. Bычислитe количество меди.
Р е ш е н и е. Пользуясь формулой v= 
m — масса вещества, М — молярная масса данного вещества, находим кoличество вещества меди:
v =m/M=3264=0,5 v (Cи) = 0,5 моль
Можно рассуждать и так:
64 г меди составляют 1 моль
64:32=1 : х =
0твет: 32г меди составляют 0,5 моль.
Задача 2. Какое количество вещества cocтавляют 66 г оксида углерода (IV)?
Р е ш е н и е. I) Находим молярную массу оксида углерода (IV)
М (С0 2 ) = 44 г/моль
2) Вычисляем количество вещества оксида углерода (IV);
v = m/М = 64/44 = 1,5; v (CO 2 ) = l,5 моль
О т в ет : 66 г оксида углерода (IV) составляют 1.5 моль.
2. Вычисление массы вещества но известному числу молей вещества .
Задача 1. Дано 0,25 моль серы. Вычислите массу серы.
v= mM; m= v ·М =0,25· 32=8 ; m(S)= 8 г
0 т ве т. 0,25 моль серы соответствуют 8 г серы.
Задача 2. Дано 2 моль серной кислоты. Вычислите массу серной кислоты
Р е ш е н и е I) Вычисляем молярную массу серной кислоты:
М(Н 2 SO 4 ) = 98 г/моль
2) Определяем массу серной кислоты:
v = mM; m = v·M=2·98=196; m(H 2 SO 4 )=196 г
О т в е т. 2 моль серной кислоты соответствуют 196 г серной кислоты.
3. Вычисление числа атомов и молекул, содержащихся в определенной
Задача I. Сколько атомов содержится в 20 г кальция?
Р е ш е н и е. 1 ) Вычисляем количество вещества, cоответствующее 20 г кальция:
v = m/M= 20/40=0,5. v(Ca)=0.5 моль
2) Вычисляем число атомов кальция:
1 моль содержит 6,02·10 23 атомов
0,5 моль » х атомов
1 :0,5=6,02· 10 23 : х ; х = 0,5· 6,02 • 10 23 =3,01 • 10 23 : х= 3,01· 10 23 атомов
Ответ. В 20 г кальция содержится 3,01-10 23 атомов.
Задача 2. Сколько молекул содержится в 36 г boды ?
Р е ш е н и е. Определяем молярную массу воды
M(H 2 O)= 18 г моль
2) Находим количество вещества воды:
v=m/M =36/18=2; v(Н 2 О)=2 моль
3) Определяем число молекул воды:
1 моль Н 2 О содержит 6,02 ∙ 10 23 молекул
2 моль Н 2 О » x
1:2=6,02 ·10 23 : х ; х=2 · 6,02 ·10 23 = 1,204·10 24 ;
х= 1,204·10 24 молекул Н 2 O.
Ответ. В воде массой 36 г содержится 1,204 ·10 24 молекул.
IV. Расчеты, связанные с использованием плотностей, относительных плотностей и молярного объема газов.
1. Нахождение плотности и относительной плотности газа по химической формуле данного газа.
Задача. Вычислите плотность и относительные плотности оксида углерода (IV) по водороду, метану и воздуху (плотность обозначается буквой р, а относительная плотность—буквой D) (I, с. 139).
Решение. 1) Вычисляем молярные массы газов:
M(C0 2 )= 44 г/моль; M(H 2 ) =2 г/моль;
М(СН 4 )= 16 г/моль; M возд =29 г/моль
2) Вычисляем плотности оксида углерода (IV):
р = 44/22,4 =1,96; р(С0 2 )=1,96 г/л;
D(CH 4 ) =44/16=2,75; D ( Н 2 ) = 44/2 =22;
D возд = 44/29=1,52
Ответ. р(С0 2 )=1,96 г/л (масса 1 л при н. у.); D (Н 2 ) = 22;
D(CH 4 )=2,75; D возд = 1,5.
Такого вида расчеты широко применяются на практике, так как часто требуется определить, тяжелее или легче данный газ по отношению к воздуху.
2. Вычисление объема определенной массы газообразного вещества
Задача. Какой объем занимают 48 г кислорода?
Решение. 1) Вычисляем молярную массу кислорода:
2) Находим, какой объем занимают 48 г кислорода:
32 г О 2 занимают объем 22,4 л
32:48=22,4:х; х =
Ответ. Кислород массой 48 г занимает объем 33,6 л.
1) Вычисляем молярную массу кислорода:
2) Находим количество вещества, которому соответствует 48 г кислорода:
v=

3) Рассчитываем объем, который занимают 1,5 моль кислорода (н. у.):
v (0 2 )= 1,5 ·22,4 =33,6 л
Ответ. Кислород массой 48 г занимает объем 33,6 л.
3. Вычисление массы газообразного вещества, занимающего определенный объем
(При расчетах необходимо следить за тем, чтобы единицы измерения разных величин были пропорциональными. Так, если масса газообразного вещества выражена в килограммах, то объем следует выражать в кубических метрах.)
Задача . Вычислите массу газовой смеси, состоящей из 5,6 м 3 метана и 2,24 м 3 оксида углерода (II)
Решение. 1) Вычисляем молярные массы метана и оксида углерода (II):
M(CH 4 )=16 г/моль; M(СО)=28 г/моль
2) Определяем массу 5,6 м 3 метана:
масса 22,4 м 3 СН 4 составляет 16 кг
» 5,6 м 3 СН 4 » х 1
22,4 :5,6= 16 :х 1 ; х 1 = 
3) Определяем массу 2,24 м оксида углерода (II):
масса 22,4 м 3 СО составляет 28 кг
» 2.24 м 3 СО » Х 2
22,4: 22,4=28 :х 2 ; х 2 = 
4) Находим общую массу газовой смеси:
4 кг + 2,8 кг =6.8 кг
Отпет. Общая масса газовой смеси 6,8 кг.
4. Вычисление массы вещества по уравнениям химических реакций, в которых участвуют или образуются газы.
Задача. Какой объем кислорода и воздуха потребуется, чтобы сжечь 224 м 3 оксида углерода (II), если содержание в нем негорючих примесей в объемных долях равно 0,25 (или 25%)?
Решение. 1) Вычисляем, сколько чистого оксида углерода (II) содержится в смеси:
100 м 3 смеси содержат 75 м 3 СО
224 м 3 смеси » х 1
100:224=75:х 1 ; х 1 = 
Вычисление можно провести и так: v (СО)=224м 3 ·0,75=168 м 3 СО.
2) Определяем, какой объем кислорода потребуется, чтобы сжечь 168 м 3 оксида углерода (II):
2СО + О 2 ——— > 2СО 2
2·22,4 м 3 22,4 м 3
44,8:168 = 22,4 😡 2 ; x 2 = 
Если молярные объемы обозначить буквой V, а данные и вычисляемые объемы газов обозначить V 0 , то вычисление можно производить и так:

V 0 (O 2 )=V(O 2 ) 
3) Находим объем воздуха, необходимый для реакции:
100 м 3 воздуха содержат 21 м 3 кислорода
100:х 3 =21:84; х 3 =
Ответ. Потребуется 84 м 3 О 2 или 400 м 3 воздуха.
V . Расчеты, связанные с определением массовой доли растворенного вещества в растворе.
1. Вычисление массы растворенного вещества и растворителя, если известны массовая доля растворенного вещества и масса раствора.
Задача 1. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором массовая доля хлорида натрия равна 0,05 (или 5%).
Решение. 1) Находим, какая масса хлорида натрия необходима для приготовления указанного раствора. При решении можно использовать два подхода.
1 массовая доля соответствует 500 г
1 : 0,05 =500 : х; х=
Рассуждать можно и так:
а) 100 г раствора содержат 5 г NaCI 500 г
100:500=5:х; х=
б) m (NaCI) = 500 г · 0,05 = 25 г
2) Вычисляем, какая масса воды потребуется:
m (Н 2 О) = 500 г — 25 г = 475 г
Ответ. Потребуется 25 г NaCI и 475 г воды.
Задача 2. Какой объем хлороводорода (н. у.) и воды потребуется, чтобы приготовить 1 л раствора (р =1,05 г/см 3 ), в котором массовая доля хлороводорода равна 0,1 (или 10%)?
Решение. 1) Вычисляем массу 1 л раствора, в котором массовая доля хлороводорода равна 0,1 (или 10%).
Вычисление можно провести по известной вам формуле из курса физики:
р = m / V ; m = р · V ,
m раствора = 1000 ·1,05=1050; m раствора = 1050 г
2) Находим массу хлороводорода, содержащегося в 1050 г раствора соляной кислоты указанной концентрации:
1 мае. д. соответствует 1050 г
1:0,1=1050:х 1 ; х 1 =
или m (НС1) = 1050 · 0,1 = 105 г; m = 105 г
3) Вычисляем, какой объем (н. у.) занимают 105 г хлороводорода:
М (НС1) = 36,5 г/моль
36,5 г НC1 занимают объем 22,4 л
105 г НСl » » x 2
36,5 : 105 = 22,4 : x 2 ; x 2 =
4) Находим, сколько потребуется воды для приготовления раствора:
m (Н 2 0)=1050 г — 105 г = 945 г
Ответ. Потребуется 64,44 л НС1 и 945 мл воды.
2. Вычисления, связанные с разбавлением растворов
Задача 1. Какой объем раствора (р =1,80 г/см 3 ), в котором массовая доля H 2 S0 4 равна 0,88, потребуется, чтобы приготовить 1 л раствора, в котором массовая доля H 2 S0 4 будет равна 0,1 (р =1,069 г/см 3 )?
Решение. 1) Вычисляем массу 1 л раствора, в котором массовая доля H 2 S0 4 равна 0,1 (или 10%):
m раствора = 1000 · 1,069 = 1069; m раствора = 1069 г
2) Определяем массу чистой серной кислоты, которая потребуется:
100 г приготовляемого раствора содержат 10 г H 2 S0 4
100 : 1069 = 10 : х 1 ; х 1 = 
или m (H 2 S0 4 ) = 1069 · 0,1 = 106,9, m (H 2 S0 4 ) = 106,9 г
3) Находим, сколько потребуется раствора, д котором массовая доля серной кислоты равна 0,88 (или 88%):
100 г раствора содержат 88 г H 2 S0 4
х 2 » » 106,9 г H 2 S0 4
100 : х 2 = 88 : 106,9; х 2 =
4) Вычисляем, какой объем занимают 121,5 г раствора, в котором массовая доля H 2 S0 4 равна 0,88 (или 88%):
V раствора =121,5/1,80 = 67,5; V раствора =67,5 мл
Ответ. Потребуется 67,5 мл раствора, в котором массовая доля серной кислоты составляет 0,88.
Задача 2. Какой объем воды потребуется для разбавления 200 мл раствора (р =1,4 г/см 3 ), в котором массовая доля НNОз составляет 0,68 (или 68%), чтобы получить раствор, в котором массовая доля НNОз равна 0,1 (или 10%)?
Решение. 1) Находим массу 200 мл разбавляемого раствора азотной кислоты:
m раствора 200 · 1,4 = 280; m раствора =280 г
2) Вычисляем массу чистой азотной кислоты, содержащейся в 280 г разбавляемого раствора:
100 г раствора содержат 68 г НNОз
100 : 280 = 68 : x 1 ,; x 1 = 
или m (НМОз) =280 · 0,68 = 190,4 г
3) Вычисляем, какую массу 10%-ного раствора можно приготовить из 190,4 г чистой азотной кислоты:
100 г раствора содержат 10 г НМОз
x 2 » » 190,4 г НМОз
100:x 2 =10:190,4; x 2 =
или m(НМОз)= 190,4:0,1 =1904 г
4) Находим объем воды, который необходимо прилить для приготовления раствора заданной концентрации:
Патриархом в период правления Василия Шуйского был избран а)митрополит Филаретб)митрополит Макарийв)митрополит Филиппг)митрополит Гермоген
Назовите причины возникновения мегаполисов в США.
Некоторое число разделили в отношении 8:9, при этом разность большей и меньшей частей получилась равной 6. какое число разделили?А)72 Б)54 В)102 Г)98