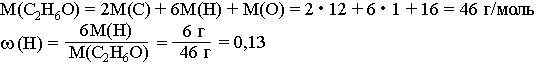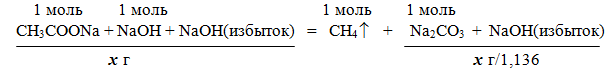По
формуле химического соединения можно
вычислить процентное содержание каждого
из элементов, образующих данное химическое
соединение.
Процентное
содержание элемента в веществе — это
отношение количества элемента,
содержащегося в молекуле вещества, к
массе всей молекулы, выраженное в
процентах.
Пример.
Вычислить процентное содержание меди
в оксиде меди (II)
CuO.
Решение:
Молекулярная
масса оксида меди (II)
CuO
равна 64+16=80. В 1 моле CuO,
масса которого 80 г , на долю Cu
приходиться 64 г , что составляет
от массы 1 моль. Чтобы выразить эту дробь
в процентах, надо умножить её на 100:
×100=80
Следовательно,
в оксиде меди (II)
CuO
содержится 80% меди.
Справочный
материал:
Массовая
доля — отношение массы растворённого
вещества к массе раствора. Массовая
доля измеряется в долях единицы или
процентах( долю умножают на 100%)
(*100%)
где:
m1
— масса растворённого вещества, г ;
m
— общая масса раствора.
Задания:
1)Вычислить
в перечисленных здесь веществах
процентное содержание элемента: а)
водорода в гашеной извести Ca(OH)2,
соляной кислоте HCl
и метане CH4;
б) кислорода в окиси меди CuO,
окиси ртути HgO,
окиси железа Fe2O3;
в) азота в азотной кислоте HNO3,
аммиаке NH3,
нашатыре NH4Cl;
г) серы в сернистом железе FeS,
сернистом газе SO2,
серной кислоте H2SO4.
(Ответ: а) 2,7%; 2,7%; 25% ; б)20,1%, 6,25%, 30,0%, в)22,22%,
82,4%, 26,2% , г)36,4%, 50,0%, 32,7%)
2)Технический
хлористый алюминий содержит 98% AlCl3;
остальное сосавляют примеси. Вычислить
процентное содержание хлора в этом
химическом продукте. (Ответ: 78,2%)
3)Неочищенный
сульфат магния содержит 96% MgSO4
( остальное — примеси, не содержащие
магния). Сколько магния содержит этот
химический продукт? (Ответ: 19,2%)
1.4 Вычисление процентного состава химического соединения по химической формуле соединения.
Результаты
химического анализа веществ принято
выражать процентным содержанием
элементов, образующих исследуемое
химическое соединение. Вычислить
процентный состав сложного вещества —
это определить процентное содержание
каждого элемента, входящего а его состав.
Пример.
Вычислить процентный состав едкого
натра NaOH.
Решение:
Молекулярная
масса NaOH
равна 23+16+1=40.
1
моль=40 г.
Вычисляем
процентное содержание натрия:
×100=57,5
(%).
Вычисляем
процентное содержание кислорода:
×100=40
(%).
Вычисляем
процентное содержание водорода:
×100=2,5
(%).
Ответ:
в едком натре содержится натрия — 57,5%,
кислорода — 40% и водорода — 2,5%.
Задания:
1)Сколько
азота содержится в: а) натриевой селитре
NaNO3;
б) сульфате аммония (NH4)2SO4;
в) цианамиде кальция CaCN2?
(Ответ: а)16,47%; б)21,21%; в)35% )
2)Сколько
фосфора находится в: а) 1 кг костяной
муки, содержащей 88% Ca3(PO4)2;
б) 2 т фосфоритной муки, содержащей 82%
Ca3(PO4)2;
в) 0,5 т двойного суперфосфата, содержащего
92% Ca(H2PO4)2?
(Ответ: а) 0,176 кг; б) 164кг; в) 50,34 кг.)
3)Вычислить
процентный состав следующих веществ:
а) едкого кали KOH;
б) угольной кислоты H2CO3;
в) сернистой кислоты H2SO3;
г) хлористого хрома CrCl2;
д) сернокислого кальция CaSO4;
е) азотнокислого магния Mg(NO3)2;
ж) сернокислого железа Fe2(SO4)3;
з) Фосфорнокислого кальция Ca3(PO4)2;
и) соды Na2CO3;
к) известняка CaCO3.
(Ответ: а)70,2%, 28,1%, 1,75%, б)3,22%, 19,35, 77,4%; в)
5,2%; 39%; 55,8%; г) 42,6%, 57,3%; д) 29,4%, к) 40%; 12%; 48%);
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1. Массовую долю элемента в веществе рассчитывают по формуле:
.
2. Если имеется (1) моль вещества, то его масса равна
.
3. (1) моль вещества содержит (x) моль элемента. Поэтому масса элемента, содержащегося в веществе, равна
m(эл.)=n(эл.)⋅M(эл.)=xмоль⋅Mг/моль
.
4. Подставив массу элемента и массу вещества в формулу ((1)), получим формулу ((2)), которой и воспользуемся для вычисления:
w(эл.)=xмоль(эл.)⋅Mг/моль(эл.)1моль⋅M г/моль(вещества)⋅100
.
Пример:
таким образом, например, расчёт массовой доли углерода в оксиде углерода((IV)) должен выглядеть так:
1. по формуле вещества видно, что (1) моль
CO2
содержит (1) моль химического элемента (C).
2. Если имеется (1) моль
CO2
, то его масса равна
.
3. А (1) моль элемента (C) имеет массу
.
4. Таким образом, массовая доля элемента (C) в
CO2
равна
27,3
%
.
Определение массовой доли (ω) вещества
Многие характеристики вещества являются суммой нескольких составляющих, каждая из которых представляет определенную долю от целого.
Математически долю каждой составляющей определяют как частное от деления части на целое (меньшей величины на большую).
Важными характеристиками состава многокомпонентных систем (молекул, смесей веществ, растворов, сополимеровСополимеры – высокомолекулярные соединения, макромолекулы которых содержат два (и более) типа структурных звеньев.) являются массовые, мольные и объёмные доли отдельных компонентов.
Массовая доля компонента (вещества, химического элемента) – содержание компонента в многокомпонентной системе (смеси веществ, растворе, молекуле), определяемое как отношение массы этого компонента к суммарной массе всех компонентов системы.
Таким образом, для нахождения массовой доли вещества в смеси (и решения обратной задачи) служит соотношение:
ω(вещества) = m(вещества) / m(смеси).
Массовую долю элемента в веществе можно определить, используя молярные массы:
ω(элемента) = M(элемента) / M(вещества).
Например, массовая доля водорода ω(H) в этиловом спирте С2Н5ОН вычисляется следующим образом:
Часто долю выражают в процентах. Для этого полученный результат умножают на 100. То есть в данном случае ω(H)=13%. Это означает, что в каждом г (кг, т) С2Н6O содержится 0,13 г (кг, т) водорода или каждые 100 г (кг, т) С2Н6O содержат 13 г (кг, т) водорода.
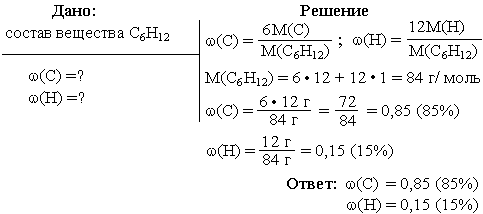
Задача 1. Вычислить массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12.
Задача 2. Из нефти получают бензин (массовая доля его в нефти составляет 25%) и мазут (55%). При дальнейшей переработке мазута получают еще некоторое количество бензина (60% от массы мазута). Рассчитайте массу бензина, который будет получен из нефти массой 200 кг.
Задача 3. Смесь ацетата натрия с избытком гидроксида натрия прокалили. После прокаливания масса сухого остатка оказалась в 1,136 раза меньше массы исходной смеси. Вычислите массовые доли компонентов исходной смеси.
Решение
При сплавлении ацетата натрия CH3COONa с гидроксидом натрия образуется метан CH4 (реакция Дюма).
Уравнение реакции: