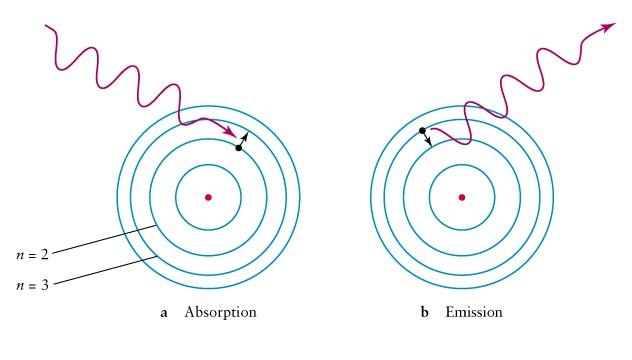
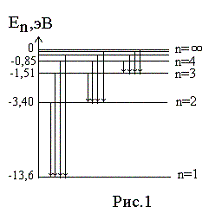
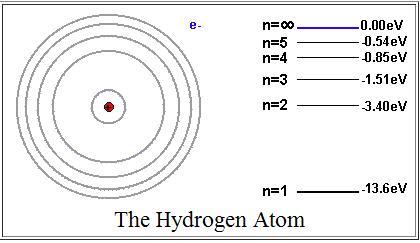
Теория
Бора водородоподобных атомов.
Нильс
Бор создал теорию строения атома,
способную объяснить опыты Резерфорда
и спектр излучения паров водорода.
Спектр
характеризует распределение интенсивности
излучения по шкале частот (или по шкале
длин волн).

Постулаты
Бора.
1-й
постулат:
электрон
в атоме может двигаться только по
определенным стационарным орбитам,
находясь на которых, он не излучает и
не поглощает энергию. Момент импульса
электрона на этих орбитах кратен
постоянной Планка:
, (1)
me
– масса электрона,
— скорость электрона на орбите с номером
n,
rn
– радиус орбиты с номером n,
n
=1,2,3,….
Дж·с
– постоянная Планка.
2-й
постулат:
при
переходе электрона с одной стационарной
орбиты на другую излучается или
поглощается фотон, энергия которого
.
(2)
E
n1
и
E
n2
— энергия электрона в состоянии 1 и 2
(т.е. на орбитах 1 и 2),
— частота электромагнитных волн,
—
постоянная Планка.
Радиус
орбиты электрона в атоме водорода.
1-й
постулат Бора,
.
Выразим
скорость электрона:
.
(3)
Рассмотрим
круговые электронные орбиты. На электрон
с зарядом —e
со стороны ядра с зарядом +e
действует сила Кулона F,
сообщая электрону нормальное ускорение,
.
По
2-му закону Ньютона,
.
(4)
Сократим
и подставим скорость из (3):
.
Отсюда

Радиус
первой орбиты электрона (n
= 1), называется радиусом
Бора
,
=
0.53·10-10
м.
Радиус
орбиты электрона в атоме водорода
,
n
=1,2,3,…. – номер орбиты.
Энергия
электрона в атоме водорода.
Энергия
электрона представляет собой сумму
кинетической энергии
и
потенциальной
.
и
.
Потенциальная
энергия – это энергия электрона с
зарядом
в электрическом поле ядра. Из уравнения
(4) видно, что
.
Тогда
на n
–ой
орбите энергия электрона равна
=
=.
Т.е.
кинетическая энергия электрона равна
полной энергии, взятой со знаком «-».
Также
полную энергию можно записать через
потенциальную:
=
, или
.
Подставим
.
Тогда
=
.
Энергия
на первой орбите (на первом энергетическом
уровне) равна
=
= -13,6 эВ.
Величину
=
13,6 эВ = 2,18∙10-18
Дж
называют
энергией ионизации
(эта энергия необходима, чтобы перевести
электрон, находящийся на первом уровне,
в свободное состояние, т.е. чтобы
ионизовать атом). Окончательно, энергия
электрона на n
–ом
энергетическом уровне (на n
–ой
орбите) записывается как
=
.
Спектр излучения водорода.
Энергия
излучаемого или поглощаемого кванта:
.
Частота
,
длина волны,
— скорость света в вакууме.
=
+
=
,
=
.
=
—
формула Бальмера,
определяет
длины волн в спектре атома водорода.
=
1,1∙107
м-1
— постоянная Ридберга.
и
— номера энергетических состояний
(номера орбит) электрона.
Переходы
электрона с возбужденных энергетических
состояний на основной энергетический
уровень (
= 1) сопровождаются излучением в УФ
области
спектра (серия линий Лаймана),
переходы
на уровень с
= 2 приводят к линиям в
видимой области
(серия Бальмера),
переходы
на уровень с
= 3, 4, 5, … приводят излучению в ИК
области.
Теория
Бора не смогла объяснить строение
сложных атомов. Для объяснения поведения
микрочастиц была развита квантовая
механика.
Она
основана на том, что любая микрочастица,
наряду с корпускулярными, обладает
также волновыми свойствами (гипотеза
де Бройля).
Для
фотона, импульс
.
По
аналогии с фотоном, любую микрочастицу
можно рассматривать как волну с длиной
волны
,
—
длина волны де Бройля.
Гипотеза
де Бройля подтверждена экспериментально
наблюдением дифракции электронов, а
затем и протонов.
Принцип
неопределенностей.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
На прошлом уроке мы с вами рассматривали опыты Эрнеста
Резерфорда по рассеянию альфа-частиц, которые позволили учёному создать ядерную
(или планетарную) модель атома.
Однако при всей своей убедительности планетарная модель атома
оказалась внутренне противоречивой. По законам электродинамики движущийся
ускоренно заряд излучает электромагнитные волны. Следовательно, атом должен
непрерывно излучать электромагнитные волны. Излучение же связано с уменьшением
энергии электрона в поле ядра. Следствием этого должно явиться уменьшение
скорости движения и частоты вращения электронов вокруг ядра. Если частота
непрерывно изменяется, то спектр излучения атома должен быть сплошным.
Уменьшение скорости электрона должно привести к тому, что электрон будет
двигаться по спирали к ядру и в течение короткого времени упадёт на него, то
есть в этой модели атом должен быть неустойчивым.
Это находится в полном противоречии с экспериментальными
фактами, которые свидетельствуют о том, что:
·
атом является достаточно устойчивой системой;
·
атом излучает электромагнитные волны лишь при определенных
условиях, а не непрерывно;
·
а спектры излучения атомов являются линейчатыми.
Эти противоречия возникли потому, что к электронам в атомах
применяли законы классической физики, а, как мы уже с вами знаем, в микромире
действуют свои законы, отличные от законов макромира. Первым признал
невозможность применения законов классической физики к атомам датский учёный
Нильс Бор. Он ввёл элементы квантовой теории в модель атома Резерфорда и в 1913
году создал неклассическую теорию атома. В её основе лежала идея связать в
единое целое три результата, полученные в физике к тому времени.
Для решения этой задачи Бор, сохраняя классический подход к
описанию поведения электрона в атоме, выдвинул два предположения, которые мы
называем постулатами Бора. Сразу же отметим, что физический смысл этих
постулатов не только не мог быть объяснён в классической физике, но, более
того, находился в глубоком противоречии с классическим описанием движения
электрона в атоме.
В современном виде постулаты Бора формулируются следующим
образом.
Первый постулат Бора (постулат стационарных состояний):
атом может находиться в особых стационарных (квантовых)
состояниях, каждому из которых соответствует определенная энергия. Находясь в
стационарном состоянии, атом не излучает и не поглощает энергию.
Стационарные состояния можно пронумеровать, присвоив им
порядковые номера, причём каждому состоянию соответствует определенное
дискретное значение энергии. Согласно модели Бора стационарным состояниям атома
соответствуют определенные (разрешённые) орбиты, по которым электроны движутся
вокруг ядра. При движении по этим орбитам электроны не излучают
электромагнитные волны.
Первый постулат противоречит нашим представлениям о движении
в классической механике, так как мы знаем, что скорость тел изменяется
постепенно и может принимать любые значения. Бор вводит понятие квантования
скоростей и орбит электрона: скорости и радиусы орбит могут изменяться не
непрерывно, а имеют только определённый дискретный набор значений.
Второй постулат Бора ещё называют правилом частот:
атом может переходить из одного стационарного состояния в
другое. При этом переходе может испускаться или поглощаться квант
электромагнитного излучения, частота которого определяется разностью энергий
атома в данных состояниях:
Из формулы следует, что если электрон переходит с более
низкой орбиты на более высокую, то он поглощает квант энергии. Если же
наоборот, переход осуществляется с более высокой на более низкую орбиту, то
электрон излучает квант энергии.
Состояние атома, которому соответствует наименьшая энергия,
называется основным. А состояния, которым соответствуют большие значения
энергии, — возбуждёнными. В основном энергетическом состоянии атом может
находиться неограниченно долго, а в остальных стационарных состояниях порядка 10–6
с. Это так называемое время жизни атома в возбуждённом состоянии.
Как следует из второго постулата Бора, частота излучения
атома не связана с частотой вращения электрона по орбите, она определяется
разностью значений энергии атома в начальном и конечном состояниях. Переход
атома из одного стационарного состояния в другое сопровождается
электромагнитным излучением определённой длины волны:
Для объяснения же эмпирических закономерностей в спектре
атома водорода эти два постулата были дополнены правилом квантования орбит,
которое иногда называют третьим постулатом Бора:
в стационарном состоянии атома электрон, движущийся по
круговой орбите, должен иметь квантованные (дискретные) значения момента
импульса, которые удовлетворяют условию:
В записанной формуле m — это масса электрона, υ — его скорость на n-й орбите, rn — радиус стационарной орбиты, а n
= 1, 2, 3, … — это номер орбиты электрона.
Таким образом, постулаты Бора основывались на трёх
экспериментальных предпосылках — результатах исследования атомных спектров,
квантовой теории излучения, развитой Планком и Эйнштейном, и ядерной
(планетарной) модели атома Резерфорда.
Исходя из этих постулатов и используя планетарную модель
строения атома, Нильс Бор разработал количественную теорию атома водорода. Он
рассчитал радиусы стационарных орбит электрона в атоме водорода и вычислил
соответствующие им значения энергии.
Проделаем это и мы. Итак, согласно классическим
представлениям, электрон движется вокруг ядра под действием кулоновской силы,
которая сообщает ему центростремительное ускорение:
Согласно второму закону Ньютона, сила притяжения со стороны
ядра должна определяться произведением массы электрона и его
центростремительного ускорения:
С другой стороны, как упоминалось выше, сила притяжения к
ядру есть не что иное, как сила Кулона, определяемая, в данном случае,
отношением квадрата заряда электрона к квадрату радиуса орбиты:
Перепишем второй закон Ньютона с учётом наших рассуждений и
представим полученное выражение так, как это показано на экране:
Теперь запишем условие квантования орбит и выразим из него
скорость электрона:
Далее найдём выражение, для определения радиусов разрешённых стационарных
орбит электрона в атоме водорода:
Как видно из формулы, радиусы стационарных устойчивых
орбит возрастают пропорционально квадратам номеров орбит:
Для примера давайте с вами определим радиус первой боровской
орбиты электрона.
Этот радиус, ближайший к атомному ядру, определяет размер
атома водорода в основном состоянии.
Так как радиус орбиты может принимать только дискретные
(квантованные) значения, то и энергия атома в различных стационарных состояниях
может также принимать только дискретные значения.
Итак, очевидно, что энергия электрона в атоме водорода равна
сумме его кинетической энергии при движении по круговой орбите и потенциальной
энергии в электростатическом поле ядра:
(поскольку взаимодействуют частицы, имеющие заряды
противоположных знаков, то между ними действует сила кулоновского притяжения и
потенциальная энергия их взаимодействия отрицательна).
Подставим в эту формулу значения скорости электрона и радиуса
орбиты:
Проведя все необходимые математические вычисления и
преобразования, получим формулу для определения энергии электрона, находящегося
на n-й орбите:
Из этой формулы видно, что энергия атома водорода квантована
и определяется только номером орбиты.
Давайте рассчитаем значение энергии электрона в атоме
водорода на первой боровской орбите.
Для наглядного представления возможных энергетических
состояний атомов используются энергетические диаграммы, на которых каждое
стационарное состояние атома отмечается горизонтальной линией, называемой
энергетическим уровнем.
Ниже всех на диаграмме располагается энергетический уровень,
соответствующий основному состоянию (состояния с минимальной энергией).
Энергетические уровни возбуждённых состояний располагаются над основным уровнем
на расстояниях, пропорциональных разности энергий возбуждённого и основного
состояний. Переходы атома из одного состояния в другое изображаются
вертикальными линиями между соответствующими уровнями на диаграмме. Направление
перехода обозначается стрелкой.
Из диаграммы видно, что чем электрон дальше от ядра, тем на
меньшую величину отличаются соседние уровни энергии, то есть густота
энергетических уровней растёт. Квантовые скачки при этом уменьшаются,
вследствие чего переходы между стационарными состояниями атома всё больше и
больше становятся «похожими» на непрерывное изменение энергии, то есть энергия
становится почти непрерывной величиной, как и в классической теории.
Если попытаться выразить частоту излучения атома водорода при
его переходе с одного энергетического уровня на другой, то окажется, что полученное
выражение полностью совпадает с эмпирической формулой Бальмера — Ридберга:
А вычисленная постоянная Ридберга по этой формуле показывает
хорошее совпадение с найденной из эксперимента.
В 1922 году Нильсу Бору была присуждена Нобелевская премия
«за заслуги в исследовании строения атомов и излучения», так как его исследования
фактически положили начало новому этапу развития спектроскопии, которая из
эмпирической науки превратилась в эффективный метод изучения атомной структуры.
Спустя пол века по этому поводу Бор скажет: «Я увидел путь рождения спектров!»
Итак, что же дала нам модель атома водорода по Бору. Во-первых,
она позволила вычислить энергию ионизации атома водорода, хорошо согласующуюся
с экспериментом. А во-вторых, дала мощный толчок к объяснению закономерностей
периодической системы химических элементов Менделеева. Согласно модели атома
Бора электроны движутся по определенным орбитам, образующим различные группы —
электронные оболочки. Структура электронных оболочек определяет химические
свойства элементов, которые периодически повторяются по мере заполнения
оболочек электронами. Это позволило «предсказывать» свойства ранее неизвестных
элементов. Так, например, был открыт элемент га́фний, по своим свойствам
аналогичный цирконию. Модель атома Бора также объяснила основные закономерности
спектра атома водорода, хотя частично сохранила классический характер,
поскольку в ней предполагалось, что электроны движутся по орбитам вокруг ядра.
Оставалось, однако, неясным, от чего зависит интенсивность
излучения тех или иных частот. Без ответа остался вопрос, почему совершаются те
или иные переходы. Но самым серьёзным недостатком модели атома Бора была
невозможность построить теорию более сложных атомов (даже атома гелия — одного
из простейших атомов, непосредственно следующего за атомом водорода). Но модель
атома Бора явилась переходным этапом на пути к созданию современной теории
атомных и ядерных явлений — квантовой механики.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,985 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.