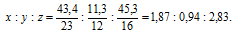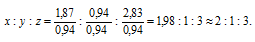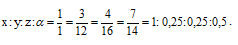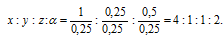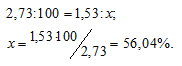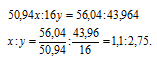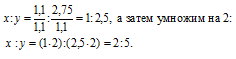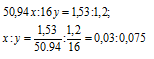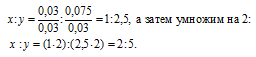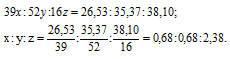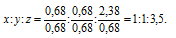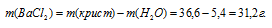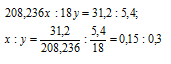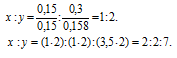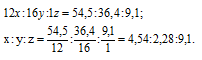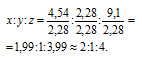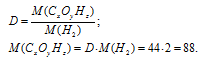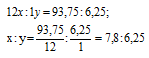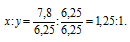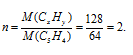Вывод химических формул различных веществ
Задача 99.
Найти простейшую формулу вещества, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Решение:
Обозначим числа атомов натрия, углерода и кислорода в простейшей формуле вещества соответственно через x, y и z. Атомные массы этих элементов равны соответственно 23, 12 и 16. Поэтому массы натрия, углерода и кислорода в составе вещества относятся как 23х : 12у : 16z. По условию задачи это отношение имеет вид: 43,4 : 11,3 : 45,3. Следовательно: 23х : 12у : 16z = 43,4 : 11,3 : 45,3.
Откуда
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
Таким образом, простейшая формула вещества NaxCyOz будет иметь вид: Na2CO3.
Ответ: Na2CO3.
Задача 100.
Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1 : З : 4 : 7.
Решение:
Обозначим числа атомов водорода, углерода, кислорода и азота в простейшей формуле вещества соответственно через x, y, z. Атомные массы этих элементов равны соответственно 1, 12, 16 14. Поэтому массы водорода, углерода, кислорода и азота в составе вещества относятся как 1х : 12у : 16z :14 . По условию задачи это отношение имеет вид: 1 : 3 : 4 : 7. Следовательно: 1х : 12у : 16z :14 = 1 : 3 : 4 : 7.
Тогда
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
Таким образом, простейшая формула вещества HxCyOzNa будет иметь вид: H4CON4 или COH4N4.
Ответ: COH4N4.
Задачи 101.
Найти простейшую формулу оксида ванадия, зная, что 2,73г оксида содержат 1,53г металла.
Решение:
Вариант I.
Находим процентное содержание ванадия в его оксиде из пропорции:
Тогда процентное содержание кислорода составляет; 100 – 56,04 = 43,96%.
Обозначим числа атомов ванадия и кислорода в простейшей формуле оксида соответственно через x и y. Атомные массы этих элементов равны соответственно 50,94 и 16. По-этому массы ванадия и кислорода в составе оксида относятся как 50,94x : 16y. По условию задачи это отношение равно 56,94 : 43,96. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
Таким образом, простейшая формула оксида ванадия имеет вид; V2O5.
Ответ: V2O5.
Вариант II.
Решение:
Находим массу кислорода в оксиде ванадия: m(O) 2,73 — 1,53 = 1,2г.
Обозначим числа атомов ванадия и кислорода в простейшей формуле оксида соответственно через x и y. Атомные массы этих элементов равны соответственно 50,94 и 16. Поэтому массы ванадия и кислорода в составе оксида относятся как 50,94x : 16y. По условию задачи это отношение в 2,73г оксида ванадия равно 1,53 : 1,2. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
Таким образом, простейшая формула оксида ванадия имеет вид; V2O5.
Ответ :V2O5.
Задача 102.
Вещество содержит (по массе) 26,53% калия, 35,37% хрома и 38,10% кислорода. Найти его простейшую формулу.
Решение:
Обозначим числа атомов калия, хрома и кислорода в простейшей формуле вещества через x, y и z. Атомные массы этих элементов равны соответственно 39, 52 и 16. Поэтому массы калия, хрома и кислорода в составе вещества относятся как 39x : 52y : 16z. По условию задачи это отношение равно 26,53 : 35,37 : 38,10. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим три его члена на наименьший из них:
а затем умножим три члена последнего отношения на 2, получим:
x : y = (1 . 2) : (1 . 2) : (3,5 . 2) = 2 : 2 : 7.
Таким образом, простейшая формула вещества имеет вид: K2Cr2O7.
Ответ: K2Cr2O7.
Задача 103.
Найти формулу кристаллогидрата хлорида бария, зная, что 36,6г соли при прокаливании теряют в массе 5,4г.
Решение:
Молекулярные массы хлорида бария и воды соответственно равны 208, 236 и 18г/моль.
Находим массу хлорида бария в кристалле:
Обозначим числа молекул хлорида бария и воды в кристаллогидрате хлорида бария соответственно через z и y, получим формулу xBaCl2 . yH2O. Массы молекул хлорида бария и воды в составе кристаллогидрата относятся как 208,236x : 18y. По условию задачи это отношение равно 31,2 : 5,4. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим два его члена на наименьший из них:
Таким образом, простейшая формула кристаллогидрата (xBaCl2 . yH2O) будет иметь вид: BaCl2 . 2H2O.
Ответ: BaCl2 . 2H2O.
Задача 104.
Найти молекулярную формулу масляной кислоты, содержащей (по массе) 54,5% углерода, 36,4% кислорода и 9,1% водорода, зная, что плотность ее паров по водороду равна 44.
Решение:
Обозначим числа атомов углерода, кислорода и водорода в простейшей формуле масляной кислоты через x, y и z. Атомные массы этих элементов равны соответственно 12, 16 и 1. Поэтому массы калия, кислорода и водорода в составе вещества относятся как 12x : 16y : 1z. По условию задачи это отношение равно 54,5 : 36,4 : 9,1. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим три его члена на наименьший из них:
Обозначим формулу масляной кислоты как CxOyHz, тогда простейшая формула будет иметь вид: C2OH4. Этой формуле отвечает молекулярная масса 44. Истинную молекулярную массу кислоты находим исходя из её плотности по водороду:
Таким образом, истинная молекулярная масса кислоты отличается от вычисленной молекулярной массы по её простейшей формуле. Вычислим множитель (n), на который следует умножить значения всех трёх членов коэффициентов в простейшей формуле кислоты, разделив значение MCxOyHz на значение MC2OH4:
Тогда
x : y : z = (2 . 2) : (2 . 1) : (2 . 4) = 4 : 2 : 8. .
Следовательно, истинная молекулярная формула масляной кислоты будет иметь вид: C4O2H8.
Ответ: C4O2H8.
Задача 105.
Найти молекулярную формулу вещества, содержащего (по массе) 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
Решение:
Молекулярная масса воздуха равна 29 г/моль.
Обозначим числа атомов углерода и водорода в простейшей формуле вещества через x, y. Атомные массы этих элементов равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе вещества относятся как 12x : 1y. По условию задачи это отношение равно 93,75 : 6,25. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
а затем умножим оба члена последнего отношения на 4, получим:
x : y = (1,25 . 4) : (1 . 4) = 5 : 4.
Простейшая формула вещества имеет вид: C5H4. Этой формуле отвечает молекулярная масса, равная 64 [M(С5H4) = (5 . 12) . (4 . 1) = 64)]. Истинную молекулярную массу вещества находим исходя из его плотности по воздуху:
M(CxHy) = D . M(Возд.) = 4,41 . 29 = 128
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
Теперь найденные значения x и y умножаем на 2, получаем: nCxHy = C10H8.
Истинная формула вещества будет иметь вид: C10H8.
Ответ: : C10H8.
Решение задач на вывод формул в соединении
Ключевые слова конспекта: решение задач на вывод формул в соединении, простейшая формула соединения, эмпирическая формула, истинная формула, молекулярная формула, вывод формулы, установление формулы, рассчитать количество вещества элементов.
При определении формул химических соединений необходимо различать простейшую (или эмпирическую) формулу соединения и его истинную (или молекулярную) формулу.
Простейшая формула (эмпирическая формула) показывает соотношение числа атомов каждого элемента в молекуле (формульной единице) вещества. Например, простейшая формула оксида фосфора (V) Р2O5. Она показывает, что на каждые 2 атома фосфора в молекуле данного оксида приходится 5 атомов кислорода.
Истинная формула (молекулярная формула) показывает точный качественный и количественный состав одной молекулы данного соединения. Так, истинная формула оксида фосфора (V) Р4О10. Она показывает, что одна молекула данного оксида образована четырьмя атомами фосфора и десятью атомами кислорода.
При выводе простейшей формулы соединения необходимо помнить, что индексы в ней пропорциональны количествам вещества элементов, образующих данное соединение и содержащихся в определенной порции данного вещества. Например, 1 моль воды содержит 2 моль атомов водорода и 1 моль атомов кислорода (т. е. v(H) : v(O) = 2:1, а формула воды — Н2О). Таким образом, чтобы определить простейшую формулу вещества, необходимо рассчитать количество вещества элементов, образующих данное соединение.
Чтобы установить истинную формулу, необходимо знать относительную молекулярную (или молярную) массу данного соединения. Молекулярная масса в целое число раз больше массы, которая отвечает простейшей формуле. На это число нужно умножить индексы в простейшей формуле, чтобы получить молекулярную формулу. Например, простейшая формула глюкозы СН2О, относительная молекулярная масса, отвечающая этой формуле, равна 30. Истинная относительная молекулярная масса глюкозы равна 180, т. е. в 6 раз больше. Таким образом, истинная формула глюкозы (СН2О)6, или С6Н12О6.
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Массовые доли железа и серы в соединении равны соответственно 46,67 и 53,33%. Определите формулу этого соединения.
Ответ. FeS2.
Задача № 2.
Массовая доля азота в оксиде азота равна 36,84%. Выведите простейшую формулу данного оксида.
Посмотреть РЕШЕНИЕ
Ответ. N2О3.
Задача № 3.
Массовая доля серы в ее оксиде в 1,5 раза меньше массовой доли кислорода. Определите простейшую формулу оксида.
Посмотреть РЕШЕНИЕ
Ответ. SО3.
Задача № 4.
Элемент образует оксид состава ЭO2. Плотность оксида по воздуху равна 1,586. Определите неизвестный элемент.
Посмотреть РЕШЕНИЕ
Ответ. Э — азот.
Задача № 5.
Азот образует оксид, плотность паров которого по гелию равна 19, а массовая доля кислорода в нем — 63,16%. Определите молекулярную формулу неизвестного оксида.
Посмотреть РЕШЕНИЕ
Ответ. N2О3.
Задача № 6.
Плотность по водороду смеси оксида серы (IV) и одного из оксидов азота равна 20,1, массовая доля оксида азота в смеси 52,24%, а массовая доля азота в оксиде — 46,67%. Определите молекулярную формулу оксида азота.
Посмотреть РЕШЕНИЕ
Ответ. NО.
Задача № 7.
Из 185,6 г оксида железа при восстановлении было получено 134,4 г железа. Какова формула данного оксида?
Посмотреть РЕШЕНИЕ
Ответ. Fe3О4.
Задача № 8.
Массы углерода и водорода, входящие в состав газа, занимающего объем 16,8 л (н. у.), равны соответственно 18 и 4,5 г. Определите истинную формулу газа.
Посмотреть РЕШЕНИЕ
Ответ. С2Н6.
Задача № 9.
Отношение молярных масс хлорида и оксида металла (М), в которых металл проявляет степень окисления +2, равно 1,679. Определите неизвестный металл.
Посмотреть РЕШЕНИЕ
Ответ. Цинк.
Задача № 10.
Элементы X и Y образуют с хлором соединения состава ХYСl2 и XY2Cl2. Массовые доли хлора в этих соединениях равны соответственно 59,66 и 52,59%. Определите формулы неизвестных соединений.
Посмотреть РЕШЕНИЕ
Ответ. SOCl2 и SO2Cl2.
Решение задач на вывод формул в соединении. Выберите дальнейшие действия:
- Перейти к: Решение задач на расчет исходных веществ и продуктов реакции
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Как выводить простейшие формулы веществ
Допустим, массовые доли железа и кислорода в оксиде железа равны соответственно 72,41% и 27,59%. Определим простейшую формулу этого оксида.
|
Дано: (Fe) = 72,41% (O) = 27,59% M (Fe) = 56 M(O) = 16 . FexOy — ? |
1. Переведем проценты в граммы. Предположим, у нас 100 граммов оксида железа. Тогда в нем будет 72,41 грамма железа и 27,59 грамма кислорода. 2.Вычисляем количество вещества атомов железа и кислорода: m(Fe) 72,41 m(O) 27,59 3.Находим соотношение между числами молей атомов железа и кислорода: ν(Fe) : ν(O) = 1,29 : 1,72 = 0,75 4.Находим целочисленное соотношение, для этого число 0,75 представляем в 75 1,29 75 3 Из этого следует, что на 3 атома железа приходится 4 атома кислорода. Следовательно, простейшая формула оксида железа выглядит так: Fe3O4. |
.
Порядок составления формул оксидов
Формулы
оксидов можно составлять по правилу креста:

Рис.1

формул первым ставят
элемент степень окисления. которого со знаком +, а
вторым элемент с отрицательной степенью окисления. Для оксидов это
всегда кислород.
Далее
необходимо:
1. расставить степени
окисления
(с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2
(минус два).
2. Для того чтобы
правильно
определить степень окисления. второго элемента необходимо познакомится
с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
|
Элемент |
Возможные степени окисления |
| N (азот) | -3, 0, +1, +2, +3, +4,+5. |
| P (фосфор) | -3, 0, +3, +5. |
| S (сера) | -2, 0, +4, +6. |
| C (углерод) | -4, 0, +2, +4. |
Степень окисления «0» —
ноль имеют:
1. Простые вещества: Н2,
Са, О2 …
2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0)
Степень окисления со знаком +
характерна для элементов которые отдают свои электроны в соединениях
другим атомам или от которых оттянуты общие электронные пары, т.е.атомы
менее электроотрицательных элементов. например металлы
всегда имеют положительную степени окисления.
Подсказка: Узнать степени окисления для металлов
можно в таблице «растворимости…«.
В ней представлены заряды ионов металлов они обычно совпадают со
степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее
электроотрицательный, чем сам кислород см. таблицу
электроотрицательности.
рис.2

окисления.
элементов в бинарных соединениях равны по модулю, то индексы в формуле
не ставятся: Сa+2О-2.
Составим формулу
оксида натрия:
По
таблице растворимости заряд иона натрия +,
соответственно степень окисления натрия имеет значение +1 (Na+1),
с.о. кислорода в оксидах всегда -2.
Натрий
имеет положительный заряд, значит, его ставим первым, а вторым
ставим кислород и по правилу креста получим: Na2+1O-2
или Na2O.
Правило
наименьшего общего кратного
это способ наиболее универсальный для составления формул. Как им
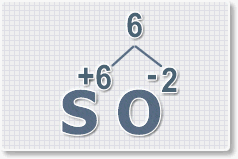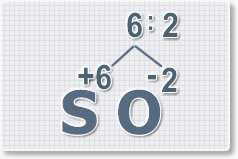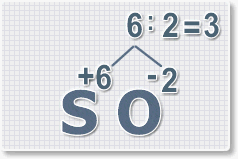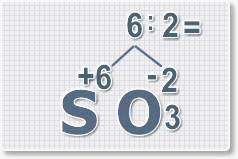
пользоваться рассмотрим на примере.
Составить формулу
оксида серы (VI).
1.
У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а
первым элементом будет сера ее с.о. указана в названии оксида VI, т. е
+6. S+6O-2.
2.
Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
3.
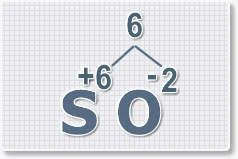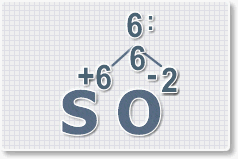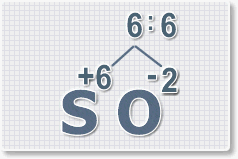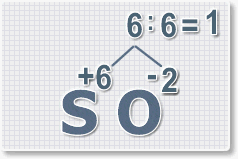
Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
6 : 6 = 1 это индекс для серы.
Индексы со значением 1 в формулах не ставятся.
Рис.3
6 : 2 = 3
это индекс для кислорода
Рис.4
В результате получим
формулу оксида серы (VI):
* * *