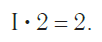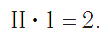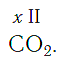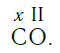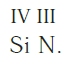Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Ковалентные связи могут образовываться по обменному и донорно-акцепторному механизмам.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Например, высшая валентность хлора равна VII, низшая валентность хлора равна I, промежуточные валентности — III, V.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
Например, валентность (число связей) атома кислорода в молекуле O2 равна II, а вот степень окисления атома кислорода равна 0.
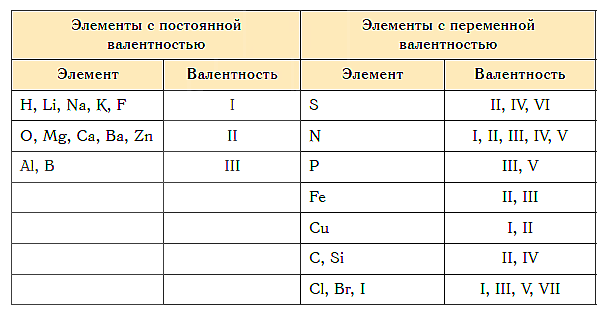
Большинство элементов проявляют переменную валентность в соединениях, но некоторые элементы проявляют постоянную валентность. Их необходимо запомнить:
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Итак, не внешнем энергетическом уровне лития 1 неспаренный электрон: 1s22s1.
+3Li 1s2 2s1
Следовательно, литий может образовывать одну связь и валентность лития I.
У бериллия на внешнем энергетическом уровне 2 электрона: 1s22s2.
+4Be 1s2 2s2
В возбужденном состоянии возможен переход электронов внешнего энергетического уровня с одного подуровня на другой: 1s22s12p1.
+4Be* 1s2 2s1
2p1
Таким образом, на внешнем энергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Например, в хлориде бериллия валентность бериллия равна II:
Электронная конфигурация атома бора в основном состоянии +5B 1s22s22p1:
+5B 1s2 2s2
2p1
В возбужденном состоянии: +5B* 1s22s12p2.
+5B 1s2 2s1
2p2
Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Например, в трихлориде бора BCl3 валентность бора равна III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
У атома углерода в возбужденном состоянии на внешнем энергетическом уровне 4 неспаренных электрона: 1s22s12p3, следовательно, максимальная валентность углерода равна IV (как правило, в органических соединениях у углерода именно такая валентность). В основном состоянии у атома углерода 2 неспаренных электрона, и валентность II. Однако посмотрим внимательно: у атома углерода в основном состоянии не внешнем энергетическом уровне есть незанятая (вакантная) электронная орбиталь. Следовательно, он может образовывать еще одну связь — по донорно-акцепторному механизму. Таким образом, в некоторых случаях углерод может образовывать три связи (например, молекула угарного газа CO, строение которой мы рассмотрим позднее).
Валентные возможности атома азота определяются также строением его внешнего энергетического уровня. В основном состоянии электронная формула азота: +7N 1s22s22p3.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
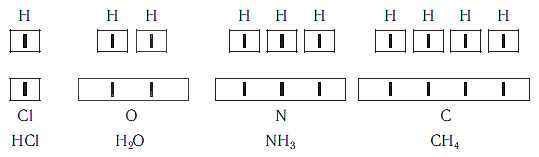
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Содержание
- Определение валентности
- Постоянная и переменная валентность
- Составление химических формул по валентности
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
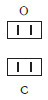
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
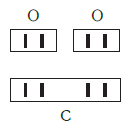
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
to continue to Google Sites
Not your computer? Use Guest mode to sign in privately. Learn more
Валентность – термин, обозначающий способность атомов химических элементов вступать в соединения с атомами других элементов. С латыни это слово можно перевести как «способность» или «сила». Понятие «валентность» в химии одно из основных. Его ученые начали использовать еще до того, как определили строение атома. Зная, как определить валентность, они смогли описать природу химических связей.
При детальном изучении предложенной химической формулы можно отметить, что количество атомов у одного и того же элемента в разных веществах может отличаться. Возникает вопрос о том, как же определить индекс хим. эл-нта и не ошибиться в написании формулы. Сделать это будет просто, если перед этим познакомиться с таким понятием как «валентность».
Основные сведения
Валентность (V) – это возможность атомов различных химических элементов образовывать связи между собой. Другими словами можно сказать, что это способность атома (мельчайшей частицы) присоединить к себе определенное количество других атомов.
[stop]Это не всегда постоянное число для одного и того же элемента. В разных соединениях последний может обладать различными значениями.[/stop]
Понятие «валентность» было введено еще до того времени, как ученые смогли наконец изучить строение атома (что произошло в 1853 году). В частности, поэтому оно пережило некоторые изменения.
Начало теории, которая объясняет наличие таких связей, изначально положил Франкленд. Но в то время его идеи о присутствии в природе «связывающей силы» не были приняты и распространены среди ученых. Важная, можно сказать, что даже решающая роль в дальнейшем развитии теории принадлежала Кекуле. Но он называл эту способность атомов создавать связи основностью. Также был уверен в том, что это неизменная способность каждой разновидности атомов. Несколько позже теория была дополнена. Свою лепту в ее формирование внес ученый Бутлеров. Постепенно на основе теории химики получили возможность изображать молекулы, что помогло им в изучении строения различных веществ, присутствующих в природе.
В дальнейшем же теория развивалась благодаря тому, что Менделеев представил широкой общественности свое научное открытие — учение о периодическом изменении свойств элементов.
Если посмотреть на валентность с точки зрения электронной теории, то можно определить, что она напрямую связана с количеством внешних электронов атома. Основываясь на этом, ученые под «валентностью» стали подразумевать то число электронных пар, которыми он может быть связан с другими атомами. Данное положение позволило в дальнейшем им определить и описать природу химической связи. Суть ее в том, что пара микрочастиц определенного вещества делит между собой тоже пару валентных электронов.
Химикам 19 века все же удавалось определять валентность еще тогда, когда они не подозревали о существовании такой мельчайшей частицы, как атом. Это было непросто. Определение проводилось с опорой на химический анализ.
С помощью химического анализа ученым удавалось определить точный состав химического соединения – сколько мельчайших частиц различных элементов присутствует в 1 молекуле. Такой способ достаточно сложен. Химикам необходимо было сначала определить точную массу каждого из эл-тов в образце вещества без примесей.
У данной методики были и свои недостатки. Например, определить V эл-нта возможно было только в простом соединении с одновалентным гидридом или двухвалентным оксидом. Это говорит о том, что такой способ определить V допустимо применять только к простым веществам. Для кислот он не подходит. Его можно применить к ним, но в таком случае получится определить только V кислотных остатков.
Валентность и электронная теория
Опираясь на электронную теорию можно сказать, что V мельчайших частиц можно определить на основании числа непарных электронов, которые принимают непосредственное участие в процессе образования электронных пар с электронами других таких же частиц.
Стоит отметить, что в образовании химических связей задействованы только те электроны, которые располагаются на внешней оболочке атома. Поэтому можно определить, что максимальная V равна числу электронов во внешней оболочке. Понятие валентность и ее определение связано с Периодическим законом, который открыл Менделеев.
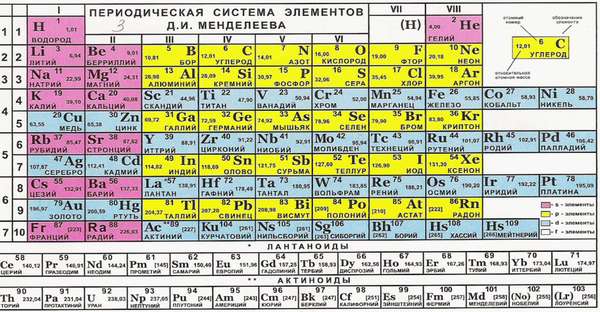
Определение по таблице Д. И. Менделеева
Чтобы определить V по таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы. Это вертикальные столбцы, которые делят все эл-нты по определенному признаку. В зависимости от признака, выделяют подразделения. Этими столбцами эл-нты делятся на тяжелые и легкие, а также подгруппы — галогены, инертные газы и тому подобное.
Итак, чтобы определить V нужно руководствоваться двумя правилами:
- Высшая V (ВВ) элемента равна номеру его группы.
- Низшая V (НВ) находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
Пример определения: фосфор проявляет ВВ – P2O5 и НВ (8-5)=3– PF3.
Таблица Менделеева (нажмите для увеличения)
Стоит также отметить несколько основных характеристик и особенностей, которые стоит учитывать переде тем, как определить этот показатель:
- V водорода всегда I – H2O, HNO3, H3PO4.
- Кислорода всегда равна II – CO2, SO3.
- У металлов, которые расположены в главной подгруппе, этот показатель всегда равен номеру группы – Al2O3, NaOH, KH.
- Для неметаллов чаще всего проявляются только две V– высшая и низшая.
Также существуют эл-нты, у которых может быть 3 или 4 разных значений этого показателя. К ним относятся хлор, бор, йод, хром, сера и другие. Например, хлор обладает показателями I, III, V, VII – HCl, ClF3,ClF5,HClO4 соответственно.
Определение по формуле
Чтобы определить по формуле можно воспользоваться несколькими правилами:
- Если известна валентность (V) одного из эл-нтов в двойном соединении: допустим, есть соединение углерода и кислорода СО2, при этом мы знаем, что V кислорода всегда равна II, тогда для определения можем воспользоваться таким правилом: произведение числа атомов на его V одного эл-нта должно равняться произведению числа атомов другого эл-нта на его V. Таким образом, V углерода можно определить так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть она будет равняться 4. Рассмотрим еще несколько примеров, как определить валентность: P2O5 – тут V фосфора = (5*2)/2 = 5. HCl – V хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1.
- Если известна V нескольких эл-нтов, которые составляют группу, определить можно так: в молекуле гидроксида натрия NaOH V кислорода равняется II, а V водорода – I, таким образом группа -OH обладает одной свободной валентностью, так как кислород присоединил только один атом водорода и еще одна связь свободна. К ней и присоединится натрий. Можно сделать вывод, что натрий – одновалентный элемент.
Разница между степенью окисления и валентностью
Очень важно понимать принципиальную разницу между этими понятиями. Степень окисления – это условный электрический заряд, которым обладает ядро, в то время как валентность – это количество связей, которые оно может установить.
Рассмотрим подробнее, что такое степень окисления. Согласно современной теории о строении атома, ядро состоит из положительно заряженных протонов и нейтронов без заряда, а вокруг него находятся электроны с отрицательным зарядом, которые уравновешивают заряд ядра и делают его электрически нейтральным.
В случае, если атом устанавливает связь с другим элементом, он отдает или принимает электроны, то есть выходит из состоянии баланса и начинает обладать электрическим зарядом. При этом если он отдает электрон, он становится положительно заряженным, а если принимает – отрицательным.
[warning]В соединении хлора и водорода HCl водород отдает один электрон и приобретает заряд +1, а хлор принимает электрон и становится отрицательным -1. В сложных соединениях, HNO3 и H2SO4, степени окисления будут такими – H+1N+5O3 -2 и H2 +1S +6O4 -2.[/warning]
Сравнивая два этих определения, можно сделать вывод, что они часто совпадают: V водорода +1 и V I, степень окисления кислорода -2 и V II, но очень важно помнить, что это правило выполняется не всегда!
В органическом соединении углерода под названием формальдегид и формулой HCOH у углерода степень окисления 0, но он обладает V, равной 4. В перекиси водорода H2O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке при определении.
Валентности распространенных элементов
Водород
Встречается во многих соединениях и можно определить, что его V=1. Это связано со строением его внешней электронной орбитали, на которой у водорода находится 1 электрон.
На первом уровне может находиться не более двух электронов одновременно, таким образом, водород может либо отдать свой электрон и образовать связь (электронная оболочка останется пустой), либо принять 1 электрон, также образовав новую связь (в таком случае его электронная оболочка полностью заполнится).
Пример: H2O – 2 атома водорода с V=1 связаны с двухвалентным кислородом; HCl – одновалентные хлор и водород; HCN – синильная кислота, где водород также проявляет V, равную 1.
Углерод
Углерод может обладать либо V II, либо IV. Связано это со строением внешнего электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V будет II. То есть 2 электрона установили 2 новые связи, например, соединение CO – угарный газ, где и кислород, и водород двухвалентные. Однако бывают ситуации, когда один электрон с первого уровня переходит на второй, тогда у углерода образуется 4 свободных электрона, которые могут образовывать связи: СО2, НСООН, Н2СО3.
Фосфор
Может обладать валентностью III и V. Как и в предыдущих случаях, связанно это со строением внешнего электронного уровня, на котором у него располагается 3 электрона, то есть возможность образовать 3 связи, но, как и углерод, у него возможен переход 1 электрона с s-орбитали на d-орбиталь, тогда неспаренных электронов станет 5, а значит. Например: РН3, Р2О5, Н3РО4.
Цинк
Цинк может обладать только валентностью, которая равна номеру его группы, то есть 2. Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, ZnH2, ZnSO4.
Видео по теме: Определение валентности химических элементов:
Видео по теме: Изучение валентности по периодической таблице Менделеева:
О том, как определить валентность, школьникам рассказывают на уроках химии в 8 классе. У многих именно эта тема вызывает значительные трудности. Но на самом деле, если разобраться в понятии, подробно ознакомиться с периодической таблицей Менделеева и немного потренироваться с формулами, то можно определить этот показатель без особого труда.
Статья по теме: Основной закон Гесса и следствия из него.
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Что такое валентность?
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
Чем поможет периодическая таблица?

Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.

В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе H2S двухвалентна, в составе SO2 четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.

- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов. Примеры — сера, хлор, бром, йод, хром и другие.
Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
- углерод,
- сера,
- хлор,
- бром.
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение

Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны. Подарки от онлайн казино можно взять на этой странице — https://www.casinobonus-ruu.com и активировать их после регистрации.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.