Формула природного газа
Определение и формула природного газа
Так, например, газ Ставропольского месторождения содержит 97,7% метана и 2,3% прочих газов, газ Саратовского месторождения – 93,4% метана, 3,6% этана, пропана, бутана и 3% негорючих газов.
К природным газам относятся и так называемые попутные газ, которые обычно растворены в нефти и выделяются при её добыче. В попутных газах содержится меньше метана, но больше этана, пропана, бутана и других высших углеводородов. Кроме того, в них присутствуют в основном те же примеси, что и в других природных газах, не связанных с залежами нефти, а именно: сероводород, азот, благородные газы, пары воды, углекислый газ.
Поскольку в природном газе содержится более 90% метана, то рассмотрим формулу именно этого соединения.
Химическая формула природного газа
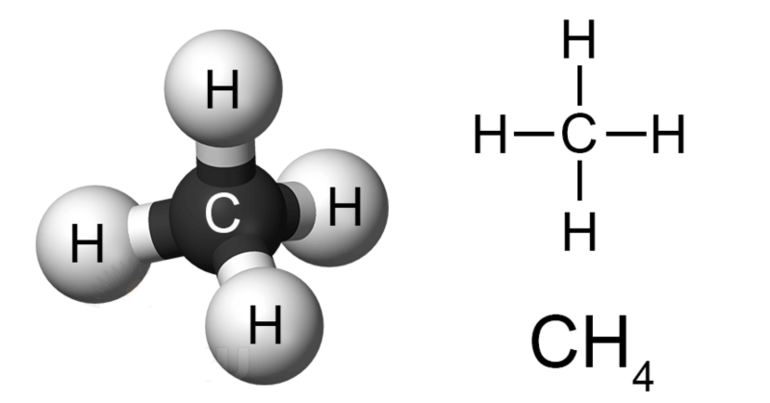
Химическая формула метана CH4. Она показывает, что в состав данной молекулы входят один атом углерода (Ar = 12 а.е.м.) и четыре атома водорода (Ar = 1 а.е.м.). По химической формуле можно вычислить молекулярную массу метана:
Mr(CH4) = Ar(C) + 4×Ar(H);
Mr(CH4) = 12 + 4×1 = 12 + 4 = 16
Графическая (структурная) формула природного газа
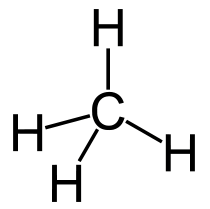
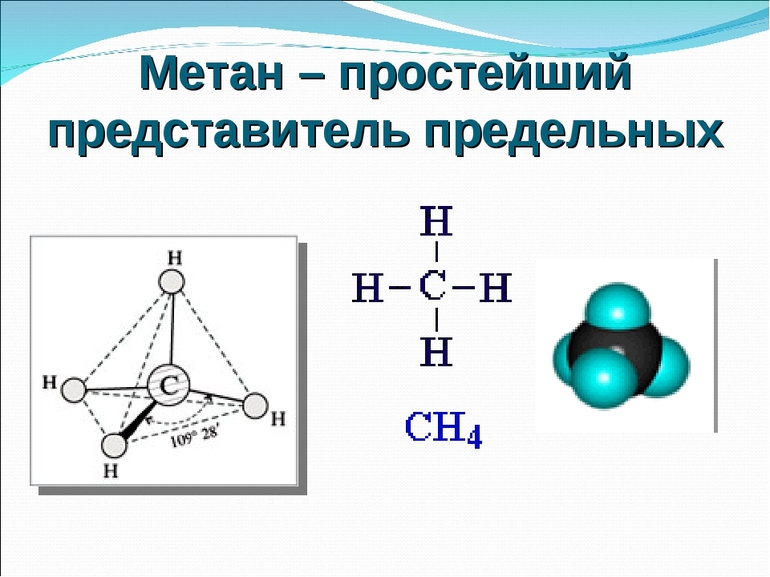
Структурная (графическая) формула метана является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 1).
Рис. 1. Графическая формула метана.
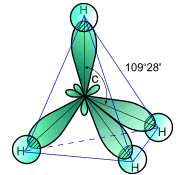
Атом углерода в молекуле метана находится в sp3 –гибридизации. Углы между связями в молекуле метана равны 109,50 (рис. 2).
Рис. 2. Пространственное изображение молекулы метана.
Электронная формула природного газа
Молекула метана в общем виде соответствует формуле AB4. Центральный атом – атом углерода, атомы водорода – лиганды. Запишем электронную конфигурацию атома углерода в основном состоянии и зарисуем его электронно-графическую формулу:
6С 1s22s22p2
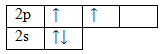
Чтобы принять четыре атома водорода, атому углерода необходимо перейти в возбужденное состояние:
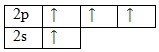
Аналогичные операции произведем для атома водорода:
1H 1s1

Примеры решения задач
Сегодня известно множество разнообразных газов. Какие-то из них человек получает лабораторными способами, из химических веществ, какие-то формируются сами в результате реакций в качестве побочных продуктов. А какие газы рождаются в природе? К основным таким газам естественного, природного происхождения относятся четыре:
- природный газ, формула которого СН4;
- азот, N2;
- водород, Н2;
- углекислый газ, СО2.
Конечно, существуют и некоторые другие — кислород, сероводород, аммиак, инертные газы, монооксид углерода. Однако перечисленные выше являются практически значимыми для людей и используются ими в разных целях, в том числе как топливо.
Что такое природный газ?
Природным называется такой газ, который дает нам природа. То есть тот, содержание которого в недрах Земли гораздо выше и больше, чем то его количество, что получают в промышленности в результате химических реакций.
Общепринято называть природным газом метан, однако это не совсем так. Если рассмотреть состав такого газа по фракциям, то можно увидеть следующий его компонентный состав:
- метан (до 96%);
- этан;
- пропан;
- бутан;
- водород;
- углекислый газ;
- азот;
- сероводород (малые, следовые количества).
Таким образом, выходит, что природный газ — это смесь нескольких газов природного происхождения.
Природный газ: формула
С химической точки зрения природный газ представляет собой смесь углеводородов линейного простого строения — метана, этана, пропана и бутана. Но так как больший объем составляет все же метан, то принято общую формулу природного газа выражать формулой непосредственно метана. Так, получается, что химическая формула природного газа метана -СН4.
Остальные компоненты имеют следующие эмпирические формулы в химии:
- этан — С2Н6;
- пропан — С3Н8;
- бутан — С4Н10;
- углекислый газ — СО2;
- азот — N2;
- водород — Н2;
- сероводород — H2S.
Смесь таких веществ и является природным газом. Формула основного его соединения метана показывает, что содержание углерода в нем очень мало. Это сказывается на его физических свойствах, например, таких как способность гореть бесцветным, совершенно некоптящим пламенем. В то время как другие представители его гомологического ряда (ряда предельных углеводородов или алканов) при горении образуют черное коптящее пламя.
Нахождение в природе
В природе данный газ встречается глубоко под землей, под толстыми и плотными пластами осадочных пород. Существует две основные теории происхождения природного газа в природе.
- Теория тектонических движений пород. Сторонники данной теории считают, что углеводороды содержатся в земных недрах всегда и поднимаются в результате тектонических движений и сокращений вверх. Наверху высокое давление и меняющаяся температура превращают их в результате химических реакций в два природных полезных ископаемых — нефть и газ.
- Биогенная теория говорит о другом методе, в результате которого образовался природный газ. Формула его отражает качественный состав — углерод и водород, что говорит о том, что в его образовании принимали участие живые органические существа, тела которых были большей частью построены из этих элементов, как и все живое на нашей планете, существующее до сих пор. С течением времени отмершие останки животных и растений опускались все ниже на дно океана, туда, где не существовало ни кислорода, ни бактерий, способных разложить и переработать эту органическую массу. В результате анаэробного окисления произошел распад биомассы, и за миллионы лет сформировалось два источника полезных ископаемых — нефть и газ. При этом основа и того и другого одинакова — это углеводороды и частично низкомолекулярные вещества. Химическая формула газа и нефти это доказывает. Однако при воздействии разных условий формируются и разные продукты: высокое давление и температура — газ, низкие показатели — нефть.
На сегодняшний день основными месторождениями и запасами газа обладают такие страны, как Россия, США, Канада, Иран, Норвегия и Нидерланды.
По своему агрегатному состоянию природный газ не всегда может содержаться только в состоянии газа. Есть несколько вариантов его конденсации:
- Газ растворен в молекулах нефти.
- Газ растворен в молекулах воды.
- Газ образует твердые газогидраты.
- При обычных условиях — газообразное соединение.
Каждое из этих состояний имеет свое месторождение и является очень ценным для человека.
Получение в лаборатории и промышленности
Помимо природных мест образования газа, существует ряд способов получить его в лабораторных условиях. Однако эти способы, безусловно, используются только для небольших порций продукта, так как экономически осуществлять синтез природного газа в лаборатории не выгодно.
Лабораторные способы:
- Гидролизом низкомолекулярного соединения — карбида алюминия: AL4C3 + 12H2O = 3CH4 + 4AL(OH)3.
- Из ацетата натрия в присутствии щелочи: CH3COOH + NaOH = CH4 + Na2CO3.
- Из синтез-газа: CO+ 3H2 = CH4 + H2O.
- Из простых веществ — водорода и углерода — при повышенной температуре и давлении.
Химическая формула природного газа отражается формулой метана, поэтому все реакции, характерные для алканов, характерны и для данного газа.
В промышленности метан получают добычей из природных месторождений и дальнейшей переработкой по фракциям. Также получаемый газ обязательно нуждается в очистке. Ведь формула природного газа метана показывает только часть тех составляющих, что он содержит. А для использования в быту нужен чистый газ, не содержащий других веществ, кроме метана. Отделяемый этан, пропан, бутан и другие газы также находят широкое применение.
Физические свойства
Формула газа дает представление о том, какими физическими свойствами он должен обладать. Рассмотрим, что же это за характеристики.
- Бесцветное вещество, не имеющее запаха.
- Приблизительная плотность варьируется в пределах 0,7-1 кг/м3.
- Температура горения 6500С.
- Почти в два раза легче воздуха.
- Теплота, выделяемая при сгорании одного кубического метра газа, равна 46 млн Джоулей.
- В повышенных концентрациях (свыше 15%) в воздухе газ очень взрывоопасен.
- При использовании в качестве топлива проявляет октановое число, равное 130.
Чистый газ получают только после прохождения его через специальные очистные станции (установки), которые воздвигаются на месте добычи ископаемого.
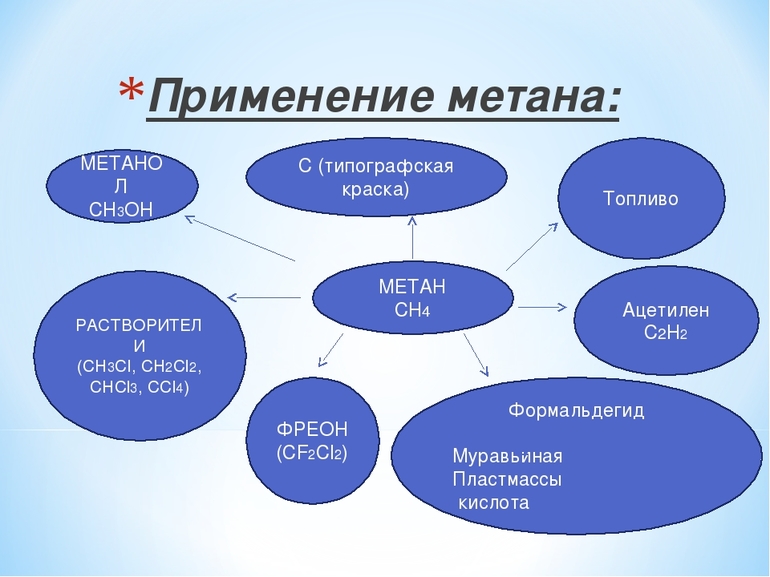
Применение
Существует несколько основных областей применения природного газа. Ведь помимо основной его составляющей, формула газа которой СН4, используются и все другие компоненты смеси.
1. Бытовая сфера жизни людей. Сюда относится газ для приготовления пищи, отопления жилых зданий, топлива для котельных и так далее. В газ, который используется для приготовления пищи, добавляют специальные вещества, относящиеся к группе меркаптанов. Делается это для того, чтобы в случае протекания трубы или другого упущения газа люди могли почувствовать его запах и принять меры. Смесь бытового газа (а это смесь пропана и бутана) чрезвычайно взрывоопасна в больших концентрациях. Меркаптаны же делают специфическим и неприятным на запах природный газ. Формула их включает такие элементы, как сера и фосфор, что и придает им такую специфику.
2. Химическое производство. В данной сфере одним из главных начальных веществ для многих реакций получения важных соединений является природный газ, формула которого показывает, в каких синтезах он может принимать участие:
- основа при производстве пластмасс, которые являются самым распространенным современным материалом практически для всех сфер промышленности;
- сырье при синтезе этина, цианистого водорода и аммиака. Сами перечисленные продукты в дальнейшем идут на производстве многих синтетических волокон и тканей, удобрений и утеплителей в строительстве;
- каучук, метанол, органические кислоты — образуются из метана и других веществ. Находят применение практически во всех сферах человеческой жизни;
- полиэтилен и многие другие соединения синтетической природы получили благодаря именно метану.
3. Использование в качестве топлива. Причем для любого вида деятельности человека, начиная от заправки соответствующего типа настольных ламп и до работы тепловых электростанций. Данный вид топлива считается экологически правильным и целесообразным на фоне всех альтернативных способов. Однако при сгорании метан образует углекислый газ, как любое другое органическое вещество. А он, как известно, причина парникового эффекта Земли. Поэтому перед людьми стоит задача поиска еще более чистого и качественного источника тепловой энергии.
Пока это все основные источники, которые используют природный газ. Формула его, если брать все комплексные составляющие, показывает, что он практически возобновляемый ресурс, только время для этого нужно очень много. Нашей стране с запасами газа чрезвычайно повезло, ведь такого количество природного ископаемого хватит на много сотен лет не только самой России, но и многим странам мира через экспорт.
Азот
Является составной частью нефтяных и газовых природных месторождений. Кроме того, данный газ занимает большую часть объема в воздухе (78%), а также встречается в виде природных соединений селитр в литосфере.
Как простое вещество практически не используется живыми организмами азот. Формула его имеет вид N2, или, с точки зрения химических связей, N≡N. Наличие такой крепкой связи говорит о высокой стабильности и химической инертности молекулы при обычных условиях. Именно это и объясняет возможность существования большого количества этого газа в свободном виде в атмосфере.
В виде простого вещества азот способен фиксироваться особыми организмами — клубеньковыми бактериями. Они затем перерабатывают в более подходящую форму для растений этот газ и таким образом осуществляют минеральное питание корневых растительных систем.
Есть несколько основных соединений, в виде которых существует в природе азот. Формула их следующая:
- оксиды — NO2, N2O, N2O5;
- кислоты — азотистая HNO2 и азотная HNO3 (образуются при грозовых разрядах из оксидов в атмосфере воздуха);
- селитры — KNO3, NaNO3 и так далее.
Человеком азот используется не только в виде газа, но и в жидком состоянии. Он обладает способностью переходить в жидкое состояние при температуре ниже -1700С, что позволяет применять его для замораживания растительных и животных тканей, многих материалов. Именно поэтому широкое применение жидкий азот находит в медицине.
Также азот является основой для получения одного из главных своих соединений — аммиака. Производство данного вещества многотоннажно, так как оно очень широко применяется в быту и промышленности (получение каучуков, красителей, пластмасс, синтетических волокон, органических кислот, лакокрасочное производство, взрывчатые вещества и так далее).
Диоксид углерода
Какова формула вещества? Углекислый газ записывается как СО2. Связь в молекуле ковалентная слабополярная, двойные прочные химические силы между углеродом и кислородами. Это говорит о стабильности и инертности молекулы при обычных условиях. Данный факт подтверждается свободным существованием углекислого газа в атмосфере Земли.
Это вещество является составной частью природного газа и нефти, а также накапливается в верхних слоях атмосферы планеты, вызывая так называемый парниковый эффект.
Огромное количество углекислого газа формируется при сгорании любого вида органического топлива. Будь то уголь, дрова, газ или другое топливо, полное сгорание приводит к образованию воды и этого вещества.
Отсюда и получается, что накопление его в атмосфере неизбежно. Поэтому важной задачей современного общества является поиск альтернативного, дающего минимум парникового эффекта топлива.
Водород
Еще одно попутное соединение, встречающееся в составе природных полезных ископаемых, — это водород. Газ, формула которого — Н2. Самое легкое вещество из всех известных на сегодняшний день.
Благодаря своим особым свойствам занимает в периодической системе два положения — среди щелочных металлов и галогенов. Имея один электрон, способен его как отдавать (металлические свойства, восстановительные), так и принимать (неметаллические свойства, окислительные).
Основная область использования — это экологически чистое топливо, за которым ученые видят будущее. Причины:
- неограниченное количество запасов этого газа;
- образование в результате горения только воды.
Однако полная технология освоения водорода как источника энергии требует доработки еще многих нюансов.
Формулы для расчетов массы, плотности и объема газов
В физике и химии применяются несколько основных способов для расчетов по газам. Так, например, если речь идет об одном из самых основных параметров, таких как масса газа, формула для расчета будет следующей:
m = V*þ, где þ — это плотность вещества, а V — его объем.
Например, если нам нужно рассчитать массу природного газа объемом 1 метр кубический при нормальных условиях, то мы берем стандартное среднее значение его плотности в справочных материалах. Оно будет равно 0,68 кг/м3. Теперь, когда мы знаем объем и плотность газа, формула для расчета вполне удовлетворяет требованиям. Тогда:
m (CH4) = 0,68 кг/м3 * 1 м3 = 0,68 кг, так как метры кубические сокращаются.
Формула объема газа, напротив, складывается из показателей массы и плотности. То есть мы можем выразить это значение из приведенной выше конфигурации:
V = m/þ, тогда при стандартных условиях объем 2 кг метана будет равен: 2/0,68 = 2,914 м3.
Также в более сложных случаях (когда условия нестандартные) для расчета массы и объема газов используют уравнение Менделеева-Клапейрона, которое имеет вид:
p*V = m/M*R*T, где р — давление газа, V — его объем, m и M — масса и молярная масса соответственно, R — универсальная газовая постоянная, равная 8,314, Т — температура в Кельвинах.
Такая формула объема газа позволяет получать расчеты весьма приближенные к значению идеального газа, который существует чисто гипотетически и используется для абстрактного понятия при решении задач в физике и химии. Также рассчитать объем можно по уравнению Бойля-Мариотта, которое имеет вид:
V=pн*Vн*T/p*Tн , где значения с индексом н — это значения при нормальных стандартных условиях.
Чтобы расчет был максимально точный и соответствовал действительности, необходимо учитывать такой параметр, как плотность газа. Формула для вычисления этого параметра пока еще вопрос спорный. Принято пользоваться самой обычной простой, которая имеет вид:
þ = m0 * n, где m0 — масса молекулы (кг), а n — концентрация, единица измерения — 1/м3.
Однако в ряде случаев необходимо использовать другие, более сложные и полные расчеты с несколькими переменными для получения точного и близкого к идеальному результата.
Сегодня известно множество разнообразных газов. Какие-то из них человек получает лабораторными способами, из химических веществ, какие-то формируются сами в результате реакций в качестве побочных продуктов. А какие газы рождаются в природе? К основным таким газам естественного, природного происхождения относятся четыре:
- природный газ, формула которого СН4;
- азот, N2;
- водород, Н2;
- углекислый газ, СО2.
Конечно, существуют и некоторые другие — кислород, сероводород, аммиак, инертные газы, монооксид углерода. Однако перечисленные выше являются практически значимыми для людей и используются ими в разных целях, в том числе как топливо.
Что такое природный газ?
Природным называется такой газ, который дает нам природа. То есть тот, содержание которого в недрах Земли гораздо выше и больше, чем то его количество, что получают в промышленности в результате химических реакций.
На сегодняшний день газ, возникший естественным образом, служит важнейшим источником энергии. Все…
Общепринято называть природным газом метан, однако это не совсем так. Если рассмотреть состав такого газа по фракциям, то можно увидеть следующий его компонентный состав:
- метан (до 96%);
- этан;
- пропан;
- бутан;
- водород;
- углекислый газ;
- азот;
- сероводород (малые, следовые количества).
Таким образом, выходит, что природный газ — это смесь нескольких газов природного происхождения.
Природный газ: формула
С химической точки зрения природный газ представляет собой смесь углеводородов линейного простого строения — метана, этана, пропана и бутана. Но так как больший объем составляет все же метан, то принято общую формулу природного газа выражать формулой непосредственно метана. Так, получается, что химическая формула природного газа метана -СН4.
Горючие газы — углеводороды, образующиеся в земной коре в результате термического разложения…
Остальные компоненты имеют следующие эмпирические формулы в химии:
- этан — С2Н6;
- пропан — С3Н8;
- бутан — С4Н10;
- углекислый газ — СО2;
- азот — N2;
- водород — Н2;
- сероводород — H2S.
Смесь таких веществ и является природным газом. Формула основного его соединения метана показывает, что содержание углерода в нем очень мало. Это сказывается на его физических свойствах, например, таких как способность гореть бесцветным, совершенно некоптящим пламенем. В то время как другие представители его гомологического ряда (ряда предельных углеводородов или алканов) при горении образуют черное коптящее пламя.
Нахождение в природе
В природе данный газ встречается глубоко под землей, под толстыми и плотными пластами осадочных пород. Существует две основные теории происхождения природного газа в природе.
- Теория тектонических движений пород. Сторонники данной теории считают, что углеводороды содержатся в земных недрах всегда и поднимаются в результате тектонических движений и сокращений вверх. Наверху высокое давление и меняющаяся температура превращают их в результате химических реакций в два природных полезных ископаемых — нефть и газ.
- Биогенная теория говорит о другом методе, в результате которого образовался природный газ. Формула его отражает качественный состав — углерод и водород, что говорит о том, что в его образовании принимали участие живые органические существа, тела которых были большей частью построены из этих элементов, как и все живое на нашей планете, существующее до сих пор. С течением времени отмершие останки животных и растений опускались все ниже на дно океана, туда, где не существовало ни кислорода, ни бактерий, способных разложить и переработать эту органическую массу. В результате анаэробного окисления произошел распад биомассы, и за миллионы лет сформировалось два источника полезных ископаемых — нефть и газ. При этом основа и того и другого одинакова — это углеводороды и частично низкомолекулярные вещества. Химическая формула газа и нефти это доказывает. Однако при воздействии разных условий формируются и разные продукты: высокое давление и температура — газ, низкие показатели — нефть.
На сегодняшний день основными месторождениями и запасами газа обладают такие страны, как Россия, США, Канада, Иран, Норвегия и Нидерланды.
По своему агрегатному состоянию природный газ не всегда может содержаться только в состоянии газа. Есть несколько вариантов его конденсации:
- Газ растворен в молекулах нефти.
- Газ растворен в молекулах воды.
- Газ образует твердые газогидраты.
- При обычных условиях — газообразное соединение.
Каждое из этих состояний имеет свое месторождение и является очень ценным для человека.
Получение в лаборатории и промышленности
Помимо природных мест образования газа, существует ряд способов получить его в лабораторных условиях. Однако эти способы, безусловно, используются только для небольших порций продукта, так как экономически осуществлять синтез природного газа в лаборатории не выгодно.
Лабораторные способы:
- Гидролизом низкомолекулярного соединения — карбида алюминия: AL4C3 + 12H2O = 3CH4 + 4AL(OH)3.
- Из ацетата натрия в присутствии щелочи: CH3COOH + NaOH = CH4 + Na2CO3.
- Из синтез-газа: CO+ 3H2 = CH4 + H2O.
- Из простых веществ — водорода и углерода — при повышенной температуре и давлении.
Химическая формула природного газа отражается формулой метана, поэтому все реакции, характерные для алканов, характерны и для данного газа.
В промышленности метан получают добычей из природных месторождений и дальнейшей переработкой по фракциям. Также получаемый газ обязательно нуждается в очистке. Ведь формула природного газа метана показывает только часть тех составляющих, что он содержит. А для использования в быту нужен чистый газ, не содержащий других веществ, кроме метана. Отделяемый этан, пропан, бутан и другие газы также находят широкое применение.
Физические свойства
Формула газа дает представление о том, какими физическими свойствами он должен обладать. Рассмотрим, что же это за характеристики.
- Бесцветное вещество, не имеющее запаха.
- Приблизительная плотность варьируется в пределах 0,7-1 кг/м3.
- Температура горения 6500С.
- Почти в два раза легче воздуха.
- Теплота, выделяемая при сгорании одного кубического метра газа, равна 46 млн Джоулей.
- В повышенных концентрациях (свыше 15%) в воздухе газ очень взрывоопасен.
- При использовании в качестве топлива проявляет октановое число, равное 130.
Чистый газ получают только после прохождения его через специальные очистные станции (установки), которые воздвигаются на месте добычи ископаемого.
Применение
Существует несколько основных областей применения природного газа. Ведь помимо основной его составляющей, формула газа которой СН4, используются и все другие компоненты смеси.
1. Бытовая сфера жизни людей. Сюда относится газ для приготовления пищи, отопления жилых зданий, топлива для котельных и так далее. В газ, который используется для приготовления пищи, добавляют специальные вещества, относящиеся к группе меркаптанов. Делается это для того, чтобы в случае протекания трубы или другого упущения газа люди могли почувствовать его запах и принять меры. Смесь бытового газа (а это смесь пропана и бутана) чрезвычайно взрывоопасна в больших концентрациях. Меркаптаны же делают специфическим и неприятным на запах природный газ. Формула их включает такие элементы, как сера и фосфор, что и придает им такую специфику.
2. Химическое производство. В данной сфере одним из главных начальных веществ для многих реакций получения важных соединений является природный газ, формула которого показывает, в каких синтезах он может принимать участие:
- основа при производстве пластмасс, которые являются самым распространенным современным материалом практически для всех сфер промышленности;
- сырье при синтезе этина, цианистого водорода и аммиака. Сами перечисленные продукты в дальнейшем идут на производстве многих синтетических волокон и тканей, удобрений и утеплителей в строительстве;
- каучук, метанол, органические кислоты — образуются из метана и других веществ. Находят применение практически во всех сферах человеческой жизни;
- полиэтилен и многие другие соединения синтетической природы получили благодаря именно метану.
3. Использование в качестве топлива. Причем для любого вида деятельности человека, начиная от заправки соответствующего типа настольных ламп и до работы тепловых электростанций. Данный вид топлива считается экологически правильным и целесообразным на фоне всех альтернативных способов. Однако при сгорании метан образует углекислый газ, как любое другое органическое вещество. А он, как известно, причина парникового эффекта Земли. Поэтому перед людьми стоит задача поиска еще более чистого и качественного источника тепловой энергии.
Пока это все основные источники, которые используют природный газ. Формула его, если брать все комплексные составляющие, показывает, что он практически возобновляемый ресурс, только время для этого нужно очень много. Нашей стране с запасами газа чрезвычайно повезло, ведь такого количество природного ископаемого хватит на много сотен лет не только самой России, но и многим странам мира через экспорт.
Азот
Является составной частью нефтяных и газовых природных месторождений. Кроме того, данный газ занимает большую часть объема в воздухе (78%), а также встречается в виде природных соединений селитр в литосфере.
Как простое вещество практически не используется живыми организмами азот. Формула его имеет вид N2, или, с точки зрения химических связей, N≡N. Наличие такой крепкой связи говорит о высокой стабильности и химической инертности молекулы при обычных условиях. Именно это и объясняет возможность существования большого количества этого газа в свободном виде в атмосфере.
В виде простого вещества азот способен фиксироваться особыми организмами — клубеньковыми бактериями. Они затем перерабатывают в более подходящую форму для растений этот газ и таким образом осуществляют минеральное питание корневых растительных систем.
Есть несколько основных соединений, в виде которых существует в природе азот. Формула их следующая:
- оксиды — NO2, N2O, N2O5;
- кислоты — азотистая HNO2 и азотная HNO3 (образуются при грозовых разрядах из оксидов в атмосфере воздуха);
- селитры — KNO3, NaNO3 и так далее.
Человеком азот используется не только в виде газа, но и в жидком состоянии. Он обладает способностью переходить в жидкое состояние при температуре ниже -1700С, что позволяет применять его для замораживания растительных и животных тканей, многих материалов. Именно поэтому широкое применение жидкий азот находит в медицине.
Также азот является основой для получения одного из главных своих соединений — аммиака. Производство данного вещества многотоннажно, так как оно очень широко применяется в быту и промышленности (получение каучуков, красителей, пластмасс, синтетических волокон, органических кислот, лакокрасочное производство, взрывчатые вещества и так далее).
Диоксид углерода
Какова формула вещества? Углекислый газ записывается как СО2. Связь в молекуле ковалентная слабополярная, двойные прочные химические силы между углеродом и кислородами. Это говорит о стабильности и инертности молекулы при обычных условиях. Данный факт подтверждается свободным существованием углекислого газа в атмосфере Земли.
Это вещество является составной частью природного газа и нефти, а также накапливается в верхних слоях атмосферы планеты, вызывая так называемый парниковый эффект.
Огромное количество углекислого газа формируется при сгорании любого вида органического топлива. Будь то уголь, дрова, газ или другое топливо, полное сгорание приводит к образованию воды и этого вещества.
Отсюда и получается, что накопление его в атмосфере неизбежно. Поэтому важной задачей современного общества является поиск альтернативного, дающего минимум парникового эффекта топлива.
Водород
Еще одно попутное соединение, встречающееся в составе природных полезных ископаемых, — это водород. Газ, формула которого — Н2. Самое легкое вещество из всех известных на сегодняшний день.
Благодаря своим особым свойствам занимает в периодической системе два положения — среди щелочных металлов и галогенов. Имея один электрон, способен его как отдавать (металлические свойства, восстановительные), так и принимать (неметаллические свойства, окислительные).
Основная область использования — это экологически чистое топливо, за которым ученые видят будущее. Причины:
- неограниченное количество запасов этого газа;
- образование в результате горения только воды.
Однако полная технология освоения водорода как источника энергии требует доработки еще многих нюансов.
Формулы для расчетов массы, плотности и объема газов
В физике и химии применяются несколько основных способов для расчетов по газам. Так, например, если речь идет об одном из самых основных параметров, таких как масса газа, формула для расчета будет следующей:
m = V*þ, где þ — это плотность вещества, а V — его объем.
Например, если нам нужно рассчитать массу природного газа объемом 1 метр кубический при нормальных условиях, то мы берем стандартное среднее значение его плотности в справочных материалах. Оно будет равно 0,68 кг/м3. Теперь, когда мы знаем объем и плотность газа, формула для расчета вполне удовлетворяет требованиям. Тогда:
m (CH4) = 0,68 кг/м3 * 1 м3 = 0,68 кг, так как метры кубические сокращаются.
Формула объема газа, напротив, складывается из показателей массы и плотности. То есть мы можем выразить это значение из приведенной выше конфигурации:
V = m/þ, тогда при стандартных условиях объем 2 кг метана будет равен: 2/0,68 = 2,914 м3.
Также в более сложных случаях (когда условия нестандартные) для расчета массы и объема газов используют уравнение Менделеева-Клапейрона, которое имеет вид:
p*V = m/M*R*T, где р — давление газа, V — его объем, m и M — масса и молярная масса соответственно, R — универсальная газовая постоянная, равная 8,314, Т — температура в Кельвинах.
Такая формула объема газа позволяет получать расчеты весьма приближенные к значению идеального газа, который существует чисто гипотетически и используется для абстрактного понятия при решении задач в физике и химии. Также рассчитать объем можно по уравнению Бойля-Мариотта, которое имеет вид:
V=pн*Vн*T/p*Tн , где значения с индексом н — это значения при нормальных стандартных условиях.
Чтобы расчет был максимально точный и соответствовал действительности, необходимо учитывать такой параметр, как плотность газа. Формула для вычисления этого параметра пока еще вопрос спорный. Принято пользоваться самой обычной простой, которая имеет вид:
þ = m0 * n, где m0 — масса молекулы (кг), а n — концентрация, единица измерения — 1/м3.
Однако в ряде случаев необходимо использовать другие, более сложные и полные расчеты с несколькими переменными для получения точного и близкого к идеальному результата.
Горение
— быстропротекающая химическая реакция
соединения горючих компонентов с
кислородом, сопровождающаяся интенсивным
выделением теплоты и резким повышением
температуры продуктов сгорания.
Реакция
горения чистого метана:
CH4 +
2O2 =
CO2 +
2H2O + Выделение тепла
Так
как больший объем составляет метан, то
принято общую формулу природного газа
выражать формулой непосредственно
метана. Так, получается, что химическая
формула природного газа метана -СН4.
Остальные
компоненты имеют следующие эмпирические
формулы в химии:
этан
— С2Н6;
пропан
— С3Н8;
бутан
— С4Н10;
углекислый
газ — СО2;
азот
— N2;
водород
— Н2;
сероводород
— H2S.
Смесь
таких веществ и является природным
газом.
Чаще
всего очистка
природного газа происходит
непосредственно при добыче исходного
сырья. В зависимости от состава и
концентрации примесей выбирают тот или
иной способ очистки.
В
мировой практике чаще всего
применяют хемосорбционные
способы очистки,
где основными действующими веществами
являются растворы
алкаколамина с водой или бенфилд (карбонат
калия и вода с добавками). Следующими
по популярности являютсякомбинированные
методики,
сочетающие в себе химические и физические
процессы, с присутствием в качестве
действующего агента сульфинола. При
необходимости тонкой
очистки сырья,
применяют твердые адсорбенты и окисление
серы до твердого осадка.
Получение
в лаборатории и промышленности
Помимо
природных мест образования газа,
существует ряд способов получить его
в лабораторных условиях. Однако эти
способы, безусловно, используются только
для небольших порций продукта, так как
экономически осуществлять синтез
природного газа в лаборатории не выгодно.
Лабораторные
способы:
-
Гидролизом
низкомолекулярного соединения — карбида
алюминия: AL4C3 + 12H2O = 3CH4 + 4AL(OH)3. -
Из
ацетата натрия в присутствии щелочи:
CH3COOH + NaOH = CH4 + Na2CO3. -
Из
синтез-газа: CO+ 3H2 = CH4 + H2O. -
Из
простых веществ — водорода и углерода
— при повышенной температуре и давлении.
Химическая
формула природного газа отражается
формулой метана, поэтому все реакции,
характерные для алканов, характерны и
для данного газа.
Бытовой
газ= Природный газ + Добавки для запаха
Чистый
природный газ не имеет цвета и запаха.
Чтобы можно было определить утечку по
запаху, в газ добавляют небольшое
количество веществ, имеющих сильный
неприятный запах (гнилой капусты, прелого
сена) (т. н. одорантов). Чаще всего в
качестве одоранта применяется
этилмеркаптан (С2H5SH) (16г на 1000 куб. м.
природного газа).
C3H8
— Пропан
Типы классификаций реакции.
|
По |
По |
|
|
Без |
С |
|
|
СОЕДИНЕНИЯ |
CaO+H2O=Ca(OH)2 PbO+SiO2=PbSiO3 |
H2+Cl2=2HCl 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
|
РАЗЛОЖЕНИЯ |
Cu(OH)2=CuO+H2O CaCO3=CaO+CO2 NH4Cl=NH3+HCl |
4HNO3=2H2O+4NO2+O2 4KClO3=3KClO4+KCl |
|
ЗАМЕЩЕНИЯ |
CuSO4+Fe=FeSO4+Cu 2KBr+Cl2=2KCl+Br2 |
|
|
ОБМЕНА |
AgNO3+KBr=AgBr NaOH+HCl=NaCl+H2O |
Краткая характеристика
Природный метан образуется при гниении останков живых организмов. В переводе с английского «methane» означает «болотный газ», так как чаще всего его обнаруживают в болотах и каменноугольных шахтах.
Почти 95% реагента появляется в результате биологических процессов. Пятая часть годовых выбросов газа в атмосферу приходится на коз и коров, в желудках которых живут бактерии, вырабатывающие метан. В атмосферу он попадает, когда рогатый скот выводит из организма продукты своей жизнедеятельности.
Другими источниками вещества являются:
- термиты;
- рис-сырец;
- болотистые водоёмы;
- фильтрация природного газа;
- фотосинтез растений;
- вулканы;
- давно погибшие организмы.
Поскольку вещество обычно связано с живыми организмами, то учёные полагают, что его присутствие на планете указывает на наличие жизни. Так, когда этот газ был обнаружен в атмосферах Марса, специалисты начали тщательное изучение планеты именно на предмет существования живых организмов. Но дальнейшие исследования показали, что на удалённых планетах Солнечной системы метана значительно больше, хотя там он появился в результате химических реакций.
На Земле вещество просачивается через трещины в земной коре, находящиеся на океанском дне, в больших количествах выделяется во время горных разработок и при лесных пожарах. Кроме того, недавно учёными был обнаружен новый источник газа, который никогда ранее в таком ключе не рассматривался.
Физические качества
Метан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет.
Кроме того, к физическим свойствам метана относятся:
- Горение голубым пламенем.
- Сгорание без выделения вредных продуктов.
- Плохая растворимость в воде.
- Он легче воздуха.
- Основная составляющая природных, попутных нефтяных, рудничного и болотного газов.
- Кипение при температуре -161 °C.
- Замерзание при температуре -183 °C.
- Молярная масса составляет 16,044 г/моль.
- Плотность — 0,656 кг/м³.
- При соединении с воздухом образуются взрывоопасные смеси.
- В жидком виде представляет собой бесцветную жидкость без запаха.
Наиболее опасен метан, который выделяется во время подземных разработок полезных ископаемых, а также на фабриках, занимающихся переработкой и обогащением угля. Когда количество газа в воздухе достигает 5−6%, то он начинает гореть рядом с источниками тепла.
Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2.
При соприкосновении с источником тепла метан воспламеняется с небольшой задержкой. Это свойство вещества применяется при изготовлении предохранительных взрывчатых веществ и электрооборудования, безопасного при взрывах. На всех объектах, где существует опасность выброса метана, действуют правила техники безопасности «газовый режим».
Химические свойства
В химии формула метана — CH4. Соединение плохо вступает в химические связи.
В обычных условиях оно не реагирует со следующими веществами:
- концентрированные кислоты;
- расплавленные и концентрированные щелочи;
- щелочные металлические реагенты;
- галогены;
- перманганат калия;
- дихромат калия в кислой среде.
При температуре около 200 °C и давлении от 30 до 90 атмосфер болотный газ окисляется, преобразуясь в муравьиную кислоту. Вещество образует соединения, называемые газовыми гидратами, которые часто встречаются в природе.
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:
- Конверсия в синтез-газ. Синтез-газ, который образуется в результате указанной реакции, используется для получения метанола, углеводородов и так далее.
- Галогенирование. Такая реакция является цепной. При ней молекула брома или йода подвергается воздействию света и распадается на радикалы, которое затем атакуют молекулы метана. В результате от соединения отрывается атом водорода, а газ становится свободным метилом CH3. Получившееся вещество сталкивается с молекулами брома или йода, которые разрушаются, образуя новые радикалы этих реагентов.
- Нитрование.
- Окисление или горение. Эта реакция происходит при избытке кислорода и описывается следующим уравнением: CH4 + 2O2 → CO2 + 2H2O. В этом случае пламя имеет голубой цвет. Если кислорода недостаточно, то результатом реакции становится выработка не углекислого газа, а оксида углерода. Если же кислорода ещё меньше, то взаимодействие веществ приведёт к выделению мелкодисперсного углерода.
- Сульфохлорирование.
- Сульфоокисление.
- Разложение.
- Дегидрирование.
- Каталитическое окисление. В подобных реакциях из болотного газа образуются карбоновые кислоты, спирты, альдегиды.
Получение в промышленности и лаборатории
В промышленных условиях вещество получают посредством нагревания углерода и водорода или синтеза водяного газа. Для того чтобы реакция протекала успешно, используют катализатор, обычно в этом качестве применяется никель. В США для добычи простейшего углеводорода используется специальная система, способная извлекать соединение из природного угля. Но также метан выделяется в виде подобного продукта при термической переработке нефти и нефтепродуктов, коксовании и гидрировании каменного угля.
В лаборатории для получения вещества применяются следующие методы:
- Реакция гидроксида натрия с ацетатом натрия.
- Взаимодействие карбида алюминия.
- Нагревание натристой извести с уксусной кислотой. Для этой реакции необходима безводная среда, а потому в ней применяется гидроксид натрия, который является наименее гигроскопичным.
Болотный газ самый термически устойчивый углеводород, а потому он широко применяется и в быту, и в промышленности. Хлорирование вещества даёт возможность получения метилхлорида, метиленхлорида, хлороформа, четырёххлористого углерода. Результатом его неполного сгорания является сажа, Если метан каталитически окисляется, то получается формальдегид. А его реакция с серой приводит к образованию сероуглерода.
К важным методам получения ацетилена из простейшего углеводорода относятся:
- термоокислительный крекинг,
- электрокрекинг.
Газ также применяется для производства синильной кислоты. Кроме того, он даёт водород, необходимый для выработки водяного газа, который, в свою очередь, применяется для создания углеводородов, альдегидов и тому подобного. Кроме того, метан необходим при производстве нитрометана.
В настоящее время газ стал часто использоваться в качестве автомобильного топлива. Но его плотность в 1000 раз меньше плотности бензина, а потому, чтобы заправить автомобиль метаном на тот же объём, что и бензином, при равном давлении необходим соответствующий бак. В таком случае для обычной поездки потребовалось бы возить прицеп с топливом.
Учёные решили эту проблему, увеличив плотность газа до 200−250 атмосфер. Сжатое вещество закачивается в специальные баллоны, установленные на автомобилях особой конструкции.
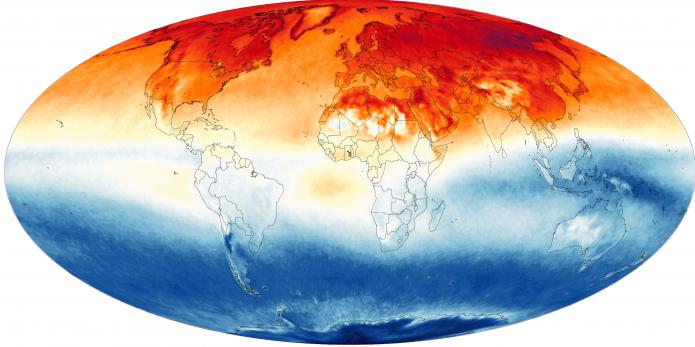
Парниковый эффект
Метан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия.
Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника.
Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла.
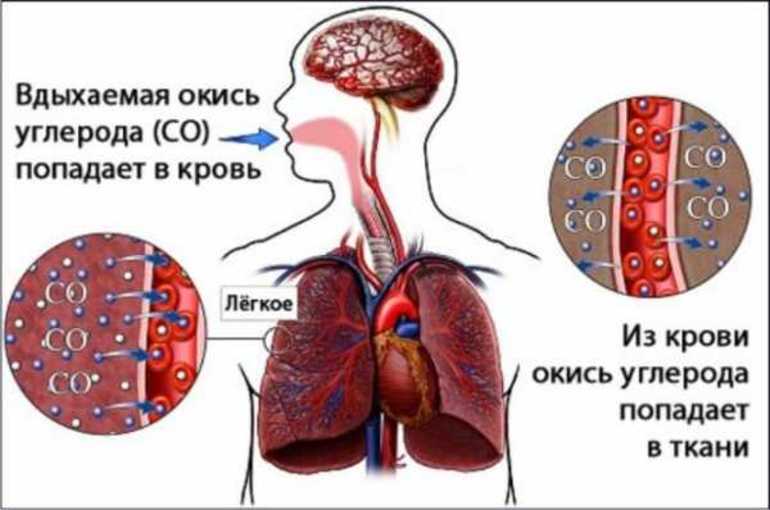
Влияние на организм человека
Человек может отравиться, надышавшись метаном при аварии на производстве или из-за неправильного обращения с приборами, работающими на этом газе. Возможна такая ситуация и при длительном нахождении на болоте, в шахте. Если концентрация вещества в воздухе составляет 20 и более процентов, то отравление может быть очень тяжёлым, вплоть до летального исхода.
Работники химических производств, рудников и шахт подвержены другому способу отравления углеводородом. Зачастую эти люди на протяжении длительного времени регулярно вдыхают небольшие дозы вещества.
Кроме того, хроническая интоксикация может наступить из-за заболеваний кишечника, например, дисбактериоза. В таких случаях в организме больного метан образуется в повышенном количестве. Этот газ не станет причиной серьёзной интоксикации, но всё же он может вызвать в организме разные нарушения, привести к желудочно-кишечному дискомфорту и общему ухудшению самочувствия.
Отличить острое отравление метаном можно по следующим признакам:
- головокружение;
- шум в ушах;
- сонливость;
- общая слабость;
- потеря координации;
- нарушение речи;
- резь в глазах;
- слезотечение;
- удушье;
- усиленное сердцебиение;
- понижение артериального давления;
- тошнота;
- приступы рвоты;
- синюшность кожных покровов и слизистых оболочек.
Если отравление тяжёлое, то человек теряет сознание, у него начинаются судороги, за которыми следует кома. А также возможна остановка дыхания и сердцебиения.
Если отравление метаном является хроническим, то пострадавший страдает от частых головных болей, общего недомогания, низкого артериального давления и снижения работоспособности. Человек становится бледным и вялым, испытывает упадок сил. Гипотония может вызывать обмороки. И также возможно истощение нервной системы, которое выражается в повышенной раздражительности, нервозности и тому подобном.
Метан известен, как один из самых опасных газов. Он токсичен, горюч и взрывоопасен. Вещество не имеет ни цвета, ни запаха, а потому обнаружить его в воздухе крайне сложно. Чтобы не подвергать своё здоровье и жизнь опасности, следует внимательно относится к технике безопасности и соблюдать осторожность при работе или бытовом использовании метана.