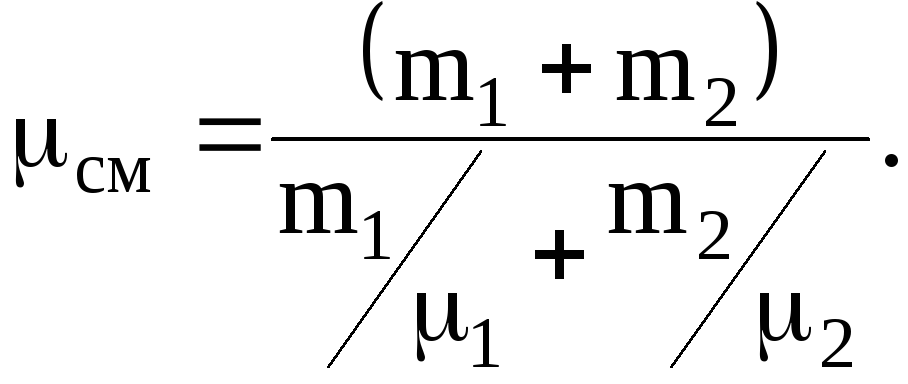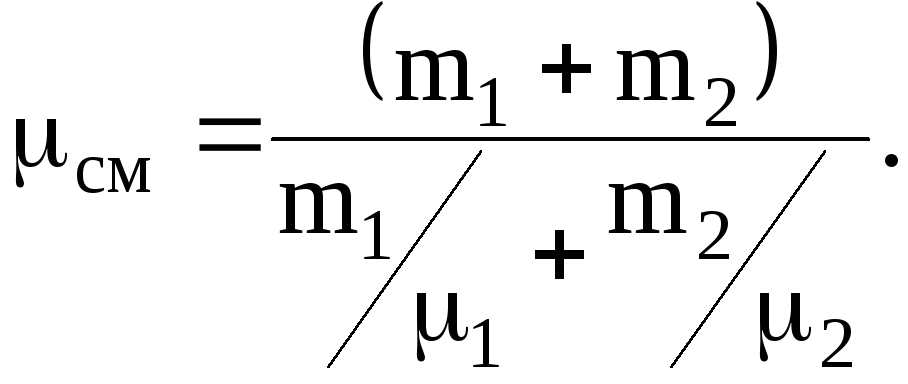поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,978 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Найдите относительную плотность кислорода: а) по водороду; б) по воздуху.
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §19. Примените свои знания. Номер №6
Решение а
Дано:
O
2
Найти:
D
H
2
(
O
2
) − ?
Решение:
Запишем формулу нахождения относительной плотности:
D
H
2
(
O
2
) = M(
O
2
) : M(
H
2
).
D
H
2
(
O
2
) = 2 * 16 : М(
H
2
) = 32 : 2 = 16
Ответ:
D
H
2
(
O
2
) = 16.
Решение б
Дано:
O
2
Найти:
D
в
о
з
д
(
O
2
) − ?
Решение:
Запишем формулу нахождения относительной плотности:
D
в
о
з
д
.
(
O
2
) = M(
O
2
) : M(возд.)
D
в
о
з
д
.
(
O
2
) = 2 * 16 : M (возд.) = 32 : 29 = 1,1
Ответ:
D
в
о
з
д
.
(
O
2
) = 1,1.
1.1.1.
Определить для серной кислоты: 1)
относительную молекулярную массу; 2)
молярную массу.
Решение.
1. Относительная молекулярная масса
вещества равна сумме относительных
атомных масс всех элементов, атомы
которых входят в состав молекулы данного
вещества,и определяется по формуле
r=niAri,
где
ni
– число атомов i-го
элемента, входящих в молекулу;
Ari
– относительная атомная масса i-го
элемента.
Химическая
формула серной кислоты имеет вид H2SO4.
Так как в состав молекулы серной кислоты
входят атомы трех элементов, то стоящая
в правой части равенства сумма будет
состоять из трех слагаемых и формула
примет вид
r=n1Ar1+n2Ar2+n3Ar3.
Из
формулы серной кислоты далее следует,
что n1=2,
n2=1,
n3=4.
Значения
относительных атомных масс водорода,
серы и кислорода соответственно равны
Ar1=1,
Ar2=32,
Ar3=16.
Подставив численные значения ni
и Ari
будем иметь:
r=2+32+64=98.
2.
Зная относительную молекулярнуюмассу,
найдем молярную массу серной кислоты
по формуле
=rk,
где
k=10-3
кг/моль.
Подставив
в последнее выражение значения величин,
получим =98710-3
кг/моль.
1.1.2.
Определить молярную массу смеси см
кислорода массой m1=25
г и азота массой m2=75
г.
Решение.
Молярная масса см
смеси, есть отношение массы смеси mсм
к количеству вещества см
смеси:
см=mсм/см.
Масса
смеси равна сумме масс компонентов
смеси: mсм=m1+m2.
Количество
вещества смеси равно сумме количеств
вещества компонентов
Подставив
выражения mсм
и см
в ранее записанную формулу для молярной
массы получим
где
1=3210-3
кг/моль, 2=2810-3
кг/моль.
Подставив,
значение величин и произведя вычисление,
будем иметь
см=28,9.10-3
кг/моль.
1.1.3.
Определить число молекул N,
содержащихся в объеме V=1
мм3
воды, и массу m1
одной молекулы воды. Считая условно,
что молекулы воды имеют вид шариков,
соприкасающихся друг с другом, найти
диаметр d
молекул.
Решение.
Число молекул N,
содержащихся в некоторой системе массой
m,
равнопроизведению постояннойАвогадро
на количество вещества N=NА.
Так
как =m/,
где -молярная
масса,то
N=(m/)NА.
Выразив
в формуле массу как произведение
плотности на объем V,
получим
N=(V/)NА.
Произведем
вычисления, учитывая =1810-3
кг/моль, =1103
кг/м3,
V=110-9
м3,
N=6,021023
моль-1:
.
Массу
одной молекулы m1
можно найти по формуле
Если
молекулы воды плотно прилегают друг к
другу, то можно считать, что на каждую
из них приходится объем (кубическая
ячейка)
V1=d3,
где
d-диаметр
молекулы.
Отсюда
d=V11/3.
Объем
V1
найдем, разделив молярный объем V
на число молекул в моле, т.е. на NА:
V1=Vm/NА.
Тогда
для диаметра одной молекулы будем иметь:
d=(Vm/NА)1/3,
где
Vm=/p
Окончательно
d=(/(pNА))1/3.
Произведем
вычисления
1.1.4.
В баллоне объемом 10 л находится гелий
под давлением p1=1
МПа и при температуре T=300
К. После того как из баллона было взято
m=10
г гелия,температура газа понизилась до
Т=290 К Определить давление p
гелия оставшегося в баллоне.
Решение.
Для решения задачи воспользуемся
уравнением Менделеева-Клапейрона,
применив его дважды к начальному и
конечному состояниям газа:
;
,
где
m1,
m2
– массы гелия в баллоне в начальном и
конечном состояниях;
– молярная
масса гелия;
R
– универсальная газовая постоянная;
T1
и T2
– температуры газа в начальном и конечном
состояниях.
Массы
m1
и m2
гелия найдем из уравнения
Менделеева-Клапейрона:
m1=p1V/(RT1),
m2=mp2V/(RT2).
Тогда масса гелия
оставшегося в баллоне будет равна
Для
давления p
гелия, оставшегося в баллоне, будем
иметь:
или
Численно
.
1.1.5.
Баллон содержит 80 г кислорода и 320 г
аргона. Давление смеси 1МПа, температура
300 К. Принимая данные газы за идеальные,
определить объем баллона.
Решение.
По закону Дальтона, давление смеси равно
сумме парциальных давлений газов,
входящих в состав смеси. Парциальные
давления кислорода p1
и аргона p2
можно определить, воспользовавшись
уравнением Менделеева-Клапейрона
p1=m1RT/(1V),
p2=m2RT/(2V).
Следовательно, по
закону Дальтона, давление смеси газов
или
Откуда
объем баллона
Подставив численные
значения, будем иметь
1.1.6.
Какое количество молекул находится в
комнате объемом 80 м3
при
температуре 17 oС
и давлении 750 мм. рт. ст?
Решение.
Количество молекул N,
содержащееся в комнате, можно определить,
зная массувоздуха m,его
молярную массу и число Авогадро NА.
Число молекул в одном киломоле газа
равно числу Авогадро. А число киломолей
содержащихся в массе m,
определяется соотношением:
=m/.
Следовательно,
N=m/(NА).
Массу
m
содержащегося в комнате воздуха
определяем из уравнения Менделеева-Клапейрона
где
p
– давление воздуха;
V
– объем;
R
– универсальная газовая постоянная;
T
– абсолютная температура (T=t+
273 );
m
– масса воздуха.
Следовательно,
для числа молекул воздуха имеем:
Подставляя все
данные, предварительно выразив их в
системе СИ, будем иметь
1.1.7.
Найти среднюю кинетическую энергию
вращательного движения одной молекулы
кислорода при температуре T=350
К, а также кинетическую энергию
вращательного движения всех молекул
кислорода массой 4 г.
Решение.
Согласно теореме о равномерном
распределении энергии по степеням
свободы, накаждую степень свободы
приходится энергия:
,
где
k
– постоянная Больцмана;
Т
– абсолютная температура.
Молекула
кислородадвухатомная, поведение такой
молекулы описывается 5-ю степенями
свободы (три изних приписываются
поступательному движению и две-
вращательному).
Следовательно,
кинетическая энергия вращательного
движения молекулы кислорода может быть
рассчитана по формуле:
<Wвр>=2
<Wк>=21/2
kТ=kТ.
Энергия
вращательного движения всех молекул,
содержащихся в 4 г кислорода, может быть
определена как произведение числа
молекул N
на энергию одной молекулы:
Wк=N<Wвр>=NkТ.
Число молекул
определяется соотношением:
где
– молекулярная масса кислорода;
m
– его масса;
NА
– число Авогадро.
Таким образом
Подставив численные
значения, предварительно выразив их в
системе СИ, будем иметь:
<Wвр>=1,3810-23.350=4,8310-21
Дж;
.
1.1.8.
Масса 10 г кислорода находится при
давлении 304 кПа и температуре 10 oС.
После расширения вследствие нагревания
при постоянном давлении кислород занял
объем 10 л. Найти объем газа до расширения,
температуру газа после расширения,
плотности газа до и после расширения.
Решение.
Согласно условию задачи, расширение
газа вследствие нагревания происходило
при постоянном давлении. В этом случае
оказывается справедливым соотношение
.
Для
определения температуры газа после
расширениявоспользуемся
уравнениемМенделеева-Клапейрона для
конечного состояния газа
,
где
p2
– давление газа после расширения;
V2
– его объем после расширения;
m
– масса газа;
– молекулярная
масса кислорода;
R
– универсальная газовая постоянная;
T2
– абсолютная температура газа.
Следовательно,
дляконечной температуры имеем
Для
определения объема газа до расширения
можно вновь воспользоваться уравнением
Менделеева-Клапейрона, записанным для
первоначального состояния газа:
где
p1,
V1,
T1
– его давление, объем и температура до
расширения.
Из
данногоуравнения имеем
.
Учитывая
то, что плотность газа 1=m/V1,
подставляя значения V1
и V2
из уравнений
Менделеева-Клапейрона, записанные для
соответствующих состояний, для плотности
кислорода до и после расширения будем
иметь
и
Подставляя
численные значения в системе СИ,
окончательно имеем:
1=4,14
кг/м3,
2=1кг/м3.
1.1.9.Масса
газа 12 г занимает объем 4 л при температуре
7 oC.
После нагревания газа при постоянном
давлении его плотность стала равной
0,6 кг/м3.
До какой температуры нагрели газ?
Решение.
Воспользовавшись уравнением
Менделеева-Клапейрона
можно
показать, что между плотностью газа
=m/V
и давлением существует связь
Следовательно,
в начальномсостоянии давление газа:
В
конечном:
Так
как нагревание газа производилось при
постоянном давлении, то p1=p2
.
Отсюда
Подставляя
численные значения, в системе СИ, для
конечной температуры будем иметь:
1.1.10.
В баллоне находилась масса m1=10
кг газа при давлении p1=10
МПа. Какую массу газа взяли из баллона,
если давление стало равным p2=2,5
МПа? Температуру газа считать постоянной.
Решение.
Запишем уравнение состояния идеального
газа (уравнение Менделеева-Клапейрона)
для двух состояний: начального и конечного
и
Из
второгосоотношения определяем объем
сосуда и подставляем его значение в
первое, имеем:
Из
последнего соотношения получаемсвязь
между давлением газа в сосуде и его
массой для данного случая:
Отсюда масса газа
оставшегося в баллоне:
.
Так
как масса израсходованного газа
m=m1-m2,то
окончательно, после соответствующих
преобразований, имеем
Подставляячисленные
значения в системе СИ определяем массу
взятого из баллона газа:
1.1.11.
В сосуде находится масса m1=14
г азота и масса m2==9
г водорода при температуре 10 oС
и давлении 1 МПа. Найти молярную массу
смеси и объем сосуда.
Решение.
По закону Дальтона давление смеси газов
равно сумме парциальных давлений
компонентов входящих в смесь
p=p1+p2,
где
p
– давление смеси;
p1
– парциальное давление азота;
p2
– парциальное давление водорода.
Из
уравнения Менделеева-Клапейрона:
Для
каждого из давлений (смеси и парциальных)
можно записать:
Следовательно,
так как p=p1+p2,
имеем
откуда
Из
последнего соотношения для молекулярной
массы смеси будем иметь
Изуравнения
Менделеева-Клапейрона, для смеси газов,
объем сосуда равен:
Подставляячисленные
значения в системе СИнаходиммолекулярную
массу смеси:
и объем сосуда
1.1.12.
Для получения хорошего вакуума в
стеклянном сосуде необходимо прогревать
стенки сосуда при откачке для удаления,
адсорбированного газа. На сколько может
повыситься давление в сферическом
сосуде радиусом 10 см, если адсорбированные
молекулы перейдут со стенок в сосуд?
Площадь поперечного сечения молекул
So==10-19
м2.
Температура газа в сосуде 300 oС.
Слой молекул на стенках считать
мономолекулярным.
Решение.
Для определения давления воспользуемся
основным уравнением молекулярно-кинетической
теории в виде
p=nokT,
где
no
– число молекул в единице объема;
k
– постоянная Больцмана;
Т
– абсолютная температура газа.
С учетом того, что
no=N/V,
где
N
– число молекул в объеме V,
для давления имеем
Поусловиюзадачи
слой молекул в сосуде мономолекулярный,
следовательно число молекул в нем можно
определить исходя из соображений:
где
S=4r2
– площадь поверхности сосуда;
So
– площадь поперечного сечения молекул
газа.
Так
как сосуд сферический, то его объем
V=4/3r3.
Таким образом,
окончательно для давления газа в сосуде
будем иметь соотношение:
Подставляячисленные
значения в полученноесоотношение в
системе СИ определяем давление газа в
сосуде
1.1.13.
В воздухе содержится 23,6 % кислорода и
76,4 % азота (по массе) при давлении 100 кПа
и температуре 13 oС.
Найти плотность воздуха и парциальные
давления кислорода и азота.
Решение.
Для определения плотности воздуха
воспользуемся уравнением Менделеева-Клапейрона
откуда
а
.
Для
определения парциальных давлений также
воспользуемся уравнением
Менделеева-Клапейрона, записанным для
каждого из компонентов, входящих в смесь
воздуха:
где
V
– объем воздуха.
Откуда
Так
как =m/V,
то V=m/,
следовательно
Подставляячисленные
значения в системе СИ для плотности
воздуха и парциальных давлений кислорода
иазота будем иметь:
1.1.14.
В сосуде находится количество =10-7
моль кислорода и масса m2==10-6
г азота. Температура смеси 100 oС,
давление в сосуде p=133
мПа. Найти объем сосуда, парциальные
давления кислорода и азота и число
молекул в единице объема.
Решение.
Для решения задачи воспользуемся
уравнением Менделеева-Клапейрона,
записанным для смеси газов в виде
где
см=1+1=(1+m2/2)
– число молей или киломолей газов
составляющих смесь.
Имеем
pV=(1+m2/2)
RT.
Отсюда
V=(1+m2/2)
(RT/p).
Парциальные
давления компонентов образующих смесь
определяем так же из уравнения
Менделеева-Клапейрона, записанным для
каждого из газов
p1V=1RT
и p2V
=(m2/2)RT.
Откуда
для парциальных давлений кислорода и
азота соответственно имеем
p1=1RT/V;
p2=m2RT/2V.
Для
определения числа молекул в единице
объема необходимо воспользоваться
основным уравнением молекулярно-кинетической
теории для давления
p=nokT.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание
- Как найти плотность кислорода после расширения
- Плотность кислорода
- Плотность кислорода и другие его физические свойства
- Распространенность кислорода в природе
- Краткое описание химических свойств и плотность кислорода
- Примеры решения задач
- Кислород физические свойства
- Плотность, теплоемкость, свойства кислорода O2
- Получение кислорода
- Теплопроводность кислорода в жидком и газообразном состояниях
- Применение при сварке и резке
- Теплопроводность кислорода при высоких температурах
- История открытия
- Теплопроводность жидкого кислорода на линии насыщения
Как найти плотность кислорода после расширения
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Масса m = 10 г кислорода находится при давлении р = 304 кПа и температуре t1 = 10 °C. После расширения вследствие нагревания при постоянном давлении кислород занял объем V2 = 10 л. Найти объем V1 газа до расширения, температуру t2 газа после расширения, плотности ρ1 и ρ2 газа до и после расширения.
Уравнение Менделеева — Клапейрона
Объем V1 газа до расширения
Температура газа после нагревания при постоянном давлении
Ответ: 

Источник
Плотность кислорода
Плотность кислорода и другие его физические свойства
Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0 o C растворяют 4,9, а при 20 o C – 3,1 объема кислорода. Важнейшие константы кислорода представлены в таблице ниже:
Таблица 1. Физические свойства и плотность кислорода.
Температура плавления, o С
Энергия ионизации атома, эВ
Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500 o C она становится заметной.
Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Известны три аллотропные формы кислорода: кислород O2, озон O3 и крайне неустойчивый тетракислород O4.
Распространенность кислорода в природе
Кислород является самым распространенным элементом земной коры. В атмосфере его находится около 23% (масс.), в составе воды – около 89%, в человеческом организме – около 65%, в песке содержится 53% кислорода, в глине – 56% и т.д. Если подсчитать его количество в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твердой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50% их общей массы. Свободный кислород содержится почти исключительно в атмосфере, причем количество его оценивается в 1,2×10 15 т. При всей громадности этой величины она не превышает 0,0001 общего содержания кислорода в земной коре.
В связанном состоянии кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, встречающиеся в земной коре, содержат кислород. Кислород является составной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
Краткое описание химических свойств и плотность кислорода
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры. Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре. Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света. Такой процесс называется горением.
O2 + N2↔2NO (электрический разряд);
O2 + S = SO2 (сгорание на воздухе);
O2 + C = CO2 (600-700 o С, сжигание на воздухе);
O2 + 2Mg = 2MgO (сгорание на воздухе);
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
Примеры решения задач
| Задание | Найдите плотность по водороду смеси газов, в которой объемная доля кислорода составляет 20%, водорода – 40%, остальное – сероводород H2S. |
| Решение | Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси: |
Mr conditional (mixture) = 0,2 × 32 + 0,4 × 2 + 0,4 × 34 = 6,4 + 0,8 + 13,6 = 20,8.
Найдем относительную плотность смеси по водороду:
Ответ Плотность по водороду смеси, состоящей из кислорода, водорода и сероводорода равна 10,4.
| Задание | Найдите плотность по кислороду смеси, состоящей из 5 л метана и 20 л неона. |
| Решение | Найдем объемные доли веществ в смеси: |
j (CH4) = 5 / (5 + 20) = 5 / 25 = 0,2.
j (Ne) = 20 / (5 + 20) = 20 / 25 = 0,8.
Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси:
Mr conditional (mixture) = 0,2 × 16 + 0,8 × 20 = 3,2 + 16 = 19,2.
Найдем относительную плотность смеси по кислороду:
Источник
Кислород физические свойства
Кислород (при нормальных условиях) – бесцветный газ без вкуса и запаха, активно поддерживающий процесс горения. Немного тяжелее воздуха, его плотность при 0°С и давлении 760 мм рт. ст. составляет 1,43 кг/м3. Мало растворим в воде и спирте.
При охлаждении до -183°С и давлении 760 мм рт. ст. кислород превращается в бледно-голубую жидкость без запаха, а при -218,8°С – замерзает.
Кислород наиболее распространен на Земле. В земной коре (около 47% по массе) существует в связанном виде, в атмосфере (около 23% по массе) – в свободном.
Основные способы получения кислорода:
- Из воздуха путем его очищения от механических примесей, влаги и углекислоты, сжатия в компрессорах, охлаждения до сжижения и последующего разделения на кислород и азот при медленном повышении температуры: азот, имеющий меньшую температуру кипения, испаряется и отводится в окружающую среду, а кислород накапливается в жидком виде (криогенная ректификация);
- Электролизом дистиллированной воды, протекающим по формальной реакции: 2H2O → O2↑ + 2H2↑ ; поскольку чистая вода практически не проводит ток, в нее добавляются электролиты, например, KOH или NaOH;
- В лабораторных условиях – каталитическое разложение пероксида водорода H2O2, разложение нагреванием оксидов тяжелых металлов (например, оксида ртути HgO), перманганата калия KMnO4, хлората калия KClO3 и др.
Кислород газообразный технический, согласно ГОСТ 5583-78, выпускается двух сортов: первого и второго. Баллон с кислородом окрашен в голубой цвет, с надписью «Кислород» черного цвета (ПБ 10-115-96, ГОСТ 949-73). Номинальное давление газообразного кислорода в баллоне и автореципиенте при 20°С (ГОСТ 5583-78) составляет 150 кгс/см2 (14,7 МПа) или 200 кгс/см2 (19,6 МПа).
Плотность, теплоемкость, свойства кислорода O2
В таблице представлены теплофизические свойства кислорода такие, как плотность, энтальпия, энтропия, удельная теплоемкость, динамическая вязкость, коэффициент теплопроводности. Свойства в таблице даны для газообразного кислорода, находящегося при атмосферном давлении, в зависимости от температуры в интервале от 100 до 1300 К.
Плотность кислорода равна 1,329 кг/м3при комнатной температуре. При нагревании кислорода, его плотность уменьшается. Теплопроводность кислорода равна 0,0258 Вт/(м·град) при комнатной температуре и при повышении температуры этого газа увеличивается.
Удельная теплоемкость кислорода при комнатной температуре равна 919 Дж/(кг·град). Теплоемкость кислорода увеличивается при росте его температуры. Также при нагревании кислорода увеличиваются значения таких его свойств, как энтальпия, энтропия и вязкость.
Примечание: будьте внимательны! Теплопроводность в таблице указана в степени 102. Не забудьте разделить на 100.
Получение кислорода
Получают кислород несколькими способами. В лаборатории кислород получают из Кислородсодержащих веществ, которые могут легко его отщеплять, например из перманганата калия КМnO4 (рис. 41) или из бертолетовой соли КСlO3: 2КМnО4 = K2MnO4 + МnО2 + O2↑
2КСlO3 = 2КСl + O2↑ При получении кислорода из бертолетовой соли для ускорения реакции должен присутствовать катализатор — двуокись марганца. Катализатор ускоряет разложение и делает его более равномерным. Без катализатора может
Рис. 41. Прибор для получения кислорода лабораторный способом из перманганата калия. 1 — перманганат калия; 2 — кислород; 3 — вата; 4 — цилиндр — сборник.
произойти взрыв, если бертолетова соль взята в большом количестве и особенно если она загрязнена органическими веществами. Из перекиси водорода кислород получают также в присутствии катализатора — двуокиси марганца МnО2 по уравнению: 2Н2O2[МnО2] = 2Н2O + О2
■ 17. Зачем при разложении бертолетовой соли добавляют МnО2? (См. Ответ) 18. Образующийся при разложении КМnO4 кислород можно собирать над водой. Отразите это в схеме прибора. 19. Иногда при отсутствии в лаборатории двуокиси марганца вместо нее в бертолетову соль добавляют немного остатка после прокаливания перманганата калия. Почему возможна такая замена? 20. Какой объем кислорода выделится при разложении 5 молей бертолетовой соли? (См. Ответ)
Кислород может быть получен также разложением Нитратов при нагревании выше температуры плавления: 2KNO3 = 2KNO2 + О2 В промышленности кислород получают в основном из жидкого воздуха. Переведенный в жидкое состояние воздух подвергают испарению. Сначала улетучивается азот (его температура кипения — 195,8°), а кислород остается (его температура кипения —183°). Этим способом кислород получается почти в чистом виде. Иногда при наличии дешевой электроэнергии кислород получают электролизом воды: Н2O ⇄ Н+ + OН— Н+ + е— → Н0 на катоде 2ОН— — е— → H2O + О; 2О = О2 на аноде
■ 21. Перечислите известные вам лабораторные и промышленные способы получения кислорода. Запищите их в тетрадь, сопровождая каждый способ уравнением реакции. (См. Ответ) 22. Являются ли реакции, используемые для получения кислорода, окислительно-восстановительными? Дайте обоснованный ответ. 23. Взято по 10 г следующих веществ; перманганата калия, бертолетовой соли, нитрата калия. В каком случае удастся получить наибольший объем кислорода? 24. В кислороде, полученном при нагревании 20 г перманганата калия, сожгли 1 г угля. Какой процент перманганата подвергся разложению? (См. Ответ)
Теплопроводность кислорода в жидком и газообразном состояниях
В таблице приведены значения коэффициента теплопроводности кислорода в жидком и газообразном состояниях при различных температурах и давлениях. Теплопроводность указана в интервале температуры от 80 до 1400 К и давления от 1 до 600 атм.
Значения теплопроводности в таблице, находящиеся выше черты, относятся к жидкому кислороду, а ниже ее — к газообразному. По данным таблицы видно, что теплопроводность жидкого кислорода выше, чем газообразного и при росте давления увеличивается.
Примечание: Будьте внимательны! Теплопроводность в таблице дана в степени 103. Не забудьте разделить на 1000. Размерность Вт/(м·град).
Применение при сварке и резке
Кислород – важнейший газ для сварки и резки. При сжигании горючего газа в воздухе образуется пламя с температурой не более 2000°C, а в технически чистом кислороде она может превышать 2500–3000°C. Именно такая температура пламени практически пригодна для сварки многих металлов.
При газопламенной обработке обычно используется кислород с объемным содержанием 99,2–99,5% и выше. Для неответственных видов газовой сварки, пайки, поверхностной закалки и других способов нагрева газовым пламенем может применяться кислород чистотой 92–98%.
Для сварки и резки используют кислород в газообразном виде, поступающий от баллона, газификационной установки (СГУ-1, СГУ-4, СГУ-7К, СГУ-8К, ГХ-0,75, ГХК-3 и др.) или автономной станции (КГСН-150, К-0,15, К-0,4, К-0,5 и др.). При значительных объемах потребления кислород безопаснее и экономически целесообразнее хранить и транспортировать в жидком, а не газообразном виде, несмотря на неизбежные потери при испарении сжиженного газа.
Превращение жидкого кислорода в газообразный осуществляется в газификационных установках – насосных или безнасосных. Примером насосной установки может служить стационарная установка АГУ-2М, предназначенная для газификации непереохлажденного кислорода и наполнения реципиентов и баллонов под давлением до 240 кгс/см2 (24 МПа).
При испарении 1 л жидкого кислорода образуется около 860 л газообразного (при нормальном атмосферном давлении и температуре 20°С). При транспортировке жидкого кислорода масса тары, приходящаяся на 1кг кислорода, в 10 и более раз меньше, чем при транспортировке газообразного. При хранении, перевозке и газификации сжиженного газа неизбежны потери на его испарение.
Расчета объема газообразного кислорода в баллоне.
Для расчета объема газообразного кислорода в баллоне в м3 при нормальных условиях используют формулу (ГОСТ 5583-78):
где K1 – коэффициент, Vб – вместимость баллона в дм3 (л).
Некоторые значения коэффициента K1 для расчета объема газообразного кислорода при нормальных условиях
| t газа в бал- лоне, °С | Значение K1 при избыточном давлении, кгс/см2 (МПа) | |||||||||||
| 140 (13,7) | 145 (14,2) | 150 (14,7) | 155 (15,2) | 160 (15,7) | 165 (16,2) | 170 (16,7) | 175 (17,2) | 180 (17,7) | 185 (18,1) | 190 (18,6) | 195 (19,1) | |
| -50 | 0,232 | 0,242 | 0,251 | 0,260 | 0,269 | 0,278 | 0,286 | 0,296 | 0,303 | 0,311 | 0,319 | 0,327 |
| -40 | 0,212 | 0,221 | 0,229 | 0,236 | 0,245 | 0,253 | 0,260 | 0,269 | 0,275 | 0,284 | 0,290 | 0,298 |
| -30 | 0,195 | 0,202 | 0,211 | 0,217 | 0,225 | 0,232 | 0,239 | 0,248 | 0,253 | 0,261 | 0,267 | 0,274 |
| -20 | 0,182 | 0,188 | 0,195 | 0,202 | 0,209 | 0,215 | 0,222 | 0,229 | 0,235 | 0,242 | 0,248 | 0,255 |
| -10 | 0,171 | 0,177 | 0,183 | 0,189 | 0,195 | 0,202 | 0,208 | 0,214 | 0,220 | 0,226 | 0,232 | 0,238 |
| 0 | 0,161 | 0,167 | 0,172 | 0,179 | 0,184 | 0,190 | 0,196 | 0,201 | 0,207 | 0,213 | 0,219 | 0,224 |
| +10 | 0,153 | 0,158 | 0,163 | 0,169 | 0,174 | 0,180 | 0,185 | 0,191 | 0,196 | 0,201 | 0,206 | 0,211 |
| +20 | 0,145 | 0,150 | 0,156 | 0,160 | 0,166 | 0,171 | 0,176 | 0,181 | 0,186 | 0,191 | 0,196 | 0,201 |
| +30 | 0,139 | 0,143 | 0,148 | 0,153 | 0,158 | 0,163 | 0,168 | 0,173 | 0,177 | 0,182 | 0,187 | 0,192 |
| +40 | 0,133 | 0,137 | 0,142 | 0,147 | 0,151 | 0,156 | 0,160 | 0,165 | 0,170 | 0,174 | 0,178 | 0,183 |
| +50 | 0,127 | 0,132 | 0,136 | 0,141 | 0,145 | 0,149 | 0,154 | 0,158 | 0,163 | 0,167 | 0,171 | 0,175 |
Характеристики марок газообразного технического кислорода (ГОСТ 5583-78)
| Параметр | Кислород газообразный технический | |
| Первого сорта | Второго сорта | |
| Объемная доля кислорода O2, %, не менее | 99,7 | 99,5 (в ряде случаев – 99,2) |
| Объемная доля водяных паров, %, не более | 0,007 | 0,009 |
| Объемная доля водорода H2, %, не более (только для кислорода, полученного электролизом воды) | 0,3 | 0,5 |
| Содержание углекислоты CO2, окиси углерода CO, газообразных кислот и оснований, озона O3 и других газов-окислителей | Не нормируется | |
| Содержание щелочи (только для кислорода, полученного электролизом воды) | Кусок фильтровальной бумаги (смоченный раствором фенолфталеина, разбавленного водой в соотношении 1:10) в стеклянной трубке с пропускаемым кислородом (0,1–0,2 дм3/мин в течение 8–10 минут) не должен окраситься в красный или розовый цвет | |
| Запах | Не нормируется |
Теплопроводность кислорода при высоких температурах
В таблице даны значения коэффициента теплопроводности кислорода при высоких температурах (от 1600 до 6000 К) и давлении от 0,001 до 100 атм.
При температурах выше 1300°С кислород начинает диссоциировать, и при некотором давлении его теплопроводность достигает максимальных значений. По данным таблицы видно, что теплопроводность диссоциированного кислорода при высоких температурах может достигать величин до 3,73 Вт/(м·град).
Примечание: Будьте внимательны! Теплопроводность в таблице дана в степени 103. Не забудьте разделить на 1000.
История открытия
Схема атома кислорода
Официально считается, что кислород был открыт английским химиком Джозефом Пристли первого августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Теплопроводность жидкого кислорода на линии насыщения
В таблице указаны значения коэффициента теплопроводности жидкого кислорода на линии насыщения. Теплопроводность дана в диапазоне температуры от 90 до 150 К. Следует отметить, что теплопроводность жидкого кислорода при увеличении температуры снижается.
Примечание: Будьте внимательны! Теплопроводность в таблице дана в степени 103. Не забудьте разделить на 1000.
Источники: 1. Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. 2. Чиркин В.С. Теплофизические свойства материалов ядерной техники.
Источник