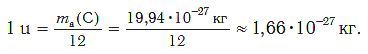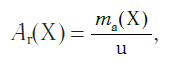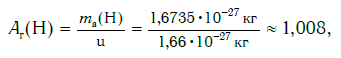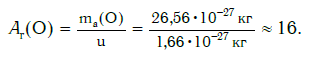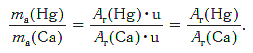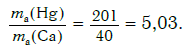Если
посмотреть в периодическую таблицу Д. И. Менделеева, то можно заметить, что все
элементы в ней расположены в клетках. В таких клетках изображён знак
химического элемента, его название. Вверху клетки указан порядковый, или
атомный, номер. Над символом элемента – его название.
Например,
рассмотрим клетку, где расположен элемент сера. Здесь указано название
элемента, его символ. Вверху стоит число 16. А что же обозначает нижнее число
32,064?
Это
число называется относительной атомной массой. Как известно, важным
свойством атомов является их масса, она выражается в граммах, киллограммах, миллиграммах.
Ещё в девятнадцатом веке, когда все учёные наконец-то приняли
атомно- молекулярное учение (то есть было доказано, что вещества состоят
из молекул и атомов), были рассчитаны атомные массы химических элементов.
Эти массы оказались очень маленькими. Это и понятно, ведь атомы
настолько малы, что их не увидишь даже в самые мощные микроскопы.
Для
удобства массы атомов химических элементов сравнивают с массой атома самого
лёгкого химического элемента – водорода. Масса атома водорода равна 1. Поэтому
можно сказать, что масса атома серы в 32 раза больше массы атома водорода.
То
есть относительная атомная масса – это величина, которая показывает, во
сколько раз масса атома данного химического элемента больше массы атома
водорода.
Относительную
атомную массу обозначают символом Ar, где буква r – это первая буква английского слова
relative,
что означает «относительный».
Все
значения относительных атомных масс округляют до целого значения по всем
правилам округления. Единственным исключением является элемент хлор, у которого
относительная атомная масса равна 35,5. Так, относительная атомная масса
кислорода – 16, азота – 14, углерода – 12, железа – 56, меди – 64, фтора – 19,
алюминия – 27, цинка – 65, фосфора – 31, брома – 80.
Как
вы могли заметить, относительная атомная масса является безразмерной
величиной.
Как
и атомы, молекулы обладают массой. Для того, чтобы найти их массу, нужно
сложить массы всех атомов, которые входят в состав молекулы.
То
есть относительная молекулярная масса – это сумма относительных атомных
масс атомов, входящих в состав молекул.
Например,
определим относительную молекулярную массу воды – Н2О. Для этого
относительную атомную массу водорода умножаем на 2, так как в молекуле 2 атома
водорода, на что нам указывает индекс. Затем складываем относительную атомную
массу водорода с относительной атомной массой кислорода. Подставляем значения и
получаем результат – 18.
Mr
(H2O) = Ar (H) · 2 + Ar (O) = 1 · 2 + 16 = 18
Понятие
«относительная молекулярная масса» справедливо только для веществ молекулярного
строения, если же вещество состоит из атомов или ионов, тогда вместо
относительной молекулярной массы говорят об относительной формульной массе.
Определим
относительную молекулярную массу углекислого газа – СО2. Для этого
относительную атомную массу углерода складываем с относительной атомной массой
кислорода, умноженной на два, так как в молекуле 2 атома кислорода. Подставляем
значения относительных атомных масс: 12 складываем с 32 и получаем 44.
Mr
(CO2)
= Ar
(C)
+ Ar
(O)
· 2 = 12 + 16 · 2 = 44
Найдём
относительную формульную массу NaNO3.
Для этого относительную атомную массу натрия складываем с относительной атомной
массой азота и относительной атомной массой кислорода, умноженной на три.
Подставляем значения относительных атомных масс и получаем 85.
Mr
(NaNO3)
= Ar
(Na)
+ Ar
(N)
+ Ar
(O)
· 3 = 23 + 14 + 16 · 3 = 85
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
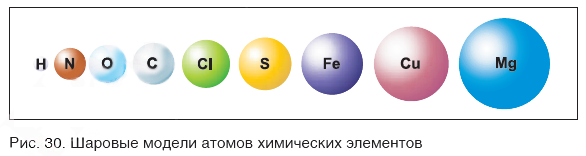
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
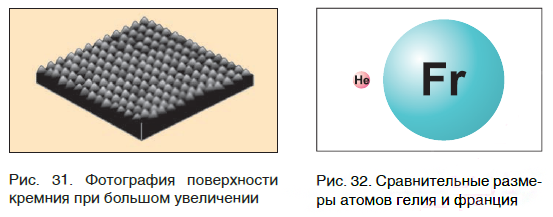
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
а кислорода:
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Абсолютная (истинная) атомная масса (ma) выражается в граммах или килограммах.
Масса атома водорода ma(Н)=1,67 х 10-24г
Масса атома кислорода ma(О)=2,66 х 10-23г
Пользоваться такими числами неудобно. Поэтому вместо абсолютных значений атомных масс применяют относительные атомные массы.
Относительная атомная масса (Ar) показывает, во сколько раз масса данного атома больше массы 1/12 массы атома углерода. Это безразмерная величина (не имеет единиц измерения).
1/12 массы атома углерода принята за эталон.
Ar = ma/ mэталона
Атомная единица массы (а.е.м.) – это 1/12 часть массы атома углерода.
1 а.е.м.= ma(С) / 12 = 1,99 х 10-23г /12 = 1,66 х 10-24г = 1,66 х 10-27кг
1 а.е.м.= 1,66 х 10-27кг
Относительную атомную массу (Ar) любого элемента можно вычислить по формуле:
Ar(Х) = ma(Х)/ 1а.е.м.
В ПСХЭ указаны относительные атомные массы элементов
(По таблице Менделеева добавляем массы записанных элементов)
H (аш) – водород, Ar (H) = 1
Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.
Для измерения массы атома используется относительная атомная масса, которая выражается в атомных единицах массы (а. е. м.). Относительная молекулярная масса складывается из относительных атомных масс веществ.
Содержание
- 1 Относительная молекулярная масса
- 2 Относительная формульная масса
- 3 Как определить массу молекулы?
- 4 Понятия
- 5 Как рассчитать
- 6 Тест по теме
-
- 6.0.1 Оценка доклада
-
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Как определить массу молекулы?
Хотя идеи о том, что все вещества состоят из мельчайших частиц, то есть атомов, высказывались ещё Демокритом в Античности, доказать подобные гипотезы было невозможно. Однако в начале XIX в. произошел научный прорыв. Джон Дальтон открыл сразу три важных закона:
- закон кратных отношений;
- закон парциальных давлений;
- закон растворимости газов в жидкостях.
Объяснить открытые закономерности можно было только с помощью гипотезы об атомной строении вещества. Эти же законы позволяли Дальтону сравнивать массы атомов и молекул между собой. Ученый принял массу атома водорода за единицу (так как он оказался самым легким атомом), и через нее (то есть через водородную единицу) в 1803 г. выразил массы многих других атомов и молекул. Впрочем, оказалось, что значительная часть вычислений была проведена с ошибками.
На тот момент для определения масс атомов чаще всего использовались реакции образования оксидов, то есть кислородных соединений. По этой причине в ходе опытов фактически в качестве единицы измерения использовалась масса не атома водорода, а атома кислорода. Изначально грубые расчеты показывали, что кислородный атом в 16 раз тяжелее водородного атома, то есть его масса, по системе Дальтона, составляла 16 единиц. Однако потом выяснилось, что всё же атом кислорода тяжелее только в 15,874 раза. Эти данные потребовали пересчета всех атомных масс. Но химики поступили проще – они договорились, что теперь масса кислородного атома принимается в точности равной 16 атомным единицам. Так возникла новая, кислородная единицы атомного веса. В результате пересчитывать пришлось лишь массу водорода – она теперь составляла не единицу, а 16:15,874≈ 1,0079 атомных единиц.
Уже в начале XX в. выяснилось, что в природе могут существовать изотопы – разные по массе атомы одного и того же элемента. В частности, в природе встречается три различных стабильных изотопов кислорода (и ещё 10 – нестабильных). Встал вопрос – масса какого из этих изотопов будет приниматься за единицу? Физики стали использовать массу изотопа кислород-16, а химики – среднюю массу всех изотопов (с учетом их распространенности в природном кислороде). Возникли разночтения, которые были решены лишь в 1960-1961 г. Тогда была принята договоренность, что масса изотопа углерода-12 принимается равной 12 атомным единицам массы (а. е. м.). Таким образом появилась углеродная единица.
Понятия
Для осознания, что такое относительная атомная масса в химии, следует понимать, что абсолютная масса атома слишком мала, чтобы выражать её в граммах, а тем более в килограммах. Поэтому в современной химии за атомную единицу массы (а. е. м.) взята 1/12 часть массы углерода. Относительная атомная масса равна отношению абсолютной массы к 1/12 абсолютной массы углерода. Другими словами относительная масса отражает, во сколько раз масса атома конкретного вещества превышает 1/12 массы атома углерода. Например, относительная масса азота – 14, т.е. атом азота содержит 14 а. е. м. или в 14 раз больше, чем 1/12 часть атома углерода.
Рис. 1. Атомы и молекулы.
Среди всех элементов водород самый лёгкий, его масса равна 1 единице. Самые тяжёлые атомы имеют массу в 300 а. е. м.
Молекулярная масса – значение, показывающее, во сколько раз масса молекулы превышает 1/12 часть массы углерода. Также выражается в а. е. м. Масса молекулы складывается из массы атомов, поэтому для вычисления относительной молекулярной массы необходимо сложить значения масс атомов вещества. Например, относительная молекулярная масса воды равна 18. Это значение складывается из относительных атомных масс двух атомов водорода (2) и одного атома кислорода (16).
Рис. 2. Углерод в периодической таблице.
Как видно, эти два понятия имеют несколько общих характеристик:
- относительная атомная и молекулярная массы вещества – безразмерные величины;
- относительная атомная масса имеет обозначение Ar, молекулярная – Mr;
- единица измерения одинакова в обоих случаях – а. е. м.
Молярная и молекулярная массы совпадают численно, но отличаются по размерности. Молярная масса – это отношение массы вещества к количеству молей. Она отражает массу одного моля, который равен числу Авогадро, т.е. 6,02 ⋅ 10
23
. Например, 1 моль воды весит 18 г/моль, а Mr(Н2О) = 18 а. е. м. (тяжелее в 18 раз одной атомной единицы массы).
Как рассчитать
Чтобы выразить относительную атомную массу математически, следует определить, что 1/2 часть углерода или одна атомная единица массы равна 1,66⋅10
−24
г. Следовательно, формула относительной атомной массы имеет следующий вид:
Ar(X) = ma(X) / 1,66⋅10
−24
,
где ma – абсолютная атомная масса вещества.
Относительная атомная масса химических элементов указана в периодической таблице Менделеева, поэтому её не нужно рассчитывать самостоятельно при решении задач. Относительные атомные массы принято округлять до целых. Исключение составляет хлор. Масса его атомов равна 35,5.
Следует обратить внимание, что при расчёте относительной атомной массы элементов, имеющих изотопы, учитывается их среднее значение. Атомная масса в этом случае высчитывается следующим образом:
Ar = ΣAr,ini,
где Ar,i – относительная атомная масса изотопов, ni – содержание изотопов в природных смесях.
Например, кислород имеет три изотопа –
16
О,
17
О,
18
О. Их относительная масса равна 15,995, 16,999, 17,999, а их содержание в природных смесях – 99,759 %, 0,037 %, 0,204 % соответственно. Поделив проценты на 100 и подставив значения, получим:
Ar = 15,995 ∙ 0,99759 + 16,999 ∙ 0,00037 + 17,999 ∙ 0,00204 = 15,999 а.е.м.
Обратившись к периодической таблице, легко найти это значение в клетке кислорода.
Рис. 3. Таблица Менделеева.
Относительная молекулярная масса – сумма масс атомов вещества:
Mr = ΣAr.
При определении значения относительной молекулярной массы учитываются индексы символов. Например, вычисление массы H2CO3 выглядит следующим образом:
Mr = 1 ∙ 2 + 12 + 16 ∙ 3 = 62 а. е. м.
Зная относительную молекулярную массу, можно вычислить относительную плотность одного газа по второму, т.е. определить, во сколько раз одно газообразное вещество тяжелее второго. Для этого используется уравнение D(y)x = Mr(х) / Mr(y).
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
Захар Харитонов
10/10
-
Александр Котков
10/10
-
Евгения Медникова
10/10
-
Александр Котков
10/10
-
Сергей Ефремов
9/10
-
Сергей Макаров
10/10
-
Вася Загайнов
9/10
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 690.
|
Поделитесь в соц.сетях: |
Оцените статью:
|