КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДИСПЕРСНЫХ СИСТЕМ в коллоидной химии
Коллоидная химия — это наука о физико-химических свойствах дисперсных систем и поверхностных явлениях. Вследствие исключительно большой роли коллоидных систем и коллоидно-химических процессов в различных областях техники и человеческой деятельности и благодаря накоплению теоретического и практического материала, она выделилась в самостоятельную научную дисциплину. Объектами ее изучения являются гетерофазные системы, в которых одна из фаз находится в высокодисперсном (раздробленном) состоянии.
Трудно назвать какую-либо сферу человеческой деятельности, в которой бы не использовались коллоидные системы или коллоидные процессы. Поверхностные явления (смачивание, адгезия, адсорбция, коагуляция, седиментация и др.) лежат в основе таких процессов химической технологии, как измельчение, гранулирование, сушка, фильтрация, флотация, спекание, склеивание, крашение. К наиболее распространенным дисперсным системам относят дымы и туманы, эмульсии, пены, суспензии, порошки, ныли, гели. Дисперсными системами являются продукты питания, лекарства, биологоческие ткани. В мире каждый год производится сотни миллионов тонн дисперсных веществ и материалов. Знание закономерностей, присущих дисперсным системам, необходимо не только для оптимизации технологических процессов, но и при получении материалов с заданными свойствами, а также при решении задач охраны окружающей среды.
Определение размера частиц и удельной поверхности
Дисперсные системы всегда гетерогенные (гетерофазные). Они состоят из дисперсной фазы и дисперсионной среды.
Объектам изучения коллоидной химии присущи два основных признака:
- гетерогенность или многофазность (качественный признак).
- дисперсность (количественный признак) определяется размерами частиц в трех измерениях.
Основные характеристики, используемые для описания дисперсных систем:
- Характеристический размер частиц — а; [м]. Для сферических частиц это диаметр сферы d, для кубических — ребро куба.
- Дисперсность (раздробленность) D — это величина, обратная наименьшему размеру частиц.
3. Удельная поверхность Sуд. — это межфазная поверхность (S1,2,), приходящаяся на единицу объема дисперсной фазы (V) или ее массы (т).
Рассмотрим, как определяется удельная поверхность: если система состоит из п частиц, то
Коэффициенты формы для сферических, кубических частиц к = 6, для пленок к = 2, для волокон к = 4.
С увеличением дисперсности или уменьшением размера частиц возрастает удельная поверхность.
Методы получения дисперсных систем
Для получения дисперсных систем используют две группы методов: диспергационные и конденсационные (табл. 1.1).
Диспергирование — метод получения дисперсных систем путем измельчения или дробления конденсированного тела.
Конденсация — метод получения дисперсных систем за счет объединения или агрегатирования молекул, или ионов вещества.
Дробление веществ до частиц малых размеров требует большой затраты работы, так как поверхность раздела между фазами в таких системах весьма велика. Однако с помощью механических методов диспергирования даже в присутствии стабилизаторов практически невозможно получение частиц с размерами менее 100 нм. В случае диспергирования одной жидкости в другой (несмешивающейся с первой) процесс называется эмульгирование.м. И в этом случае требуется почти обязательное присутствие в системе веществ — эмульгаторов, стабилизирующих ее дисперсный состав (поверхностно-активных веществ, полимеров, порошков). Таким образом, обычно получают частицы радиусом не меньше 500 нм.
Более высокая дисперсность системы может быть достигнута при использовании мегодов, основанных на агрегации атомов и молекул, т. е. методов конденсации. Именно эти методы чаще всего используются для получения истинно-коллоидных растворов.
Образование дисперсных систем при использовании конденсационных методов происходит в результате либо гетерогенного зарождения, когда возникновение новой фазы осуществляется на уже имеющихся поверхностях (стенках сосуда, частицах посторонних веществ — ядрах конденсации), либо на поверхностях зародышей, возникающих самопроизвольно в гомогенной среде.
Зародыши в этом случае могут возникать лишь при определенном критическом пересыщении раствора.
Степень пересыщения
Самопроизвольное возникновение ядер конденсации зависит от многих причин: химических свойств реагирующих веществ, от характера ассоциации атомов и молекул, вязкости среды, температуры и др.
Процесс образования дисперсной фазы при конденсации имеет две основные стадии:
- возникновение центров конденсации;
- рост зародышей.
Дисперсность получаемых коллоидных систем зависит от соотношения скорости образования зародышей (υ1) и скорости их роста (υ2). При малой скорости образования зародышей (υ1 < υ2), в системе образуется небольшое число достаточно крупных частиц. Если же скорость возникновения зародышей велика, а скорость их роста мала (υ1 > υ2) в системе, наоборот, возникает большое число мелких частиц. В этом случае образуются высокодисперсные золи, размер частиц в которых позволяет отнести их к коллоидным растворам.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1.1.
Методом механического диспергирования 5 г толуола в 1 л воды получена дисперсная система с частицами толуола шарообразной формы с радиусом 2,5 -10 7 м. Плотность толуола равна 0,867 г/см3.
Решение:
Определяем дисперсность системы D и удельную поверхность S уд
Рассчитываем общую поверхность частиц S и число частиц N в дисперсной системе.
Пример 1.2.
Дисперсность частиц коллоидного золота равна 108 м-1. Принимая частицы золота в виде кубиков, определите, какую поверхность S обш они могут покрыть, если их плотно уложить в один слой. Масса коллоидных частиц золота 1 г. Плотность золота равна 19,6 • 103 кг/м3.
Решение:
Пример 1.3.
Коллоидные частицы золота имеют дисперсность D = 108 м-1. Какой длины (L) будет нить, если 1 г кубиков золота расположить друг за другом. Плотность золота составляет 19,6 • 103 кг/м3.
Примеры решения задач и упражнений
1.
Рассчитать удельную поверхность частиц
золя золота, полученного в результате
дробления 0,5 г золота на частицы
шарообразной формы диаметром 7 нм и
плотностью 19,32 г/мл.
Решение:
Если раздробленные
частицы имеют шарообразную форму, то
удельную поверхность частиц определяем
по формуле (0).
Рассчитываем
радиус частицы золя золота:
Определяем объем,
занимаемый 0,5 г золота:
Удельная поверхность
раздробленных шарообразных частиц
золота равна:
Находим общую
площадь поверхности S
частиц золя золота:
S
=
SудV=
0,86·109·2,58·10–8
= 2,22 м2.
2.
Эритроциты человека имеют форму диска
диаметром 7,5 мкм и толщиной 1,6 мкм.
Вычислите эффективный радиус и удельную
поверхность эритроцитов.
Решение:
Эритроцит человека
приблизительно имеет форму диска (рис.
1), поэтому его площадь равна сумме двух
площадей круга и площади образующего
цилиндра
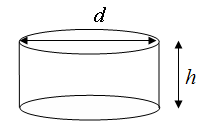
Рис. 1.
Схематическое изображение эритроцита
Задачи и упражнения для самостоятельного решения
1. Золь
коллоидной камфоры содержит в 1 мл 200
млн. сферических частиц камфоры диаметром
1,00∙10–4 см.
Найти общую площадь поверхности частиц
камфоры в 200 мл такого раствора.
(Ответ:
1,912∙104 см2)
2. Вычислите
удельную поверхность суспензии каолина
(плотность 2,5∙10–3
кг/м3),
если ее частицы считать шарообразными,
а средний диаметр частиц равным 0,5∙10–6
м. Суспензия монодисперсна.
(Ответ:
4,8·109
м2/кг)
3. Определите
удельную поверхность и суммарную площадь
поверхности частиц золя серебра,
полученного при дроблении 1,2 г серебра
на частицы шарообразной формы с диаметром
1,0·10–8 м.
Плотность серебра 10500 кг/м3
(Ответ:
6·10–8 м–1;
68,4 м2
)
4.
Аэрозоль получен распылением 0,5 кг угля
в 1 м3 воздуха.
Частицы аэрозоля имеют шарообразную
форму, диаметр частицы 8·10–5
м. Определите
удельную поверхность и число частиц в
этом аэрозоле. Плотность угля 1,8 кг/м3.
(Ответ:
0,75·105
м–1;
1,04·1023)
5.
Вычислите суммарную площадь поверхности
шарообразных частиц золя ртути с
диаметром 2,5·10–8
м. Золь
получен дроблением 5,2 г ртути. Плотность
ртути 13546 кг/м3.
(Ответ:
92,2 м2)
6.
Рассчитайте суммарную площадь поверхности
частиц золя сульфида мышьяка и число
частиц в 0,5 л золя, если 1 л золя содержит
2,25 г As2S3.
Частицы золя имеют форму кубиков с
длиной ребра 1,2·10–7
м. Плотность
As2S3
равна 3506
кг/ м3.
(Ответ:
16,0 м2,
1,85·1014)
7.
При дроблении 8,13 г металла на правильные
кубические частицы с длиной ребра 4·10–8
м получили
дисперсную систему, которая может
применяться в качестве адсорбента.
Рассчитать удельную и общую поверхность
адсорбента. Плотность металла 1,355·103
кг/м3.
(Ответ:
900 м2)
2.1.2. Классификация дисперсных систем
Дисперсные системы
в природе отличаются огромным
разнообразием, поэтому невозможно
составить для них единственную
классификацию.
Существуют общие признаки, которые
характерны для всех дисперсных систем,
и частные, распространяющиеся лишь на
отдельные виды этих систем.
Классифицировать
дисперсные системы можно на основе
следующих общих признаков:
-
агрегатное
состояние дисперсной фазы и дисперсионной
среды; -
размер и распределение
частиц дисперсной фазы по размерам; -
вид дисперсной
фазы.
Таблица 1.
Классификация дисперсных систем в
зависимости от размера частиц дисперсной
фазы (дисперсности)
|
Класс |
Размер частиц |
Дисперсность |
Примеры |
|
|
нм |
м |
м–1 |
||
|
Высоко дисперсные |
1 – 100 |
10–9 |
109 |
Золь H2SiO3 |
|
Средне дисперсные |
100 – 10000 |
10–7 |
107 |
Растворимый |
|
Грубо дисперсные |
>10000 |
>10–5 |
<105 |
Крупа, капли |
Классификация по
структурно-механическим свойствам
Все дисперсные
системы можно подразделить на два
класса: свободнодисперсные,
в которых частицы дисперсной фазы не
связаны между собой и могут свободно
перемещаться, взаимодействие является
слабым. Подобные системы характеризуются
текучестью (золи, эмульсии). В
связнодисперсных
системах
частицы дисперсной фазы соединены теми
или иными связями. В итоге они образуют
пространственные структуры – решетки,
сетки и т.д. – и текучесть системы
невелика (кремы, гели).
Таблица 2.
Классификация по структурно-механическим
свойствам
|
Класс дисперсных |
Характеристика |
Примеры |
|
Свободнодисперсные |
Дисперсная фаза |
Лиозоли, суспензии, |
|
Связнодисперсные |
Дисперсная фаза |
Лиогели, студни, |
Классификация по
характеру взаимодействия
дисперсной фазы
и дисперсионной среды
По характеру
взаимодействия между веществом дисперсной
фазы и веществом жидкой дисперсионной
средой различают лиофильные и лиофобные
дисперсные системы.
-
Лиофильные
дисперсные системы
– термодинамически
устойчивые системы, которые образуются
самопроизвольно при приведении в
контакт двух фаз, одна из которых будущая
дисперсная фаза, а другая – будущая
дисперсионная среда.
Система «олеат
натрия – вода» является лиофильной:
если поместить достаточное количество
кристаллов олеата натрия в воду, то
через некоторое время они самопроизвольно
диспергируются с образованием мутной
мицеллярной системы. В таких системах
сильно выражено взаимодействие молекул
дисперсной фазы и дисперсионной среды.
-
Лиофобные
дисперсные системы
– термодинамичеси
неустойчивые системы, которые не
образуются самопроизвольно при
приведении в контакт двух фаз, одна из
которых будущая дисперсная фаза, а
другая – будущая дисперсионная среда.
Система «кристаллы
иодида серебра – вода» является
лиофобной: если поместить в воду
достаточное количество кристаллов
иодида серебра, то самопроизвольное
диспергирование не происходит. В таких
системах взаимодействие молекул
дисперсной фазы и дисперсионной среды
выражено слабо.
Таблица 3.
Классификация по
агрегатному состоянию
дисперсной фазы
и дисперсионной среды
|
Дисперсная фаза |
Дисперсионная |
Условное |
Примеры дисперсных систем |
|
газ |
газ |
г/г |
Атмосфера Земли |
|
жидкость |
газ |
ж/г |
Туман, облака, |
|
твердое тело |
газ |
т/г |
Дым, пыль, порошки, |
|
газ |
жидкость |
г/ж |
Пены, газовые |
|
жидкость |
жидкость |
ж/ж |
Эмульсии (молоко, |
|
твердое тело |
жидкость |
т/ж |
Суспензии |
|
газ |
твердое тело |
г/т |
Твердые пены, |
|
жидкость |
твердое тело |
ж/т |
Жемчуг, минералы, |
|
твердое тело |
твердое тело |
т/т |
Цветные стекла, |
Частицы, которые
имеют размерность намного меньше, чем
10–10 м
становятся не заметными в микроскоп и
их реальные размеры определить не
удается.
Таблица 4.
Характеристика дисперсных систем по
виду дисперсной фазы
|
Дисперсная фаза |
Примеры систем |
|
|
Вид |
Характеристика |
|
|
Одномерная |
Пленки, мембраны |
Жидкие пленки |
|
Двухмерная |
Нити, волокна, |
Кожа, волосы, |
|
Трехмерная |
Капли, пузырьки, |
Мука, молоко, |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Общая площадь поверхности частиц Калькулятор
| Search | ||
| Дом | Инженерное дело ↺ | |
| Инженерное дело | Химическая инженерия ↺ | |
| Химическая инженерия | Механические операции ↺ | |
| Механические операции | Основы механической работы ↺ | |
| Основы механической работы | Основные формулы ↺ |
|
✖Площадь поверхности одной частицы — это общая площадь поверхности трехмерного объекта.ⓘ Площадь поверхности одной частицы [S] |
+10% -10% |
||
|
✖Количество частиц — это количество частиц, присутствующих в данном образце/смеси.ⓘ Количество частиц [Np] |
+10% -10% |
|
✖Площадь поверхности трехмерной фигуры равна сумме всех площадей поверхности каждой из сторон.ⓘ Общая площадь поверхности частиц [SA] |
⎘ копия |
Общая площадь поверхности частиц Решение
ШАГ 0: Сводка предварительного расчета
ШАГ 1. Преобразование входов в базовый блок
Площадь поверхности одной частицы: 10.8 Квадратный метр —> 10.8 Квадратный метр Конверсия не требуется
Количество частиц: 17 —> Конверсия не требуется
ШАГ 2: Оцените формулу
ШАГ 3: Преобразуйте результат в единицу вывода
183.6 Квадратный метр —> Конверсия не требуется
8 Основные формулы Калькуляторы
Общая площадь поверхности частиц формула
Площадь поверхности = Площадь поверхности одной частицы*Количество частиц
SA = S*Np
Общая площадь поверхности частиц
Общая площадь поверхности частиц — это общая площадь поверхности всех частиц, присутствующих в данной смеси.








