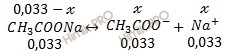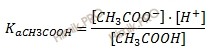Температура и объем смеси двух жидкостей
Предположим, что мы собрались смешать две жидкости разного объема и температуры. Какими же будут температура и объем смеси? Наш калькулятор поможет ответить на этот вопрос.
Для расчета заполняем окна ниже и нажимаем «Рассчитать». Я предлагаю вводить температуру в °С, а объем – в мл. Хотя при желании мы можем использовать и другие единицы измерений, главное – не использовать их вперемешку. Например, если ввели первый объем в литрах, то и второй вводим в литрах, и в результате тоже получаем литры.
Когда можно применять данный калькулятор
Использовать этот калькулятор мы будем только при смешивании безалкогольных жидкостей.
Температура и объем смеси из этилового спирта и воды с помощью данного калькулятора не вычисляются. Это связано с тем, что растворение этилового спирта в воде всегда происходит с выделением тепла, то есть температура смеси после соединения этилового спирта и воды будет заведомо больше расчетной.
Но это не значит, что данный калькулятор бесполезен в самогоноварении. Например, он будет нам хорошим помощником в приготовлении браги. Предположим, при подготовке браги нам нужно смешать воду комнатной температуры и сироп, нагретый для лучшего растворении сахара в воде. Мы знаем, что дрожжи нельзя вводить в смесь, температура которой превышает 30°С, иначе дрожжевые грибы могут погибнуть. Вводя в калькулятор объем и температуру смешиваемых компонентов, мы можем подобрать температуру, до которой следует нагревать сироп, чтобы температура смеси из воды и сиропа не превысила отметку в 30°С.
Так же на нашем сайте представлены другие калькуляторы:
Смешивание спиртов | Крепость и объем – сервис, позволяющий вычислить процент содержания спирта в смеси, состоящей из двух спиртов разной крепости и объема.
Разбавление спирта | Необходимый объем воды – сервис, позволяющий рассчитать, какой объем воды потребуется для разведения спирта до нужной крепости.
Спиртометр | Корректировка показаний спиртометра – сервис, позволяющий скорректировать показания спиртометра в зависимости от температуры раствора спирта.
Сколько самогона получится | Дробная перегонка спирта-сырца – сервис, позволяющий узнать, сколько самогона и сколько головных фракций получится при дробной перегонке спирта-сырца.
Объем сиропа: растворение сахара в воде – сервис для расчета объема сиропа, исходя из используемого объема воды и веса растворяемого сахара.
Смешение растворов
Вычислить pH раствора, полученного смешением растворов 10 миллилитров 0,1 М раствора уксусной кислоты (СН3СООН) и 5 миллилитров 0,1 М раствора гидроксида натрия (NaOH). Kа = 1,75 ⋅ 10–5.
Решение задачи
Рассчитаем объем раствора (V) после смешения растворов по формуле:
Получаем:
V = 10 + 5 = 15 (мл).
Вычислим концентрации компонентов после смешения растворов уксусной кислоты (СН3СООН) и гидроксида натрия (NaOH):
СМ (СН3СООН) = (Vисх. (СН3СООН) ⋅ СМ,исх.(СН3СООН)) / V = (10 ⋅ 0,1) / 15 = 0,066 (моль/л),
СМ (NaOH) = (Vисх. (NaOH) ⋅ СМ,исх.( NaOH)) / V = (5 ⋅ 0,1) / 15 = 0,033 (моль/л).
При смешении растворов протекает реакция:
Найдем концентрацию ацетата натрия (CH3COONa):
СМ (СН3СООNa) = 0,066 — 0,033 = 0,033 (моль/л).
В результате протекания реакции получили буферный раствор. Рассмотрим равновесия в буферном растворе:
Константа диссоциации слабой кислоты рассчитывается по формуле:
Найдем х:
1,75 ⋅ 10–5 = х ⋅ (0,033 + х) / 0,033 — х
Так как х << 0,033, то:
1,75 ⋅ 10–5 = х ⋅ 0,033 / 0,033 = х
Получаем:
[H+] = х = 1,74 ⋅ 10–5 (моль/л)
Вычислим рН раствора, полученного смешением растворов по формуле:
Получаем:
рН = -lg1,74 ⋅ 10–5 = 4,76
Ответ:
рН раствора после смешения растворов равен 4,76.
Похожие задачи
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Есть несколько
методов определения парциальных молярных величин. Если известна аналитическая
зависимость экстенсивной величины от количеств компонент, то парциальная
молярная величина может быть найдена аналитическим дифференцированием этой
зависимости, в соответствии с определением (4.9). Чаще приходится иметь дело с
графическими зависимостями, которые строят на основании экспериментальных
данных.
По «методу
отрезков», следует построить график в координатах xB (по
оси абсцисс) и Vm = V/n (по оси
ординат), где n = nA + nB – общее
количество вещества в бинарном растворе. (Величину Vm
называют средним молярным объёмом раствора). Этот график соответствует
уравнению
, (4.15)
которое получается делением (4.11) на n
= nA + nB. Затем к графику проводят касательную
при том значении xB, для которого требуется определить
парциальный молярный объём. Как можно вывести из (4.15), касательная отсекает
по оси Vm (при xB = 0) величину Vm
= VA, а при xB = 1 (на правой оси ординат)
она имеет ординату Vm = VВ.
Разновидностью
этого способа является построение графика зависимости объёма раствора,
содержащего 1 кг растворителя, от количества растворённого вещества nB.
В этом случае находят парциальный молярный объём растворенного вещества по
наклону касательной к этому графику при нужном значении nB.
Оба этих варианта
имеют тот недостаток, что в большинстве случаев график имеет только
незначительное отклонение от линейности, что затрудняет построение касательной.
Трудность можно избежать в другом методе, по которому строят зависимость
молярного объёма смешения от мольной доли одного из компонент. Объёмом
смешения называют разность между объёмом смеси и суммой объёмов чистых компонент:
,
где «звёздочка» в верхнем
индексе означает принадлежность величины к чистой фазе (нижний индекс m
означает молярную величину, как обычно). Молярным объёмом смешения
называют отношение этой величины к общему количеству раствора n = nA
+ nB: .
Касательная,
проведенная к любой точке этой зависимости, отсекает на оси ординат (при xB
= 0) величину . Из неё можно вычислить
парциальный молярный объём этого компонента, зная молярный объём чистой фазы
компонента А. Аналогично, парциальный молярный объём компонента В находят из
значения ординаты касательной при xB = 1.
В заключении
заметим, что у некоторых веществ объём смешения равен нулю. То есть, их
парциальные молярные объёмы в смеси равны молярным объёмам чистых компонент. В
отношении жидких смесей это явление обсуждается в следующих разделах (соответствующие
смеси или растворы называют идеальными). В отношении смесей идеальных газов это
свойство следует из их уравнения состояния. Для идеальной газовой смеси
компонент А и В уравнение состояния имеет вид V = (nA
+ nB)RT/p. По определению (4.9) для
компонента А получается:
=.
Аналогично для
компонента В.
4.3. Энтальпия
смешения и энтальпия растворения
Смешением называют процесс, в начальном
состоянии которого имеются только чистые вещества, каждое в своей фазе, а в конечном
состоянии – смесь этих веществ в одной фазе при тех же значениях р и Т.
В предыдущем разделе уже обсуждалось изменение объёма при смешении жидкостей. В
общем случае, оно не равно нулю из-за различия межмолекулярных взаимодействий в
растворе и в чистых компонентах. По этой же причине смешение или растворение,
обычно, сопровождается изменением энтальпии. В изобарной изотермической системе
величина этого изменения равна количеству теплоты, которым обменивается система
и окружающая среда. Поэтому, энтальпию смешения можно найти экспериментально с
помощью калориметра, как упоминалось в главе 2. Отношение энтальпии смешения к
количеству вещества в смеси называется молярной энтальпией смешения. Например,
для смешения компонент А и В: =.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание — внизу страницы.
Задача определения объема воды разных температур для смешивания и получения необходимой температуры довольно распространена в быту. Особенно она актуальна если в доме есть маленький (грудной) ребенок. Температура смеси для кормления должна быть определенной температуры — как правило это 36-37°C. Получают ее, как правило, смешиванием кипятка (вода при температуре 100°C) и воды, находящейся при комнатной температуре (18-24°C). Как определить сколько воды нужно взять для смешивания?
А если отключили воду и приходится греть ее на плите — как получить нужную температуру для купания малыша? На этот и многие другие вопросы по смешиванию воды (и других жидкостей) разных температур поможет ответить наш калькулятор. Достаточно измерить температуру холодной воды, а зная температуру кипятка и подставив нужный объем воды в калькулятор легко получить нужные пропорции для смешивания.
Калькулятор смешивания воды
Сколько воды надо смешать для получения нужной температуры
Пример расчета температуры смеси воды
Рассмотрим на простом примере. Вы хотите приготовить 150мл смеси для кормления ребенка, у вас есть кипяток и вода при комнатной температуре (22°C). Нужная температура смеси 37 градусов. Подставив данные в калькулятор мы получим, что для получения такого количества смеси при требуемой температуре нужно смешать 29мл кипятка и 121мл воды при комнатной температуре.
Калькулятор смеси воды разных температур
Еще одна задача на смешивание воды — определение итоговой температуры смеси и ее объема. Для ее решения воспользуйтесь вторым калькулятором ниже — просто введите известные данные и тут же получите результат.
Ваша оценка
[Оценок: 558 Средняя: 3.6]
Расчет объема воды разных температур при смешивании Автор admin средний рейтинг 3.6/5 — 558 рейтинги пользователей