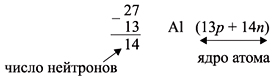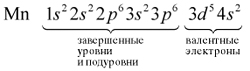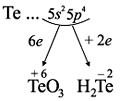Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13, 18, 23/2007
Глава 3. Элементарные сведения о
строении атома.
Периодический закон Д.И.Менделеева
В с п о м н и т е, что такое атом, из чего состоит
атом, изменяется ли атом в химических
реакциях.
Атом – это электронейтральная частица,
состоящая из положительно заряженного ядра и
отрицательно заряженных электронов.
Число электронов в ходе химических процессов
может изменяться, но заряд ядра всегда остается
неизменным. Зная распределение электронов в
атоме (строение атома), можно предсказать многие
свойства данного атома, а также свойства простых
и сложных веществ, в состав которых он входит.
Строение атома, т.е. состав ядра и распределение
электронов вокруг ядра, несложно определить по
положению элемента в периодической системе.
В периодической системе Д.И.Менделеева
химические элементы располагаются в
определенной последовательности. Эта
последовательность тесно связана со строением
атомов этих элементов. Каждому химическому
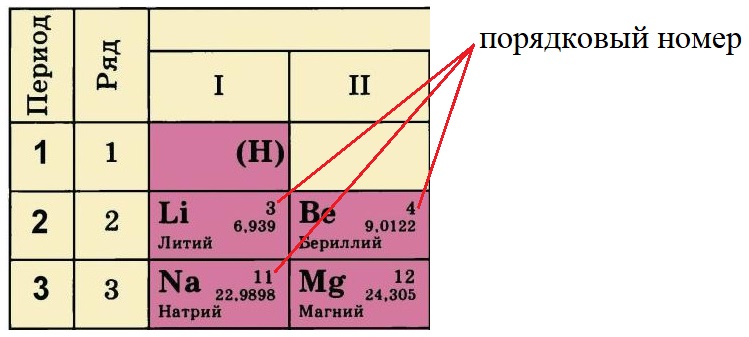
элементу в системе присвоен порядковый номер,
кроме того, для него можно указать номер периода,
номер группы, вид подгруппы.
Спонсор публикации статьи интернет-магазин «Мегамех». В магазине Вы найдёте изделия из меха на любой вкус — куртки, жилетки и шубы из лисы, нутрии, кролика, норки, чернобурки, песца. Компания также предлагает Вам приобрести элитные меховые изделия и воспользоваться услугами индивидуального пошива. Меховые изделия оптом и в розницу — от бюджетной категории до класса люкс, скидки до 50%, гарантия 1 год, доставка по Украине, России, СНГ и странам Евросоюза, самовывоз из шоу-рума в г.Кривой Рог, товары от ведущих производителей Украины, России, Турции и Китая. Посмотреть каталог товаров, цены, контакты и получить консультацию Вы сможете на сайте, который располагается по адресу: «megameh.com».
Зная точный «адрес» химического элемента –
группу, подгруппу и номер периода, можно
однозначно определить строение его атома.
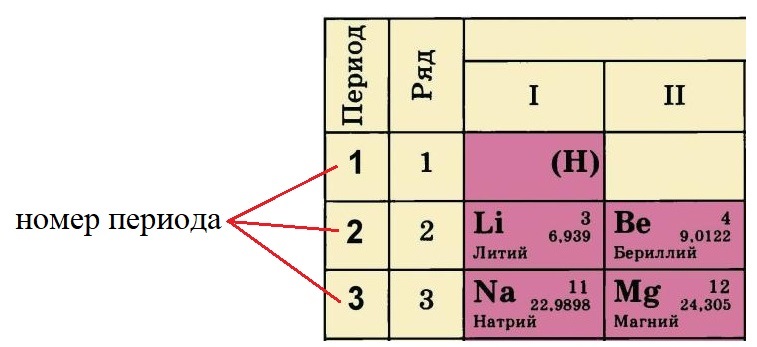
Период – это горизонтальный ряд химических
элементов. В современной периодической
системе семь периодов. Первые три периода – малые,
т.к. они содержат 2 или 8 элементов:
1-й период – Н, Не – 2 элемента;
2-й период – Li … Nе – 8 элементов;
3-й период – Na … Аr – 8 элементов.
Остальные периоды – большие. Каждый из них
содержит 2–3 ряда элементов:
4-й период (2 ряда) – K … Kr – 18 элементов;
6-й период (3 ряда) – Сs … Rn – 32 элемента. В этот
период входит ряд лантаноидов.
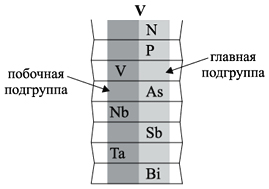
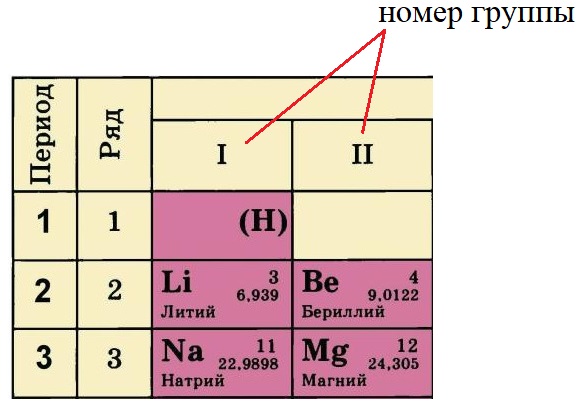
Группа – вертикальный ряд химических
элементов. Всего групп восемь. Каждая группа
состоит из двух подгрупп: главной подгруппы и
побочной подгруппы. Например:
Главную подгруппу образуют химические
элементы малых периодов (например, N, P) и больших
периодов (например, As, Sb, Bi).
Побочную подгруппу образуют химические
элементы только больших периодов (например, V, Nb,
Ta).
Визуально эти подгруппы различить легко.
Главная подгруппа «высокая», она начинается с
1-го или 2-го периода. Побочная подгруппа –
«низкая», начинается с 4-го периода.
Итак, каждый химический элемент периодической
системы имеет свой адрес: период, группу,
подгруппу, порядковый номер.
Например, ванадий V – это химический элемент
4-го периода, V группы, побочной подгруппы,
порядковый номер 23.
Задание 3.1. Укажите период, группу и
подгруппу для химических элементов с
порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и
название химического элемента, если известно,
что он находится:
а) в 4-м периоде, VI группе, побочной подгруппе;
б) в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать сведения о
положении элемента в периодической системе со
строением его атома?
Атом состоит из ядра (оно имеет положительный
заряд) и электронов (они имеют отрицательный
заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен
порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре
сосредоточена почти вся масса атома. Поскольку
химический элемент – совокупность атомов с
одинаковым зарядом ядра, то около символа
элемента указывают следующие его координаты:
По этим данным можно определить состав ядра.
Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1.
Нейтрон n заряда не имеет (нейтрален), а масса
его приблизительно равна массе протона (1,0087 а. е.
м.).
Заряд ядра определяют протоны. Причем число
протонов равно (по величине) заряду ядра
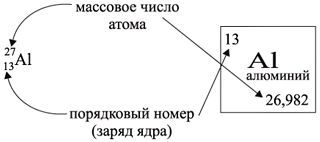
атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности
между величинами: «масса ядра» А и
«порядковый номер» Z. Так, для атома алюминия:
N = А – Z = 27 –13 = 14n,
Задание 3.3. Определите состав ядер атомов,
если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Внимание! При определении массового числа ядра
атома приходится округлять атомную массу,
указанную в периодической системе. Так поступают
потому, что массы протона и нейтрона практически
целочисленны, а массой электронов можно
пренебречь.
Определим, какие из приведенных ниже ядер
принадлежат одному и тому же химическому
элементу:
А (20р + 20n),
Б (19р + 20n),
В (20р + 19n).
Атомам одного химического элемента
принадлежат ядра А и В, поскольку они
содержат одинаковое число протонов, т. е. заряды
этих ядер одинаковые. Исследования показывают,
что масса атома не оказывает существенного
влияния на его химические свойства.
Изотопами называют атомы одного и того же
химического элемента (одинаковое число
протонов), различающиеся массой (разное число
нейтронов).
Изотопы и их химические соединения отличаются
друг от друга по физическим свойствам, но
химические свойства у изотопов одного
химического элемента одинаковы. Так, изотопы
углерода-14 (14С) имеют такие же химические
свойства, как и углерода-12 (12С), которые
входят в ткани любого живого организма. Отличие
проявляется только в радиоактивности (изотоп 14С).
Поэтому изотопы применяют для диагностики и
лечения различных заболеваний, для научных
исследований.
Вернемся к описанию строения атома.
Как известно, ядро атома в химических
процессах не изменяется. А что изменяется?
Переменным оказывается общее число электронов в
атоме и распределение электронов. Общее число
электронов в нейтральном атоме определить
несложно – оно равно порядковому номеру, т.е.
заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса
их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны
отталкиваются друг от друга и находятся на
разных расстояниях от ядра. При этом электроны,
имеющие приблизительно равный запас энергии,
находятся на приблизительно равном расстоянии
от ядра и образуют энергетический уровень.
Число энергетических уровней в атоме равно
номеру периода, в котором находится химический
элемент. Энергетические уровни условно
обозначают так (например, для Al):
Задание 3.4. Определите число энергетических
уровней в атомах кислорода, магния, кальция,
свинца.
На каждом энергетическом уровне может
находиться ограниченное число электронов:
• на первом – не более двух электронов;
• на втором – не более восьми электронов;
• на третьем – не более восемнадцати
электронов.
Эти числа показывают, что, например, на втором
энергетическом уровне может находиться 2, 5 или 7
электронов, но не может быть 9 или 12 электронов.
Важно знать, что независимо от номера
энергетического уровня на внешнем уровне
(последнем) не может быть больше восьми
электронов. Внешний восьмиэлектронный
энергетический уровень является наиболее
устойчивым и называется завершенным. Такие
энергетические уровни имеются у самых
неактивных элементов – благородных газов.
Как определить число электронов на внешнем
уровне остальных атомов? Для этого существует
простое правило: число внешних электронов
равно:
• для элементов главных подгрупп – номеру
группы;• для элементов побочных подгрупп оно не может
быть больше двух.
Например (рис. 5):
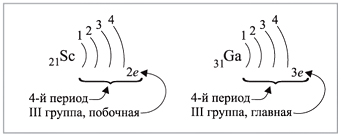 |
Рис. 5.
|
Задание 3.5. Укажите число внешних
электронов для химических элементов с
порядковыми номерами 15, 25, 30, 53.
Задание 3.6. Найдите в периодической системе
химические элементы, в атомах которых имеется
завершенный внешний уровень.
Очень важно правильно определять число внешних
электронов, т.к. именно с ними связаны важнейшие
свойства атома. Так, в химических реакциях атомы
стремятся приобрести устойчивый, завершенный
внешний уровень (8е). Поэтому атомы, на внешнем
уровне которых мало электронов, предпочитают их
отдать.
Химические элементы, атомы которых способны
только отдавать электроны, называют металлами.
Очевидно, что на внешнем уровне атома металла
должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома
много электронов, то такие атомы стремятся
принять электроны до завершения внешнего
энергетического уровня, т. е. до восьми
электронов. Такие элементы называют неметаллами.
В о п р о с. К металлам или неметаллам
относятся химические элементы побочных
подгрупп? Почему?
О т в е т. Металлы и неметаллы главных
подгрупп в таблице Менделеева отделяет линия,
которую можно провести от бора к астату. Выше
этой линии (и на линии) располагаются неметаллы,
ниже – металлы. Все элементы побочных подгрупп
оказываются ниже этой линии.
Задание 3.7. Определите, к металлам или
неметаллам относятся: фосфор, ванадий, кобальт,
селен, висмут. Используйте положение элемента в
периодической системе химических элементов и
число электронов на внешнем уровне.
Для того, чтобы составить распределение
электронов по остальным уровням и подуровням,
следует воспользоваться следующим а л г о р и т м
о м.
1. Определить общее число электронов в атоме (по
порядковому номеру).
2. Определить число энергетических уровней (по
номеру периода).
3. Определить число внешних электронов (по виду
подгруппы и номеру группы).
4. Указать число электронов на всех уровнях,
кроме предпоследнего.
5. Рассчитать число электронов на предпоследнем
уровне.
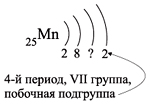
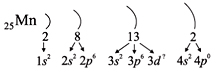
Например, согласно пунктам 1–4 для атома
марганца определено:
Всего 25е; распределили (2 + 8 + 2) = 12e;
значит, на третьем уровне находится: 25 – 12 = 13e.
Получили распределение электронов в атоме
марганца:
Задание 3.8. Отработайте алгоритм, составив
схемы строения атомов для элементов № 16, 26, 33, 37.
Укажите, металлы это или неметаллы. Ответ
поясните.
Составляя приведенные выше схемы строения
атома, мы не учитывали, что электроны в атоме
занимают не только уровни, но и определенные подуровни
каждого уровня. Виды подуровней обозначаются
латинскими буквами: s, p, d.
Число возможных подуровней равно номеру
уровня. Первый уровень состоит из одного
s-подуровня. Второй уровень состоит из двух
подуровней – s и р. Третий уровень – из
трех подуровней – s, p и d.
На каждом подуровне может находиться строго
ограниченное число электронов:
на s-подуровне – не больше 2е;
на р-подуровне – не больше 6е;
на d-подуровне – не больше 10е.
Подуровни одного уровня заполняются в строго
определенном порядке: s p
d.
Таким образом, р-подуровнь не может начать
заполняться, если не заполнен s-подуровень
данного энергетического уровня, и т.д. Исходя из
этого правила, несложно составить электронную
конфигурацию атома марганца:
В целом электронная конфигурация атома марганца
записывается так:
25Мn 1s22s22p63s23p63d54s2.
Здесь и далее приняты следующие обозначения:
Задание 3.9. Составьте электронные
конфигурации атомов для химических элементов №
16, 26, 33, 37.
Для чего необходимо составлять электронные
конфигурации атомов? Для того, чтобы
определять свойства этих химических элементов.
Следует помнить, что в химических процессах
участвуют только валентные электроны.
Валентные электроны находятся на внешнем
энергетическом уровне и незавершенном
d-подуровне предвнешнего уровня.
Определим число валентных электронов для
марганца:
или сокращенно: Мn … 3d54s2.
Что можно определить по формуле электронной
конфигурации атома?
1. Какой это элемент – металл или неметалл?
Марганец – металл, т.к. на внешнем (четвертом)
уровне находится два электрона.
2. Какой процесс характерен для металла?
Атомы марганца в реакциях всегда только отдают
электроны.
3. Какие электроны и сколько будет отдавать атом
марганца?
В реакциях атом марганца отдает два внешних
электрона (они дальше всех от ядра и слабее
притягиваются им), а также пять предвнешних d-электронов.
Общее число валентных электронов – семь (2 + 5).
В этом случае на третьем уровне атома
останется восемь электронов, т.е. образуется
завершенный внешний уровень.
Все эти рассуждения и заключения можно
отразить при помощи схемы (рис. 6):
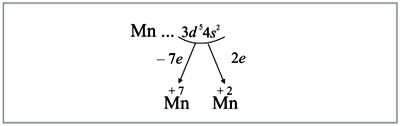 |
Рис. 6.
|
Полученные условные заряды атома
называют степенями окисления.
Рассматривая строение атома, аналогичным
способом можно показать, что типичными степенями
окисления для кислорода является –2, а для
водорода +1.
В о п р о с. С каким из химических
элементов может образовывать соединения
марганец, если учесть полученные выше степени
его окисления?
О т в е т. Только с кислородом, т.к. его атом
имеет противоположную по заряду степень
окисления. Формулы соответствующих оксидов
марганца (здесь степени окисления соответствуют
валентностям этих химических элементов):
Строение атома марганца подсказывает, что
большей степени окисления у марганца быть не
может, т.к. в этом случае пришлось бы
затрагивать устойчивый, теперь уже завершенный
предвнешний уровень. Поэтому степень окисления +7
является высшей, а соответствующий оксид Мn2О7
– высшим оксидом марганца.
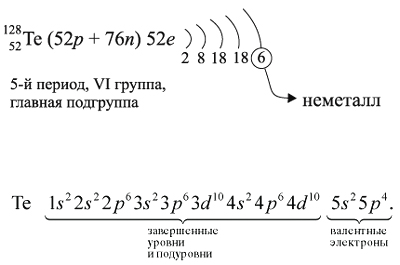
Для закрепления всех этих понятий рассмотрим
строение атома теллура и некоторые его свойства:
Как неметалл, атом Te может принять 2 электрона
до завершения внешнего уровня и отдать «лишние» 6
электронов:
Задание 3.10. Изобразите электронные
конфигурации атомов Nа, Rb, Cl, I, Si, Sn. Определите
свойства этих химических элементов, формулы их
простейших соединений (с кислородом и водородом).
Практические выводы
1. В химических реакциях участвуют только
валентные электроны, которые могут находиться
только на двух последних уровнях.
2. Атомы металлов могут только отдавать
валентные электроны (все или несколько), принимая
положительные степени окисления.
3. Атомы неметаллов могут принимать электроны
(недостающие – до восьми), приобретая при этом
отрицательные степени окисления, и отдавать
валентные электроны (все или несколько), при этом
они приобретают положительные степени
окисления.
Сравним теперь свойства химических элементов
одной подгруппы, например натрия и рубидия:
Nа …3s1 и Rb …5s1.
Что общего в строении атомов этих элементов?
На внешнем уровне каждого атома по одному
электрону – это активные металлы. Металлическая
активность связана со способностью отдавать
электроны: чем легче атом отдает электроны, тем
сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их
к ядру. Чем ближе электроны к ядру, тем сильнее
они притягиваются ядром атома, тем труднее их
«оторвать».
Исходя из этого, ответим на вопрос: какой
элемент – Nа или Rb – легче отдает внешний
электрон? Какой из элементов является более
активным металлом? Очевидно, рубидий, т.к. его
валентные электроны находятся дальше от ядра (и
слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз
металлические свойства усиливаются, т.к.
возрастает радиус атома, и валентные электроны
слабее притягиваются к ядру.
Сравним свойства химических элементов VIIa
группы: Cl …3s23p5 и I …5s25p5.
Оба химических элемента – неметаллы, т.к. до
завершения внешнего уровня не хватает одного
электрона. Эти атомы будут активно притягивать
недостающий электрон. При этом чем сильнее
притягивает атом неметалла недостающий
электрон, тем сильнее проявляются его
неметаллические свойства (способность принимать
электроны).
За счет чего происходит притяжение электрона?
За счет положительного заряда ядра атома.
Кроме того, чем ближе электрон к ядру, тем сильнее
их взаимное притяжение, тем активнее неметалл.
В о п р о с. У какого элемента сильнее
выражены неметаллические свойства: у хлора или
йода?
О т в е т. Очевидно, у хлора, т.к. его валентные
электроны расположены ближе к ядру.
Вывод. Активность неметаллов в подгруппах
сверху вниз убывает, т.к. возрастает радиус
атома и ядру все труднее притянуть недостающие
электроны.
Сравним свойства кремния и олова: Si …3s23p2
и Sn …5s25p2.
На внешнем уровне обоих атомов по четыре
электрона. Тем не менее эти элементы в
периодической системе находятся по разные
стороны от линии, соединяющей бор и астат.
Поэтому у кремния, символ которого находится
выше линии В–At, сильнее проявляются
неметаллические свойства. Напротив, у олова,
символ которого находится ниже линии В–At,
сильнее проявляются металлические свойства. Это
объясняется тем, что в атоме олова четыре
валентных электрона удалены от ядра. Поэтому
присоединение недостающих четырех электронов
затруднено. В то же время отдача электронов
с пятого энергетического уровня происходит
достаточно легко. Для кремния возможны оба
процесса, причем первый (прием электронов)
преобладает.
Выводы по главе 3. Чем меньше внешних
электронов в атоме и чем дальше они от ядра, тем
сильнее проявляются металлические свойства.
Чем больше внешних электронов в атоме и чем
ближе они к ядру, тем сильнее проявляются
неметаллические свойства.
Основываясь на выводах, сформулированных в
этой главе, для любого химического элемента
периодической системы можно составить
«характеристику».
Алгоритм описания свойств
химического элемента по его положению
в периодической системе
1. Составить схему строения атома, т.е.
определить состав ядра и распределение
электронов по энергетическим уровням и
подуровням:
• определить общее число протонов, электронов
и нейтронов в атоме (по порядковому номеру и
относительной атомной массе);• определить число энергетических уровней (по
номеру периода);• определить число внешних электронов (по виду
подгруппы и номеру группы);• указать число электронов на всех
энергетических уровнях, кроме предпоследнего;• рассчитать число электронов на
предпоследнем уровне.
2. Определить число валентных электронов.
3. Определить, какие свойства – металла или
неметалла – сильнее проявляются у данного
химического элемента.
4. Определить число отдаваемых (принимаемых)
электронов.
5. Определить высшую и низшую степени окисления
химического элемента.
6. Составить для этих степеней окисления
химические формулы простейших соединений с
кислородом и водородом.
7. Определить характер оксида и составить
уравнение его реакции с водой.
8. Для указанных в пункте 6 веществ составить
уравнения характерных реакций (см. главу 2).
Задание 3.11. По приведенной выше схеме
составить описания атомов серы, селена, кальция и
стронция и свойства этих химических элементов.
Какие общие свойства проявляют их оксиды и
гидроксиды?
Если вы выполнили упражнения 3.10 и 3.11, то
легко заметить, что не только атомы элементов
одной подгруппы, но и их соединения имеют общие
свойства и похожий состав.
Периодический закон Д.И.Менделеева:
свойства химических элементов, а также свойства
простых и сложных веществ, образованных ими,
находятся в периодической зависимости от заряда
ядер их атомов.
Физический смысл периодического закона: свойства
химических элементов периодически повторяются
потому, что периодически повторяются
конфигурации валентных электронов
(распределение электронов внешнего и
предпоследнего уровней).
Так, у химических элементов одной и той же
подгруппы одинаковое распределение валентных
электронов и, значит, похожие свойства.
Например, у химических элементов пятой группы
пять валентных электронов. При этом в атомах
химических элементов главных подгрупп – все
валентные электроны находятся на внешнем уровне:
… ns2np3, где n – номер
периода.
У атомов элементов побочных подгрупп на
внешнем уровне находятся только 1 или 2 электрона,
остальные – на d-подуровне предвнешнего
уровня: … (n – 1)d3ns2, где n
– номер периода.
Задание 3.12. Составьте краткие электронные
формулы для атомов химических элементов № 35 и 42,
а затем составьте распределение электронов в
этих атомах по алгоритму. Убедитесь, что ваше
предсказание сбылось.
Упражнения к главе 3
1. Сформулируйте определения понятий
«период», «группа», «подгруппа». Что общего у
химических элементов, которые составляют: а)
период; б) группу; в) подгруппу?
2. Что такое изотопы? Какие свойства –
физические или химические – совпадают у
изотопов? Почему?
3. Сформулируйте периодический закон
Д.И.Менделеева. Поясните его физический смысл и
проиллюстрируйте примерами.
4. В чем проявляются металлические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
5. В чем проявляются неметаллические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
6. Составьте краткие электронные формулы
химических элементов № 43, 51, 38. Подтвердите свои
предположения описанием строения атомов этих
элементов по приведенному выше алгоритму.
Укажите свойства этих элементов.
7. По кратким электронным формулам
а) …4s24p1;
б) …4d15s2;
в) …3d54s1
определите положение соответствующих
химических элементов в периодической системе
Д.И.Менделеева. Назовите эти химические элементы.
Свои предположения подтвердите описанием
строения атомов этих химических элементов по
алгоритму. Укажите свойства этих химических
элементов.
Продолжение следует
Строение атома
Материал по химии
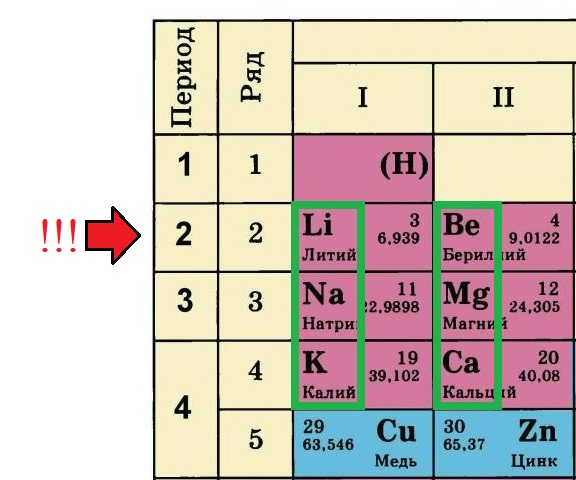
Порядковый номер, группа и период.
Для удобства будем использовать планетарную модель строения атома Н. Бора, согласно которой в центре атома располагается положительно заряженное ядро, состоящее из протонов и нейтронов, а вокруг двигаются электроны по «орбитам» и образуют электронную оболочку
Вся необходимая для построения модели атома информация находится в Периодической системе химических элементов Д.И. Менделеева:
-
Порядковый номер элемента равен количеству протонов (р+) в ядре этого атома, так у лития три протона, у бериллия – четыре, а у натрия одиннадцать. Известно, что атом – нейтральная частица, количество протонов в ней всегда будет равно количеству электронов. Поэтому порядковый номер определяет не только заряд ядра, но и общее количество электронов на всех орбиталях атома этого элемента.
Строение атома
Порядковый номер в таблице Менделеева
-
Номер периода, в котором располагается данный элемент, показывает, на каком количестве уровней находятся электроны. Так, электроны лития и бериллия располагаются на двух уровнях, а натрия и магния – на трёх.
-
Номер группы, в котором стоит элемент определяет количество электронов на внешнем уровне (валентные электроны). У лития и натрия по одному электрону на внешнем уровне, а у бериллия и магния – по два. Это правило действует только на элементы А-подгрупп.
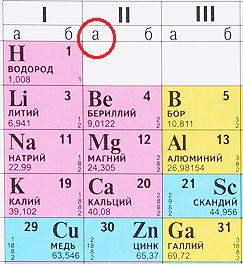
А-подгруппа и Б-подгруппа.
Как определить, какой элемент относится к А-подгруппе, а какой – к B (Б)-подгруппе?
Некоторые таблицы содержат эту информацию:
Но большинство таблиц имеет только обозначения групп. Что делать в таком случае? Всё просто: ориентируйтесь по элементам второго периода, они все являются элементами А-подгрупп (литий, бериллий, бор, углерод, азот, кислород, фтор, неон), те элементы, что располагаются прямо под ними тоже относятся к А-подуровню:
В данном примере зеленым прямоугольником выделены элементы А-подгрупп, так как с них начинается второй период ПС. А значок меди и цинка расположен с другой стороны, это элементы В-подгрупп.
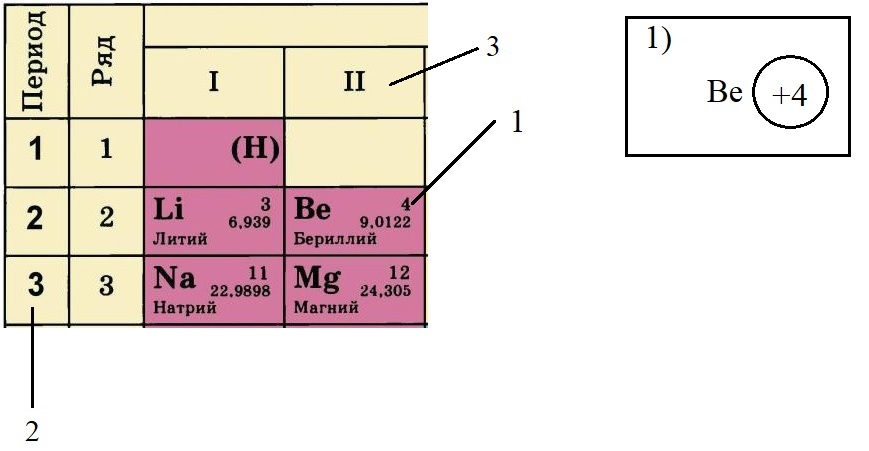
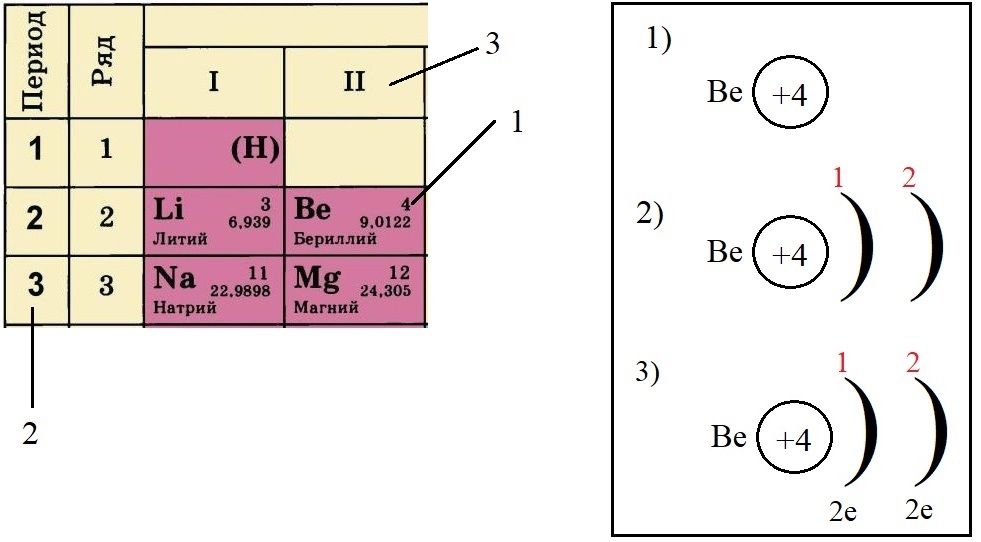
Пример построения модели атома.
Теперь попробуем составить электронную конфигурацию атома бериллия. Последовательность действий отображена цифровыми обозначениями на рисунке, изображающем фрагмент ПС:
-
По порядковому номеру определяем заряд ядра, записываем в круг после символа элемента. Помним, что это еще и количество электронов.
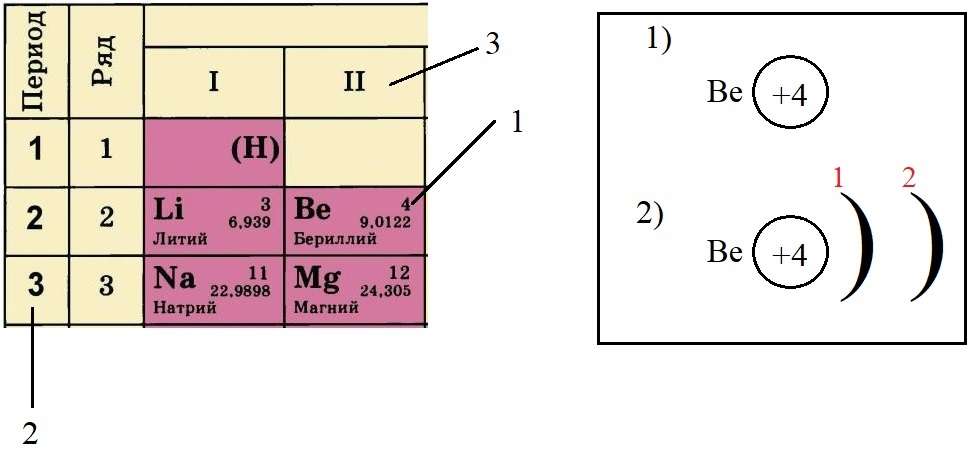
-
Определяем количество энергетических уровней, оно равно номеру периода, в котором стоит элемент. Бериллий стоит во втором периоде, значит, у него два энергетических уровня:
-
Определяем количество электронов на внешнем уровне, оно равно номеру группы. Бериллий стоит во второй группе, у него два электрона на внешнем слое:
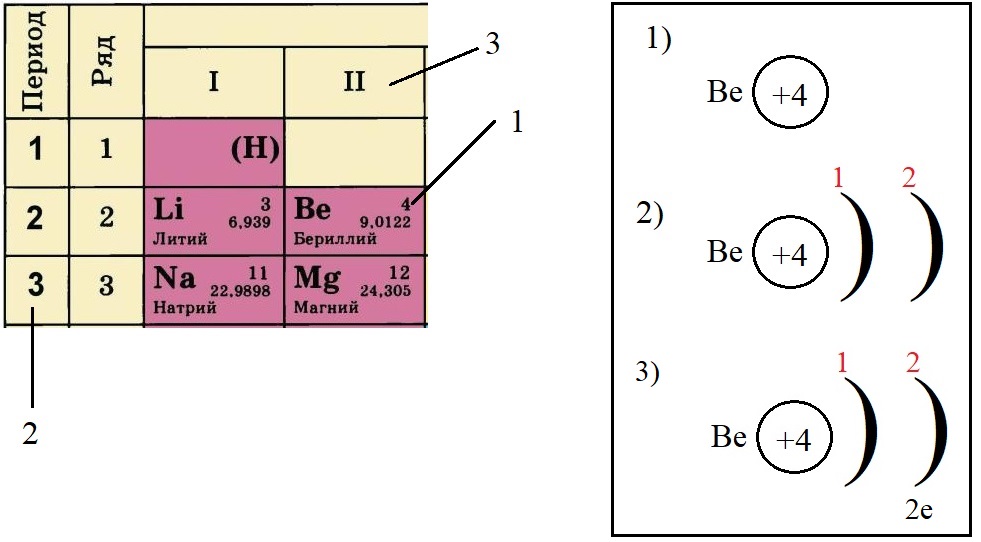
-
Не трудно догадаться, что если всего у бериллия должно быть четыре электрона, два из которых находятся на внешнем слое, то оставшиеся два находятся на внутреннем слое:
Максимальное количество электронов на уровнях
Чтобы строить электронные конфигурации более крупных атомов, необходимо ввести еще несколько данных. Начнем с максимального количества электронов на определенном уровне, это количество показано на рисунке:
Стоит помнить, что это лишь максимальное количество, большинство элементов не имеют на каждом уровне такого количества электронов.
Так же следует помнить, что какой бы номер не имел бы внешний уровень, на нем максимальное количество электронов не должно превышать восьми.
Следует учитывать, что предвнешний слой следует заполнять последним, чтобы избежать ошибок.
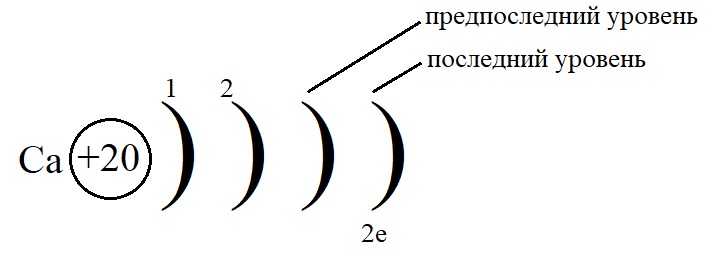
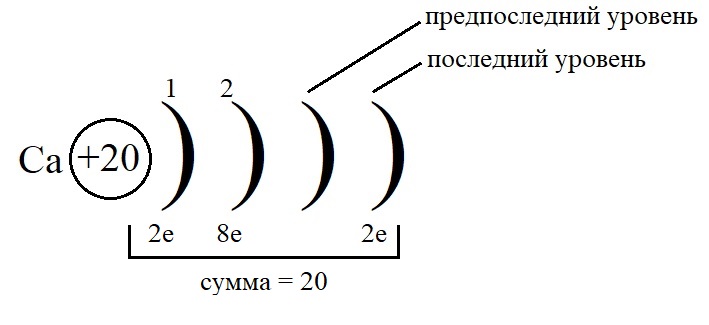
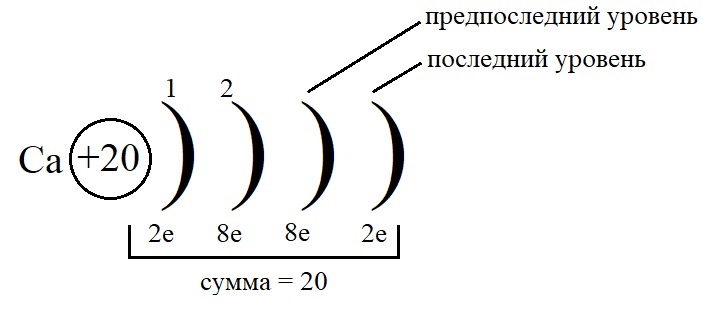
Рассмотрим данные правила на примере построения конфигурации атома кальция.
-
Порядковый номер кальция – 20, у него 20 протонов в ядре и 20 электронов на орбиталях. Кальций стоит во второй группе, значит, на внешнем слое у него 2 электрона.
-
Остальные уровни, кроме предвнешнего, заполняем по максимальному количеству на этих слоях:
-
Как показано на рисунке, общее количество электронов должно быть равным двадцати, а пока мы распределили только двенадцать, значит, на предпоследнем уровне необходимо поставить восемь электронов:
Каждый энергетический уровень можно разбить на подуровни (орбитали). Их существует 4 вида: s-, p-, d-, f-орбитали. Они характеризуют область пространства, в которой электрон находится с наибольшей вероятностью.
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодический закон звучал так: «Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы.» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.
Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома.
Поэтому современная формулировка периодического закона звучит так:
«Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов«.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
Как следствие,
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
| Пример. Выберите три элемента малых периодов и расположите эти элементы в порядке уменьшения металлических свойств.
1) Li 2) Ca 3) Cs 4) N 5) S |
| Пример. Выберите три элемента одного периода и расположите эти элементы в порядке уменьшения неметаллических свойств.
1) Be 2) Ba 3) Mg 4) N 5) F |
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H+. Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру.
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Из строения атомов и электронных оболочек вытекают следующие закономерности:
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
2. Радиус атома
Рассмотрим, как меняется атомный радиус. Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Мы говорим про орбитальный радиус изолированного атома .
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Например, в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.
Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
Например, в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.
В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.
| Пример. Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке увеличения радиуса атома
1) O 2) Se 3) F 4) S 5) Na |
|
Решение: В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S. В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142. Ответ: 142 |
| Пример. Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения радиуса атома
1) K 2) Li 3) F 4) B 5) Na |
|
Решение: В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243. Ответ: 243 |
| Пример. Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения радиуса их атомов.
1) Ca 2) P 3) N 4) О 5) Ti |
|
Решение: p-элементы это фосфор Р, азот N, кислород О. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. В группе — сверху вниз увеличивается. Следовательно, правильный ответ: P, N, O или 234. Ответ: 234 |
Рассмотрим закономерности изменения радиусов ионов: катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например, радиус иона Na+ меньше радиуса атома натрия Na:
Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Например, радиус иона Cl– больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например: частицы Na+ и F‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na+ меньше радиуса иона F ‒.
3. Электроотрицательность
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.
По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности:
1) Mg 2) P 3) O 4) N 5) Ti |
|
Решение: Элементы-неметаллы – это фосфор Р, кислород О и азот N. Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243. Ответ: 243 |
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) As 2) P 3) Al 4) B 5) Na |
| Пример.Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) V 2) B 3) Li 4) C 5) He |
Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их
электроотрицательности.
1) Mg 2) P 3) N 4) O 5) Ti
4. Окислительные и восстановительные свойства
Химические свойства простых веществ определяются не только электроотрицательностью, но и особенностями строения (химической связью, кристаллической решеткой и др.). Поэтому лишь с некоторой степенью упрощения можно сказать, что электроотрицательность определяет окислительные и восстановительные свойства простых веществ.
Окислительные свойства — это способность принимать электроны.
В главных подгруппах сверху вниз уменьшаются окислительные свойства простых веществ.
В периодах слева направо окислительные свойства простых веществ увеличиваются.
Важно отметить, что эти закономерности работают только в некоторых рядах, чаще всего для похожих по строению веществ.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания окислительных свойств соответствующих им простых веществ.
1) F 2) Al 3) Br 4) Zn 5) H |
Восстановительные свойства — это способность отдавать электроны.
В главных подгруппах сверху вниз увеличиваются восстановительные свойства простых веществ.
В периодах слева направо восстановительные свойства простых веществ уменьшаются.
А что насчет побочных подгрупп? В них расположены металлы. И как сравнивать восстановительные свойства металлов в главных подгруппах и в побочных подгруппах? Примерно сравнить восстановительные свойства простых веществ-металлов позволяет ряд активности металлов.
Слева направо восстановительные свойства металлов уменьшаются.
| Пример. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств этих металлов.
1) S 2) Na 3) Al 4) C 5) Mg |
| Пример. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств соответствующих им простых веществ. Запишите номера выбранных элементов в нужной последовательности. 1) Sn 2) K 3) B 4) C 5) Ca |
5. Сводная таблица свойств химических элементов и простых веществ
Итак, резюмируем свойства элементов и простых веществ.
Проверьте себя: как меняются по синим стрелкам следующие свойства:
| Свойство | Характер изменения |
| Металлические свойства | |
| Неметаллические свойства | |
| Окислительные свойства простых веществ | |
| Восстановительные свойства простых веществ | |
| Орбитальный радиус | |
| Электроотрицательность |
| Свойство | Характер изменения |
| Металлические свойства | увеличиваются |
| Неметаллические свойства | уменьшаются |
| Окислительные свойства простых веществ | уменьшаются |
| Восстановительные свойства простых веществ | увеличиваются |
| Орбитальный радиус | увеличивается |
| Электроотрицательность | уменьшается |
6. Кислотно-основные свойства оксидов и гидроксидов
Периодически меняются не только свойства элементов и простых веществ, но и свойства сложных соединений. Рассмотрим закономерности изменения свойств высших оксидов и гидроксидов химических элементов 3 периода.
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
|
основные свойства уменьшаются слева направо кислотные свойства увеличиваются слева направо |
||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
Легко заметить, что:
основные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
Аналогично изменяются свойства в главных подгруппах.
основные свойства высших оксидов и гидроксидов химических элементов увеличиваются сверху вниз в главных подгруппах
кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются снизу вверх в главных подгруппах
Проверьте себя: как меняются по синим стрелкам следующие свойства:
| Свойство | Характер изменения |
| Основные свойства высших оксидов | |
| Кислотные свойства высших оксидов | |
| Основные свойства высших гидроксидов | |
| Кислотные свойства высших гидроксидов |
| Свойство | Характер изменения |
| Основные свойства высших оксидов | увеличиваются |
| Кислотные свойства высших оксидов | уменьшаются |
| Основные свойства высших гидроксидов | увеличиваются |
| Кислотные свойства высших гидроксидов | уменьшаются |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых электронами заполнено одинаковое количество энергетических уровней, и расположите эти элементы в порядке уменьшения основных свойств их высших оксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 1) Li 2) N 3) Be 4) As 5) P |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых на внешнем энергетическом уровне содержится одинаковое количество электронов, и расположите эти элементы в порядке уменьшения основных свойств высших оксидов, которые образуют эти элементы.
1) Al 2) Sr 3) In 4) Tl 5) Ge |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых на внешнем энергетическом уровне содержится одинаковое количество электронов, и расположите эти элементы в порядке уменьшения основных свойств высших оксидов, которые образуют эти элементы.
1) Al 2) Sr 3) In 4) Tl 5) Ge |
| Пример.Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения кислотных свойств их высших оксидов.
1) Zn 2) C 3) Al 4) Cl 5) Ti |
7. Кислотно-основные свойства водородных соединений
Водород образует два типа бинарных соединений — солеобразные гидриды с металлами и летучие водородные соединения с неметаллами.
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Свойства летучих водородных соединений изменяются нетипично.
Кислотные свойства водородных соединений неметаллов усиливаются от NH3 к HI
Основные свойства водородных соединений усиливаются от HI к аммиаку NH3
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке увеличения валентности в их летучих водородных соединениях.
1) Ne 2) Be 3) N 4) C 5) O |
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Cl 2) Zn 3) N 4) S 5) Mg |
| Пример.Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Ca 2) Cl 3) Si 4) S 5) Mn |
Тренажер по теме «Периодический закон» — 10 вопросов, при каждом прохождении новые.
На этой странице вы узнаете
- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
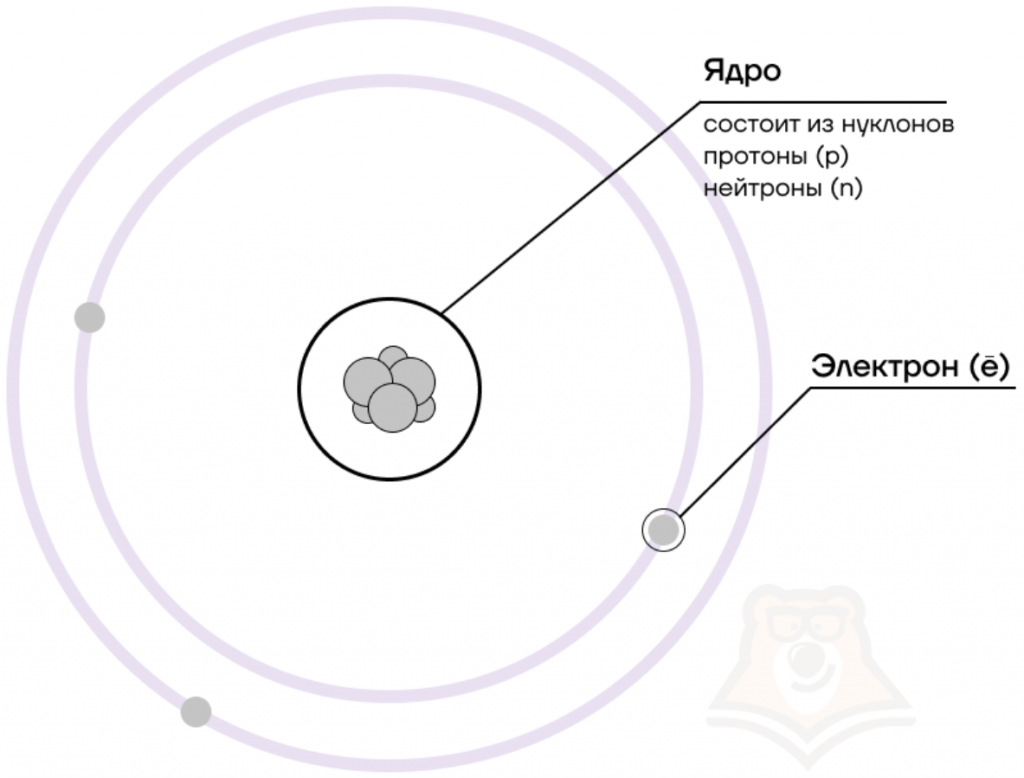
Чем атом похож на Солнечную систему?
Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями.
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:

Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.

Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n!
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:

В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
(№ элемента = p = Z = ē)
Число нейтронов = массовое число – порядковый номер
(n = Ar — № элемента)
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.

На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.

Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → …
Проскок электрона
Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация.
Такое явление называется проскоком электрона: электрон как бы нарушает общую очередь элементов в оболочке и обходит их.
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11

Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний.
Классификация химических элементов: s-,p-,d-,f-элементы
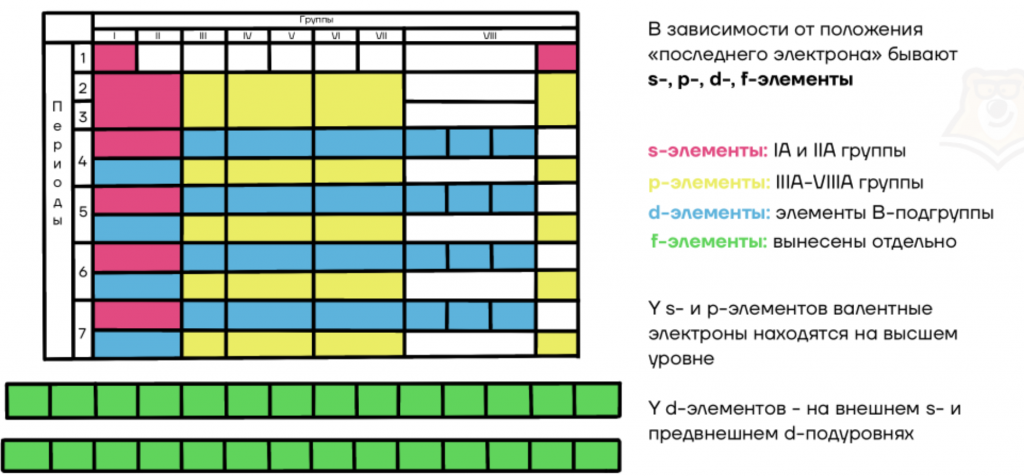
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.

Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.
Проверь себя
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.