Физические свойства
Нитрат магния Mg(NO3)2 — соль магния и азотной кислоты. Белый. При нагревании разлагается. Хорошо растворяется в воде (гидролиз по катиону).
Относительная молекулярная масса Mr = 148,31; относительная плотность для тв. и ж. состояния d = 1,636;
Способ получения
1. Нитрат магния можно путем взаимодействия магния и разбавленной азотной кислоты, образуется нитрат магния, оксид азота (I) и вода:
4Mg + 10HNO3 = 4Mg(NO3)2 + 2N2O↑ + 5H2O
Качественная реакция
Качественная реакция на нитрат магния — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат магния образует сульфат магния, нитрат меди, бурый газ оксид азота и воду:
Cu + 2Mg(NO3)2 + 2H2SO4 = Cu(NO3)2 + 2MgSO4 + 2NO2 ↑ + 2H2O
Химические свойства
1. Hитрат магния разлагается при температуре выше 300º С с образованием оксида магния, оксида азота (IV) и кислорода:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
2. Возможны реакции между нитратом магния и сложными веществами:
2.1. Нитрат магния вступает в реакцию с основаниями:
2.1.1. В результате реакции между нитратом магния и разбавленным раствором гидроксида натрия образуется гидроксид магния и нитрат натрия:
Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
Admin2
Магний азотнокислый (нитрат магния, магниевая селитра) представляет собой бесцветное кристаллическое вещество, расплывающееся на воздухе.
Характеристики
- Гигроскопичен.
- Химическая формула Mg(NO3)2*6H2O.
- Плотность вещества 1,46 г/см3.,
- температура плавления 90 С.
- Растворимость в воде составляет 410 г/л при 20 С.
- Растворим в этиловом спирте, жидком аммиаке.
- Магний азотнокислый образует многочисленные кристаллогидраты, при обычных условиях стабилен гексагидрат.
- В природе магний азотнокислый встречается в виде минерала магнетита.
Получение
- Магний азотнокислый получают путем растворения магнийсодержащего сырья (магнетита или брусита) в азотной кислоте с последующей очисткой, упариванием раствора, фильтрацией и сушкой.
- В лабораторных условиях магний азотнокислый получают растворением оксида магния или металлического магния в азотной кислоте.
- Безводный магний азотнокислый получают взаимодействием металлического магния с тетраоксидом азота.
Применение
- Магний азотнокислый применяется в сельском хозяйстве в качестве комплексного минерального удобрения.
- В промышленности находит применение как окислитель в пиротехнических составах, как антислеживающая добавка в производстве аммиачной селитры, а также как обезвоживающий агент.
ПАСПОРТ № _________
МАГНИЙ АЗОТНОКИСЛЫЙ 6-ВОДНЫЙ «Ч»
Mg(NO3 )2*6H2O
| ГОСТ 11088-75 | ОКП 26 2121 0011 04 |
| Партия ________________ | Дата изготовления ______________ |
| Масса нетто ___________________ | Вид и тип тары __________ |
| Количество мест __________ | Группа фасовки__________________ |
Показатели качества
|
№№, п/п |
Наименование показателей |
Требования ГОСТ 11088-75 |
Результаты анализов |
|---|---|---|---|
| 1. | Массовая доля 6-водного азотнокислого магния (Mg(NO3 )2*6H2O), %, не менее | 98 | |
| 2. | Массовая доля нерастворимых в воде веществ, %, не более | 0,01 | |
| 3. | Массовая доля сульфатов (SO4), %, не более | 0,01 | |
| 4. | Массовая доля фосфатов (PO4), %, не более | 0,002 | |
| 5. | Массовая доля хлоридов (Сl), %, не более | 0,001 | |
| 6. | Массовая доля бария (Ва), %, не более | 0,01 | |
| 7. | Массовая доля железа (Fe), %, не более | 0,001 | |
| 8. | Массовая доля суммы калия и натрия (К+Na), %, не более | 0,1 | |
| 9. | Массовая доля кальция (Са), %, не более | 0,05 | |
| 10. | Массовая доля мышьяка (As), %, не более | 0,0001 | |
| 11. | Массовая доля тяжелых металлов (Pb), %, не более | 0,002 | |
| 12. | рН раствора препарата с массовой долей 5%, в пределах | 3,9-7 |
Гарантийный срок хранения — 1 год со дня изготовления.
Продукт ___________________ требованиям ГОСТ 11088-75 квалификации «Ч».
Начальник ОТК _________________________
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Magnesium nitrate |
|
| Other names
Nitromagnesite (hexahydrate) |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.739 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1474 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Mg(NO3)2 |
| Molar mass | 148.32 g/mol (anhydrous) 184.35 g/mol (dihydrate) 256.41 g/mol (hexahydr.) |
| Appearance | White crystalline solid |
| Density | 2.3 g/cm3 (anhydrous) 2.0256 g/cm3 (dihydrate) 1.464 g/cm3 (hexahydrate) |
| Melting point | 129 °C (264 °F; 402 K) (dihydrate) 88.9 °C (hexahydrate) |
| Boiling point | 330 °C (626 °F; 603 K) decomposes |
|
Solubility in water |
71 g/100 mL (25 °C)[1] |
| Solubility | moderately soluble in ethanol, ammonia |
|
Refractive index (nD) |
1.34 (hexahydrate) |
| Structure | |
|
Crystal structure |
cubic |
| Thermochemistry | |
|
Heat capacity (C) |
141.9 J/mol K |
|
Std molar |
164 J/mol K |
|
Std enthalpy of |
-790.7 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-589.4 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Irritant |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Warning |
|
Hazard statements |
H272, H315, H319, H335 |
|
Precautionary statements |
P210, P220, P221, P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P370+P378, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
1 0 0 OX |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
Magnesium sulfate Magnesium chloride |
|
Other cations |
Beryllium nitrate Calcium nitrate Strontium nitrate Barium nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium nitrate refers to inorganic compounds with the formula Mg(NO3)2(H2O)x, where x = 6, 2, and 0. All are white solids.[2] The anhydrous material is hygroscopic, quickly forming the hexahydrate upon standing in air. All of the salts are very soluble in both water and ethanol.
Occurrence, preparation, structure[edit]
Being highly water soluble, magnesium nitrate occurs naturally only in mines and caverns as nitromagnesite (hexahydrate form).[3]
The magnesium nitrate used in commerce is made by the reaction of nitric acid and various magnesium salts.
Structure of [Mg(H2O)6]2+ in the dinitrate salt.[4]
Use[edit]
The principal use is as a dehydrating agent in the preparation of concentrated nitric acid.[2]
Its fertilizer grade has 10.5% nitrogen and 9.4% magnesium, so it is listed as 10.5-0-0 + 9.4% Mg. Fertilizer blends containing magnesium nitrate also have ammonium nitrate, calcium nitrate, potassium nitrate and micronutrients in most cases; these blends are used in the greenhouse and hydroponics trade.
Reactions[edit]
Magnesium nitrate reacts with alkali metal hydroxide to form the corresponding nitrate:
- Mg(NO3)2 + 2 NaOH → Mg(OH)2 + 2 NaNO3.
Since magnesium nitrate has a high affinity for water, heating the hexahydrate does not result in the dehydration of the salt, but rather its decomposition into magnesium oxide, oxygen, and nitrogen oxides:
- 2 Mg(NO3)2 → 2 MgO + 4 NO2 + O2.
The absorption of these nitrogen oxides in water is one possible route to synthesize nitric acid. Although inefficient, this method does not require the use of any strong acid.
It is also occasionally used as a desiccant.
References[edit]
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ a b Thiemann, Michael; Scheibler, Erich and Wiegand, Karl Wilhelm (2005). «Nitric Acid, Nitrous Acid, and Nitrogen Oxides». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_293. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ^ Mindat, http://www.mindat.org/min-2920.html
- ^ Schefer, J.; Grube, M. (1995). «Low temperature structure of magnesium nitrate hexahydrate, Mg (N O3)2 . 6(H2 O): a neutron diffraction study at 173 K». Materials Research Bulletin. 30: 1235–1241. doi:10.1016/0025-5408(95)00122-0.
- Liquid Chemistry
- Nitromagnesite Mineral Data
- Magnesium Nitrate MSDS
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
| Нитрат магния | |
|---|---|
 |
|
| Систематическое наименование |
Нитрат магния |
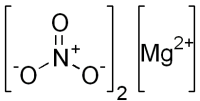
| Хим. формула | Mg(NO3)2 |
| Рег. номер CAS | 10377-60-3 |
| PubChem | 25212 |
| Рег. номер EINECS | 233-826-7 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Mg+2] |
| InChI |
1S/Mg.2NO3/c;2*2-1(3)4/q+2;2*-1 YIXJRHPUWRPCBB-UHFFFAOYSA-N |
| ChEBI | 64736 |
| ChemSpider | 23415 |
| ГОСТ | ГОСТ 11088-75 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты.
Известен также метастабильный тетрагидрат. Гексагидрат — бесцветные кристаллы. Существует в трех модификациях. При —13-66 °C устойчива форма с моноклинной решеткой (а = 0,619 нм, b = 0,127 нм, с = 0,666 нм, b = 93°, пространств. группа P21/c); т. пл. 90 °C; плотность 1,46 г/см3; DH0пл 41,0 кДж/моль, DH0обр −2614,7 кДж/моль; S0298 427 Дж/(моль. К); уравнение температурной зависимости давления пара Н2О над твердым веществом: lgр(мм рт. ст.) = 10,0372 — 3088/Т (293—323 К); выше 90 °C обезвоживается до дигидрата, затем происходит отщепление воды с частичным гидролизом и разложение до MgO. Дигидрат — бесцветные кристаллы с моноклинной решеткой (а = 0,581 нм, b = 0,599 нм, с = 0,865 нм, b = 90,7°, пространств. группа Р21/с); т. пл. 130 °C; плотн. 2,02 г/см3; DH0обр −1411,4 к Дж/моль; S0298 251 Дж/(моль. К).
Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также аммины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов др. металлов, а также разложении соединений Mg;
30-40% растворы нитрата магния технической чистоты, получаемые азотнокислотным разложением магнийсодержащего сырья (чаще, каустического магнезита или брусита) нашли применение в производстве концентрированной азотной кислоты (как обезвоживающий агент) и гранулированной аммиачной селитры (как модифицирующая добавка).
Компонент сложных удобрений, поскольку магний входит в состав хлорофилла, который необходим для фотосинтеза, способствует повышению активности многих ферментов и выступает в роли транспортера фосфора. Высокая растворимость и низкая электропроводность делают продукт исключительно подходящим для листовой подкормки и фертигации, особенно при использовании оросительных вод с высокой концентрацией солей. Удобрение используется для корневого и некорневого питания овощных, ягодных, плодовых культур, винограда; окислитель в пиротехнических составах. Применение нитрата магния, как удобрения, в кристаллической или гранулированных формах, несмотря на содержание в его составе двух питательных компонентов в водорастворимой форме — собственно, магния и азота ( в виде нитрат-иона), и высокую агрохимическую эффективность, существенно ограничивается значительной гигроскопичностью продукта и повышенной склонностью к слеживаемости при хранении и транспортировке.
|
Нитраты |
|---|
|
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.





