| Нитрат цинка | |
|---|---|
 |
|
| Систематическое наименование |
Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
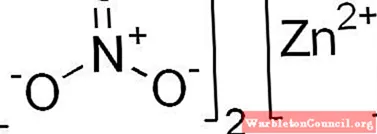
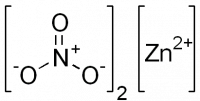
| Хим. формула | Zn(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Растворимость | |
| • в воде | 12825; 125073 г/100 мл |
| ГОСТ | ГОСТ 5106-77 |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2] |
| InChI |
1S/2NO3.Zn/c2*2-1(3)4;/q2*-1;+2 ONDPHDOFVYQSGI-UHFFFAOYSA-N |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
-
- ZnO + 2HNO3 → Zn(NO3)2 + H2O
-
- Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2H2O
-
- ZnCO3 + 2HNO3 → Zn(NO3)2 + CO2↑ + H2O
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
-
- Zn + 2N2O4 → Zn(NO3)2 + 2NO↑
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Применение
- Протрава при крашении тканей.
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Zinc nitrate |
|
| Other names
Zinc dinitrate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.038 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1514 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Zn(NO3)2 |
| Molar mass | 189.36 g/mol (anhydrous) 297.49 g/mol (hexahydrate) |
| Appearance | colorless, deliquescent crystals |
| Density | 2.065 g/cm3 (hexahydrate) |
| Melting point | 110 °C (230 °F; 383 K) (anhydrous) 45.5 °C (trihydrate) 36.4 °C (hexahydrate) |
| Boiling point | ~ 125 °C (257 °F; 398 K) decomposes (hexahydrate) |
|
Solubility in water |
327 g/(100 mL), 40 °C (trihydrate) 184.3 g/(100 mL), 20 °C (hexahydrate) |
| Solubility | very soluble in alcohol |
|
Magnetic susceptibility (χ) |
−63.0·10−6 cm3/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Oxidant, may explode on heating |
| GHS labelling: | |
|
Pictograms |
 
|
| Flash point | Non-flammable |
| Safety data sheet (SDS) | ICSC 1206 |
| Related compounds | |
|
Other anions |
Zinc sulfate Zinc chloride |
|
Other cations |
Cadmium nitrate Mercury(II) nitrate |
|
Related compounds |
Copper(II) nitrate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Zinc nitrate is an inorganic chemical compound with the formula Zn(NO3)2. This colorless, crystalline salt is highly deliquescent. It is typically encountered as a hexahydrate Zn(NO3)2·6H2O. It is soluble in both water and alcohol.
Synthesis[edit]
Zinc nitrate is usually prepared by dissolving zinc metal, zinc oxide, or related materials in nitric acid:
- Zn + 2 HNO3 → Zn(NO3)2 + H2
- ZnO + 2 HNO3 → Zn(NO3)2 + H2O
These reactions are accompanied by the hydration of the zinc nitrate.
The anhydrous salt arises by the reaction of anhydrous zinc chloride with nitrogen dioxide:[1]
- ZnCl2 + 4 NO2 → Zn(NO3)2 + 2 NOCl
Reactions[edit]
Treatment of zinc nitrate with acetic anhydride gives zinc acetate.[2]
On heating, zinc nitrate undergoes thermal decomposition to form zinc oxide, nitrogen dioxide and Oxygen:
- 2 Zn(NO3)2 → 2 ZnO + 4 NO2 + 1 O2
Applications[edit]
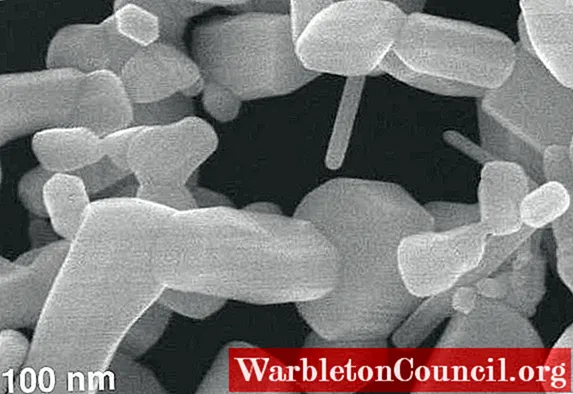
Zinc nitrate has no large scale application but is used on a laboratory scale for the synthesis of coordination polymers.[3] Its controlled decomposition to zinc oxide has also been used for the generation of various ZnO based structures, including nanowires.[4]
It can be used as a mordant in dyeing. An example reaction gives a precipitate of zinc carbonate:
- Zn(NO3)2 + Na2CO3 → ZnCO3 + 2 NaNO3
References[edit]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 455. ISBN 978-0-08-037941-8.
- ^ O. F. Wagenknecht; R. Juza (1963). «Zinc Acetate». In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 2. NY,NY: Academic Press. p. 1087.
- ^ Barnett, Sarah A; Champness, Neil R (November 2003). «Structural diversity of building-blocks in coordination framework synthesis—combining M(NO3)2 junctions and bipyridyl ligands». Coordination Chemistry Reviews. 246 (1–2): 145–168. doi:10.1016/S0010-8545(03)00121-8.
- ^ Greene, Lori E.; Yuhas, Benjamin D.; Law, Matt; Zitoun, David; Yang, Peidong (September 2006). «Solution-Grown Zinc Oxide Nanowires». Inorganic Chemistry. 45 (19): 7535–7543. doi:10.1021/ic0601900. PMID 16961338.
- v
- t
- e
Salts and covalent derivatives of the nitrate ion
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
2ZnSO4 → 2ZnO + 2SO2 + O2
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например, тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами.
Например, гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2NaHCO3
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
K2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2KHCO3
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например, с соляной кислотой:
Na2[Zn(OH)4] + 4HCl(избыток) → 2NaCl + ZnCl2 + 4H2O
Правда, под действием небольшого количества (недостатка) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Na2[Zn(OH)4] + 2НCl(недостаток) → Zn(OH)2↓ + 2NaCl + 2H2O
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Na2[Zn(OH)4] + 2HNO3(недостаток) → Zn(OH)2↓ + 2NaNO3 + 2H2O
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Na2[Zn(OH)4] → Na2ZnO2 + 2H2O↑
K2[Zn(OH)4] → K2ZnO2 + 2H2O↑
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn2+ + H2O = ZnOH+ + H+
II ступень: ZnOH+ + H2O = Zn(OH)2 + H+
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
ZnO + Na2O → Na2ZnO2
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка:
K2ZnO2 + 4HCl (избыток) → 2KCl + ZnCl2 + 2H2O
СaZnO2 + 4HCl (избыток) = CaCl2 + ZnCl2 + 2H2O
Na2ZnO2 + 4HNO3 → Zn(NO3)2 + 2NaNO3 + 2H2O
Na2ZnO2 + 2H2SO4 → ZnSO4 + Na2SO4 + 2H2O
Под действием избытка воды цинкаты переходят в комплексные соли:
K2ZnO2 + 2H2O = K2[Zn(OH)4]
Na2ZnO2 + 2H2O = Na2[Zn(OH)4]
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
ZnS + 8HNO3(конц.) → ZnSO4 + 8NO2 + 4H2O
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
ZnS + 4H2SO4(конц.) = ZnSO4 + 4SO2 + 4H2O
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr

Содержание
- Получение
- Физические свойства
- Применение
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
| Нитрат цинка | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Хим. формула | Zn(NO3)2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 12825; 125073 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2] |
| InChI |
1S/2NO3.Zn/c2*2-1(3)4;/q2*-1;+2 ONDPHDOFVYQSGI-UHFFFAOYSA-N |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Безопасность | |
| Пиктограммы СГС |     |
Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Применение
- Протрава при крашении тканей.
Содержание
- Состав
- Номенклатура
- Свойства
- Физическое состояние
- Молекулярный вес
- Температура плавления
- Точка кипения
- Плотность
- Растворимость
- pH
- Химические свойства
- Получение
- Приложения
- В катализе реакций
- В композитных полимерах
- В оксидных цементах
- В покрытиях из оксида цинка и наноматериалах
- В гербицидах
- В производстве анодов
- Другие приложения
- Возможное использование в инженерии костной ткани
- Риски
- Ссылки
В нитрат цинка Это неорганическое соединение, образованное элементами цинка (Zn), азота (N) и кислорода (O). Степень окисления цинка +2, азота +5 и кислорода -2.
Его химическая формула — Zn (NO3)2. Это бесцветное кристаллическое твердое вещество, которое имеет тенденцию поглощать воду из окружающей среды. Его можно получить, обработав металлический цинк разбавленной азотной кислотой. Это сильно окисляющее соединение.
Он служит ускорителем реакций органической химии и позволяет получать композитные полимеры с электропроводящими свойствами. Он используется для формирования слоев материалов, используемых в электронике.
Он входит в состав некоторых жидких удобрений и некоторых гербицидов с медленным высвобождением. Помогает в получении сложных оксидов, улучшая их плотность и электропроводность.
Он был успешно протестирован при получении структур, которые служат основой для регенерации и роста костной ткани, улучшают этот процесс и являются эффективным антибактериальным средством.
Хотя он негорючий, он может ускорить горение таких веществ, как уголь или органические материалы. Он раздражает кожу, глаза и слизистые оболочки и очень токсичен для водных организмов.
Состав
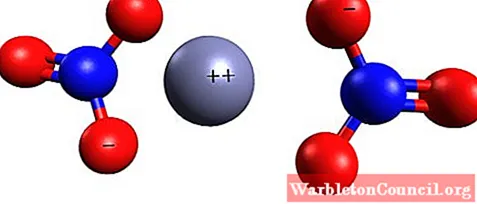
Нитрат цинка — ионное соединение. Имеет двухвалентный катион (Zn2+) и два одновалентных аниона (NO3–). Нитрат-анион — это многоатомный ион, образованный атомом азота в степени окисления +5, ковалентно связанным с тремя атомами кислорода с валентностью -2.
На изображении ниже показана пространственная структура этого соединения. Центральная серая сфера — это цинк, синие сферы — азот, а красные сферы — кислород.
Номенклатура
- Нитрат цинка
- Динитрат цинка
Свойства
Физическое состояние
Бесцветное или белое кристаллическое твердое вещество.
Молекулярный вес
189,40 г / моль
Температура плавления
Примерно 110 ºC.
Точка кипения
Примерно 125 ºC.
Плотность
2,065 г / см3
Растворимость
Растворим в воде: 120 г / 100 г H2Или при 25 ° С. Растворим в спирте.
pH
Его водные растворы кислые. 5% раствор имеет pH примерно 5.
Химические свойства
Будучи нитратом, это соединение является сильным окислителем. Реагирует бурно с углеродом, медью, сульфидами металлов, органическими веществами, фосфором и серой. Если его распылить на раскаленный уголь, он взорвется.
С другой стороны, он гигроскопичен и впитывает воду из окружающей среды. При нагревании образует оксид цинка, диоксид азота и кислород:
2 Zn (NO3)2 + тепло → 2 ZnO + 4 NO2↑ + O2↑
В щелочных растворах, таких как NaOH, цинк в этом соединении образует гидроксид и другие сложные формы:
Zn (НЕТ3)2 + 2 ОН– → Zn (OH)2 + 2 НЕТ3–
Zn (OH)2 + 2 ОН– → [Zn (OH)4]2-
Получение
Его можно получить обработкой цинка или оксида цинка разбавленной азотной кислотой. В этой реакции образуется газообразный водород.
Zn + 2 HNO3 → Zn (NO3)2 + H2↑
Приложения
В катализе реакций
Он используется в качестве катализатора для получения других химических соединений, таких как смолы и полимеры. Это кислотный катализатор.
Другой случай ускорения реакций — каталитическая система Zn (NO3)2/ VOC2ИЛИ4, который позволяет окислять α-гидроксиэфиры до α-кетоэфиров с конверсией 99% даже при атмосферном давлении и температуре.
В композитных полимерах
Полиметилметакрилат и Zn (NO3)2 со свойствами электропроводности, которые делают их подходящими кандидатами для использования в суперконденсаторах и высокоскоростных компьютерах.
В оксидных цементах
С помощью водных растворов нитрата цинка и порошка оксида цинка получают материалы, которые относятся к классу цементов, образующихся в результате кислотно-щелочной реакции.
Они обладают разумной устойчивостью к растворению в разбавленных кислотах и щелочах, развивая сопротивление сжатию, сравнимое с сопротивлением других цементов, таких как оксихлориды цинка.
Это свойство увеличивается по мере того, как ZnO / Zn (NO3)2, а как концентрация Zn (NO3)2 в растворе. Полученные цементы полностью аморфны, то есть не имеют кристаллов.
В покрытиях из оксида цинка и наноматериалах
Zn (НЕТ3)2 Он используется для электролитического осаждения очень тонких слоев оксида цинка (ZnO) на различные подложки. Наноструктуры из этого оксида также изготавливаются на поверхностях.
ZnO представляет собой материал, представляющий большой интерес из-за множества применений в области оптоэлектроники, он также обладает полупроводниковыми свойствами и используется в датчиках и преобразователях.
В гербицидах
Нитрат цинка использовался в сочетании с некоторыми органическими соединениями для замедления скорости высвобождения определенных гербицидов в воду. Медленный выпуск этих продуктов позволяет им оставаться доступными в течение более длительного времени и требует меньшего количества приложений.
В производстве анодов
Он стимулирует процесс спекания и улучшает плотность некоторых оксидов, которые используются для изготовления анодов для топливных элементов. Спекание — это получение твердого материала путем нагревания и сжатия порошка без его плавления.
Испытанные материалы представляют собой сложные оксиды стронция, иридия, железа и титана. Присутствие цинка значительно увеличивает их электропроводность.
Другие приложения
Используется при получении лекарств. Он действует как протрава при нанесении чернил и красителей. Служит латексным коагулянтом. Это источник цинка и азота в жидких удобрениях.
Возможное использование в инженерии костной ткани
Этот состав использовался в качестве добавки при разработке каркасов или каркасов для регенерации костных волокон, поскольку он позволяет улучшить механическое сопротивление этих структур.
Было обнаружено, что цинкосодержащий каркас не токсичен для клеток-остеопрогениторов, поддерживает активность остеобластов, клеток, образующих кость, и улучшает их адгезию и пролиферацию.
Он способствует образованию апатита, минерала, образующего кости, а также обладает антибактериальным действием.
Риски
Это материал с потенциальной опасностью пожара и взрыва.
Он не горюч, но ускоряет горение горючих материалов. При попадании большого количества этого соединения в пожар или если горючий материал мелко измельчается, может произойти взрыв.
При воздействии сильной жары выделяются токсичные газы оксидов азота. А если выдерживать длительное время, она может взорваться.
Он раздражает кожу, может вызвать серьезное повреждение глаз, раздражение дыхательных путей, токсичен при проглатывании и вызывает повреждение пищеварительного тракта.
Очень токсично для водных организмов с долгосрочными последствиями.
Ссылки
- Ju, Y. et al. (2019). Новый эффект нитрата цинка / ванадилоксалата для селективного каталитического окисления сложных эфиров ALFA-гидрокси в сложные эфиры ALFA-кето с молекулярным кислородом: исследование ATR-IR in situ. Molecules 2019, 24, 1281. Восстановлено с mdpi.com.
- Мохд С., С.Н. и другие. (2020). Состав с контролируемым высвобождением нитрата гидроксида цинка, интеркалированного додецилсульфатом натрия и анионами биспирибака: новый гербицидный нанокомпозит для выращивания риса. Arabian Journal of Chemistry 13, 4513-4527 (2020). Восстановлено из научной директивы.
- Мани, М. и другие. (2019). Повышенная механическая прочность и минерализация костей биомиметического каркаса из электроспрядника, насыщенного маслом иланг-иланга и нитратом цинка для инженерии костной ткани. Полимеры 2019, 11, 1323. Восстановлено с mdpi.com.
- Ким, К. и другие. (2018). Влияние нитрата цинка как спекающей добавки на электрохимические характеристики Sr0,92Y0,08Дядя3-ДЕЛЬТА и Sr0,92Y0,08Вы0,6Вера0,4ИЛИ3-ДЕЛЬТА Ceramics International, 44 (4): 4262-4270 (2018). Восстановлено с sciencedirect.com.
- Прасад, Б. и другие. (2012). Электроосаждение покрытия ZnO из водного Zn (NO3)2 ванны: влияние концентрации Zn, температуры и времени осаждения на ориентацию. J. Solid State Electrochem 16, 3715-3722 (2012). Восстановлено с link.springer.com.
- Бахадур, Х., Шривастава, А.К. (2007). Морфология золь-гель-производных тонких пленок ZnO с использованием различных исходных материалов и их наноструктур. Nanoscale Res Lett (2007) 2: 469-475. Восстановлено с link.springer.com.
- Николсон, Дж. и Тибальди, Дж. (1992). Образование и свойства цемента, приготовленного из оксида цинка и водных растворов нитрата цинка. J Mater Sci 27, 2420-2422 (1992). Восстановлено с link.springer.com.
- Лиде, Д. (редактор) (2003). CRC Справочник по химии и физике. 85th CRC Press.
- Maji, P. et al. (2015). Влияние Zn (NO3)2 наполнитель по диэлектрической проницаемости и электрическому модулю ПММА. Bull Mater Sci 38, 417-424 (2015). Восстановлено с link.springer.com.
- НАС. Национальная медицинская библиотека. (2019). Нитрат цинка. Получено с pubchem.ncbi.nlm.nih.gov.
- Byju’s. (2020). Нитрат цинка — Zn (NO3) 2. Получено с byjus.com.
- Американские элементы. Нитрат цинка. Получено с сайта americanelements.com.
- Коттон, Ф. Альберт и Уилкинсон, Джеффри. (1980). Продвинутая неорганическая химия. Четвертый выпуск. Джон Вили и сыновья.