| Нитрат алюминия | |
|---|---|
  |
|
| Систематическое наименование |
Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий, нитрат алюминия, тринитрат алюминия, алюминия III нитрат |
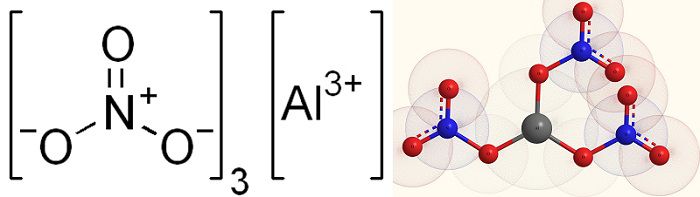
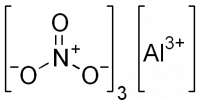
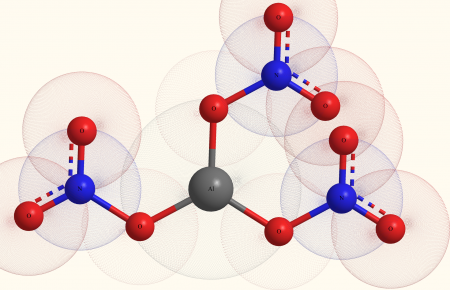
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89 |
| Температура | |
| • плавления | 66 °C (с разл.); нонагидрат: 73,5 |
| Энтальпия | |
| • образования | − 927 кДж/моль; нонагидрат: − 3757; гексагидрат: − 2871 кДж/моль |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9 |
| • в в метаноле | при 35 °C: 14,45 |
| • в в этаноле | при 35 °C: 8,63 |
| • в в этиленгликоле | при 35 °C: 18,32 |
| Кристаллическая структура | моноклинная |
| Рег. номер CAS | 13473-90-0 7784-27-2 (нонагидрат) |
| PubChem | 16713320 |
| Рег. номер EINECS | 236-751-8 |
| SMILES |
[Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/Al.3NO3/c;3*2-1(3)4/q+3;3*-1 JLDSOYXADOWAKB-UHFFFAOYSA-N |
| RTECS | BD1040000 BD1050000 (нонагидрат) |
| ChemSpider | 24267 |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 3.1 Лабораторные методы
- 3.2 Промышленное производство
- 4 Применение
- 5 Опасность
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
|---|---|---|---|---|---|---|---|---|
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу:
- Al(NO3)3 + 4 H2O ⇆ [Al(H2O)4]3+ + 3 NO3−
- [Al(H2O)4]3+ + H2O ⇆ [Al(H2O)3(OH)]2+ + H3O+
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.
- При нагревании гидролиз можно провести полностью:
- Al(NO3)3 + 3 H2O = Al(OH)3 ↓ + 3 HNO3 ↑
- Вступает в реакцию со щелочами:
- Al(NO3)3 + 3 NaOH = Al(OH)3 ↓ + 3 NaNO3
- Al(NO3)3 + 4 NaOH = Na[Al(OH)4] + 3 NaNO3
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоде:
- Al(NO3)3 + 3 NH3 + 3 H2O = Al(OH)3 ↓ + 3 NH4NO3
- При нагревании:
- Al(NO3)3 + 3 NH3 + 3 H2O = AlO(OH) ↓ + 3 NH4NO3 + H2O
- При нагревании разлагается:
- 4 Al(NO3)3 = 2 Al2O3 + 12 NO2 ↑ + 3 O2 ↑
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
- 8 Al + 30 HNO3 = 8 Al(NO3)3 + 3 N2O ↑ + 15 H2O
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
- Al(OH)3 + 3 HNO3 = Al(NO3)3 + 3 H2O
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
- Al2(SO4)3 + 3 Ba(NO3)2 = 2 Al(NO3)3 + 3 BaSO4 ↓
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота V (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
- Al(NO3)3 ⋅ 9 H2O + 9 N2O5 ⟶ Al(NO3)3+ 18 HNO3 (1)
- AlCl3 + 3 ClNO3 ⟶ Al(NO3)3 + 3 Cl2 (2)
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота V:
- Al2O3 + 3 N2O5 ⟶ 2 Al(NO3)3
- Al(OH)3 + 3 N2O5 ⟶ Al(NO3)3 + 3 HNO3
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
- 2 AlBr3 + 8 N2O5 = 2 [NO2]− [Al(NO3)4]+ + 3 Br2 + 6 NO2
- 2 [NO2]− [Al(NO3)4] = 2 Al(NO3)3 + 4 NO2 + O2
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.
Нитрат алюминия — это неорганическое вещество, соль алюминия и азотной кислоты. Широко применяется в промышленности, раствор нитрата необходим для прокрашивания тканей, востребован в качестве реагента на предприятиях, используется в металлургии, при изготовлении трансформаторов, на нефтеперерабатывающих заводах. Нитрат алюминия малоопасен для здоровья, но может вызвать взрыв и возгорание.
Содержание
- Что такое нитрат алюминия, формула, виды
- Физические свойства, внешний вид
- Химические свойства
- Реакции с нитратом алюминия
- Производство и получение
- Применение
- Применение алюминия нитрата в текстильной и химической промышленности
- Применение алюминия нитрата в электротехнике и нефтепереработке
- Опасность, токсичность, меры предосторожности
- Где купить и сколько стоит
- Заключение
Что такое нитрат алюминия, формула, виды
Нитрат алюминия представляет собой соединение амфотерного металла алюминия и остатка азотной кислоты. Формула – Al(NO3)3. Один атом алюминия удерживает три нитратные группировки за счёт валентности, равной трём.
В природе существует несколько видов нитратов алюминия, которые отличаются наличием гидроксильных группировок в составе:
- AlOH(NO3)2;
- Al(OH)2NO3.
За счёт свойства алюминия впитывать влагу образуются гидратированные соли, гидраты: нонагидрат – Al(NO3)3 ∙ 9H2O, а также вещества ряда Al(NO3)3 ∙ xH2O, где х → 4, 6, 8, 9.
Физические свойства, внешний вид
Нитрат алюминия – это белый либо бесцветный мелкокрупинчатый кристаллический порошок. Характеризуется высокой гигроскопичностью, легко поглощает влажность и комкается. За счёт этого свойства алюминия нитрата он дымится на открытом воздухе. Обладает хорошей растворимостью, смешивается с водой, в том числе холодной. Растворяется в полярных органических растворителях: спирте, ацетоне, феноле, эфирах. Раствор нитрата алюминия даёт кислую реакцию среды за счёт выделения большого количества ионов H+. В горячей воде нитрат алюминия разлагается.
Неустойчив к температурным воздействиям. Температура плавления составляет 66 °С, в условиях вакуума возгонка проходит при 55 °С. Напитавшийся влагой нитрат алюминия немного изменяется. Нонагидрат – расплывающиеся кристаллы, при нагревании до 73 °С отдаёт присоединённые молекулы воды.
Химические свойства
Нитрат алюминия проявляет двойственные химические свойства за счёт амфотерности металла – способности функционировать как кислота и основание. Его широкие реакционные возможности определяют повсеместное применение. Для нитрата алюминия характерен обмен с выпадением осадка или необратимым гидролизом. Действует как сильный окислитель.
Реакции с нитратом алюминия
Структурная формула и молекула нитрата алюминия
Нитрат алюминия реагирует с едкой щелочью, находящейся в недостатке. При этом в осадок отделяется белый гидроксид алюминия:
Al(NO3)3 + 3NaOH → 3NaNO3 + Al(OH)3↓
При воздействии избытка едкого натра продукты меняются, образуется комплексный тетрагидроксоалюминат:
Al(NO3)3 + 4NaOH → Na[Al(OH)4] + 3NaNO3
Нитрат алюминия реагирует с фосфатами, формируя аморфный триалюминийфосфат:
Al(NO3)3 + Na3PO4 → AlPO4↓ + 3NaNO3
Реакция с полным разложением итоговой смеси соединений возможна, поскольку нитрат алюминия реагирует с водным раствором карбоната:
2Al(NO3)3 + 3Na2CO3 + 3H2O → 2Al(OH)2 + 3CO2↑ + 6NaNO3
При прокаливании до 200 °С запускается реакция термолиза, идёт разложение на составляющие компоненты: бурый газ и кислород, оксид.
4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑
Нитрат алюминия реагирует с водой, формируется раствор нитрата, в котором ступенчато протекает реакция распада. Она обратима. При этом идёт по катиону, поскольку соль образована слабым основанием и сильной кислотой. В результате равновесие смещается влево, а значение pH – в кислотную сторону (менее 7).
Al(NO3)3 + H2O → AlOH(NO3)2 + H+ +NO3–
Нитрат алюминия реагирует с раствором аммиака. На холоду реакция даёт нерастворимую гидрооксиь алюминия и аммиачную селитру:
Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4NO3
При подогревании раствора нитрата наблюдается изменение состава выхода:
Al(NO3)3 + 3NH3 + 3H2O → AlO(OH)↓ + 3NH4NO3 + H2O
Производство и получение
Нитрат алюминия в лабораторных условиях получают путём растворения металлического алюминия в кислоте:
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O↑ + 15H2O
Схожего результата можно добиться действием на раствор гидроксида алюминия:
Al(OH)3 + 3HNO3 → Al(NO3)3 +3H2O
Возможна добыча реактива при применении сульфата алюминия с нитратом бария:
Al(SO4)3 + 3Ba(NO3)2 → 2Al(NO3)3 + 3BaSO4↓
В промышленных масштабах нитрат алюминия получают окислением оксида алюминия при участии пентаоксида диазота:
Al2O3 + N2O5 → 2Al(NO3)3
Иногда для этого используют бромиды, однако технология усложняется прохождением синтеза в две стадии.
Применение
Применение алюминия нитрата распространилось на многие сферы, но из-за специфического физико-химического состава он наиболее востребован в химии, текстиле и кожевенном деле. Его часто используют для выпуска ламп накаливания, построения электротрансформаторов, в качестве антикоррозийного напыления.
Применение алюминия нитрата в текстильной и химической промышленности
Вещество в растворе применяется для усиления окраски тканей благодаря свойству алюминия нитрата проникать вглубь нитей. Он действует как протрава – агент, закрепляющий на волокнах частички пигмента. При этом нитрат алюминия бережен по отношению к качеству материала. Его добавляют для сохранения яркого и насыщенного цвета на долгое время.
Поскольку нитрат алюминия – сильный окислитель, взаимодействующий с органикой, что важно для дубления кожи. Он влияет на белковый комплекс на поверхности, делая кожу менее восприимчивой к воздействию отрицательных температур и растяжения. Чаще всего нитрат вносят на этапе замачивания.
Нитрат алюминия – ценный реактив, необходимый для органического и неорганического синтеза. На его основе получают различные газы и соли алюминия, работает как катализатор, ускоряющий процессы превращения веществ.
Применение алюминия нитрата в электротехнике и нефтепереработке
Нитрат алюминия нужен при производстве нитей накаливания – основного компонента ламп. Его также применяют для создания изоляционной бумаги, которая обеспечивает электроизоляцию. Нитрат алюминия — это основной компонент специальных губок для инновационной очистки сырой нефти, применяющихся на нефтяных заводах. Пористый по физическим свойствам материал быстро впитывает летучие алканы, образующиеся при переработке. Это значительно удешевляет процесс очистки.
Соединение можно встретить в тонком строении электротрансформаторов: в их нагревательных элементах, слоистых сердечниках. В дезодорантах добавка нитрата алюминия способствует закупориванию пор и уменьшению потливости, а также адсорбирует выделяющийся запах.
Опасность, токсичность, меры предосторожности
Нитрат алюминия относится к 4 классу опасности. При контакте с открытыми участками кожи и слизистой вызывает раздражение и покраснение, поэтому необходимо при работе с ним надевать защитные перчатки и очки, избегать вдыхания. Реактив пожаро- и взрывоопасен, его следует хранить вдали от источников тепла и прямого солнечного света.
Где купить и сколько стоит
Нитрат алюминия продаётся заводами-производителями в оптовых количествах: от 25 кг. Цена составляет 160-200 руб/кг. Его можно купить в специализированных интернет-магазинах, стоимость реагента от 1500 руб/кг.
Заключение
Нитрат алюминия – это очень гигроскопичная соль с высокой реакционной активностью. Она востребована для окрашивания тканей, выделки кожи, переработки нефтепродуктов, создания электротехнических устройств.
Читайте также:
- Сульфат алюминия: свойства, применение
- Хлорид алюминия: свойства, применение
- Алюмосиликаты: свойства, виды, получение, применение
- Оксид магния: описание, польза и вред, применение, реакции
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Формула нитрата алюминия
Определение и формула нитрата алюминия
Хорошо растворяется в воде (гидролизуется по катиону). Растворяется в азотной кислоте. Реагирует со щелочами, гидратом аммиака.
Рис. 1. Нитрат алюминия. Внешний вид.
Химическая формула нитрата алюминия
Химическая формула нитрата алюминия Al(NO3)3. Она показывает, что в состав данной молекулы входят один атом алюминия (Ar = 27 а.е.м.), три атома азота (Ar = 14 а.е.м.) и девять атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата алюминия:
Mr(Al(NO3)3) = Ar(Al) + 3×Ar(N) + 9×Ar(O);
Mr(Al(NO3)3) = 27 + 3×14 + 9×16 = 27 + 42 + 144 = 213.
Графическая (структурная) формула нитрата алюминия
Структурная (графическая) формула нитрата алюминия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
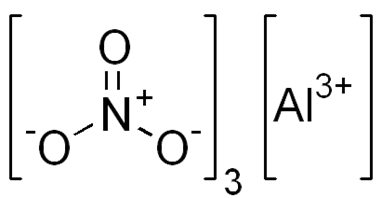
Ионная формула
Нитрат алюминия представляет собой электролит, который диссоциирует на ионы в водном растворе согласно следующему уравнению реакции:
Al(NO3)3 ↔ Al3+ + 3NO3—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Содержание
- Физические свойства
- Химические свойства
- Получение
- Лабораторные методы
- Промышленное производство
- Применение
- Опасность
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
| Нитрат алюминия | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий; нитрат алюминия(+3), тринитрат алюминия, алюминия (III) нитрат |
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89 |
| Термические свойства | |
| Температура | |
| • плавления | 66 °C (с разл.); нонагидрат: 73,5 |
| Энтальпия | |
| • образования | − 927 кДж/моль; нонагидрат: − 3757; гексагидрат: − 2871 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9 |
| • в в метаноле | при 35 °C: 14,45 |
| • в в этаноле | при 35 °C: 8,63 |
| • в в этиленгликоле | при 35 °C: 18,32 |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 13473-90-0 7784-27-2 (нонагидрат) |
| PubChem | 16713320 |
| Рег. номер EINECS | 236-751-8 |
| SMILES |
[Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/Al.3NO3/c;3*2-1(3)4/q+3;3*-1 JLDSOYXADOWAKB-UHFFFAOYSA-N |
| RTECS | BD1040000 BD1050000 (нонагидрат) |
| ChemSpider | 24267 |
| Безопасность | |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Токсичность | Низкая |
| NFPA 704 |
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу:
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.
- При нагревании гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоде:
- При нагревании:
- При нагревании разлагается :
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V):
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.