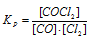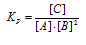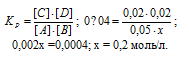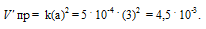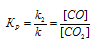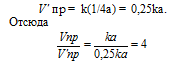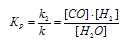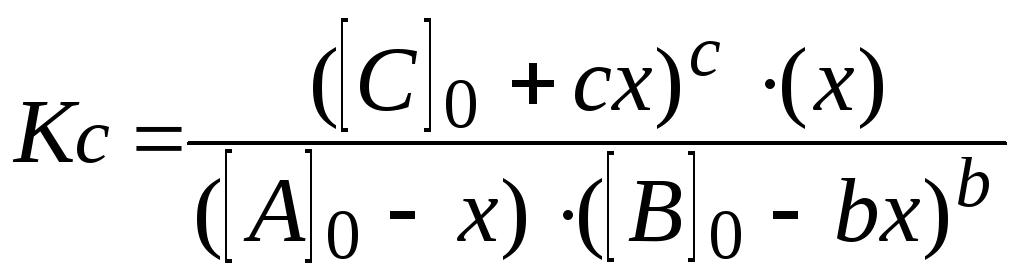Как найти исходную концентрацию вещества зная равновесную
Тип 23 № 30429
В реакторе постоянного объёма смешали оксид азота(II) и кислород. Быстро установилось равновесие:
(Другие процессы в системе не протекают.)
Используя данные таблицы, найдите исходную концентрацию и равновесную концентрацию
| Вещество | ||
|---|---|---|
| Исходная концентрация (моль/л) | 0,24 | |
| Равновесная концентрация (моль/л) | 0,54 | 0,18 |
Выберите из списка номера правильных ответов.
Запишите выбранные номера в таблицу под соответствующими буквами
Так как объем системы постоянен (по условию), то количества веществ в системе пропорциональны их концентрациям. Согласно уравнению обратимой реакции:
на образование 2 моль оксида азота(IV) тратится 2 моль оксида азота(II) и 1 моль кислорода. Отсюда следует, что на образование 0,18 моль оксида азота(IV) потребовалось 0,18 моль оксида азота(II) и 0,09 моль кислорода. Тогда исходная концентрация определяемая как сумма прореагировавшего количества вещества и равновесного (на единицу объема), будет равна Равновесная концентрация равна разности исходного количества вещества и прореагировавшего (в единице объема). Следовательно, равновесная концентрация равна
Решаем сложные задачи по химии (с использованием константы равновесия)
материал для подготовки к егэ (гиа) по химии (11 класс) на тему
Равновесие во многих системах, в том числе и в растворах электролитов, можно количественно описать с помощью константы равновесия. Многие школьники испытывают трудности при решении задач с использованием понятий « константа равновесия». В данном материале рассматривается решение задач с использованием константы равновесия.
Скачать:
| Вложение | Размер |
|---|---|
| ravnovesie_vo_mnogih_sistemah.docx | 25.77 КБ |
Предварительный просмотр:
РЕШАЕМ СЛОЖНЫЕ ЗАДАЧИ
( с использованием константы равновесия)
Равновесие во многих системах, в том числе и в растворах электролитов, можно количественно описать с помощью константы равновесия. Многие школьники испытывают трудности при решении задач с использованием понятий « константа равновесия», « константа диссоциации слабого электролита» и т.п. Попробуем рассмотреть решение задач на равновесие, переходя от решения простых задач к решению более сложных.
- Задача 1.
В системе А(г) + 3В(г) = 2С(г) , равновесные концентрации равны :
[А] = 0,03 моль/л, [В] = 0,10 моль/л, [С] = 0,40 моль/л. Найдите исходные концентрации веществ А и В и рассчитайте константу равновесия.
Константа равновесия для данной реакции выражается уравнением:
Подставляем в него данные задачи, получаем:
Для нахождения исходных концентраций веществ А и В запишем данные задачи в виде таблицы (так будет нагляднее):
(исходя из уравнения реакции)
Осталось или образовалось
Предположим, что исходные концентрации веществ [А] 0 и [В] 0 соответственно равны Х моль/л и У моль/л. Зная, что исходная концентрация вещества [С] 0 = 0 моль/л (С – это продукт реакции, которого изначально быть не могло ), мы можем найти сколько моль вещества С прореагировало в результате реакции в каждом литре системы : 0,4 – 0 = 0,4 моль. А так как по уравнению реакции из 1 моль вещества А и 3 моль вещества В образуется 2 моль вещества С, можно вычислить сколько моль А и В прореагирует в каждом литре системы:
А + 3В = 2С ( все вещества – газообразны):
1 3 2 (по уравнению)
Находим ? для вещества А: 0,2 моль и ? для вещества В : 0,6 моль и вписываем в строку « Прореагировало» таблицы. Осталось посчитать исходные концентрации веществ А и В (складываем «прореагировало» и «осталось», так как ищем сколько «было»):
[А] 0 = Х = 0,03 + 0,2 = 0,23 моль/л
[В] 0 = У = 0,1 + 0,6 = 0,7 моль/л
- Ответ: [А] 0 = 0,23 моль/л; [В] 0 = 0,7 моль/л; К р = 5333
- Задача 2.
Исходные концентрации СО и паров воды равны и составляют 0,03 моль/л.
В системе СО + Н 2 О = СО 2 + Н 2 вычислите равновесные концентрации СО;
Н 2 О; Н 2 , если равновесная концентрация [СО 2 ] равна 0,01 моль/л. Вычислите константу равновесия.
Вычисление константы равновесия системы и исходных концентраций реагирующих веществ
Задание 128.
В гомогенной системе СО + Сl2 ↔ СОСl2 равновесные концентрации реагирующих веществ (моль/л): [СО] = 0,2; [Сl2] = 0,3; [СОСl2] = 1,2. Вычислите константу равновесия системы и исходные концентрации Сl2 и СО. Ответ:
К р = 20; [С12]исх = 1,5 молы/л; [СO]исх = 1.4 молы/л.
Решение:
Уравнение реакции имеет вид:
Выражение константы равновесия данной реакции имеет вид:
Подставляя в него данные задачи, получим:
Кр = 1,2/(0,2 . 0,3) = 20.
Для нахождения исходных концентраций веществ СО и Cl2 учтём, что, согласно уравнению реакции, из 1 моль Со и 1 моль Cl2 образуется 1 моль COCl2. Поскольку по условию задачи в каждом литре системы образовалось 1,2 моль COCl2, то при этом было израсходовано 1,2 моль СО и 1,2 моль Cl2. Таким образом, искомые исходные концентрации равны:
Ответ: К = 20; [С12]исх = 1,5 молы/л; [СO]исх = 1.4 молы/л.
Задание 129.
В гомогенной системе А + 2В = С равновесные концентрации реагирующих газов (молы/л): [А] = 0,06; [В] = 0,12; [С] = = 0,216. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 250; [А] = 0,276 моль/л; [В] = 0,552 моль/л.
Решение:
Уравнение реакции имеет вид:
Выражение константы равновесия данной реакции имеет вид:
Подставляя в него данные задачи, получим:
Кр = 0,216/[0,06 . (0,12)2] = 250.
Для нахождения исходных концентраций веществ А и В учтём, что, согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль C. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль C, то при этом было израсходовано 0,216 моль А и 0,432 моль В.
Таким образом, искомые исходные концентрации равны:
[А]исх = 0,06 + 0,216 = 0,276 молы/л;
[В]исх = 0,12 + 0,432 = 0,552 молы/л.
Ответ: Кр = 250; [А] = 0,276 моль/л; [В] = 0,552 моль/л.
Задание 130.
В гомогенной газовой системе А + В С ↔ С + D равновесие установилось при концентрациях (моль/л): [В] = 0,05 и [С] 0,02. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А] = 0,22 моль/л; [В] = =0,07 молы/л.
Решение:
Уравнение реакции имеет вид:
Обозначим исходную концентрацию вещества А через х. По уравнению реакции в результате взаимодействия веществ А и В образуются одинаковые количества вещества С и D, т. е. равновесные концентрации продуктов будут равны: [С] = [D] = 0,02 моль/л. Подставляем равновесные концентрации веществ в выражение константы равновесия:
Поскольку по условию задачи в каждом литре системы образовалось 0,02 моль веществ C и D, то при этом было израсходовано 0,02 моль А и 0,02 моль В. Таким образом, искомые исходные концентрации равны:
[А]исх = 0,2 + 0,02 = 0,22 молы/л;
[В]исх = 0,05 + 0,02 = 0,07 молы/л.
Ответ: [А] = 0,22 моль/л; [В] = =0,07 молы/л.
Скорость реакции
Задание 131.
Константа скорости реакции разложения N2O, протекающей по уравнению 2N 2 O = 2N 2 + О 2, равна 5 . 10 -4 . Начальная концентрация N2О равна 6,0 моль/л. Вычислите начальную скорость реакции и её скорость, когда разложится 50% N2O. Ответ: 1,8 . 10-2; 4,5 . 10 -3 .
Решение:
Уравнение реакции имеет вид:
Обозначим начальную концентрацию исходного вещества: [N2O] = a. Согласно закону действующих масс, скорость прямой реакции до изменения концентрации N2O равна:
Vпр = ka2 = 5 . 10 -4 . (6) 2 = 1,8 . 10 -2 .
После разложения 50% N2O, концентрация его будет равна 3 моль/л (50 . 6/100 = 3). При новой концентрации N2O скорость прямой реакции ( пр) равна:
Ответ: 1,8 . 10 -2 ; 4,5 . 10 -3 .
Задание 132.
Напишите выражение для константы равновесия гетерогенной системы
СО2 + С ↔ 2СО. Как изменится скорость прямой реакции образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия системы:
При гетерогенной реакции учитываются только концентрации газообразных веществ. Обозначим концентрацию исходного вещества: [CO2] = a. Согласно закону действующих масс, скорость прямой реакции до изменения концентрации равна: Vпр = ka. После уменьшения концентрации СО2 в 4 раза её значение можно записать так: [CO2] = 1/4a. При новой концентрации СО2 скорость прямой реакции пр будет равна:
Следовательно, при уменьшении концентрации СО2 в 4 раза скорость прямой реакции уменьшится в 4 раза.Так как в данной системе происходит увеличение объёма (из 1 моль газообразного исходного вещества образуется
2 моль газообразного продукта реакции), то для смещения равновесия в данной системе в сторону прямой реакции – образовании СО надо уменьшить давление в системе.
Задание 133.
Напишите выражение для константы равновесия гетерогенной системы
С + Н2О (г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции — образования водяных паров?
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы. В выражении для гетерогенной системы концентрации твёрдых веществ не указываются. Выражение константы равновесия для данной реакции:
а) Смещение равновесия в сторону образования водяных паров можно достигнуть увеличением концентрации СО или Н2, так и уменьшением концентрации паров воды, так как, согласно принципу Ле Шателье, равновесие в системе сместится в сторону той реакции, которая ослабляет это воздействие.
б) Так как в данной системе из углерода и водяных паров образуются углекислый газ и водород, т. е. в данной системе увеличивается объём (из 1 моль газа образуется 2 моль газов), то для смещения равновесия в сторону образования паров воды надо увеличить давление.
Равновесие гомогенной системы
Задание 134.
Равновесие гомогенной системы
4НСI (г) + О 2 ↔ 2Н2О (г) + 2Сl2 (г)
установилось при следующих концентрациях реагирующих веществ (молы/л): [Н2O]P = 0,14; [С12]P = 0,14; [НС1]P = 0,20; [O2]р = О,32. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [НС1]исх = 0,48 моль/л; [О2]исх = 0,39 моль/л.
Решение:
Уравнение реакции имеет вид:
Для нахождения исходных концентраций хлороводорода и кислорода учтём, что согласно уравнению реакции из 4 моль HCl 1 моль О2 образуется 2 моль Н2О и 2 моль Cl2. Поскольку по условию задачи в каждом литре системы образовалось 0,14 моль Н2О и 0,14 моль Cl2, то при этом было израсходовано 0,14 . 4/2 = 0,28 моль HCl и ,
14 . 1/2 = 0,07 моль Cl2. Таким образом, искомые концентрации HCl и Cl2 равны:
Ответ: [НС1]исх = 0,48 моль/л; [О2]исх = 0,39 моль/л.
- Назад
- Вперёд
Зная
величины констант равновесия и используя
стехиометрические соотношения реакции
(закон сохранения массы), рассчитывают
равновесный состав продуктов по
следующей схеме.
-
Пишут
уравнение реакции.
2.
Пишут под формулами уравнения начальные
концентрации исходных веществ (в
моль/л). Если начальные концентрации
продуктов реакции не оговариваются в
условии задачи, они обычно принимаются
равными нулю.
3.
Принимают, что в ходе реакции до состояния
равновесия прореагировало x
моль/л какого-либо вещества. Обычно за
x
принимают изменение концентрации того
реагента, стехиометрический коэффициент
при котором в уравнении реакции
наименьший, чтобы избежать дробных
коэффициентов при неизвестном x.
Например, прореагировало x
моль/л вещества А.
4.
По уравнению реакции определяют изменение
концентраций других веществ.
5.
Определяют равновесные концентрации
веществ. При протекании реакции в прямом
направлении до состояния равновесия
происходит уменьшение концентраций
исходных веществ и увеличение концентраций
продуктов реакции.
А
+ b
В
c
С + D
начальное
состояние
А0
В0
С0
0
число молей
по уравнению
1 b
c
1
изменение
концентраций
x
b
x
c
x
x
равновесное
состояние
А0
—
x
В0
–
bx
С0
+ c
x
x
6.
Пишут выражение закона действующих
масс. Подставляют в него найденные
значения равновесных концентраций.
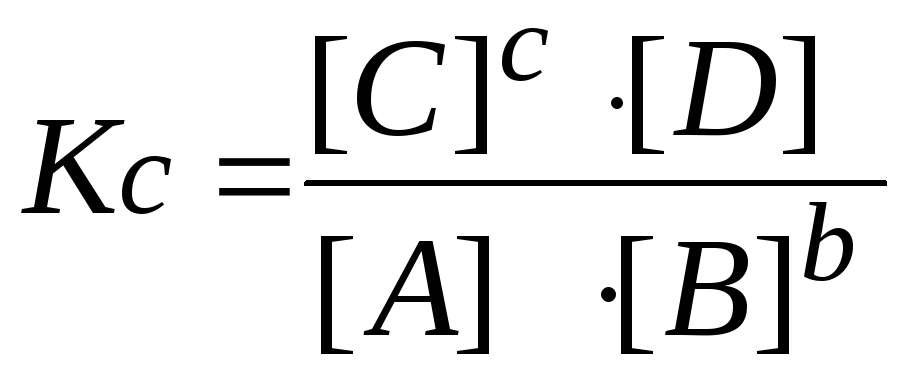
7.
Решают уравнение. При этом учитывают,
что отрицательный корень не имеет
физического смысла, и убыль концентрации
исходного вещества не может быть больше
величины самой концентрации (начальная
концентрация исходного вещества не
может быть меньше его остаточной
равновесной концентрации).
-
Находят
равновесные концентрации.
А
= А0—
x;
B
= B0
—
b
x;
C
= С0
+
cx;
D
=
x.
4. Смещение химического равновесия. Принцип Ле Шателье
Истинное
химическое равновесие является
динамическим и подвижным: изменение
внешних условий (температуры, давления,
концентраций реагирующих веществ) ведет
к смещению равновесия в сторону прямой
или обратной реакции.
Характер
влияния внешних факторов на равновесные
системы выражает принцип Ле Шателье.
Если
на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие,
то смещение равновесия происходит в
сторону той реакции (прямой или обратной),
которая ослабляет эффект внешнего
воздействия.
4.1. Изменение концентраций
Равновесное
состояние в системе
H2
(г)
+ I2
(г)
2 HI
(г)
характеризуется
(для одной и той же температуры) константой
равновесия:
.
Если,
например, в систему добавить водород,
т.е. увеличить его концентрацию, то
скорость прямой реакции увеличится (в
соответствии с законом действующих
масс):
пр
= kпр
[H2]
[I2],
пр
обр,
равновесие
сместится вправо. Концентрация
йодоводорода будет увеличиваться, а
концентрация водорода и йода будет
уменьшаться. Процесс будет протекать
до тех пор, пока не установится новое
равновесие. Новые равновесные концентрации
всех компонентов будут другими, но
соотношение между ними, определяемое
константой равновесия, останется
постоянным.
Если
в систему ввести дополнительное
количество йодоводорода, то скорость
обратной реакции увеличится:
обр
=
kобр
[HI]
2
,
обр
пр
,
равновесие
сместится влево.
В
соответствии с принципом Ле Шателье:
—
при увеличении концентрации какого-либо
из веществ, участвующих в равновесии,
равновесие смещается в сторону расхода
этого вещества;
—
при уменьшении концентрации какого-либо
из веществ равновесие смещается в
сторону образования этого вещества.
Удаление
из системы продуктов (или продукта)
реакции ведет к смещению равновесия
в сторону прямой реакции, а уменьшение
концентрации
исходных (или исходного) веществ,
приводит к сдвигу равновесия в направлении
обратной реакции.
Соседние файлы в папке Кинетика_лекции
- #
- #
- #
- #
Как решать задание 23 в ЕГЭ по химии в 2022-2023? Установить исходную концентрацию веществ, найти известное вещество, по которому будут проводиться расчеты. Затем провести расчеты по уравнению реакции и найти неизвестные концентрации.
Особенности задания
Как решать новое задание 23 в ЕГЭ по химии, которое появилось только в 2022 году? Разумеется, хорошенько подготовившись – аналогов этой задаче до сих пор не было, в 2023 году она будет использоваться лишь второй раз. Поэтому важно заранее получить максимум информации о том, как можно найти правильный ответ.
Прежде чем разбираться, как решать номер 23 в ЕГЭ по химии, отметим, что задание относится к повышенному уровню сложности. Соответственно, за правильное решение можно заработать два первичных балла. На выполнение отводится в среднем 5-7 минут.
В задании проверяются ваши знания и умения в следующих областях:
- Обратимые и необратимые химические реакции;
- Химическое равновесие и его смещение под воздействием различных факторов;
- Расчеты количества вещества, его массы или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
Если вкратце: вот как делать 23 задание на ЕГЭ по химии: проанализировать исходные данные и установить известные концентрации вещества. После этого произвести расчеты по уравнению реакции и вычислить неизвестные вещества.
Демонстрационные задания
А теперь на практике покажем, как решать задачи 23 в ЕГЭ по химии – используем несколько демонстрационных вариантов. Помните, что нет никакой гарантии, что именно эти задачки попадутся в вашем комплекте заданий. Но ими можно руководствоваться как примером.
Итак, первый вариант решения 23 номера ЕГЭ по химии.
Дано:
В замкнутый реактор поместили газообразную смесь оксида азота (II) с кислородом и нагрели. В результате протекания обратимой реакции 2NO(г) + O2(г) ⇄ 2NO2(г) в системе установилось равновесие.
Используя данные, приведенные в таблице, определите равновесные концентрации оксида азота (II) (Х) и кислорода (Y).
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,5 | 0,8 | |
| Равновесная концентрация (моль/л) | 0,2 |
На основании приведенных данных рассказываем, как решать 23 задание ЕГЭ по химии:
Сначала производим базовый расчет: исходя из приведенной информации, следует, что в реакторе не было NO2, а значит, исходная концентрация NO2 равна нулю.
Известное вещество (с известной исходной и равновесной концентрацией) – это NO2, которого образовалось 0,2 моль.
Теперь переходим к стехиометрическим расчетам. Подставляем нужные цифры:
- 2NO(г) + O2(г) ⇄ 2NO2(г)
- 0,2 + 0,1 ⇄ 0,2
Из уравнения реакции становится ясно, что прореагировали 0,2 моль NO и 0,1 моль О2.
Наконец, переходим к окончательным расчетам. Еще раз представим перед собой таблицу и подставим нужные значения:
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,5 | 0,8 | 0 |
| Равновесная концентрация (моль/л) | 0,3 | 0,7 | 0,2 |
Итого, получаем следующий ответ:
- х = 0,5 – 0,2 = 0,3
- у = 0,8 – 0,1 = 0,7
Еще один разбор 23 задачи ЕГЭ по химии 2022-2023. Хороший пример, который может помочь вам разобраться.
Дано:
В реактор для синтеза метанола постоянного объема поместили водород и угарный газ. В результате протекания обратной химической реакции 2Н2(г) + СО(г) ⇄ СН3ОН(г) в системе установилось химическое равновесие.
Используя данные, приведенные в таблице, определите равновесную концентрацию угарного газа (Х) и исходную концентрацию водорода (Y).
| Реагент | Н2 | СО | СН3ОН |
| Исходная концентрация (моль/л) | Y | 2 | 0 |
| Равновесная концентрация (моль/л) | 1,2 | Х | 0,4 |
Решение демо 23 задания ЕГЭ по химии 2022 выглядит так:
Так как в первоначальный момент в системе не было метанола (а в состоянии равновесия метанола стало 0,4 моль), соответственно, изменения в ходе реакции по метанолу будет равно +0,4 моль.
Далее необходимо определить, сколько угарного газа было потрачено на реакцию. Концентрация угарного газа в ходе реакции уменьшается, из уравнения реакции следует, что n(CH3ОН):n(CO) = 1:1. Отсюда следует, что n(CO) = n(CH3ОН) = 0,4 моль.
Равновесную концентрацию угарного газа можно посчитать так: [СО]равн = [СО]исх – [CO]измен = 2 моль/л = 0,4 моль/л = 1,6 моль/л.
Первая часть разбора 23 задания ЕГЭ по химии 2022г. окончена, теперь посчитаем второе неизвестное значение:
Из уравнения реакции следует, что n(CH3ОН):n(Н2) = 1:2, отсюда следует, что n(Н2) = 2n(CH3ОН) = 2х0,4 = 0,8 моль.
Концентрация водорода в ходе реакции уменьшается. Чтобы найти исходную концентрацию водорода: [H2]исх – [H2]измен = 1,2 моль/л.
[H2]исх = [H2]измен + [H2]равн = 1,2 моль/л + 0,8 моль/л = 2 моль/л.
Ответ: х = 1,6 моль/л, у = 2 моль/л.
Как вам такое объяснение 23 задания ЕГЭ по химии 2022 года? Как видите, задачи действительно сложные – нужно знать довольно много вещей и свободно оперировать химическими формулами. Что может быть довольно сложно, если на уроках вы уделяли недостаточно внимания этим темам. Хорошо, что еще есть время на подготовку!
Решение задачи 23 в ЕГЭ по химии 2022-2023 вполне доступно каждому. Конечно, если вы понимаете смысл нужных понятий и умеете пользоваться вычислениями по химическим формулам и уравнениям. Задание это новое, поэтому лучше прорешать все доступные демонстрационные варианты перед экзаменом, чтобы хорошенько подготовиться!
Концентрации исходных веществ
Равновесие гомогенной системы СО + Cl2 = COCl2 установилось при следующих концентрациях: [Cl2] = 0,4 моль/л; [CO]=0,1 моль/л; [COCl2] = 4 моль/л. Вычислите концентрации исходных веществ в начальный момент.
Решение задачи
Рассмотрим обратимую химическую реакцию:
Для нахождения концентрации исходных веществ учтем, что, если известно изменение концентрации одного из веществ, то по уравнению реакции можно найти изменения концентраций всех других веществ, составляющих реакционную систему.
Для нахождения концентрации исходных веществ CO и Cl2 учтем, что, согласно уравнению реакции, из 1 моль CO и 1 моль Cl2 образуется 1 моль COCl2. Поскольку по условию задачи в каждом литре системы образовалось 4 моль вещества COCl2, то при этом было израсходовано 4 моль CO и 4 моль Cl2. Таким образом, искомые концентрации исходных веществ равны:
C(CO) = 0,1 + 4 = 4,1 (моль/л);
C(Cl2) = 0,4 + 4 = 4,4 (моль/л).
Ответ:
концентрация исходного вещества CO 4,1 моль/л;
концентрация исходного вещества Cl2 4,4 моль/л.
Расчет равновесных концентраций веществ, константы равновесия реакции
Определение равновесных концентраций веществ
Задача 52.
Константа равновесия реакции FeO(тв.) + CO(г) = Fe(тв.) + CO2(г) при некоторой температуре равна 0,5. Найти равновесные концентрации CO и CO2, если начальные концентрации этих веществ составляли: [CO] = 0,05 моль/л, [CO2] = 0,01 моль/л.
Решение:
Уравнение реакции имеет вид:
FeO(тв.) + CO(г) = Fe(тв.) + CO2(г)
К = 0,5.
Начальные концентрации [CO] = 0,05 моль/л; [CO2] = 0,01 моль/л. По мере течения реакции концентрация исходных веществ уменьшается, а концентрация продуктов реакции увеличивается. Изменение концентрации идет в строгом соответствии со стехиометрическими соотношениями, которые берутся из уравнения реакции, примем изменение концентрации [СО] до равновесия равному «х» моль/л тогда в момент равновесия его концентрация станет (0,05 — х), а у СО2 увеличится на х, т.е. будет (0,01 + х). Коэффициенты в уравнении одинаковы n(CO) = n(CO2). Для момента равновесия концентрации взяты равновесны.
Запишем выражение константы равновесия для реакции, получим:
К = [CO2]/[CO];
0,5 = (0,01 + х)/(0,05 — х);
0,01 + х = 0,5(0,05 — х);
0,01 + x = 0,025 — 0,5x;
x + 0,5x = 0,025 — 0,01;
1,5x = 0,015;
x = 0,01.
Таким образом, x = 0,01моль/л. Отсюда в момент равновесия равновесные концентрации будут равны:
[CO2]равн. = 0,01 + 0,01 = 0,02 моль/л;
[CO]равн. = 0,05 — 0,01 = 0,04 моль/л.
Ответ: [CO2]равн. = 0,02 моль/л; [CO]равн. = 0,04 моль/л.
Расчет константы равновесия
Задача 53.
Реакция идет по уравнению: А + 2В = С + D. К моменту равновесия прореагировало 20% вещества В. Чему равна константа равновесия, если исходные концентрации (моль/л) веществ А = 3; В = 4?
Решение:
Согласно условию, прореагировало 20% вещества (В). Это составило 4 * 0,2 = 0,8 моль. Исходя из стехиометрических коэффициентов, расходование 0,8 молей идет на получение по 0,4 молей веществ (С) и (D). Столько же израсходовано вещества (А). Если начальные концентрации веществ (А) и (В) 3 и 4 моль соответственно, то равновесная их концентрация составила:
вещества (А) – 3 — 0,4 = 2,6 моль/л;
вещества (В) – 4 — 0,8 = 3,2 моль/л.
Выражение константы равновесия данной реакции:
К = [С][D]/[А][В]2 = [0,4][0,4]/[2,6][3,2]2 = 0,16/26,624 = 6 . 10-3 моль/л.
Ответ: К = 6 . 10-3 моль/л.