Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
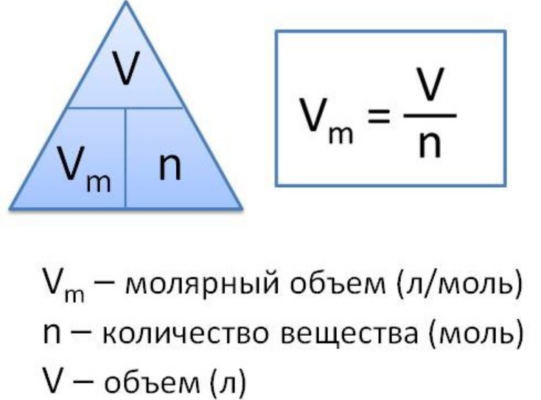
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
А какая ваша оценка?
Задача №1
Образец: Какой объем занимает 0,2 моль N2 при н.у.?
Дано: н.у.
Vm = 22, 4 л/моль
ν (N2) = 0,2 моль
Найти:
V -?
Решение:
ν (N2) = V (N2)/Vm, следовательно
V (N2) = ν(N2) ·Vm =
= 0,2 моль · 22,4 л/моль = 4,48 л
Ответ: V (N2) = 4,48 л
Решите задачи по приведённому образцу:
1. Какой объем занимают 5 моль О2 при н.у.?
2. Какой объем занимают 2,5 моль Н2 при н.у.?
Задача №2
Образец: Какое количество вещества содержит водород объемом 33,6 л при н.у.?
Дано: н.у.
Vm = 22, 4 л/моль
V (H2) = 33,6 л
Найти:
ν -?
Решение:
ν (Н2) = V(Н2)/Vm = 33,6 л/ 22,4 л/моль = 1,5 моль
Ответ: ν (Н2) = 1,5 моль
Решите задачи по приведённому образцу:
1. Какое количество вещества содержит кислород объемом 0,224 л при н.у.?
2. Какое количество вещества содержит углекислый газ объемом 4,48 л при н.у.?
Задача №3
Образец: Какой объем займут 56 г. газа СО при н.у.?
Дано: н.у.
Vm = 22, 4 л/моль
m (CO) = 56 г
Найти:
V -?
Решение:
ν (CO) = V(CO) / Vm, следовательно
V (CO) = ν (CO) · Vm
Неизвестное количество вещества найдём по формуле:
ν = m/M
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль
ν (СО) = m/M = 56 г / 28 г/моль = 2 моль
V (CO) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л
Ответ: V (CO) = 44,8 л
Решите задачи по приведённому образцу:
1. Какой объем займут 8 г. газа О2 при н.у.?
2. Какой объем займут 64 г. газа SО2 при н.у.?
Задача №4
Образец: В каком объёме содержится 3·1023 молекул водорода Н2 при н.у.?
Дано: н.у.
Vm = 22, 4 л/моль
N = 3·1023 молекул
Na = 6,02 ·1023 моль-1
Найти:
V -?
Решение:
ν (Н2) = V(Н2) / Vm, следовательно
V (Н2) = ν (Н2) · Vm
Неизвестное количество вещества найдём по формуле:
ν = N / Na = 3·1023 / 6,02 ·1023 моль-1 = 0,48 моль
V (Н2) = ν (Н2) · Vm = 0,48 моль · 22,4 л/моль = 10,752 л
Ответ: V (Н2) = 10,752 л
Решите задачи по приведённому образцу:
1. В каком объеме содержится 12,04 ·1023 молекул углекислого газа — СО2 при н.у.?
2. В каком объеме содержится 3,01·1023 молекул кислорода — О2 при н.у.?
Дополнительно решите задачи для закрепления:
1. Найдите массу (н.у.): а) 6 л. О3; б) 14 л. газа Н2S?
2. Какой объём водорода при н.у. образуется при взаимодействии 0,23 г натрия с водой?
3. Какова молярная масса газа, если 1 л. его имеет массу 3,17 г.? (Подсказка! m = ρ·V)
Молярный объём
Vm
— это отношение объёма данной порции вещества к его количеству.
Численно молярный объём равен объёму (1) моль вещества.
Обрати внимание!
Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству
Преобразуем формулу молярного объёма — выразим из неё
V
:
— объём газа равен произведению его количества на молярный объём.
Пример:
вычисли объём (н. у.) метана количеством (1,5) моль.
дм³.
Вычисление количества газа по его объёму
Выразим из формулы молярного объёма
n
:
— количество газа можно вычислить, если его объём разделить на молярный объём.
Пример:
вычисли количество водорода, соответствующее при н. у. его объёму (11,2) дм³.
моль.
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 


Формула относительной молекулярной массы
Здесь 


Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 




Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 




Формулы средней квадратичной скорости молекул
Здесь 


Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 



Формула средней кинетической энергии молекул
Здесь 


Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 


Объединенный газовый закон — уравнение Клапейрона
при
Здесь 



Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 



Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 




Закон Шарля
при
Здесь V — объем газа 


Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 



Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 


Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 

Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), 

Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 





Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 



Коэффициент полезного действия идеального теплового двигателя
Здесь 


Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:
Данный онлайн калькулятор рассчитывает молярный объем идеального газа в зависимости от условий (разных значений температуры и давления). Формулы и перечисление некоторых часто используемых значений для описания физических условий можно найти под калькулятором.
Молярный объем газа
Точность вычисления
Знаков после запятой: 3
Калькулятор использует уравнение молярного объема идеального газа:
Уравнение идеального газа является достаточно близкой аппроксимацией для многих реальных газов. Для заданных температуры и давления, молярный объем для всех идеальных газов один и тот же, и известен с точностью совпадающей с точностью универсальной газовой постоянной: R = 0.082 057 338(47) Л атм K−1 моль−1, то есть относительная стандартная неопределенность молярного объема равна 5.7×10−7, в соответствии с рекомендацией CODATA от 20141
Так как молярный объем одинаков для всех газов, он может быть вычислен независимо от газа по температуре и давлению (физическим условиям). Например, для стандартных условий по версии НИСТ (стандартной температуре 273.15 K и стандартному давлению 101.325 kPa), молярный объем идеального газа равен 22.413962×10-3 м3 моль-1 со стандартной неопределенностью 0.000013 x 10-3 м3 моль-12
Собственно, слова стандартные условия или нормальные условия (что не одно и тоже) для давления и температуры — это отсылка к «справочным», известным значениям температуры и давления, применяющимся для вычисления значений других физических величин, зависящих от давления и температуры.
Для удобства значения молярного объема для некоторых общеупотребимых физических условий приведены в таблице ниже.
| Физические условия | Температура | Давление | Молярный объем, литры |
|---|---|---|---|
| Стандартные условия (НИСТ) | 0C (273.15K) | 101.325кПа (1атм) | 22.414 |
| Стандартные условия (ИЮПАК) | 0C (273.15K) | 100.000кПа (1бар) | 22.711 |
| Нормальные условия (некоторые ГОСТы, НИСТ) | 20C (293.15K) | 101.325кПа (1атм) | 24.055 |
Разные отрасли и организации, могут использовать свои значения температуры и давления для расчетов. Используя калькулятор, мы можете ввести нужные вам значения температуры и давления и получить молярный объем газа.
Обратите внимание, что для больших значений (сотни атмосфер и тысячи градусов) поведение реальных газов отличается от поведения идеальных газов (собственно, поэтому они и не «идеальные») и использовать уравнение, приведенное выше, нельзя.