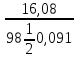Задачи на определение молярной концентрации вещества
-
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
-
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
-
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
-
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
-
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
-
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора. (2б)
-
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора? (2б)
-
Какой объем 38 % — го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
-
Раствор серной кислоты с массовой долей H2SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
-
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
-
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
-
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
-
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора H2SO4 объемом 40 мл? (3б)
-
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
-
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
-
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
-
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
-
К раствору 3,5 М NH4CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе. (4б)
-
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл. (4б)
-
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
-
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
-
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
-
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % — го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % — го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С — ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4 = 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С — ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С — ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон — ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 — ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль

V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?

Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 — ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль

Vр-ра 1 = 2 л 3.
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С — ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С — ? 

3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ
С
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра — ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 — ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 — ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω
ρ р-ра = 1,05 г/мл 4. 1 л р-ра — 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл

Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 — ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %

Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г

ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра — ?
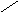


0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г


Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 — ? Ответ: 12,1 %
-
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г

ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω 

Ответ: 13,87 %
-
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М

-
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль

О
-
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω

Ответ: 18,2 %
-
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 — ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль

Ответ: 17,7 М
Практическое занятие № 5
Тема: Решение
задач на вычисление концентрации растворов
Цель: закрепить
умения по использованию формул для нахождения молярной концентрации растворов
и массовой доли растворенного вещества
Ход
занятия.
1. Организационный
момент.
2. Актуализация
знаний: повторение формул используемых для решения
задач на нахождение концентрации и массовой доли вещества.
3. Выполнение
заданий практического занятия.
В методических
рекомендациях по выполнению практического занятия предложены 25 вариантов с
образцом решения задач.
4. Подведение
итогов.
Методические
рекомендации для выполнения практического занятия № 5
Решение
задач на вычисление концентрации растворов
Для получения
оценки удовлетворительно достаточно выполнить первые три задания; для получения
оценки хорошо необходимо выполнить четыре задания, для получения оценки отлично
необходимо выполнить пять заданий.
С –
молярная концентрация раствора.
Молярная
концентрация – это отношение количества растворенного
вещества к объему раствора
С = n
(вещества)/ V(раствора)
n
(вещества)= m(в-ва)/М(в-ва)
Пример 1 Рассчитайте
молярную концентрацию раствора (моль/л) раствора.
|
Дано: m (H2SO4)=14,5 V |
Решение: С = n n |
|
Найти: С (H2SO4)- ? |
1. М (H2SO4)= 2Ar(H)+Ar(S)+4Ar(О)=2*1+32+4*16=98г/моль 2. n (H2SO4)= n (H2SO4)=14,5/98=0,15 3. С (H2SO4)=0,15/0,5=0,3 Ответ: |
Задание №1:
Выполните по образцу задание своего варианта.
|
Вариант |
Формула |
Масса |
Объем |
|
1. |
KBrO3 |
12,4 |
0,3 |
|
2. |
KNO3 |
8,5 |
0,4 |
|
3. |
KReO4 |
18,1 |
0,75 |
|
4. |
K2Cr2O7 |
14,7 |
0,75 |
|
5. |
K2GeO3 |
6,3 |
0,65 |
|
6. |
KNCS |
23,9 |
0,8 |
|
7. |
Tl(NO3)3 |
0,91 |
0,25 |
|
8. |
Tl2CO3 |
0,93 |
0,05 |
|
9. |
Tl2SO4 |
54,27 |
5,46 |
|
10. |
ZnSO4 |
25,35 |
1,27 |
|
11. |
CoCl2 |
17,72 |
0,65 |
|
12. |
Fe(NO3)3 |
35,23 |
2,54 |
|
13. |
Cu(NO3)2 |
22,27 |
0,74 |
|
14. |
Fe2(SO4)3 |
44,58 |
3,08 |
|
15. |
Al2(SO4)3 |
6,54 |
0,2 |
|
16. |
TlNO3 |
1,92 |
0,15 |
|
17. |
CH3COONa |
3,03 |
0,1 |
|
18. |
Ca(ClO4)2 |
4,13 |
0,5 |
|
19. |
KAl(SO4)2 |
5,9 |
1,65 |
|
20. |
Na4B4O7 |
12,04 |
3,98 |
|
21. |
CuSO4 |
13,6 |
2,4 |
|
22. |
Na3PO4 |
15,9 |
0,65 |
|
23. |
Fe(NO3)3 |
23,4 |
3,67 |
|
24. |
KMnO4 |
34,9 |
1,45 |
|
25. |
Na2SO4 |
24,7 |
1,55 |
Пример №2 Рассчитайте
массовую долю (в %) гидроксида цезия в растворе массой 172 г, если масса
растворенной щелочи равна 8,6г.
|
Дано: m m (в-ва)=8,6 |
Решение: W= m |
|
Найти: w ( CsOH)- ? |
1. W=8,6/172=0,05; Ответ: W (H2SO4)= 5% |
Задание №2: Найдите массовую долю
вещества в данном растворе:
|
Вариант |
Формула |
Масса |
Масса |
|
1. |
KOH |
125 |
5 |
|
2. |
H2SO4 |
250 |
15 |
|
3. |
HNO3 |
300 |
25 |
|
4. |
CH3COOH |
200 |
38 |
|
5. |
HCl |
160 |
24 |
|
6. |
NaOH |
235 |
9 |
|
7. |
H3PO4 |
345 |
23 |
|
8. |
H2SO4 |
500 |
134 |
|
9. |
CuSO4 |
127 |
35 |
|
10. |
CuCl2 |
435 |
56 |
|
11. |
Na2SO4 |
238 |
125 |
|
12. |
K2SO4 |
250 |
38 |
|
13. |
BaCl2 |
200 |
40 |
|
14. |
AlCl3 |
190 |
45 |
|
15. |
NaCl |
150 |
50 |
|
16. |
CH3COOH |
145 |
14 |
|
17. |
H2SO4 |
400 |
8,5 |
|
18. |
H3PO4 |
200 |
9,7 |
|
19. |
AlCl3 |
150 |
8 |
|
20. |
Na2SO4 |
125 |
5,8 |
|
21. |
CuSO4 |
110 |
67 |
|
22. |
KOH |
230 |
45 |
|
23. |
NaOH |
180 |
50 |
|
24. |
CuCl2 |
165 |
65 |
|
25. |
BaCl2 |
170 |
70 |
Пример №3 Какая
масса серной кислоты, содержится в 400г 12%раствора?
|
Дано: m W (H2SO4)=12%; |
Решение: W= m m |
|
Найти: m (H2SO4)=? |
1. m (H2SO4)= Ответ: m (H2SO4)= 48г |
Задание
№3: Найдите массу вещества в данном растворе:
|
Вариант |
Задание |
|
1. |
Какую |
|
2. |
Сколько |
|
3. |
Какая |
|
4. |
Какая |
|
5. |
Какую |
|
6. |
Какая |
|
7. |
Какая |
|
8. |
Какая |
|
9. |
Какая |
|
10. |
Какая |
|
11. |
Какая |
|
12. |
Какая |
|
13. |
Какая |
|
14. |
Какую |
|
15. |
Какую |
|
16. |
Какую |
|
17. |
Какую |
|
18. |
Какую |
|
19. |
Какую |
|
20. |
Какую |
|
21. |
Какая |
|
22. |
Какая |
|
23. |
Какая |
|
24. |
Какая масса |
|
25. |
Какая |
Пример №4 Смешали
600г 20%-ного и 750г 40%-ного раствора нитрата аммония. Какова массовая доля
соли в полученном растворе?
|
Дано: m1 (р—ра)=600г. W1 m2 (р—ра)=750г. W2 |
Решение: W= m W3 (NH4NO3 )= m |
|
Найти: W3 |
1. m1 (NH4NO3)= m2 (NH4NO3)= 2. W3 Ответ: W3 |
Задание № 4 Рассчитайте
массовую долю в растворе при смешивании двух растворов с разной массовой долей
вещества.
|
Вариант |
Масса (m1 (р-ра)) |
Массовая |
Масса (m2 (р-ра)) |
Массовая |
|
1. |
100 |
20 |
50 |
32 |
|
2. |
120 |
15 |
60 |
12 |
|
3. |
110 |
5 |
80 |
15 |
|
4. |
115 |
8 |
90 |
10 |
|
5. |
60 |
10 |
50 |
5 |
|
6. |
75 |
12 |
125 |
20 |
|
7. |
87 |
15 |
300 |
25 |
|
8. |
90 |
17 |
250 |
15 |
|
9. |
45 |
6 |
120 |
30 |
|
10. |
56 |
5 |
100 |
10 |
|
11. |
100 |
35 |
240 |
5 |
|
12. |
150 |
2 |
250 |
25 |
|
13. |
400 |
20 |
150 |
18 |
|
14. |
350 |
25 |
160 |
15 |
|
15. |
200 |
12 |
80 |
5 |
|
16. |
190 |
15 |
30 |
2 |
|
17. |
180 |
15 |
120 |
12 |
|
18. |
125 |
50 |
125 |
10 |
|
19. |
130 |
32 |
400 |
15 |
|
20. |
145 |
22 |
300 |
12 |
|
21. |
155 |
3 |
250 |
25 |
|
22. |
160 |
9 |
140 |
30 |
|
23. |
180 |
10 |
240 |
50 |
|
24. |
190 |
15 |
130 |
23 |
|
25. |
210 |
16 |
140 |
10 |
Задание повышенной
сложности
Задание
№5: Проведите необходимые вычисления.
Формулы
необходимые для вычисления:
W=
m
(вещества)/ m(раствора)
m
(вещества)= W×m(раствора)
m(раствора)
= ᴠ×ρ
С=ν/ᴠ
m( Н2О) = m(раствора)
— m
(вещества)
|
вариант |
Формула растворенного вещества |
Масса растворенного вещества m(в-ва), г |
Масса раствора m(р-ра), г |
Масса воды m(H2O) |
Массовая доля вещества ω,% |
Молярная концентрация раствора, |
Число молей растворенного , моль |
Плотность раствора ρ,г/мл |
|
1. |
NaCl |
400 |
10 |
1,0 |
||||
|
2. |
LiBr |
110 |
0,2 |
1,0 |
||||
|
3. |
NH4F |
15 |
55 |
1,01 |
||||
|
4. |
KF |
100 |
2 |
1,0 |
||||
|
5. |
Na2SO4 |
200 |
0,4 |
1,0 |
||||
|
6. |
BaCl2 |
10 |
120 |
1,0 |
||||
|
7. |
KNO3 |
1050 |
50 |
1,0 |
||||
|
8. |
MgCl2 |
300 |
1,2 |
1,01 |
||||
|
9. |
NaNO3 |
25 |
105 |
1,01 |
||||
|
10. |
LiCl |
60 |
0,5 |
1,01 |
||||
|
11. |
NH4NO3 |
600 |
2,5 |
1,0 |
||||
|
12. |
CrCl3 |
50 |
200 |
1,0 |
||||
|
13. |
FeCl3 |
170 |
430 |
1,0 |
||||
|
14. |
FeBr2 |
360 |
2,4 |
1,12 |
||||
|
15. |
NaOH |
620 |
50 |
1,11 |
||||
|
16. |
LiOH |
240 |
35 |
1,2 |
||||
|
17. |
HNO3 |
150 |
2 |
1,3 |
||||
|
18. |
HCl |
400 |
10 |
1,01 |
||||
|
19. |
H2SO4 |
50 |
100 |
1,35 |
||||
|
20. |
HBr |
250 |
5 |
1,01 |
||||
|
21. |
KOH |
120 |
25 |
1,2 |
||||
|
22. |
AlCl3 |
200 |
2 |
1,0 |
||||
|
23. |
Ba(NO3)2 |
130 |
270 |
1,0 |
||||
|
24. |
CH3COOH |
30 |
2 |
1,1 |
||||
|
25. |
H2SO4 |
500 |
400 |
1,15 |
Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
ν(HNO3) = m/M(HNO3) = 6,3 г/ 63 г/моль = 0,1 моль
С(HNO3) = ν(HNO3)/Vр-ра = 0,1 моль/ 0,5 л = 0,2 моль/л
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
Растворы Примеры решения задач
Задача
1. Определите молярность, нормальность
и мольную долю 16,08% раствора H2SO4
(
=1,1 г/см3).
РЕШЕНИЕ.
Молярная концентрация (молярность)
определяется по формуле
гдеm=16,08г
— масса H2SO4,
содержащаяся в 100г раствора
(из определения
массовой доли).
Объем
100г р-ра V
=


0,091л.
Следовательно,
Cм
=
=1,8 моль/л
Нормальность
рассчитывается по формуле Сн
=

= 2
(кислота
двухосновная), таким образом. Сн
=
= 3,6 моль/л.
Зная
молярную концентрацию и фактор
эквивалентности fэкв=
нормальную концентрацию можно рассчитать
и по формуле
Сн
=
=
166
Мольная
доля определяется по формуле



=
100 – 16,08 = 83,92 г.

моль.
Таким
образом,

Задача
2. Сколько миллилитров 60% раствора
СН3СООН
(
=1,07 г/см3)
потребуется для приготовления 200 мл
0,1М раствора.
РЕШЕНИЕ.
Масса уксусной кислоты в 200 мл (0,2л) 0,1М
раствора СН3СООН
рассчитывается по формуле m
= CMMV
=
0,1моль/л∙60г/моль∙0,2л =1,2г
(М =
60 г/моль). Масса 60% раствора, в котором
содержится
1,2г
СН3СООН,
определяется из формулы, ω,% =

=
2г. Таким образом, необходимый объем 60%
раствора кислоты V=
=

Задача
3. В каком соотношении надо смешать
растворы 12% и 3% азотной кислоты для
получения 10% раствора?
РЕШЕНИЕ.
Для решения задачи воспользуемся
правилом креста.
12
10 — 3 = 7
10
3
12 — 10 = 2
Значит,
для получения 10% раствора азотной
кислоты необходимо смешать 7
частей (масс) 12% раствора и 2 части (массы)
3%.
Задача
4.
Рассчитать концентрацию ионов
водорода в растворе HCN
(См
= 10-3 М
), если
= 4,2∙10-3.
РЕШЕНИЕ.
Диссоциация
цианистоводородной кислоты протекает
по уравнению HCN
↔ H+
+ CN—;
концентрации ионов [H+]
и [CN—]
в растворе равны между собой (
так как Н+
: СN—
= 1:1,
где
— стехиометрические
коэффициенты) т.е. [H+]
= [CN—]
=
Cм,
моль/л; Тогда [H+]
= [CN—]
= 4,2∙10-3∙
10-3 =
4,210-7
моль/л.
Задача
5. Рассчитать
концентрацию ионов водорода и
гидроксид-ионов в рстворе NH4OH,
концентрацией См=
0,01М, если Кд
= 1,810-5.
РЕШЕНИЕ.:
Гидроксид
аммония диссоциирует следующим образом:
NH4OH
↔ NH4+
+ OH—,
константа диссоциации имеет вид
167
Кд
=
концентрации
ионов аммония [NН4+]
и гидроксида [OH—]
совпадают
(
(NH4+)
:
(OH—)
= 1:1), обозначим их за х:
[NH4+]
= [OH—]
= х моль/л
, тогда
выражение для Кд
примет вид
1,810-5
= х2/
0,01-х.
Считая, что х
<< См,
решаем уравнение
1,810-5=x2/
0,01, относительно х:
х
=

[OH—]=
4,2∙10-4
моль/л.
Концентрации
ионов водорода и гидроксида связаны
через ионное произведение воды Кw=
[H+][OH—]
=10-14,
выразим концентрацию ионов водорода
[H+]
= Kw/[OH—]
и рассчитаем её значение:
[H+]=110-14/4,210-4
=
2,310-11моль/л.
Задача 6. Определить
рН раствора НСl
(
=1), если См
=2∙10-3
М.
РЕШЕНИЕ.
Диссоциация
соляной кислоты протекает по уравнению
HCl
H+
+ Cl—,
концентрация ионов водорода [H+]
=
Cм
=1∙2∙10-3
= =2∙10-3
моль/л. Водородный показатель рН = —
lg[H+]
= — lg2∙10-3
= 2,7.
Задача
7.
Определить молярную концентрацию
гидроксида аммония, если рН=11, а
Кд=1,8∙10-5.
РЕШЕНИЕ.
Концентрация ионов водорода
[H+]=10—pH=10-11моль/л.
Из ионного произведения воды определяем
концентрацию [OH—]
[OH—]
= Kw
/
[H+]=10-14/10-11
=10-3моль/л.
Гидроксид
аммония — слабое основание и характеризуется
уравнением реакции диссоциации NH4OH
↔ NH4+
+ OH—.
Выражение для константы диссоциации
Кд
=
из
закона Оствальда следует, что [NH4+
] = [OH—]
= ∙Cм,
а Кд
= 2См.
Объединяя уравнения, получим См=[OH—]2/Kд
= 10-6/
1.8∙10-5
= 0,056 моль/л.
Задача
8. Концентрация насыщенного раствора
(См)
Mg(OH)2
равна 1,1•10-4
моль/л. Записать выражение для ПР
и
вычислить его величину.
РЕШЕНИЕ.
В насыщенном
растворе Mg(OH)2
устанавливается равновесие между
осадком и раствором Mg(OH)2
↔ Mg2++2OH—,
для которого выражение ПР имеет вид
ПР =
[Mg2+][OH—]2.
158
Зная
концентрации ионов, можно найти его
численное значение. Учитывая полную
диссоциацию Mg(OH)2,
концентрация
его насыщенного
раствора
См
= [Mg2+]=
1,110-4
моль/л, а [OH—]
= 2[Mg2+]
= 2,210-4
моль/л.
Следовательно, ПР= [Mg2+][OH—]2
=1,1. 10-4
(2,2 10-4)2
= 5,3. 10-12.
168
Задача
9. Вычислить
концентрацию насыщенного раствора и
ПР хромата серебра, если в 0,5 л воды
растворяется 0,011 г соли.
РЕШЕНИЕ.
Для определения
молярной концентрации насыщенного
раствора Ag2CrO4
воспользуемся
формулой

где m—
масса растворенного вещества (г), М-
молярная масса ( г/моль), V
— объем раствора (л). М(Ag2CrO4)
=332 г/моль.
См
=

моль/л. Растворение хромата серебра (I)
сопровождается полной (=1)
диссоциацией соли:
Ag2CrO4
↔
2Ag++
CrO42-
ПР=[Ag+]2[CrO42-],
где
[CrO42-]
= См
= 9,48.10-5
моль/л, а [Ag+]
= 2 См
=1,896
10-4
моль/л .
Таким образом, ПР = (1,896
10-4)2
(9,48 10-5)
= 3,4 10-12.
Задача
10.
Можно ли приготовить растворы соли
СаСО3
с концентрациями СаСО3
С1
=10-2
М и С2 =
10-6
М , если ПР СаСО3
= 3,8
10-9.
РЕШЕНИЕ.
Зная
величину ПР, можно рассчитать
концентрацию насыщенного раствора
соли и, сравнив ее с предлагаемыми
концентрациями, сделать вывод о
возможности или невозможности
приготовления растворов. Растворение
карбоната кальция протекает по схеме
CaCO3
↔ Ca2+
+CO32-
В данном
уравнении n
= m
= 1, тогда

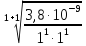
6,2•10-5моль/л
,
С1>
См
– раствор приготовить нельзя, так как
будет выпадать осадок;
С2<
См
– раствор
приготовить можно.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Задачи, связанные с изучением растворов, можно условно разделить на следующие группы:
1. вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества;
2. вычисление молярной концентрации и массы вещества в растворе определённой молярной концентрации;
3. разбавление растворов с массовой долей растворённого вещества и молярной концентрацией;
4. смещение растворов с массовой долей растворённого вещества и молярной концентрацией;
5. расчёты по химическим уравнениям с применением растворов различной концентрации.
:
вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества
Необходимо знать условные обозначения физических величин, которые используются при решение задачи:
· m(р.в.), или m, — масса растворённого вещества в растворе, например, m(CACL2);
· m(р-ра.), или m(р.), — масса раствора;
· w(р.в.), или w, — массовая доля растворённого вещества.
Растворённое вещество является частью целого – раствора. Следовательно, масса раствора представляет собой сумму масс растворённого вещества и растворителя (воды):
w(р.в.) = m(р.в.)/m(р-ра.)*100%
Задача 1: Какова массовая доля растворённого вещества в растворе, полученном растворением хлорида кальция массой 10г в воде 70г?
|
Дано m (CaCL2) =10г m(H2O) = 70г |
Решение w(р.в.) = m(р.в.)/m(р-ра.)*100% w(CaCL2) = m(CaCL2) /m(р—ра.)*100% в данном случае нам из формулы не известна масса раствора. Найдём массу раствора. m(р.в.) –это (CaCL2) его10г m(р-ра) = m(р.в.) + m(H2O) m(р-ра) =10г +70г =80г w(CaCL2) =10г :80г = 0.125*100%=12.5% |
|
Найти : w(CaCL2) — ? |
|
|
Ответ: |
Массовая доля CaCL2 в полученном растворе 12,5% |
2. Приготовление раствора с заданной массовой долей растворённого вещества.
Задача 2
Сколько безводного карбоната натрия и воды надо взять, чтобы приготовить раствор массой 70 г с массовой долей карбоната натрия 10%
|
Дано: m(р-ра) – 70г w(р.в.) – 9% = 0,09 |
Решение w(р.в.) = m(р.в.) / m (р-ра) нам не известно из формулы m(р.в.) следует m(р.в.)=w(р.в.) * m (р-ра) m (р-ра) = m(р.в.) + m(H2O), отсюда, m(H2O) = m (р-ра) — m(р.в.) ; m(р.в.) = 0,09 * 70г = 6.3г m(H2O) = 70г – 6.3г = 63,7г |
|
Найти: m(H2O) -? m(Na2CO3) -? |
|
|
Ответ: |
Для приготовления раствора надо взять 6,3г карбоната натрия (Na2CO3) и 63,7г или 63,7 мл. воды (H2O) |
3. Вычисление молярной концентрации раствора.
Исходные уравнение для вычислений:
с(р.в.) = n(р.в) / V(р-ра) или с(р.в.) = v(р.в.) / V(р-ра)
с(р.в.) – молярная концентрация растворённого вещества,
n(р.в) или v(р.в.) – количество растворенного вещества,
V(р-ра) – объём раствора.
Задача 3
В воде растворили гидроксид натрия массой 21,4г . Объём раствора довели до 300 мл.. Определите молярную концентрацию полеченного раствора.
|
Дано: m(NaOH) = 21.4г V(р-ра) –300мл.= 0.3л |
Решение: с(р.в.) = n(р.в) / V(р-ра) n(р.в) =m / M; M(NaOH) = 40г/моль n(NaOH) =21,2г :40г/моль = 0,53моль c(NaOH) = 0.53моль : 0,3л = 1,77моль/литр или 1,8M |
|
Найти: c(NaOH)-? |
|
|
Ответ: |
Концентрация полученного растворённого 1.8 моль/л |
4, Приготовление раствора заданной молярной концентрации
Растворы молярной концентрации можно готовит из твёрдых, жидких и газообразных веществ. В случае жидкого вещества необходимо знать его плотность; если раствор готовится из газообразного вещества, то применяется молярный объём газов (при н.у.)
Вычисления, связанные с приготовлением молярного раствора, часто являются составным компонентом в расчётах по химическим уравнениям (комбинированные задачи).
Задача 4 Какая масса хлорида цинка потребуется для приготовления раствора этой соли объёмом 500 мл. и с концентрацией 1.15 моль/л
|
Дано: V(р-ра) = 500мл или 0,5 c(ZnCL2) = 1.15моль/л |
Решение: m(ZnCL2) = n(ZnCL2) * M(ZnCL2) M(ZnCL2) =136г/моль c(р.в.) = n(р.в.) / V(р-ра)концентрация хлорида цинка нам дана в задаче, а количество вещества нам не известна n(р.в.) =c(р.в.) * V(р-ра) n(ZnCL2) = 1.15моль/л * 0,5 =0,575моль m(ZnCL2) = n(ZnCL2) * M(ZnCL2) m(ZnCL2) =0,575моль * 136г/моль =78г |
|
Найти: m(ZnCL2) = ? |
|
|
Ответ: |
Для приготовления 500мл 1.15Mраствора потребуется 78г хлорида цинка |