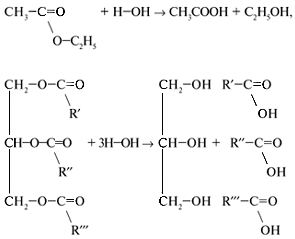
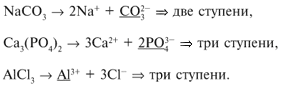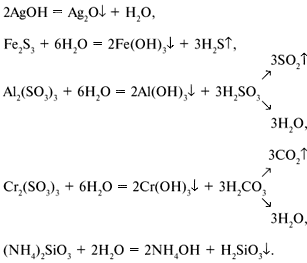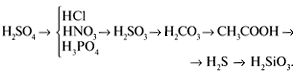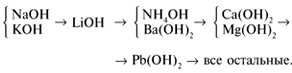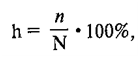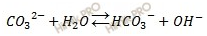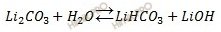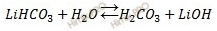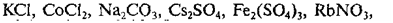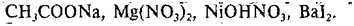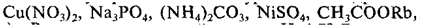Массовая доля w
W=5:50=0,1*100%=10%
aleksandrprjanz:
А сколько молекул соли?
aleksandrprjanz:
сколько молекул соли содержится в полученном вами растворе
karachagina16:
Какая именно соль
aleksandrprjanz:
Поваренная
aleksandrprjanz:
Тоесть обычная
karachagina16:
N=n*Na n=m:M M=23+35,5=58,5.
karachagina16:
n=50:58,5=0,9
karachagina16:
N=0,9*6*10в23
karachagina16:
N=54*10в22
aleksandrprjanz:
Спасибо
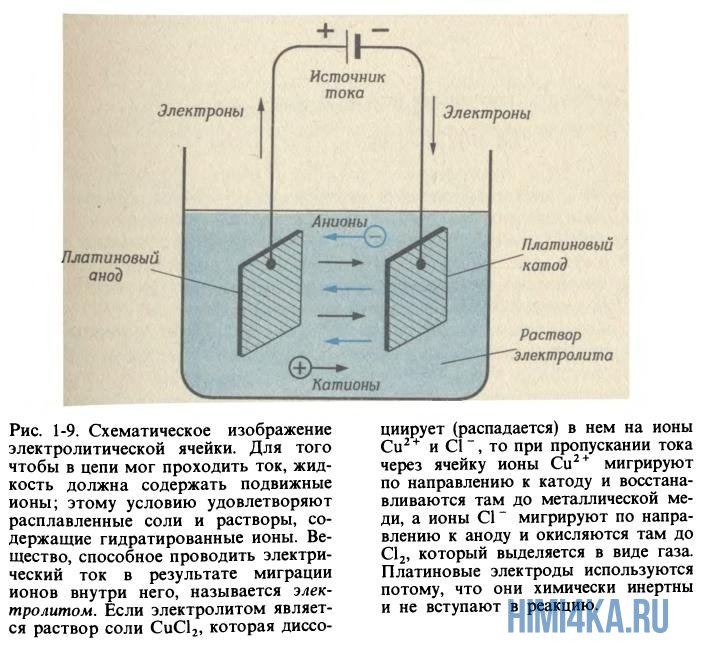
В уроке 9 «Ионы в водном растворе» из курса «Химия для чайников» рассмотрим растворение соли в воде, а также электролиз растворов и расплавов солей; познакомимся с законами Фарадея для электролиза и научимся находить продукты электролиза. Базой знаний для данного урока послужит материал из урока 8 «строение солей».
Растворение соли в воде
Из прошлого урока нам известно, что соли трудно расплавить и еще сложнее довести ее до кипения, однако, полярные жидкости, такие как вода, способны растворять соли без особых усилий, поскольку неполные положительные и отрицательные заряды на атомах полярных молекул воды в какой-то мере заменяют собой положительные и отрицательные ионы в кристаллической решетке соли. Другими словами, молекулы воды помогают разрушить кристалл соли.
Из рисунка видно, что происходит с положительными и отрицательными ионами при растворении в воде кристалла поваренной соли NaCl. Каждый ион Na+ окружается молекулами воды, которые обращены к нему отрицательно заряженными атомами кислорода. То же самое происходит с ионами Cl—, которые окружаются молекулами воды, обращенными к нему своими положительно заряженными атомами водорода. Ионы из кристалла соли оказываются гидратированными, а сам процесс присоединения молекул воды к ионам получил название — гидратация. Если в результате процесса гидратации устойчивость ионов, переходящих в раствор, становится больше их устойчивости в кристаллической решетке, то происходит растворение соли в воде. Хлорид натрия является отличным примером растворимой соли. И, наоборот, если энергия гидратации слишком мала, то кристалл является более устойчивой формой и не растворяется в воде. Примером таких нерастворимых солей является сульфат бария (BaSO4) и хлорид серебра (AgCl). Когда кристалл растворяется, он не просто распадается на ионы, а разъединяется на ионы молекулами жидкости, в которой происходит растворение. Неполярные жидкости (например, бензин С8H18) НЕ способны разъединять ионы в кристаллической решетке солей.
Электролиз растворов и расплавов солей
Металлы хорошо проводят ток — это знает каждый школьник. Электропроводность в металлах вызвана перемещением электронов в них, но ионы металла остаются неподвижными. Хотя кристаллы солей не проводят ток, зато растворы и расплавы солей это умеют и практикуют, так как анионы (отрицательные ионы) и катионы (положительные ионы) могут направленно перемещаться в противоположные направления, если приложить напряжение. Подвижность ионов соли оказывается еще большей, если она подверглась процессу гидратации.
Давным-давно английский ученый Майкл Фарадей расплавил соль (нагрев ее выше 801ºС), затем погрузил в расплав два электрода (катод и анод), а после взял и пропустил электрический ток через расплавленную соль. После этих манипуляций он обратил внимание что на электродах начали протекать химические реакции: ионы натрия начали мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия
- Na+ + e— (с катода) → Na
Хлорид-ионы мигрируют в другом направлении-в сторону анода, отдают ему свои избыточные электроны и окисляются до газообразного хлора
- Cl— → ½Cl2 + e—
Все это можно изобразить с помощью полной реакции, которая представляет собой разделение NaCl на составляющие его элементы:
- Na+ + Cl— → Na + ½Cl2
Весь процесс получил название электролиз, что означает «разрыв на части при помощи электричества». Для электролиза не обязательно расплавлять соль, можно также использовать обычный водный раствор соли, ведь подвижность ионов оказывается еще большей, если соль подверглась процессу гидратации. Но тогда полная реакция будет выглядеть иначе, и на катоде будет выделяться не металлический натрий, а газообразный водород:
- Na+ + Cl— + H2O → Na+ + ½Cl2 + ½H2 + OH—
Надеюсь, что вам стало интересно, почему продуктом электролиза водного раствора является не Na (как это было в расплавленной соли), а ½H2. Объясняется просто: часть молекул H2O диссоциируют на ионы H+ и OH—. Поскольку ион H+ обладает большим сродством к электрону (то есть сильнее его притягивает), нежели ион Na+, то ионы H+ первыми достигают катода, где незамедлительно восстанавливают недостающий электрон и превращаются из иона в полноценный газ H2, а ионы Na+ так и остаются в растворе.
Вот вам плюшка с продуктами электролиза водного раствора солей, может пригодится — может нет, но лучше законспектируйте:
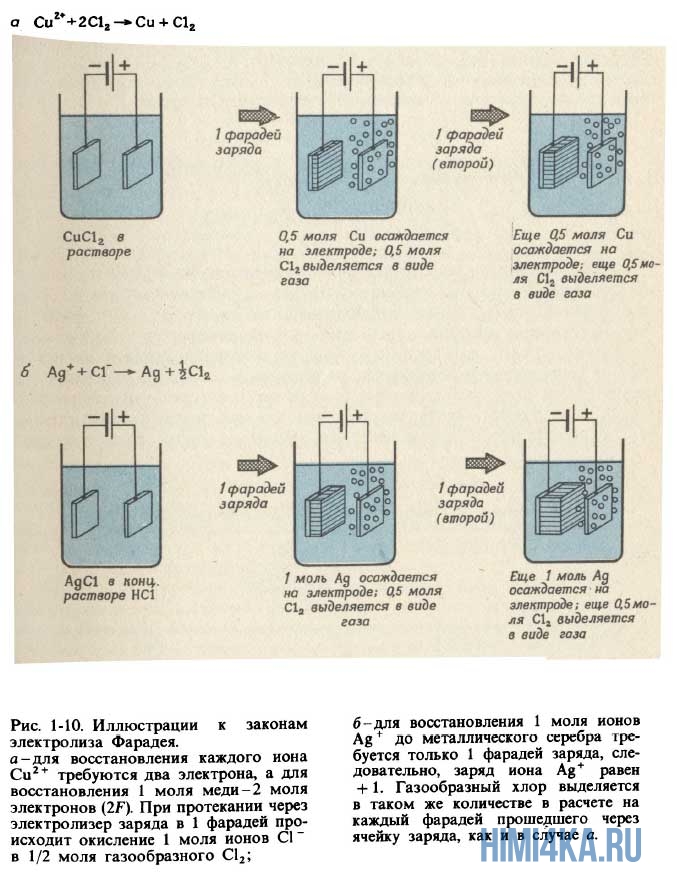
А Фарадей тем временем не сидел без дела, а наблюдал, проводил опыты, использовал другие электролиты, увеличивал-уменьшал заряд и опять наблюдал. В конце концов он заметил взаимосвязь между количеством подаваемого электричества и количеством получаемых веществ. Установленные им закономерности называются законы Фарадея для электролиза. Сформулируем их:
- Пропускание одного и того же электрического заряда через электролитическую ячейку всегда приводит к количественно одинаковому химическому превращению в данной реакции. Масса элемента, выделяемого на электроде, пропорциональна количеству заряда, пропущенному через электролитическую ячейку.
- Для выделения на электроде 1 моля вещества, которое в процессе электрохимической реакции приобретает или теряет 1 электрон, необходимо пропустить через ячейку 96485 кулонов (Кл) электричества. Если в реакции принимает участие N электронов, для выделения моля продукта необходимо N·96485 Кл электричества.
Количество электричества, равное 96485 Кл, получило название 1 фарадей и обозначается символом F. Законы Фарадея становятся очевидными, если принять во внимание, что 1 F — это просто заряд 1 моля электронов, т.е. 6,022 1023 электронов. Множитель 6,022-1023, позволяющий переходить от индивидуальных молекул к молям вещества, одновременно позволяет перейти и от 1 электронного заряда к 1 F электрического заряда. Разумеется, в свое время Фарадей ничего не знал ни о числе Авогадро, ни о заряде электрона. Однако из проведенных экспериментов он смог сделать вывод, что заряды на ионах кратны некоторой элементарной единице заряда, так что 96485 Кл электричества соответствуют 1 молю таких единиц. Термин электрон впервые появился в 1881 г.; его ввел английский физик Дж.Стоней для обозначения элементарной единицы ионного заряда. Применять термин «электрон» к реальной отрицательно заряженной частице начали спустя еще 10 лет.
1 пример. Запишите уравнения реакций, протекающих при пропускании электрического тока через расплавленную соль NaCl. Сколько граммов натрия и хлора выделится при пропускании 1 F электричества через электролитическую ячейку?
Решение: Уравнение реакции, протекающей на катоде: Na+ + е— → Na, а уравнение 1 анодной реакции: Сl— → Cl2 + е—. Когда через расплавленную соль NaCl проходит 1 моль электронов (1 F), каждый электрон восстанавливает 1 ион натрия, в результате чего образуется 1 моль атомов натрия. Следовательно, на катоде выделяется 22,990 г Na. На аноде происходит удаление 1 моля электронов от 1 моля хлорид-ионов, после чего остается 1 моль атомов хлора, которые попарно соединяются, образуя 1/2 моля молекул Сl2. Следовательно, масса газообразного хлора, выделяющегося на аноде, должна быть равна 35,453 г (что равно атомной массе Сl, или половине молекулярной массы Сl).
Пример 2. Сколько граммов металлического магния и газообразного хлора выделяется при пропускании 1 F электричества через электролитическую ячейку с расплавленным хлоридом магния, MgCl2?
Решение: На катоде происходит реакция Mg2+ + 2е— → Mg, а на аноде — реакция 2Сl— → Сl2 + 2е—. Поскольку для восстановления каждого иона Mg2+ необходимо 2 электрона, 1 моля электронов хватит только для восстановления половины моля ионов магния, таким образом на катоде должно выделиться 12,153 г магния. (Атомная масса магния равна 24,305 г/моль.) Как и в примере 1, на аноде окислится 1 моль ионов Сl— и выделится половина моля, т.е. 35,453 г, газообразного Сl2.
Пример 3. Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы Аl3 +. Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг металла.
Решение: 1 кг алюминия содержит 1000 г / 26,98 г·моль-1 = 37,06 моля атомов. Поскольку на выделение каждого атома алюминия необходимо 3 электрона, на 37,06 моля атомов потребуется 3·37,06 = 111,2 моля электронов. Это количество электричества эквивалентно 111,2F, или 10 730 000 Кл.
Надеюсь урок 9 «Ионы в водном растворе» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к уроку 10 «Ионы в газе».
Расчеты с участием кристаллогидратов и их свойства
При подготовке к экзаменам по химии, будь то ЕГЭ или ДВИ, мы неизбежно встречаемся с кристаллогидратами. Давайте разберемся, что это такое. Начнем с процесса кристаллизации. Когда мы охлаждаем горячий насыщенный раствор какой-либо соли, то ее растворимость начинает снижаться. Условному избытку соли некуда деваться, поэтому он выпадает в осадок. В зависимости от условий (скорость охлаждения, чистота раствора, тип вещества), при которых мы проводим процесс, осадок может получиться аморфным или кристаллическим. Иногда могут получиться крупные сформированные кристаллы правильной формы. Такие кристаллы часто содержат в себе не только растворенное вещество, но и молекулы растворителя. Эти молекулы встроены в решетку кристалла и не удаляются оттуда без внешних воздействий. Такие кристаллические вещества называют кристаллосольватами (solvent – растворитель). Если растворителем была вода, как в большинстве экзаменационных заданий, то будет кристаллогидрат. Отметим основные особенности и свойства кристаллогидратов.
1) Состав кристаллогидратов в большинстве случаев вполне определен и выражается отношением числа формульных единиц соли (или иного соединения) и кристаллизационной воды. Например, запись Fe2(SO4)3·9H2O означает, что в составе таких кристаллов на 1 моль кристаллогидрата приходится 1 моль безводного сульфата железа (III) и 9 моль кристаллизационной воды:
n(Fe2(SO4)3) = n(Fe2(SO4)3·9H2O)
n(H2O крист.) = 9n(Fe2(SO4)3·9H2O)
2) При растворении в воде кристаллогидрата образуется просто водный раствор самой соли. Говорить о растворе кристаллогидрата по этой причине не совсем верно. Будет раствор соли. Также важно отметить, что фраза «при растворении в воде кристаллогидрата Х был получен 10%-ный раствор» означает именно 10%-ный раствор относительно безводной соли, а не кристаллогидрата. Будьте внимательны!
3) В названии кристаллогидратов отражают само вещество и количество и молекул воды. Например, кристаллы Fe2(SO4)3·9H2O можно назвать нонагидрат сульфата железа (III) или сульфат железа (III) девятиводный (редко). По тому же принципу Cu(NO3)2·3H2O – тригидрат нитрата меди (II), NiSO4·7H2O – гептагидрат сульфата никеля, Ba(OH)2·8H2O – октагидрат гидроксида бария. Также существуют тривиальные названия для некоторых кристаллогидратов. Например, CuSO4·5H2O – медный купорос, FeSO4·7H2O – железный купорос, KAl(SO4)2·12H2O – алюмокалиевые квасцы и т.д.
4) При нагревании кристаллогидраты разлагаются. Возможно два варианта: обезвоживание или гидролиз. В рамках ЕГЭ и ДВИ может встретиться первый вариант. Приведем пару примеров:
CuSO4·5H2O = CuSO4 + 5H2O
MgSO4·7H2O = MgSO4 + 7H2O
При более сильном нагревании разложение может пойти дальше, зависит от свойств самой безводной соли. В таком случае можно записать суммарное уравнение процесса:
4Fe(NO3)2·9H2O = 2Fe2O3 + 8NO2 + O2 + 36H2O
5) (на ЕГЭ пока не встречалось) При образовании кристаллогидрата он забирает часть воды из раствора на собственное формирование. Например, если при охлаждении сформировалось 0,2 моль CuSO4·5H2O, то раствор при этом потерял 1 моль воды:
n(H2O крист.) = 5n(CuSO4·5H2O) = 5·0,2 = 1 моль
Справедливо и то, что при растворении кристаллогидрата вся его кристаллизационная вода перейдет в раствор.
Рассмотрим несколько задач с участием кристаллогидратов. Все из них будут полезны при подготовке к ДВИ, а многие и для ЕГЭ. Тем более, что формулировка задания 33 постоянно меняется и пополняется новыми идеями)
Задача №1
Неизвестный кристаллогидрат нитрата меди (II) содержит 22,31% воды по массе. Установите формулу кристаллогидрата.
Решение:
Пусть формульная единица кристаллогидрата содержит х молекул кристаллизационной воды. Тогда его формула будет Cu(NO3)2·xH2O. Молярная масса такого вещества будет равна:
M(Cu(NO3)2·xH2O) = 64 + 14·2 + 16·6 + 18х = 188 + 18х г/моль
Выразим массовую долю воды в кристаллогидрате:
ω(H2O) = M(xH2O)/M(Cu(NO3)2·xH2O)·100% = 22,31%
ω(H2O) = 18х/(188 + 18х)·100% = 22,31%
18х/(188 + 18х) = 0,2231
18х = 41,94 + 4,016х
х = 3
Ответ: Cu(NO3)2·3H2O
Задача №2
Массовая доля протонов в кристаллогидрате хлорида марганца равна 50%. Установите формулу кристаллогидрата.
Решение:
Пусть формульная единица кристаллогидрата содержит х молекул кристаллизационной воды. Тогда его формула будет MnCl2·xH2O. Молярная масса такого вещества будет равна:
M(MnCl2·xH2O) = 55 + 35,5·2 + 18х = 126 + 18х г/моль
В составе атома марганца содержится 25 протонов, хлора – 17, кислорода – 8, водорода – 1. Тогда в составе одной формульной единицы будет:
N(p) = 25 + 17·2 + 10х = 59 + 10х
На 1 моль кристаллогидрата приходится (59 + 10х) моль протонов. Их масса будет равна:
m(p) = n(p)·M(p) = 59 + 10х г
Выразим массовую долю воды в кристаллогидрате:
ω(р) = m(p)/m(MnCl2·xH2O)·100% = 50%
ω(p) = (59 + 10х )/( 126 + 18х)·100% = 50%
(59 + 10х )/( 126 + 18х) = 0,5
59 + 10х = 63 + 9х
х = 4
Ответ: MnCl2·4H2O
Задача №3
Отношение количеств электронов в безводном сульфате натрия и его кристаллогидрате равно 7:17. Установите формулу кристаллогидрата.
Решение:
Пусть формульная единица кристаллогидрата содержит х молекул кристаллизационной воды. Тогда его формула будет Na2SO4·xH2O. В составе атома натрия содержится 11 электронов, серы – 16, кислорода – 8, водорода – 1. Тогда в составе одной формульной единицы будет:
N(e) = 11·2 + 16 + 8·4 + 10x = 70 + 10x
В формульной единице сульфата натрия будет 70 электронов. Тогда составим уравнение:
70/(70 + 10х) = 7/17
1190 = 490 + 70х
х = 10
Ответ: Na2SO4·10H2O
Задача №4
Навеску кристаллогидрата перхлората магния разделили на две равные части. Первую нагревали в вакууме до постоянной массы, затем растворили полученную безводную соль в 50 мл воды, что привело к образованию раствора с массовой долей соли 4,27%. Вторую часть растворили 50 мл воды что привело к образованию раствора с массовой долей соли 4,183%. Установите формулу кристаллогидрата.
Решение:
Пусть было х г безводной соли. Вычислим массу соли в первом растворе:
ω(Mg(ClO4)2) = m(Mg(ClO4)2)/m(р-ра)·100%
m(p-pa) = m(H2O доб.) + m(Mg(ClO4)2)
m(H2O доб.) = ρ·V = 50 г
х/(50 + х))·100% = 4,27%
х/(50 + х) = 0,0427
х = 2,135 + 0,0427х
х = 2,23
m(Mg(ClO4)2) = 2,23 г
Далее вычислим массу воды во втором растворе:
m(р-ра Mg(ClO4)2) = m(Mg(ClO4)2)/ω(Mg(ClO4)2)·100%
m(р-ра Mg(ClO4)2) = 2,23/4,183%·100% = 53,31 г
m(H2O общ.) = m(p-pa) — m(Mg(ClO4)2) = 53,31 – 2,23 = 51,08 г
Поскольку часть воды в растворе происходит от исходного кристаллогидрата, ее можно найти по разности:
m(H2O крист.) = m(H2O общ.) — m(H2O доб.) = 51,08 – 50 = 1,08 г
Далее вычислим количества безводной соли и кристаллизационной воды:
n(Mg(ClO4)2) = m(Mg(ClO4)2)/M(Mg(ClO4)2) = 2,23/223 = 0,01 моль
n(H2O крист.) = m(H2O)/M(H2O) = 1,08/18 = 0,06 моль
Пусть формульная единица кристаллогидрата содержит х молекул кристаллизационной воды. Тогда его формула будет Mg(ClO4)2·xH2O. Найдем отношение количеств соли и воды:
n(H2O крист.)/n(Mg(ClO4)2) = х/1 = 0,06/0,01 = 6
х = 6
Ответ: Mg(ClO4)2·6H2O
Задача №5
При охлаждении до 0˚С 150 г горячего насыщенного раствора сульфата меди (II) в осадок выпало 42,38 г медного купороса. Определите растворимость сульфата меди (II) при 80˚С. Растворимость сульфата меди (II) при 0˚С равна 18,3 г/100 г воды.
Решение:
Выразим массовую долю сульфата меди в составе медного купороса:
ω(CuSO4) = m(CuSO4)/m(CuSO4·5H2O)·100% = М(CuSO4)/М(CuSO4·5H2O)·100%
ω(CuSO4) = 160/250·100% = 64% или 0,64
Далее вычислим массу безводной соли в составе выпавшего в осадок кристаллогидрата:
m(CuSO4) = m(CuSO4·5H2O)·ω(CuSO4) = 42,38·0,64 = 27,12 г
Пусть в исходном растворе было х г безводной соли. Тогда будет справедлива следующая запись:
(х – 27,12)/(150 – 42,38) = 18,3/118,3
Решим уравнение:
118,3(х – 27,12) = 18,3·107,62
118,3х – 3208,3 = 1969,4
х = 43,8
Вычислим, сколько в горячем растворе было воды:
m(Н2О) = m(р-ра) — m(CuSO4) = 150 – 43,8 = 106,2 г
Определим растворимость безводной соли на 100 г воды:
S(CuSO4) = m(CuSO4)/m(Н2О)·100 = 43,8/106,2·100 = 41,2 г на 100 г воды
Ответ: 41,2 г/100 г воды.
Гидролиз солей
Тема «Гидролиз солей» – одна из наиболее
трудных для учащихся 9-го класса, изучающих
неорганическую химию. И как думается, трудность
ее не в действительной сложности самого
изучаемого материала, а в том, как он излагается в
учебниках. Так, у Ф.Г.Фельдмана и Г.Е.Рудзитиса из
соответствующего параграфа очень мало, что можно
понять. В учебниках же Л.С.Гузея и Н.С.Ахметова
данная тема вообще исключена, хотя учебник
Ахметова предназначен для учащихся 8–9-х классов
с углубленным изучением химии.
Пользуясь учебниками указанных авторов, ученик
вряд ли сможет хорошо понять теорию растворов,
сущность электролитической диссоциации веществ
в водной среде, соотнести реакции ионного обмена
с реакциями гидролиза солей, образованных
разными по силе кислотами и основаниями. Кроме
того, в конце каждого учебника имеется таблица
растворимости, но нигде и никак не поясняется,
почему в отдельных ее клеточках стоят прочерки, а
в текстах учебников ученики встречают формулы
этих солей.
Мы попытаемся в краткой лекции для учителей
(прежде всего для начинающих, им особенно трудно
отвечать на возникающие у детей вопросы)
восполнить данный пробел и по-своему осветить
проблему составления уравнений реакций
гидролиза и определения характера образующейся
среды.
Гидролизом называется процесс разложения
веществ водой (само слово «гидролиз» об этом
говорит: греч. –
вода и –
разложение). Разные авторы, давая определение
этому явлению, выделяют, что при этом
образуется кислота или кислая соль, основание
или основная соль (Н.Е.Кузьменко); при
взаимодействии ионов соли с водой образуется
слабый электролит (А.Э.Антошин); в результате
взаимодействия ионов соли с водой смещается
равновесие электролитической диссоциации воды (А.А.Макареня);
составные части растворенного вещества
соединяются с составными частями воды
(Н.Л.Глинка) и т.д.
Каждый автор, давая определение гидролиза,
отмечает наиболее важную, на его взгляд, сторону
этого сложного, многогранного процесса. И каждый
из них по-своему прав. Думается, дело учителя,
какому определению отдать предпочтение – что
ему ближе по его образу мышления.
Итак, гидролиз – это разложение веществ водой.
Причиной его является электролитическая
диссоциация соли и воды на ионы и взаимодействие
между ними. Вода диссоциирует незначительно на
ионы Н+ и ОН– ( 1
молекула из 550 000), причем в процессе гидролиза
один или оба этих иона могут связываться с
ионами, образующимися при диссоциации соли, в
малодиссоциирующее, летучее или нерастворимое в
воде вещество.
Соли, образованные сильными основаниями (NаОН,
КОH, Ва(ОH)2) и сильными кислотами (Н2SO4,
HCl, НNO3), гидролизу не подвергаются, т.к.
образующие их катионы и анионы не способны в
растворах связывать ионы Н+ и ОН–
(причина – высокая диссоциация).
Когда соль образована слабым основанием или
слабой кислотой или оба «родителя» – слабые,
соль в водном растворе подвергается гидролизу.
При этом реакция среды зависит от относительной
силы кислоты и основания. Другими словами, водные
растворы таких солей могут быть нейтральными,
кислыми или щелочными в зависимости от констант
диссоциации образующихся новых веществ.
Так, при диссоциации ацетата аммония СН3СООNН4
реакция раствора будет слабощелочной, т.к.
константа диссоциации NН4ОН (kдис =
6,3•10–5) больше константы диссоциации СН3СООН
(kдис = 1,75•10–5). У другой же соли
уксусной кислоты – ацетата алюминия (СН3СОО)3Al
– реакция раствора будет слабокислой, т.к. kдис(СН3СООН)
= 1,75•10–5 больше kдис(Al(ОН)3) =
1,2•10–6.
Реакции гидролиза в одних случаях являются
обратимыми, а в других – идут до конца.
Количественно гидролиз характеризуется
безразмерной величиной г, называемой степенью гидролиза и
показывающей, какая часть от общего количества
молекул соли, находящихся в растворе,
подвергается гидролизу:
г
= n/N•100%,
где n – число гидролизованных молекул, N
– общее число молекул в данном растворе.
Например, если г
= 0,1%, то это означает, что из 1000 молекул соли водой
разложилась только одна:
n = г•N/100
= 0,1•1000/100 = 1.
Степень гидролиза зависит от температуры,
концентрации раствора и природы растворенного
вещества. Так, если рассмотреть гидролиз cоли СН3СООNа,
то степень ее гидролиза для растворов различной
концентрации будет следующая: для 1М раствора –
0,003%, для 0,1М – 0,01%, для
0,01М – 0,03%, для 0,001М – 0,1% (данные взяты из книги
Г.Реми). Эти значения согласуются с принципом Ле
Шателье.
Повышение температуры увеличивает кинетическую
энергию молекул, их распад на катионы и анионы и
взаимодействие с ионами воды (Н+ и ОН–)
– слабого при комнатной температуре
электролита.
Учитывая природу реагирующих веществ, для
связывания ионов ОН– к раствору соли можно
добавить кислоту, а для связывания ионов Н+
– щелочь. Можно также добавить другие соли,
гидролизующиеся по противоположному иону. В этом
случае происходит взаимное усиление гидролиза
обеих солей.
Ослабить гидролиз можно (если это необходимо)
понижением температуры, увеличением
концентрации раствора, введением в него одного
из продуктов гидролиза: кислоты, если при
гидролизе накапливаются ионы Н+, или
щелочи, если накапливаются ионы ОН–.
Все реакции нейтрализации протекают
экзотермически, а гидролиза – эндотермически.
Поэтому выход первых с повышением температуры
уменьшается, а вторых – увеличивается.
Ионы Н+ и ОН– не могут существовать в
растворе в значительных концентрациях – они
соединяются в молекулы воды, смещая равновесие
вправо.
Разложение соли водой объясняется связыванием
катионов и/или анионов диссоциированной соли в
молекулы слабого электролита ионами воды (Н+
и/или ОН–), всегда имеющимися в растворе.
Образование слабого электролита, осадка, газа
или полное разложение нового вещества
равноценно удалению ионов соли из раствора, что в
соответствии с принципом Ле Шателье (действие
равно противодействию) смещает равновесие
диссоциации соли вправо, а следовательно,
приводит к разложению соли до конца. Отсюда и
появляются прочерки в таблице растворимости
против ряда соединений.
Если молекулы слабого электролита образуются за
счет катионов соли, то говорят, что гидролиз идет
по катиону и среда будет кислая, а если за счет
анионов соли, то говорят, что гидролиз идет по
аниону и среда будет щелочная. Иными словами, кто
сильнее – кислота или основание, – тот и
определяет среду.
Гидролизу подвергаются только растворимые соли
слабых кислот и/или оснований. Дело в том, что
если соль малорастворима, то концентрации ее
ионов в растворе ничтожно малы и говорить о
гидролизе такой соли не имеет смысла.
Составление уравнений реакций
гидролиза солей
Гидролиз солей слабых многоосновных оснований
и/или кислот происходит ступенчато. Число
ступеней гидролиза равно наибольшему заряду
одного из ионов соли.
Например:
Однако гидролиз по второй ступени и особенно по
третьей идет очень слабо, поскольку
г1 >>
г2 >>
г3. Поэтому
при написании уравнений гидролиза обычно
ограничиваются первой ступенью. Если гидролиз
практически завершается на первой ступени, то
при гидролизе солей слабых многоосновных
оснований и сильных кислот образуются основные
соли, а при гидролизе солей сильных оснований и
слабых многоосновных кислот образуются кислые
соли.
Количество молекул воды, участвующих в
процессе гидролиза соли по схеме реакции,
определяется произведением валентности катиона
на число его атомов в формуле соли
(правило автора).
Например:
Nа2СО3 2Na+
1•2 = 2 (H2O),
Al2(SО4)3 2Al3+
3•2
= 6 (H2O),
Co(CH3COO)2 Со2+
2•1 = 2 (H2O).
Поэтому при составлении уравнения гидролиза
пользуемся следующим алгоритмом (на
примере гидролиза Al2(SО4)3):
1. Определяем, из каких веществ образована соль:
2. Предполагаем, как мог бы пойти гидролиз:
Al2(SО4)3 + 6Н–ОН = 2Аl3+
+ 3 + 6H+ + 6OH–.
3. Поскольку Al(ОН)3 – слабое основание и
его катион Al3+ связывают ионы ОН– из
воды, то процесс фактически идет так:
Al2(SO4)3 + 6Н+ + 6OH–
= 2Аl(ОН)2+ + 3 +
6H+ + 2OH–.
4. Сопоставляем количества оставшихся в
растворе ионов Н+ и ОН– и определяем
реакцию среды:
6Н+ + 2ОН– = 2Н2О + 4Н+
кислая среда.
5. После гидролиза образовалась новая соль:
(Al(ОН)2)2SО4, или Аl2(ОН)4SO4,
– дигидроксосульфат алюминия (или
тетрагидроксосульфат диалюминия) – основная
соль. Частично может образоваться и AlОНSО4
(гидроксосульфат алюминия), но в значительно
меньшем количестве, и им можно пренебречь.
Другой пример:
1.
2. Na2SiO3 + 2Н2О = 2Na+ +
+ 2Н+ + 2ОН–.
3. Поскольку Н2SiO3 – слабая кислота и
ее ионсвязывает
ионы Н+ из воды, то фактически реакция идет
так:
2Na+ + + 2Н+ + 2ОН– = 2Na+ + Н
+ Н+ + 2ОН–.
4. Н+ + 2ОН– = Н2О + ОН–
щелочная среда.
5. Na+ + Н
=
NаНSiO3 – гидросиликат натрия – кислая соль.
Кислотность или щелочность среды легко
определить по количеству оставшихся в растворе
ионов Н+ или ОН– при условии, что
новые вещества образовались и существуют в
растворе в эквивалентных отношениях и другие
реактивы в ходе реакции не добавлялись. Среда
может быть кислая или слабокислая (если ионов Н+
мало), щелочная (если ионов ОН– много) или
слабощелочная, а также нейтральная, если
значения констант диссоциации слабой кислоты и
слабого основания близки и все оставшиеся в
растворе ионы Н+ и ОН– после
гидролиза снова соединились с образованием Н2О.
Мы уже отмечали, что степень гидролиза соли тем
больше, чем слабее кислота или основание,
образовавшие эту соль. Поэтому необходимо для
помощи учащимся привести ряды анионов и
катионов, соответствующие уменьшению силы
кислот и оснований их образующих (по
А.В.Метельскому).
Сd2+ > Mg2+ > Mn2+ > Fe2+
> Co2+ > Ni2+ >
> Cu2+ > Pb2+ > Zn2+ > Al2+
> Cr2+ > Fe2+.
Чем правее в этих рядах расположен ион, тем с
большей силой идет гидролиз образованной им
соли, т.е. его основание или кислота cлабее, чем у
стоящих слева от него. Особенно сильно идет
гидролиз солей, образованных одновременно
слабыми основанием и кислотой. Но даже для них
степень гидролиза обычно не превышает 1%. Тем не
менее в некоторых случаях гидролиз таких солей
протекает особенно сильно и степень гидролиза
достигает почти 100%. Такие соли в водных растворах
не существуют, а хранятся только в сухом виде. В
таблице растворимости против них стоит прочерк.
Примерами таких солей могут служить ВаS, Аl2S3,
Сr2(SO3)3 и другие (см. таблицу
растворимости в учебниках).
Подобные соли, имеющие высокую степень
гидролиза, гидролизуются полностью и необратимо,
т. к. продукты их гидролиза выводятся из раствора
в виде малорастворимого, нерастворимого,
газообразного (летучего), малодиссоциирующего
вещества или разлагаются водой на другие
вещества.
Например:
Соли, полностью разлагаемые водой, нельзя
получить реакцией ионного обмена в водных
растворах, т.к. вместо ионного обмена более
активно протекает реакция гидролиза.
Например:
2АlCl3 + 3Na2S Аl2S3 + 6NaCl (так могло бы быть),
2АlCl3 + 3Na2S + 6H2O 2Al(OH)3
+ 3H2S
+ 6NaCl (так есть фактически).
Соли, подобные Al2S3, получают в
безводных средах спеканием компонентов в
эквивалентных количествах или другими
способами:
Многие галогениды, как правило, активно
реагируют с водой, образуя гидрид одного
элемента и гидроксид другого.
Например:
СlF + H–OH HClO + HF,
PСl3 + 3H–OH
P(OH)3 + 3HCl
(по Л.Полингу).
Как правило, при такого рода реакциях, также
называемых гидролизом, более
электроотрицательный элемент соединяется с Н+,
а менее электроотрицательный – с ОН–.
Легко заметить, что приведенные выше реакции
протекают в соответствии с этим правилом.
Кислые соли слабых кислот также подвергаются
гидролизу. Однако в этом случае наряду с
гидролизом протекает диссоциация кислотного
остатка. Так, в растворе NaHCО3 одновременно
протекают гидролиз H, приводящий к
накоплению ОH–-ионов:
Н + Н–ОН
Н2СО3
+ ОH–,
и диссоциация, хотя и незначительная:
Н
+ H+.
Таким образом, реакция раствора кислой соли
может быть как щелочной (если гидролиз аниона
преобладает над его диссоциацией), так и кислой (в
обратном случае). Это определяется соотношением
константы гидролиза соли (Кгидр) и
константы диссоциации (Кдис)
соответствующей кислоты. В рассмотренном
примере Кгидр аниона больше Кдис
кислоты, поэтому раствор данной кислой соли
имеет щелочную реакцию (что и используют
страдающие изжогой от повышенной кислотности
желудочного сока, хотя делают это зря). При
обратном соотношении констант, например в случае
гидролиза NaHSO3, реакция раствора будет
кислой.
Гидролиз основной соли, например
гидроксохлорида меди(II), протекает так:
Сu(ОН)Сl + Н–ОН
Сu(ОН)2 + НСl,
или в ионном виде:
СuОН+ + Сl– + H+ + ОH–
Сu(ОН)2
+ Cl– + H+
среда кислая.
Гидролиз в широком смысле – это реакции
обменного разложения между различными
веществами и водой (Г.П.Хомченко). Такое
определение охватывает гидролиз всех соединений
– как неорганических (солей, гидридов,
галогенидов, халькогенов и др.), так и
органических (сложных эфиров, жиров, углеводов,
белков и др.).
Например:
(C6H10O5)n + nH–OH nC6H12O6,
CaC2 + 2H–OH
Ca(OH)2 + C2H2,
Cl2 + H–OH HCl
+ HClO,
PI3 + 3H–OH H3PO3
+ 3HI.
В результате гидролиза минералов –
алюмосиликатов – происходит разрушение горных
пород. Гидролиз некоторых солей – Na2CO3,
Na3РО4 – применяется для очистки воды
и уменьшения ее жесткости.
Растущая быстрыми темпами гидролизная отрасль
промышленности вырабатывает из отходов
(древесные опилки, хлопковая шелуха,
подсолнечная лузга, солома, кукурузные
кочерыжки, отходы сахарной свеклы и др.) ряд
ценных продуктов: этиловый спирт, кормовые
дрожжи, глюкозу, «сухой лед», фурфурол, метанол,
лигнин и многие другие вещества.
Гидролиз протекает в организме человека и
животных при переваривании пищи (жиров,
углеводов, белков) в водной среде под действием
ферментов – биологических катализаторов. Он
играет важную роль в ряде химических превращений
веществ в природе (цикл Кребса, цикл
трикарбоновых кислот) и промышленности. Поэтому
нам думается, что вопросам изучения гидролиза в
школьном курсе химии необходимо уделять
значительно больше внимания.
Ниже приведен пример раздаточной карточки,
предлагаемой учащимся для закрепления материала
после изучения темы «Гидролиз солей» в 9-м классе.
Алгоритм написания уравнения
гидролиза Fe2(SO4)3
1. Определяем, чем образована соль:
2. Предполагаем, как мог бы пойти
гидролиз:
Fe2(SO4)3 + 6Н2О = 2Fe3+
+ 3 + 6H+ + 6OH–.
3. Поскольку Fe(OH)3 – слабое
основание, то катионы Fe3+ будут связываться
анионами ОН– из воды и гидролиз фактически
будет протекать так:
2Fе3+ + 3 + 6H+ + 6OH– = 2Fe(OH)2+ + 3
+ 6H+ + 2OH–.
4. Определяем реакцию среды:
6Н+ + 2ОН– = 2Н2О + 4Н+
кислая среда.
5. Определяем новую соль по ионам,
оставшимся в растворе:
2Fe(OH)2+ + = [Fe(OH)2]2SO4 –
дигидроксосульфат железа(III)
– основная соль.
Гидролиз идет по катиону.
Дополнительная информация
(на обороте карточки)
1. Кто сильнее – основание или кислота,
тот и определяет среду: кислую или щелочную.
2. Диссоциацию и гидролиз многоосновных
кислот и оснований учитываем только по первой
ступени. Например:
Аl(ОН)3 = Аl + ОH–,
Н3РO4 = Н+ + .
3. Ряд активности кислот (их силы):
4. Ряд активности оснований (их силы):
5. Чем правее в своем ряду стоит
кислота и основание, тем они слабее.
6. Количество молекул воды, участвующих
в гидролизе соли по схеме реакции, определяется
произведением валентности катиона на число его
атомов в формуле соли:
Na2SO3
2Na+ 1•2 = 2 (H2O),
ZnCl2 1Zn2+
2•1 = 2 (H2O),
Al2(SO4)3 2Al3+
3•2
= 6 (H2O).
7. Гидролиз идет по катиону, если
основание слабое, и по аниону, если кислота
слабая.
Применение данного алгоритма
способствует осознанному написанию учащимся
уравнений гидролиза и при достаточной
тренировке не вызывает никаких затруднений.
ЛИТЕРАТУРА
Антошин А.Э., Цапок П.И. Химия. М.: Химия, 1998;
Ахметов Н.С. Неорганическая химия. М.:
Просвещение, 1990;
Глинка Н.Л. Общая химия. Л.: Химия, 1978;
Еремин В.В., Кузьменко Н.Е. Химия. М.: Экзамен,
1998;
Еремин В.В., Кузьменко Н.Е., Попов В.А. Химия. М.:
Дрофа, 1997;
Кузьменко Н.Е., Чуранов С.С. Общая и
неорганическая химия. М.: Изд-во МГУ, 1977;
Метельский А.В. Химия. Минск: Белорусская
энциклопедия, 1997;
Полинг Л., Полинг П. Химия. М.: Мир, 1998;
Пиментел Д.С. Химия. М.: Мир, 1967;
Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.:
Просвещение, 1997;
Холин Ю.В., Слета Л.А. Репетитор по химии.
Харьков: Фолино, 1998;
Хомченко Г.П. Химия. М.: Высшая школа, 1998.
А.А.ТРУСКОВ, учитель химии
магистральнинской средней школы № 2,
(п. Магистральный, Казачинско-Ленинский р-н,
Иркутская обл.)
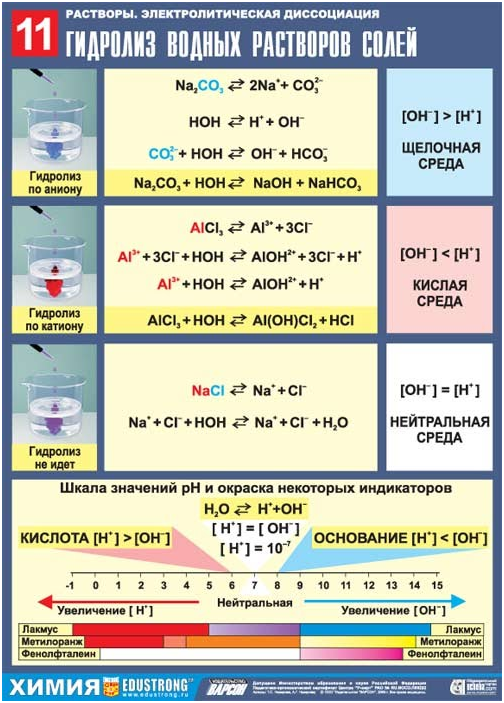
5.7. Гидролиз солей
Гидролиз солей — это химическое
взаимодействие ионов соли с ионами воды, приводящее к образованию слабого
электролита.
Гидролиз – процесс обратимый для
большинства солей. В состоянии равновесия только небольшая часть ионов соли
гидролизуется. Количественно гидролиз характеризуется степенью гидролиза (h).
Степень гидролиза равна отношению
числа гидролизованных молекул соли к общему числу растворенных молекул:
где n – число молекул соли,
подвергшихся гидролизу; N – общее число
растворенных молекул соли.
Если рассматривать соль как продукт
нейтрализации основания кислотой, то можно разделить соли на четыре группы, для
каждой из которых гидролиз будет протекать по-своему.
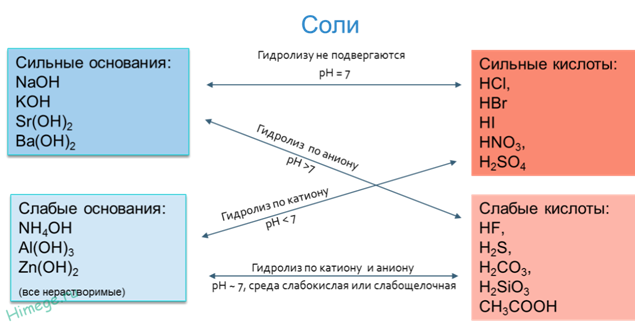
1). Гидролиз не
возможен
Соль, образованная
сильным основанием и сильной кислотой (KBr, NaCl, NaNO3),
гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов =
7. Реакция среды остается нейтральной.
2). Гидролиз по
катиону (в реакцию с водой вступает только катион)
В соли, образованной
слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3,MgSO4)
гидролизу подвергается катион:
FeCl2 +
HOH <=>Fe(OH)Cl + HCl
Fe2+ + 2Cl— + H+ + OH— <=>
FeOH+ + 2Cl— + Н+
В результате гидролиза
образуется слабый электролит, ион H+ и другие ионы.
рН раствора < 7
(раствор приобретает кислую реакцию).
3). Гидролиз
по аниону (в реакцию с водой вступает только анион)
Соль, образованная
сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3,CH3COONa)
подвергается гидролизу по аниону, в результате чего образуется слабый
электролит, гидроксид-ион ОН— и другие ионы.
K2SiO3 + НОH
<=>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH—<=>
НSiO3— + 2K+ + ОН—
рН таких растворов
> 7 (раствор приобретает щелочную реакцию).
4). Совместный
гидролиз (в реакцию с водой вступает и катион и анион)
Соль, образованная
слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3,Al2S3),
гидролизуется и по катиону, и по аниону. В результате образуются
малодиссоциирующие основание и кислота. рН растворов таких солей зависит от
относительной силы кислоты и основания. Мерой силы кислоты и основания является
константа диссоциации соответствующего реактива.
Реакция среды этих
растворов может быть нейтральной, слабокислой или слабощелочной:
Al2S3 + 6H2O
=>2Al(OH)3↓+ 3H2S↑
Гидролиз — процесс обратимый.
Гидролиз протекает
необратимо, если в результате реакции образуется нерастворимое основание и
(или) летучая кислота.
Алгоритм
составления уравнений гидролиза солей
|
Ход рассуждений |
Пример |
||||
|
1. Определяем силу Помните! Гидролиз
|
Na2CO3 – карбонат натрия, соль образованная сильным основанием (NaOH) и слабой кислотой (H2CO3) |
||||
|
2. Записываем |
2Na+ + CO32- + H+OH— ↔ Это гидролиз по От слабого |
||||
|
3. Записываем полное |
2Na+ + CO32- + H+OH— ↔ В продуктах реакции |
||||
|
4. Записываем молекулярное гидролиза |
Na2CO3 + HOH ↔ |
УПРАЖНЕНИЯ
1.
Определить,
какие соли из перечисленных подвергаются гидролизу, какие из них по катиону,
какие по аниону, какие и по катиону, ти по аниону.
NaCl, KI, Rb2SO4,
Ba(ClO4)2, K2CO3, KCN, K2SO3,
FeCl3, NH4Cl, CuCl2, (NH4)2CO3.
Решение:
Гидролиз по катиону не идет, если катион
образует сильное основание (щелочь).
Это: щелочные, щелочноземельные металлы,
серебро.
Li+, Na+, K+,
Rb+, Cs+, Ca2+, Sr2+, Ba2+,
Ag+.
Гидролиз по аниону не идет, если анион —
кислотный остаток сильной кислоты.
Это: галогеноводороды (кроме HF), серная,
азотная, хлорная кислоты.
HCl, HBr, HI, H2SO4, HNO3,
HClO4.
Отсюда:
1. Соли NaCl, KI, Rb2SO4,
Ba(ClO4)2, образованы сильной кислотой и сильным
основанием. Не гидролизуются.
2. Соли K2CO3, KCN, K2SO3,
образованы сильным основанием и слабыми кислотами. Гидролиз по аниону.
3. Соли FeCl3, NH4Cl, CuCl2,
образованы слабым (малорастворимым) основанием и сильной кислотой. Гидролиз по
катиону.
4. (NH4)2CO3.
Образован слабым основанием и слабой кислотой. Гидролиз по катиону и аниону.
_____________________________________________________________
2.
Установите соответствие между названием соли и отношением ее к гидролизу.
|
ФОРМУЛА |
ТИП |
Используя полученные знания о
гидролизе солей, приходим к выводу: А – 3; Б – 1;В – 2; Г – 2
_____________________________________________________________
3.
Укажите реакцию среды в растворе соли Li2CO3.
Составьте ионно-молекулярные и молекулярные уравнения гидролиза.
Решение:
Напомню, что гидролиз
солей – это реакция обменного взаимодействия соли с водой.
Соль карбонат лития (Li2CO3)образована сильным
основанием – гидроксидом лития (LiOH) и слабой кислотой – угольной (H2CO3),
следовательно, гидролиз идет по аниону.
Так, как анион двухзаряден, гидролиз протекает в две стадии (ступени).
Запишем уравнения гидролиза соли карбоната лития
(Li2CO3):
Уравнения гидролиза соли по первой ступени:
Уравнения гидролиза соли по второй ступени (гидролиз
протекает в меньшей степени):
В растворе появляется избыток ионов ОН—, среда щелочная,
pH>7.
_____________________________________________________________
4.
Определите, какие из
солей подвергаются гидролизу (Na3PO4, ZnSO4, RbCl)? Cоставьте ионно-молекулярные и молекулярные уравнения
реакций гидролиза солей. Укажите реакцию среды. Какое значение рН имеют
растворы этих солей?
Решение:
Соль ортофосфат натрия ( Na3PO4) образована сильным основанием NaOH и слабой кислотой H3PO4. Следовательно,
гидролиз этой соли протекает по аниону соли.
При растворении в воде Na3PO4 диссоциирует
Na3PO4⇌3Na+ + PO43-.
В данном случае ионы PO43- связывают катион H+,
образуя ион HPO42- . Ионно-молекулярное уравнение гидролиза
PO43- + H2O⇌ HPO42- + OH–.
Уравнение гидролиза в
молекулярной форме
Na3PO4 + H2O⇌Na2HPO4 + NaOH.
Практически гидролиз
соли ограничивается первой ступенью с образованием кислой соли (в данном случае Na2HPO4). Избыток ионов OH– в растворе обусловливает щелочную реакцию среды в растворе (pН>7).
Соль сульфат цинка (ZnSO4) образована слабым основанием Zn(OH)2 и сильной кислотой H2SO4. Гидролиз этой соли протекает по катиону
соли.
При растворении в воде ZnSO4 диссоциирует
ZnSO4⇌Zn2+ + SO42–
В данном случае ионы Zn2+ соединяются с ионами OH–, образуя гидроксоионы ZnOH+. Гидролиз соли ограничивается первой
ступенью, и образование молекулы Zn(OH)2 не происходит.
Ионно-молекулярное уравнение имеет вид
Zn2+ + HOH⇌ZnOH++ H+.
В данном случае продуктами
гидролиза являются основная соль и кислота. Уравнение гидролиза в
молекулярной форме записывается следующим образом
2ZnSO4+ 2H2O⇌ (ZnOH)2SO4+
H2SO4 .
Избыток ионов H+ в растворе обусловливает кислую реакцию
среды в растворе (рН<7).
Cоль RbCl образована сильным основанием RbOH и сильной кислотой HCl. Эта соль не подвергается гидролизу, т.к.
единственным малодиссоциирующим соединением является H2O. Раствор
соли имеет нейтральную среду (рН=7).
____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Запишите уравнения гидролиза солей и
определите среду водных растворов (рН) и тип гидролиза:
Na2SiO3 , AlCl3, K2S.
2.
Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
3.
Составьте уравнения гидролиза, определите тип гидролиза и среду водного
раствора соли для следующих веществ:
Сульфид Калия — K2S, Бромид алюминия — AlBr3,
Хлорид лития – LiCl, Фосфат натрия — Na3PO4,
Сульфат калия — K2SO4, Хлорид цинка — ZnCl2,
Сульфит натрия — Na2SO3, Cульфат аммония — (NH4)2SO4,
Бромид бария — BaBr2 .
4. Установить соответствие между названием соли и типом
гидролиза её в водном растворе
|
Название соли |
Тип гидролиза |
|
1) Нитрат меди (II) |
А) по катиону |
|
2) Карбонат аммония |
Б) по аниону |
|
3) Хлорид железа (II) |
В) по катиону и аниону |
|
4) Силикат калия |
Заполните следующую таблицу:
6.
Изменится ли окраска фенолфталеина в растворе соли K2S? Составьте молекулярное и ионное уравнения
гидролиза этой соли.
7.
В одну пробирку налили раствор щелочи, в другую –
раствор кислоты, в третью – раствор хлорида натрия. Как с помощью индикатора
лакмуса определить, в какой из пробирок находится кислота, щелочь и хлорид
натрия? Ответ объясните.
8.
В одну пробирку налили раствор Na2CO3, в другую – раствор CuBr2.
Почему при добавлении фенолфталеина малиновую окраску имеет только один
раствор. Составьте молекулярные и ионные
уравнения гидролиза этих солей.
9.
Составьте молекулярные и ионные уравнения гидролиза
солей
. Растворы каких солей имеют рН< 7.
10.
Составьте молекулярные и ионные уравнения гидролиза
солей
Какова значение рН (больше или меньше 7)
в растворах каждой из этих солей. В растворах каких солей лакмус имеет синий
цвет?
|
1. Между какими ионами в водном растворе нет |
|
|
а) все ответы |
б) CO32- и H+ |
|
в)HCO3— и OH— |
г)Ca2+ и HCO3— |
|
2. Какие уравнения реакций, схемы которых приведены |
|
|
а)CuCl2 |
б) CuCl2 |
|
в)CuSO4 |
г) Cu(OH)2 + 2HCl→ |
|
3. Какое сокращенное ионное уравнение отвечает |
|
|
а)CO32- + 2H+ → H2O + CO2 |
б) HCO3— + OH— → CO32- + H2O |
|
в) H+ |
г)KHCO3 + OH— → K+ + |
|
4. Какие пары ионов, формулы которых приведены ниже, |
|
|
а) К+ и |
б) Na+ и |
|
в) K+ и Cl— |
г) Ca2+ и SO42- |
|
5. В какой реакции из приведенных ниже ионных схем |
|
|
а) Н+ + ОН— → |
б) 2Н+ + СО32- → |
|
в) НСО3— + ОН— → |
г) Са2+ + СО32- → |
|
6. Каким реактивом можно различить растворы карбоната |
|
|
а)NaOH |
б) NaNO3 |
|
в)H2SO4 |
г)K2SO4 |
|
7. Нейтрализация какой кислоты и основания отражается |
|
|
а) сильная кислота и сильное основание |
б) слабая кислота и сильное основание |
|
в) слабое основание и сильная кислота |
г) оба электролита слабые |
|
8. С каким веществом сульфид калия реагирует согласно |
|
|
а) Сu(OH)2 |
б)CuO |
|
в)CuSO4 |
г)CuCO3 |
|
9. Взаимодействие каких веществ описывается |
|
|
а) BaCO3 |
б)K и HCl |
|
в) (NH4)2CO3 и HNO3 |
г) NaHCO3 |
|
10. В водных |
|
|
а) NH4Cl |
б) Na3PO4 |
|
в) НNO3 |
г) K2SO4 |
Ответы:
|
1 |
г |
|
2 |
в |
|
3 |
б |
|
4 |
в |
|
5 |
б |
|
6 |
в |
|
7 |
в |
|
8 |
в |
|
9 |
в |
|
10 |
а |