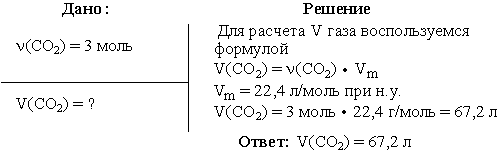Как вычислить массу газа
Довольно часто встает вопрос: как можно вычислить массу какого-либо газа, содержащегося в определенном объеме при определенных условиях (давлении, температуре)? Произвести эти вычисления несложно, надо лишь знать несколько правил.

Инструкция
Предположим, перед вами поставлена задача: надо определить массу углекислого газа, занимающего при нормальном давлении и комнатной температуре объем в 0,18 м^3. Прежде всего вспомните универсальное правило, согласно которому 1 моль любого газа при нормальных условиях занимает объем, равный 22,4 литра. (Точнее – 22, 414 литра, но для упрощения расчетов эту величину можно округлить).
Потом переведите данный вам объем в литры. 0,18м^3 – это 180 литров. Соответственно, в нем содержится 180/22,4 = 8,036 молей углекислого газа.
А теперь остается последний шаг. Формула углекислого газа — СО2. Его молярная масса: 12 + 16*2 = 44 грамма/моль. То есть в одном моле углекислого газа содержится примерно 44 грамма этого вещества. Сколько же его в 8,036 молях? Произведите умножение: 44*8,036 = 353, 58 грамма или округленно 353,6 грамма. Задача решена.
Если вам надо найти массу того же углекислого газа, но находящегося при условиях весьма отличающихся от нормальных? Например, какое-то количество этого газа поместили в герметичный сосуд объемом V, нагрели до температуры Т, измерили его давление, оказавшееся равным P. Вопрос: какая масса углекислого газа содержится в сосуде при таких условиях?
И эта задача также очень простая. Для ее решения надо всего лишь вспомнить про уравнение Менделеева-Клапейрона, названное в честь двух выдающихся ученых. Оно было выведено ими для описания состояний так называемого «идеального газа». Его формула такова: PV = MRT/m. Или в слегка видоизмененной форме: PVm = МRT, где З – давление в паскалях, V – объем в кубических метрах, m – молярная масса газа, M – его фактическая масса, T – температура в градусах Кельвина, R – универсальная газовая постоянная, примерно равная 8,31.
Легко можно видеть, что фактическая масса газа М вычисляется по формуле: М = PVm / RT. Подставив в эту формулу все известные данные, и помня, что молярная масса углекислого газа m равна 44 грамма/моль, вы легко получите ответ.
Конечно же, ни углекислый газ, ни какой-либо другой не является идеальным газом. Поэтому, уравнение Менделеева-Клапейрона не вполне точно описывает его состояние. Но, если условия не очень сильно отличаются от нормальных, погрешности вычислений малы, и ими можно пренебречь.
Источники:
- формула углекислого газа
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как найти массу газа в баллоне?
#37026
2020-03-24 14:18 GMT
Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
#37028
2020-03-24 15:34 GMT
#37026
РоманУфа :Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
Вот вам формула с пояснениями:

Отсюда (m=frac{PVM}{RT}).
Для метана (M=0.016;frac{кг}{моль} ).
Как видите, нужно ещё знать температуру. Чем больше температура, тем меньше масса газа.
Подставляете числа в формулу и считаете.
#37029
2020-03-24 16:56 GMT
#37028
zam :#37026
РоманУфа :Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
Вот вам формула с пояснениями:

Отсюда (m=frac{PVM}{RT}).
Для метана (M=0.016;frac{кг}{моль} ).
Как видите, нужно ещё знать температуру. Чем больше температура, тем меньше масса газа.
Подставляете числа в формулу и считаете.
А в каких единицах измерения подставлять значения???
#37031
2020-03-24 17:32 GMT
#37029
РоманУфа :А в каких единицах измерения подставлять значения???
Главное, что бы все в одной системе. Наиболее популярная — Си.
Тогда (P = 24.5; МПа = 2.45 cdot 10^7 ; Па),
(V=0.21; м^3)
,
(T=293;K)
(нормальная комнатная температура).
#37032
2020-03-24 18:26 GMT
#37031
zam :#37029
РоманУфа :А в каких единицах измерения подставлять значения???
Главное, что бы все в одной системе. Наиболее популярная — Си.
Тогда (P = 24.5; МПа = 2.45 cdot 10^7 ; Па),
(V=0.21; м^3)
,(T=293;K)
(нормальная комнатная температура).Огромное спасибо за помощь
#37041
2020-03-25 09:37 GMT
zam, тут давление больно высокое.
245 атмосфер.
У Метан Tk=190,65 К Pk=45,8 атмосферы
Плохо помню какие есть методы исследовани я веществ в критическом состоянии и как они себя видут, но думается там уже будет жидкость, а не пар.
Относительный удельный вес жидкого метана 0,555
210 Л *0,555= 116,55 кг.

#37047
2020-03-25 12:31 GMT
#37041
Очепятка :но думается там уже будет жидкость, а не пар.
В задании сказано: «Какая масса газа…».
Так что, условия там такие, что метан в газообразном состоянии.
#37053
2020-03-25 13:49 GMT
#37047
zam :#37041
Очепятка :но думается там уже будет жидкость, а не пар.
В задании сказано: «Какая масса газа…».
Так что, условия там такие, что метан в газообразном состоянии.
Так Вы фразу целиком читайте. «Какая масса газа уместиться в такой баллон?»
Это не значит, что газ в болоне, это значит что закачиваем мы газ. А балон такой что сжимает газ до жидкого состояния.
Вычисление массы и объема газов
Если в условиях задачи указаны вещества в газообразном состоянии, то при вычислениях необходимо использовать газовые законы, связывающие количества и массы веществ с их объемами.
Задача 1. Вычислить объем диоксида углерода при н.у., взятого количеством
вещества 3 моль.
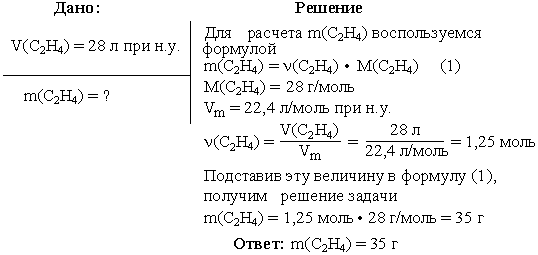
Задача 2. Вычислить массу этилена (C2H4), занимающего при н.у. объем 28 л.
Задача 3. Вычислить объемную долю метана в смеси, состоящей из 30 л
метана, 5 л этана и 2 л водорода. Объемы газов измерены при одинаковых
условиях.
Часто допускается ошибка, когда при проведении расчётов отождествляются величины массовых и объёмных долей вещества.
Чтобы показать ошибочность таких представлений, рассмотрим решение задачи, в которой расчёт объемов газов связан с вычислениями их масс.
Задача 4. Имеется газовая смесь, массовые доли газа в которой равны (%): метана – 65, водорода – 35. Определите объемные доли газов в этой смеси.
Таким образом, числовые значения массовых и объемных долей не совпадают.
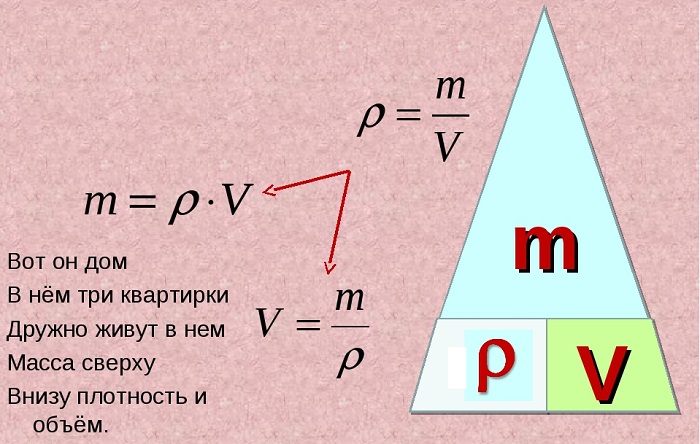
Формула массы через плотность и объем является одной из базовых формул физики, изучаемых в рамках школьной программы еще в седьмом классе. Она пригодится в решении многих задач.
Формула зависимости массы от объема и плотности
Для того, чтобы найти плотность жидкости или твердого вещества, существует базовая формула: плотность равна массе, поделенной на объем.
Записывается это так:
ρ = m / V
И из нее можно вывести еще две формулы.
Формулу для объема тела:
V = m / ρ
А также формулу для расчета массы:
m = V * ρ
Как видите, запомнить последнюю очень легко: это единственная формула, где две единицы нужно умножить.
Для запоминания этой зависимости можно использовать рисунок в виде «пирамидки», разделенной на три секции, в вершине которой находится масса, а в нижних углах – плотность и объем.
Несколько иначе обстоят дела с газами. Рассчитать их вес гораздо сложнее, так как у газов нет постоянной плотности: они рассеиваются и занимают весь доступный им объем.
Для этого пригодится понятие молярной массы, которую можно найти, сложив массу всех атомов в формуле вещества при помощи данных из периодической таблицы.
Вторая единица, которая нам понадобится – количество вещества в молях. Его можно вычислить по уравнению реакции. Подробнее об этом можно узнать в рамках курса химии.
Другой способ нахождения мольного количества – через объем газа, который нужно поделить на 22,4 литра. Последнее число – это объемная постоянная, которую стоит запомнить.
В итоге, зная две предыдущие величины, мы можем определить массу газа:
m = n * M,
где M – это молярная масса, а n – количество вещества.
Результат получится в граммах, поэтому для решения физических задач важно не забыть перевести его в килограммы, поделив на 1000. Числа в этой формуле часто могут оказываться достаточно сложными, поэтому для вычислений может понадобиться калькулятор.
Еще один нестандартный случай, с которым можно столкнуться – необходимость найти плотность раствора. Для этого существует формула средней плотности, построенная аналогично формулам других средних величин.
Для двух веществ посчитать ее можно так:
(m1 + m2) / V1 + V2.
Также из этой формулы можно вывести несколько других в зависимости от того, какие из величин известны по условию задачи.
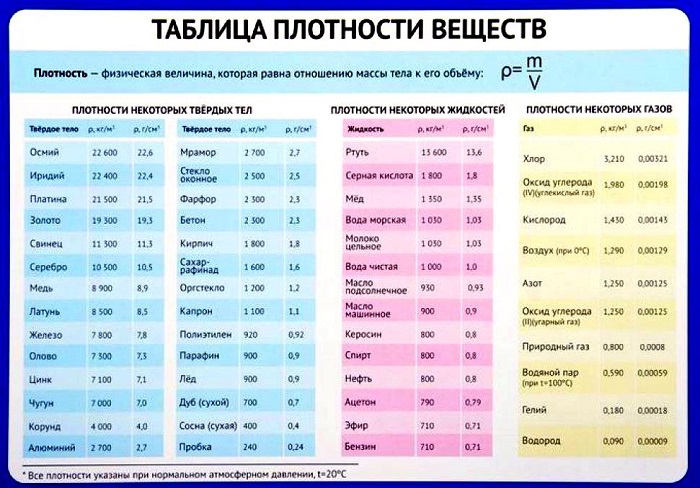
Таблица плотности некоторых веществ
Плотность многих веществ известна заранее и легко находится по соответствующей таблице.
В работе с ней важно обращать внимание на размерности и не забывать о том, что все данные собраны при нормальных условиях: комнатной температуре в 20 градусов Цельсия, а также определенном давлении, влажности воздуха и так далее.
Плотности других, более редких веществ можно найти онлайн.
Как минимум одно из значений плотности стоит запомнить, так как оно часто появляется в задачах. Это плотность воды – 1000 кг/м3 или 1 г/см3.
Примеры решения задач
Задача 1
Условие: имеется алюминиевый брусок со сторонами 3, 5 и 7 сантиметров. Какова его масса?
Решение:
Найдем объем бруска:
V = a * b * c;
V = 3 * 5 * 7 = 105 см3;
Табличное значение плотности алюминия: 2800 кг/м3 или 2,8 г/см3;
Вычислим массу бруска:
m = V * ρ;
m = 105 * 2,8 = 294 г.
Ответ: m = 294 г.
Задача 2
Задача по смежной теме.
Условие: сколько энергии потребуется для того, чтобы довести воду комнатной температуры (20 градусов Цельсия) из стакана (ёмкость 200 мл) до температуры кипения?
Решение:
Найдем недостающую информацию: температура кипения воды t2 = 100 градусов Цельсия, удельная теплоемкость воды с = 4200 Дж/кг * С, плотность воды 1 г/см3, 1 мл воды = 1 см3;
Найдем массу воды:
m = V * ρ;
m = 200 * 1 = 200 г = 0,2 кг;
Найдем энергию:
Q = c * m * (t2 – t1);
Q = 4200 * 0,2 * (100 – 20) = 67200 Дж = 67,2 кДж.
Ответ: Q = 67,2 кДж.
Задача 3
Задача с молярной массой.
Условие: найдите массу CO2 при объеме в 5,6 л.
Решение:
Найдем молярную массу CO2 :
M = 12 + 16 * 2 = 44 г/моль;
Найдем количество вещества через объем:
n = 5,6 / 22,4 = 0,25 моль;
Найдем массу:
m = n * M;
m = 0,25 * 44 = 11 г.
Ответ: m = 11 г.
Довольно часто встает вопрос: как можно вычислить массу какого-либо газа, содержащегося в определенном объеме при определенных условиях (давлении, температуре)? Произвести эти вычисления несложно, надо лишь знать несколько правил.
Предположим, перед вами поставлена задача: надо определить массу углекислого газа, занимающего при нормальном давлении и комнатной температуре объем в 0,18 м^3. Прежде всего вспомните универсальное правило, согласно которому 1 моль любого газа при нормальных условиях занимает объем, равный 22,4 литра. (Точнее – 22, 414 литра, но для упрощения расчетов эту величину можно округлить).
Потом переведите данный вам объем в литры. 0,18м^3 – это 180 литров. Соответственно, в нем содержится 180/22,4 = 8,036 молей углекислого газа.
А теперь остается последний шаг. Формула углекислого газа — СО2. Его молярная масса: 12 + 16*2 = 44 грамма/моль. То есть в одном моле углекислого газасодержится примерно 44 грамма этого вещества. Сколько же его в 8,036 молях? Произведите умножение: 44*8,036 = 353, 58 грамма или округленно 353,6 грамма. Задача решена.
Если вам надо найти массу того же углекислого газа, но находящегося при условиях весьма отличающихся от нормальных? Например, какое-то количество этого газа поместили в герметичный сосуд объемом V, нагрели до температуры Т, измерили его давление, оказавшееся равным P. Вопрос: какая масса углекислого газа содержится в сосуде при таких условиях?
И эта задача также очень простая. Для ее решения надо всего лишь вспомнить про уравнение Менделеева-Клапейрона, названное в честь двух выдающихся ученых. Оно было выведено ими для описания состояний так называемого «идеального газа». Его формула такова: PV = MRT/m. Или в слегка видоизмененной форме: PVm = МRT, где З – давление в паскалях, V – объем в кубических метрах, m – молярная масса газа, M – его фактическая масса, T – температура в градусах Кельвина, R – универсальная газовая постоянная, примерно равная 8,31.
Легко можно видеть, что фактическая масса газа М вычисляется по формуле: М = PVm / RT. Подставив в эту формулу все известные данные, и помня, что молярная масса углекислого газа m равна 44 грамма/моль, вы легко получите ответ.
Конечно же, ни углекислый газ, ни какой-либо другой не является идеальным газом. Поэтому, уравнение Менделеева-Клапейрона не вполне точно описывает его состояние. Но, если условия не очень сильно отличаются от нормальных, погрешности вычислений малы, и ими можно пренебречь.