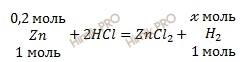1 час назад, Alisa-@ сказал:
Дан объем воды и масса цинка. Объем воды равен объёму водорода, который выделися. А масса водорода, будет равна массе цинка?
У-у-у! Как всё запущено… Массу, деточка, ты рассчитываешь
по уравнению Менделеева-Клапейрона: PV=RTm/M
Видишь там маленькую букву m? Так обозначают массу!
Для этого у тебя есть P, есть V, есть R, есть T,
и, надеюсь, молярную массу водорода M — ты тоже сможешь найти
Преобразуй формулу, подставляй значения и считай.
Дано:
m (Н₂О) = 9 г
Найти:
m (Н₂) — ?
Решение:
1. Составим уравнение реакции разложения воды:
2 Н₂О = 2 Н2 + О2
По уравнению:
разлагается 2 моль воды; образуется 2 моль водорода.
Найдём массу воды по формуле:
m (Н₂О) = n * M = 2 моль * (1*2 + 16) = 36 г
Найдём массу водорода по формуле:
m (Н₂) = n * M = 2 моль * (1*2) г/моль = 4 г
2. Вычислим массу водорода, вступившего в реакцию, составив пропорцию:
9 г Н₂О — х г Н₂
36 г Н₂О — 4 г Н₂
Отсюда, х = 9 * 4 / 36 = 1 г
Ответ: m (Н₂) = 1 г.
Дано:
m (Na) = 4,6 г;
Найти:
m (H2) — ?
V (H2) — ?
Решение:
1) Составляем уравнение реакции, характерной для данной задачи:
2Na + H2O = Na2O + H2;
2) Находим количество натрия в 4,6 граммах металла:
n (Na) = m : M = 4,6 г : 23 г/моль = 0,2 моль;
3) Составляем логическое равенство:
если 2 моль Na дает 1 моль H2,
то 0,2 моль Na даст x моль H2,
тогда х = 0,1 моль.
4) Находим массу выделившегося водорода:
m (H2) = n * M = 0,1 моль * 2 г/моль = 0,2 г;
5) Находим объем водорода:
V (H2) = n * Vm = 0,2 моль * 22,4 л/моль = 4,48 л .
Ответ: m (H2) = 0,2 г; V (H2) = 4,48 л .
Вычислить объем водорода
13,5 грамм цинка (Zn) взаимодействуют с соляной кислотой (HCl). Объемная доля выхода водорода (H2) составляет 85 % . Вычислить объем водорода, который выделился?
Решение задачи
Запишем уравнение реакции взаимодействия цинка (Zn) с соляной кислотой (HCl):
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Учитывая, что молярная масса цинка (Zn) равна 65 г/моль (смотри таблицу Менделеева), найдем химическое количество цинка (Zn) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (Zn) = 13,5 / 65 = 0,2 (моль).
Вычислить объем водорода. По уравнению реакции найдем химическое количество водорода (H2) (теоретический выход), который выделяется в ходе реакции:
1 моль Zn вытесняет 1 моль водорода (H2)
0,2 моль Zn вытесняет х моль водорода (H2)
Откуда:
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем водорода, который образуется в ходе реакции:
Получаем:
V теор.(H2) = 0,2 ∙ 22,4 = 4,48 (л).
Вычислим объем водорода практический по формуле:
Получаем:
V практ. (H2) = 85 ⋅ 4,48 / 100 = 3,81 (л).
Ответ:
объем водорода равен 3,81 литра.
Объяснение:
Дано:
m(Na) = 4,6 г.
Найти:
V(H2) — ?
m(NaOH) — ?
Решение:
Составим УХР по условию задачи:
2Na + 2H2O = 2NaOH + H2↑
Найдем количество вещества натрия по формуле:
n(в-ва) = m(в-ва) / M(в-ва) M(Na) = 23 г/моль
n(Na) = 4,6 г. / 23 г/моль = 0,2 моль
По УХР составим пропорцию для нахождения кол-ва в-ва водорода:
2n(Na) = n(H2), тогда n(H2) = 0,1 моль
Найдем объем водорода по формуле:
V(в-ва) = n(в-ва) * Vm, где Vm — молярный объем, постоянная величина, равная 22,4 л/моль
V(H2) = 0,1 моль * 22,4 л/моль = 2,24 л.
По УХР составим пропорцию для нахождения кол-ва в-ва гидроксида натрия:
n(Na) = n(NaOH) = 0,2 моль
Найдем массу гидроксида натрия по формуле:
m(в-ва) = n(в-ва) * M(в-ва) M(NaOH) = 40 г/моль
m(NaOH) = 0,2 моль * 40 г/моль = 8 г.
Ответ: 1) 2,24 л.; 2) 8 г.